第一轮复习碳族元素
高三化学一轮复习 第28讲 硅 无机非金属材料 课件

1.碳族元素的结构特点和性质
(2)碳元素的存在形态
[互为同素异形体]
碳元素 游离态:金刚石、石墨、无定形碳、炭黑、足球烯C60等 化合态:CO、CO2 、H2CO3 、CaCO3、NaHCO3、CaC2等
正四面体
高 大
考点一 碳族元素 硅和二氧化碳
1.碳族元素的结构特点和性质
正六边形
高 小能
正六
正五
考点一 碳族元素 硅和二氧化碳
3.硅单质
②高纯硅的制备:
若C过量:Si + C == SiC 碳化硅(俗名:金刚砂)
SiO2+2C=高==温==Si(粗)+2CO↑
△ Si(粗)+3HCl=====SiHCl3+H2
(三氯硅烷)
SiHCl3+H2=高==温==Si(纯)+3HCl
考点一 碳族元素 硅和二氧化碳
第四章 金属及其化合物 第28讲 硅
无机非金属材料
考点一 碳族元素 硅和二氧化碳
第ⅣA族——碳族元素, 有: C、Si 、 Ge、Sn、Pb、Fl
碳族元素
考点一 碳族元素 硅和二氧化碳族碳元素易形成共价键,但同样可以存
1.碳族元素的结构特点和性质 在离子化合物中,如CaC2、Na2CO3
碳C 硅Si
高
大
考点一 碳族元素 硅和二氧化碳
4.二氧化硅
(2)二氧化硅的性质
②酸性氧化物:SiO2+2NaOH===__N_a_2_S_i_O_3_+__H_2_O___。 ③高温下,Na2CO3、CaCO3与SiO2反应制玻璃的化学方程式为:
N_a_2C__O_3_+__S_i_O__2=_高_=_=温_=_=_N__a_2S_i_O__3+__C__O__2↑__C_a_C__O_3_+__S_i_O_2_=_高=_=_温_=_=_C_a_S_i_O__3+__C__O。2↑
高三一轮复习碳及碳的化合物
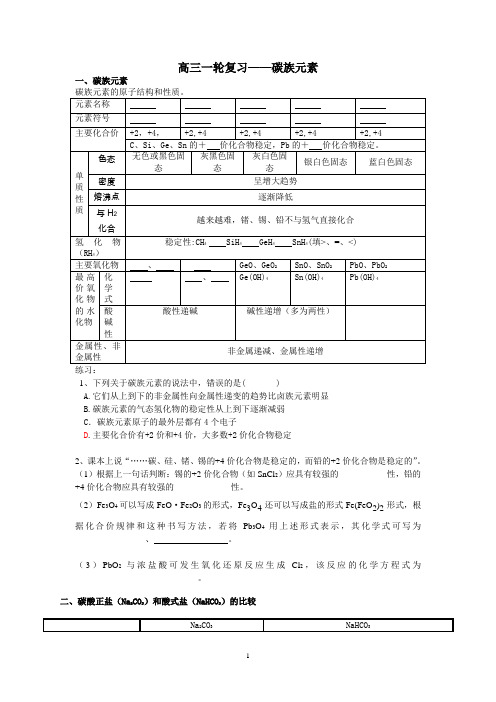
高三一轮复习——碳族元素一、碳族元素1、下列关于碳族元素的说法中,错误的是( )A.它们从上到下的非金属性向金属性递变的趋势比卤族元素明显B.碳族元素的气态氢化物的稳定性从上到下逐渐减弱C .碳族元素原子的最外层都有4个电子D .主要化合价有+2价和+4价,大多数+2价化合物稳定2、课本上说“……碳、硅、锗、锡的+4价化合物是稳定的,而铅的+2价化合物是稳定的”。
(1)根据上一句话判断:锡的+2价化合物(如SnCl 2)应具有较强的___________性,铅的+4价化合物应具有较强的_____________性。
(2)Fe 3O 4可以写成FeO ·Fe 2O 3的形式,Fe 3O 4还可以写成盐的形式Fe(FeO 2)2形式,根据化合价规律和这种书写方法,若将Pb 3O 4用上述形式表示,其化学式可写为______________ 、 。
(3)PbO 2与浓盐酸可发生氧化还原反应生成Cl 2,该反应的化学方程式为____________________________。
二、碳酸正盐(Na 2CO 3)和酸式盐(NaHCO 3)的比较23a、用酚酞做指示剂,达到滴定终点时发生的反应为:b、用甲基橙做指示剂,达到滴定终点时发生的反应为:,典型例题[例1]下列关于碳族元素的说法正确的是()A.单质都是无色晶体B.单质中硅单质熔点最高C.碳族元素形成的化合物种类最多D.在化合物中最稳定的化合价都是+4价[例2]门捷列夫在19世纪中叶,曾根据他所发现的周期律,预言过第四周期第ⅣA族元素X(当时称为类硅)。
下列有关类硅的元素性质,不正确的是()A.XH4不稳定,但有强还原性B.可用焦炭在高温下从XO2中冶炼XC.X单质的熔点比硅高D.X(OH)4的酸性比H2SiO3强[例3]若发现了114号新元素X, 则有关X元素及其化合物的叙述正确的是: ( )(A)X有稳定的气态氢化物(B)X的最高正价氧化物的化学式为XO2(C)X为非金属元素(D)X的低价氧化物是酸性氧化物[例4]下列饱和溶液中,通入过量二氧化碳气体,肯定没有沉淀产生的是()①氢氧化钠②碳酸钠③硅酸钠④次氯酸钙⑤氯化钙A、①⑤B、①②C、④⑤D、③④[例5]某种混合气体,可能含有N2、HCl、CO,常温下,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都有没有变化,再将其通过足量的过氧化钠固体,气体体积减小,最后混合气体通过红热的铜丝网,经充分反应后气体体积又减少,但仍有剩余气体,以下对混合气体组成的判断正确的是()A、一定没有氮气,至少有一氧化碳和氯化氢中的一种B、一定有氮气,一氧化碳和氯化氢C、一定有氮气,一氧化碳和氯化氢至少有其中的一种D、一定有氮气和氯化氢,没有一氧化碳【真题演练】1.(2002上海15)将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是()A B C D2、(2003全国理综8)某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。
2008年 高三化学第一轮复习: 高化学第一轮复习 课题39 第七章 碳族元素

高三化学第一轮复习:高: 课题39 第七章碳族元素第二讲硅及其化合物一、复习目标:1.掌握硅和二氧化硅的性质。
2、了解新型无机非金属材料。
二.知识回顾(一)硅及其化合物1.硅〈1〉硅的存在在自然界中,硅全部以____态存在,是构成矿物和岩石的主要成分。
在地壳中,硅的含量在所有元素中居第__位,仅次于氧。
〈2〉、硅的物理性质单质硅有晶体硅和无定形硅两种。
晶体硅是___色、有___光泽、脆而硬的固体,是良好的___材料。
〈3〉硅的化学性质(1)常温下硅的化学性质稳定,但能和氟、HF、强碱(NaOH)发生反应。
①硅和氟气反应生成四氟化硅气体,化学方程式为:。
②硅和氢氟酸反应生成四氟化硅,放出学方程式为:。
③硅与NaOH溶液作用生成硅酸钠,反应的化学方程式为:(2)在加热条件下,硅能和某些非金属单质发生反应。
①硅与氧气在加热时反应生成二氧化硅程式为。
②硅和C12在加热条件下反应生成四氯化硅的化学方程式为:〈4〉硅的制取:自然界中没有游离态的硅,常见的化合态的硅有和等。
工业上,用焦炭在电炉中还原二氧化硅得到含有少量杂质的粗硅。
反应的化学方程式:。
在该反应中,氧化剂是,还原剂。
2、二氧化硅(1)物理性质:二氧化硅广泛存在于自然界中,沙子、石英的主要成分就是二氧化硅,SiO2不溶于水,熔点、硬度。
水晶、石英是二氧化硅晶体。
(2)二氧化硅出化学性质①酸性氧化物的性质:Si02是酸性氧化物,是的酸酑,于水。
常温下Si02与NaOH溶液反应得到硅酸钠(Na2SiO3),反应的化学方程式为:高温下Si02能和碱性氧化物(如CaO)反应生成硅酸盐,反应的化学方程式为②常温下,SiO2能与氢氟酸(HF)反应,此反应常用于刻蚀玻璃,反应的化学方程式为:。
③二氧化硅的弱氧化性:Si02高温下与C作用可制取粗硅,反应的化学方程式为:_(3)二氧化硅的用途 :①Si02是制造光导纤维的主要。
②Si02常被用来制造石英表中的压电材料(3)Si02用于制造各种例3、硅酸(1)硅酸(H2Si03)硅酸不溶于水,其酸性比碳酸的酸性___。
2012高考第一轮复习教学案__碳、硅及其化合物

2011高考第一轮复习教学案碳、硅及其化合物【课标要求】1.了解单质硅及其重要硅的化合物的主要性质及应用2.能综合应用硅及硅的化合物知识【知识梳理】1、本考点知识结构:2、碳族元素:①碳族元素的特征:碳族元素原子最外层电子数为4,既不容易失去电子,又不容易得到电子,易形成共价键,难形成离子键。
碳族元素形成的单质在同周期中硬度最大,熔沸点最高(如金刚石、晶体硅)。
②碳族元素的化合价:碳族元素的主要化合价有+2,+4,其中铅+2价稳定,其余元素+4价稳定。
③碳族元素的递变规律:从上到下电子层数增多,原子半径增大,原子核对最外层电子的吸引能力减弱,失电子的能力增强,从上到下由非金属递变为金属的变化非常典型。
其中碳是非金属,锡、铅是金属,硅、锗是半导体材料。
④碳族元素在自然界里的存在:自然界里碳有游离态和化合态两种;硅在地壳里无游离态,主要以含氧化合物的形式存在。
⑤几种同素异形体:碳:金刚石、石墨、C60、C70等;硅:晶体硅,无定形硅。
3、碳:在常温下碳很稳定,只在高温下能发生反应,通常表现为还原性。
①燃烧反应②与某些氧化物的反应:C+CO 22CO;C+2CuO CO2↑+2Cu;C+H2O CO+H2O(CO、H2的混合气体叫水煤气);2C+SiO 2Si+2CO↑③与氧化性酸反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O;C+4HNO3(浓)CO2↑+4NO2↑+2H2O4、一氧化碳:不溶于水,有毒(CO和血红蛋白结合,使血红蛋白无法和O2结合,而使细胞缺氧引起中毒),但由于CO无色无味因此具有更大的危险性。
①可燃性②还原性:CO+CuO CO2+Cu,CO+H2O(g)CO2+H2O5、二氧化碳:直线型(O=C=O)非极性分子,无色能溶于水,密度大于空气,可倾倒,易液化。
固态CO2俗称干冰,能升华,常用于人工降雨。
实验室制法:CaCO3+2HCl=CaCl2+CO2↑+H2O。
①酸性氧化物一—酸酐Ca(OH)2+CO2=CaCO3↓+H2O(用于检验CO2)②氧化性:CO2+C2CO;2Mg+CO 22MgO+C6、碳酸盐:①溶解性:Ca(HCO3)2>CaCO3;Na2CO3>NaHCO3。
碳族元素一轮复习

碳族元素复习第一节碳族元素【考点解读】1.根据碳族元素在周期表中的位置及其结构特点,了解其性质的相似性和递变性。
2.了解碳的核外电子排布,三种重要的同素异形体及导致它们物理性质有较大差别的原因。
了解碳的多样性。
3、CO、CO2的性质,碳的氧化物对大气的污染4、碳酸盐的性质及CO32-的检验【学习指导】复习策略:本章主要采用对比的方法复习碳硅及化合物的主要性质,同时注意碳硅及化合物的某些特殊性,在元素推断题中形成物质种类最多的元素之一有碳,原因是碳元素最外层4个电子,可以进行sp、sp2、sp3杂化及形成三键、双键、单键。
【基础与疑难突破】1.碳族元素:包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb),为第IV A族元素;最外层均有四个电子,决定了碳族元素性质具有相似性,容易形成共价化合物(特别是碳和硅),其化合价主要有+4和+2;但电子层数不同,又导致了性质具有递变性:从碳→铅,非金属性逐渐减弱,金属性逐渐增强,有着明显的递变规律。
见如下表格:(1)2、核外电子排布:本族元素基态原子的价电子层结构为ns2np2,主要价态为+4,+2。
碳的同素异形体的比较:(表2)碳元素不仅可以形成多种同素异形体,而且还可以形成多种无机化Array合物和有机化合物,是形成化合物种类最多的元素。
例题1:(1)质量相等的石墨与足球烯(C60)所含质子数()A.前者多 B. 相等 C. 后者多 D. 无法确定(2)设计一个实验证明金刚石、石墨和C60都是由碳元素组成的。
答案:(1)B (2)分别将三种物质在氧气充足的条件下燃烧,若三者产生的都是无色无味的气体且将所得气体通入澄清石灰水中,若气体都使澄清的石灰水变浑浊,则说明它们都是由碳元素组成的。
解析:(1)等质量的石墨与足球烯含有相同物质的量碳原子,所含质子数也相等3、碳单质及重要化合物的主要性质、制法及应用的比较一、碳单质:(1)物理性质:碳元素形成的同素异形体由于碳原子的排列方式不同,导致物理性质有较大的差别。
碳族元素复习

二、硅及化合物 1、硅(Si)
在自然界中,没游离态的硅, 以化合态存在, 在地壳中含量 居第二位。
Si
晶体硅的晶体结构与金刚石相似,正四面 体向周围空间延伸形成空间网状的结构。 但由于硅原子半径比碳原子半径大,所以, 其熔沸点要比金刚石低,硬度要比金刚石 小。
Si化学 性质
常温下,硅的化学性质不活泼, 除氢氟酸、氟气、强碱外 与F2
所选装置
操作方法
将CO2的试管的 橡皮塞打开 通过分液漏斗向 CO2气体的集气瓶 a中加入NaOH溶液 向a瓶中通入 CO2气体 将滴管中NaOH溶 液挤入烧瓶中
B
C D E
实验现象 水槽中NaOH 溶液上升到 试管中
b瓶中的NaOH 溶液不能排 入烧杯中 b中无气泡 冒出 产生喷泉 现象
某无色混合气体中可能含有H2、CO、CO2、HCl、NH3 及水蒸气中的两种或多种,当混合气体依次通过: (1)澄清石灰水(无浑浊现象);(2)氢氧化钡 (有浑浊现象);(3)浓硫酸(无现象);(4) 灼热氧化铜(变红色);(5)无水硫酸铜(变蓝 色)。试分析该混合气体中肯定有___________, 肯定没有______________,可能有______________。
高温
高温
Si+C == SiC
硅的制备
+C
SiO2 高温 粗硅
+Cl2
高温
SiCl4
精馏+H2 高温
Si
1、 SiO2+2C ==
高温
高温
2CO+Si
(含杂质的粗硅) SiHCl3+H2
2、 Si+2Cl2 == SiCl4 或
高温 Si+3HCl(气)==
高考化学第一轮复习 碳族元素课件

碳族元素
• • • • •
1.结合实验考查C、CO的还原性。 2.CO、CO2的检验与鉴别。 3.CO2、CO等气体的制取和收集。 4.CO2与NaOH反应产物的确定及计算。 5.金刚石、石墨、干冰的晶体类型、结构、性质。
• • • • • • •
(1)碳族元素 ①包括:
。 ②周期表中的位置: ③最外层电子数: 。 6 ④主要化合价: (铅 ⑤原子半径:随核电荷数的增大而 82 族, 周期。
•
(2009年安徽理综)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如右图所示) ,可由石墨剥离而成,具有极好的应用前景。下列说法正确的是 ( )
• • • • •
•
A.石墨烯与石墨互为同位素 B.0.12 g石墨烯中含6.02×1022个碳原子 C.石墨烯是一种有机物 D.石墨烯中碳原子间以共价键结合 【解析】 A项,石墨烯和石墨是同素异形体;B项,0.12 g石墨烯物质的量为0.01 mol ,含6.02×1021个原子,C项错。 【答案】 D
•
BaCl2溶液或CaCl2溶液,一般不用稀HCl,因为反应可能有时候不明显。
• • • • •
(2009年全国Ⅱ理综)下列叙述中正确的是 ( ) A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶 液,又有CaCO3沉淀生成 B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量 之比为1∶2 C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积 相同 D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
•
•
(5)乙同学提出甲同学的装置太复杂,可将酒精灯合二为一,去掉B,而将尾气导气管出 口旋转到A的火焰上即可。乙同学的设计是否合理?简述理由(从A、B使用的一致性的角 度考虑)。 (6)丙同学质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入CuO之前,应先 通入澄清石灰水,以比较排除CO与澄清石灰水反应。试对此作出评价,你认为丙的设计 ________(填“必要”或“不必要”)。
高三化学一轮复习碳、硅教案

工业制粗硅第一步的化学方程式:。
(二)CO2易错易混点
将足量的CO2分别通入①CaCl2溶液;②Ba(OH)2溶液;③Ca(ClO)2溶液;④NaClO溶液
⑤饱和Na2CO3溶液; Na2SiO3⑦苯酚钠。最终溶液中有白色沉淀析出的是.
思考:上述反应与通入CO2量有关的是,若使①溶液产生沉淀,应加入.
碳族元素、硅
学习目标
1.硅的用途、化学性质、制备。
2.书写CO、CO2、H2C2O4相关化学方程式。
3.对比碳族元素的递变性,对比异同。
重点难点
重点:硅的用途、化学性质、铅的化合物的性质
难点:根据价态陌生方程式;硅的易错易混点
(一)硅
(1)用途:硅是一种良好的材料,因为此性质,故可用作、。
(2)化学性质:①常温只能与F2、HF及强碱反应②加热可与C、O2、Cl2反应
(三)碳族元素:已知:Pb的+2价较稳定。+4价强氧化性:PbO2>KMnO4>Cl2>Fe3+。
C、Si、Ge、Sn的+4价较稳定,+2价强还原性:Sn2+>Fe2+;
①氯气跟锡、铅分别共热的产物;
②向SnCl2溶液中加入FeCl3,书写离子方程式。
(四)草酸:①向FePO4沉淀中加入Li2CO3、H2C2O4,经高温煅烧,得到LiFePO4,写出该反应的化学方程式;
②草酸(乙二酸),其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解为CO、CO2和H2O.
(1)为依次验证分解的三种产物,下列装置连接顺O的现象是;.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
学案1 碳族元素 硅及其化合物
第一轮复习碳族元素
第一轮复习碳族元素
第一轮复习碳族元素
特殊性:
1、碳、硅是非金属,锗、锡、铅是金属 .
硅、锗具有半导体的性质
2、碳族元素易形成共价键
3、碳族元素除了+4价外,还有+2价
碳、硅、锗、锡的+4价化合物是稳定的
如CO2、SiO2、GeO2、SnO2稳定,氧化性 较弱铅+4价化合物不稳定,+2价化合物是 稳稳定定的如PbO2有第较一轮强复习碳的族元素氧化性, 而PbO较
、 三 硅酸 不溶于水,弱酸(比碳酸弱)
H4SiO4= H2SiO3 +H2O
H2SiO3= SiO2 +H2O (表现硅酸的不稳定性)
简介:硅胶是有多个单分子硅酸在水中逐渐聚合而 成的硅酸凝胶,经充分洗涤、干燥、脱水后形成
Na2SiO3的+多C孔O2状+固H体2O,对=水2等N极aC性l+物质H都2S有iO极3 强的吸附
二、二氧化硅
水晶
玛瑙
光导纤维
石英坩埚
纯净的二氧化硅是六 方柱状的透明晶体
原子晶体
第一轮复习碳族元素
坚硬、难溶固体
物理性质:坚硬、难溶于水、熔沸点高
化学性质
1、酸性氧化物:
但不能与水反应生成对应的酸 SiO2+H2O===
SiO2+2NaOH=Na2SiO3+H2O
高温
不能用玻璃 塞的原因!!
SiO2+CaO===CaSiO3 高温
第一轮复习碳族元素
Si+2NaOH+H2O=Na2SiO3+2H2↑ 生氢剂
生氢剂:在野外,用含量高的硅粉与干燥 的Ca(OH)2和NaOH混合,并强热,即可迅 速得到氢气
3、硅的制备和提纯
制备: SiO2+2C=高=温=Si+2CO↑ 提纯: Si+2Cl2=高=温=SiCl4
高温
SiCl4+2H2第=一轮=复习=碳S族元i素+4HCl
考点3
硅及其化合物
第一轮复习碳族元素
一、单质硅
硅的结构类 似金刚石
灰黑色、有金属光 泽,硬而脆的固体
熔、沸点高,硬度大
良好的半导体
第一轮复习碳族元素
1、物理性质:灰黑色、有金属光泽,硬而 脆的固体,熔、沸点高,硬度大,良好的半 导体
2 、化学性质:
①加热时: Si+O2高=温SiO2
②常温时: Si+2F2 = SiF4 Si+4HF=SiF4↑+2H2↑
高岭石:Al2(Si2O5)(OH)4
Al2O3 ·2SiO2 ·2H2O
钠长石:NaAlSi3O8
Na2O ·Al2O3 ·6SiO2
正长石:KAlSi3O8
K2O ·Al2O3 ·6SiO2
2、重要的硅酸盐: Na2SiO3
第一轮复习碳族元素
四、硅酸盐工业简介(传统无机非金属材料)
原料 设备 原理
例1: 水蒸气通过灼热的煤所产生的混合气, 其主要成分是CO、H2,还含有CO2和水蒸气, 请用如图所示装置设计一个实验,以确认上述 混合气中含有CO和H2。
连接上述装置的正确顺序是: E,F接D,C接A,B(或B,A)接J,I接H,G。
第一轮复习碳族元素
第一轮复习碳族元素
例题引路2. 对位练兵2 第一轮复习碳族元素
2、氧化性:SiO2+2C===Si+2CO
3、特殊性质:与氢氟酸反应—雕刻玻璃
SiO2+4HF=SiF第4一↑轮+复习2碳H族元2素O
思考:下列物质的晶体或分子空间构型为 正四面体的是( )
①SiO2 ②晶体硅 ③金刚石 ④NH4+ ⑤
NH3⑥CCl4
C
A 只有 ②③
B 只有①②③⑥
C ①②③④⑥ D 第一轮复习碳族元素 全部
石墨
- - - -- ------------------------------------- -- -- - ----------------
- - -- -- -- -- -- -- -- -- -- -- -- -- -- -- - -
-
-
--
-----------------
-
---
----------------
陶瓷
粘土
复杂的物理 化学变化
高温
高温
第一轮复习碳族元素
高温
新型无机非金属材料的特征
(1)耐高温、强度高 (2)具有电学性质
(3)具有光学性质 (4)具有生——高温结构陶瓷
高温结构材料与金属材料的性能比较:
高温结构材料:耐高温、耐腐蚀、硬度大、耐磨损、不怕氧化。 金属材料: 易受腐蚀、不耐氧化、不适合高温时使用
-
-
-
-
简介1:碳的第三种同素异形体 C60
笼状分子,固态时是分子 晶体,每个碳原子只跟相 邻的三个碳原子形成共价 键,60个碳原子构成球形, 共32面体,包括12个五 边形,20个六边形。
第一轮复习碳族元素
足球烯
C60晶体结构
第一轮复习碳族元素
第一轮复习碳族元素
D
第一轮复习碳族元素
第一轮复习碳族元素
作用,是很好的干燥剂,吸附剂以及催化剂
制取:强酸制弱酸
Na2SiO3+2HCl = 2NaCl+ H2SiO3
Na2SiO3+CO2 +H2O = Na2CO3 + H4SiO4↓表现其弱酸性 第一轮复习碳族元素
四、硅酸盐:多数不溶于水
1、硅酸盐化学式的氧化物表示方法:
硅酸钠:Na2SiO3可以写成 Na2O ·SiO2
对位练兵1
第一轮复习碳族元素
金刚石
石墨
第一轮复习碳族元素
C60
金 刚 石
第一轮复习碳族元素
109°28′
120º
共价键 范德华力
第一轮复习碳族元素
- - -- -- -- -- -- ---- ---- -- -- -- -- -- - -
- - -- ----------------- ------ ----------------- -- - -
主要 成分
反应 条件
水泥
玻璃
粘土、石 灰石
水泥回转窑
石灰石、纯碱、石英 玻璃窑
复杂的物理 Na2CO3+SiO高2温=Na2SiO3+CO2↑ 化学变化 CaCO3+SiO高2=温CaSiO3+CO2↑
3CaO·SiO2 2CaO·SiO2 3CaO·SiO2
Na2SiO3、CaSiO3、 4SiO2
第一轮复习碳族元素
第一轮复习碳族元素
酸性氧化物: CO2 + Ca(OH)2 ==== CaCO3 + H2O
CaCO3 + CO2 + H2O ==== Ca(HCO3)2
Na2CO3(饱和) + CO2 + H2O ==2NaHCO3
第一轮复习碳族元素
第一轮复习碳族元素
第一轮复习碳族元素
