第6章 热力学基础 复习题
物理化学答案——第六章-统计热力学

第六章 统计热力学基础内容提要:1、 系集最终构型:其中“n*”代表最可几分布的粒子数目2.玻耳兹曼关系式:玻耳兹曼分布定律:其中,令为粒子的配分函数。
玻耳兹曼分布定律描述了微观粒子能量分布中最可几的分布方式。
3、 系集的热力学性质:(1)热力学能U :(2)焓H :**ln ln ln !i n i m iig t t n ≈=∏总2,ln ()N VQU NkT T∂=∂iiiQ g e βε-=∑*i ii i i i i in g e g e N g e Q βεβεβε---==∑m ln ln S k t k t ==总(3)熵S :(4)功函A :(5)Gibbs 函数G :(6)其他热力学函数:4、粒子配分函数的计算(1)粒子配分函数的析因子性质粒子的配分函数可写为:,ln ln ln()mN V S k t Q Q Nk NkT Nk N T=∂=++∂ (i)tvenrkTi ikTkTkTkTkTt r v e n trvent r v e nQ g eg eg eg eg eg eQ Q Q Q Q εεεεεε------===∑∑∑∑∑∑2,ln N VQ H U pV NkT NkTT ∂⎛⎫=+=+ ⎪∂⎝⎭lnQA NkT NkT N=--lnQ G NkT N=-()22ln ln ln ln V V U Q Q C Nk Nk T T T ∂∂∂⎛⎫==+ ⎪∂∂⎝⎭∂(2)热力学函数的加和性质1)能量2)熵3)其他5、 粒子配分函数的计算及对热力学函数的贡献(1)粒子总的平动配分函数平动对热力学函数的贡献:2222ln ()ln ln ln ()()()iVt v r V V V t r v Q U NkT TQ Q Q NkT NkT NkT T T T U U U ∂=∂∂∂∂⎡⎤⎡⎤⎡⎤=+++⎢⎥⎢⎥⎢⎥∂∂∂⎣⎦⎣⎦⎣⎦=+++t r v H H H H =+++t r v A A A A =+++t r v G G G G =+++3/222()t mkT Q V hπ=2ln 3()2i t V Q U NkT NkT T ∂==∂2ln 5()2i t V Q H NkT NkT NkT T ∂=+=∂t r v S S S S =+++(2)转动配分函数1)异核双原子分子或非对称的线形分子转动特征温度:高温区低温区中温区2) 同核双原子分子或对称的线形多原子分子配分函数的表达式为在相应的异核双原子分子的Q r 表达式中除以对称数σ。
NO.6热力学基础答案

《大学物理C 》作业班级 __________ 学号 ____________ 姓名 _____________ 成绩 ____________N0.6 热力学基础选择题1. 气体经过如P —V 图中所示的三个过程 (A )吸热相等 (B )对外做功相等 (C) 吸热和做功都不相等,但内能变化相等 (D) 吸热、做功及内能变化都不相等解:功和热量都是过程量,都与过程有关,三个过程 abc ,adc ,aec 不相同,因此吸热和做功都不相等。
内能是温度的单值函数, 是状态函数,只与初态、末态有关, 因三个过程 abc , adc ,aec 都是由a 到c ,所以内能变化相2. —定量的理想气体,经过某过程后,它的温度升高了,由热力学定律可断定 (1)该理想气体系统在此过程中吸了热 2) 在此过程中外界对系统做了正功 3) 该理想气体系统内能增加了(4)在此过程中系统从外界吸了热,又对外做了正功 A ) (1) (3)正确 (B ) (2) (3)正确 C ) ( 3)正确 (D ) (3) (4)正确 (巳(4)正确[C ]而功和热量都与过程有关,不能只由温度升降而判断其正3. 如图所示,工质经alb 和b2a 构成的一循环过程, 已知在alb 过程中,工质与外界交换的静热量为 Q , b2a 为绝热过程,循环包围的面积为 A ,则此循环效解:内能是温度的单值函数,温度升高只能说明内能增加了则各过程C ]QA(D ) 1「上(T i , T 2为循环过程中的最高和最低温度)解:此循环效率为Q 2A 净=1 -Q 1 Q Q 2由热力学第二定律的开尔文表述,热机不能从单一热源吸热 而对外做功,该循环的效率应小于-。
Q4. 已知孤立系统B 态的熵S B 小于A 态的熵S A , 即卩S B < S A ,贝U (A )系统可由 A 态到B 态 (B )系统可由B 态到A 态 C ) 对不可逆过程,可由 A 态变为B 态,也可由B 态变为A 态 D ) 上述说法都不对[B ]解:由克劳修斯熵公式 飞=S B - S A 二BdQ可逆 - 0 ,AT等号适用于可逆过程,不等号适用于不可逆过程。
《大学物理学》热力学基础练习题
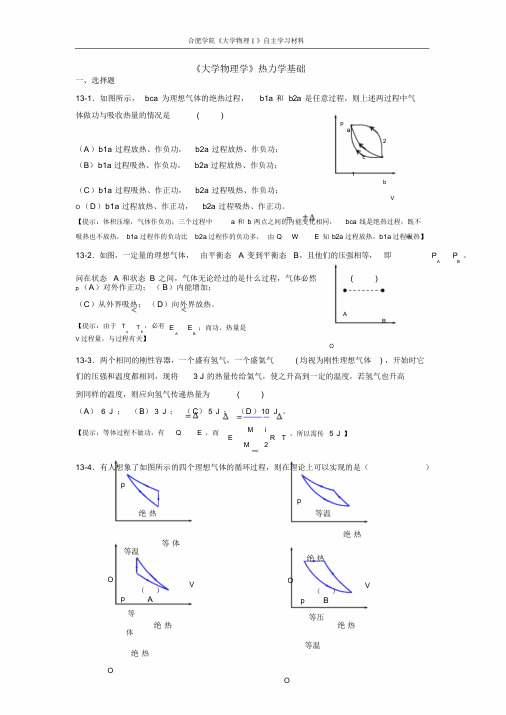
合肥学院《大学物理Ⅰ》自主学习材料《大学物理学》热力学基础一、选择题13-1.如图所示,bca 为理想气体的绝热过程,b1a 和b2a 是任意过程,则上述两过程中气体做功与吸收热量的情况是( )pa2(A)b1a 过程放热、作负功,b2a 过程放热、作负功;c(B)b1a 过程吸热、作负功,b2a 过程放热、作负功;1b(C)b1a 过程吸热、作正功,b2a 过程吸热、作负功;VO (D)b1a 过程放热、作正功,b2a 过程吸热、作正功。
【提示:体积压缩,气体作负功;三个过程中 a 和b 两点之间的内能变化相同,bca 线是绝热过程,既不吸热也不放热,b1a 过程作的负功比b2a 过程作的负功多,由Q W E 知b2a 过程放热,b1a 过程吸热】13-2.如图,一定量的理想气体,由平衡态 A 变到平衡态B,且他们的压强相等,即P P 。
A B问在状态 A 和状态 B 之间,气体无论经过的是什么过程,气体必然( )p (A)对外作正功;(B)内能增加;(C)从外界吸热;(D)向外界放热。
AB【提示:由于T T ,必有A B E E ;而功、热量是A BV 过程量,与过程有关】O13-3.两个相同的刚性容器,一个盛有氢气,一个盛氦气( 均视为刚性理想气体) ,开始时它们的压强和温度都相同,现将 3 J 的热量传给氦气,使之升高到一定的温度,若氢气也升高到同样的温度,则应向氢气传递热量为( )(A) 6 J ;(B)3 J ;(C)5 J ;(D)10 J 。
【提示:等体过程不做功,有Q E ,而M iE R TM 2mol,所以需传 5 J 】13-4.有人想象了如图所示的四个理想气体的循环过程,则在理论上可以实现的是()pp绝热等温绝热等体等温绝热Op 等()AV Op()B等压V 绝热绝热体等温绝热OOVV ()C()D【提示:(A) 绝热线应该比等温线陡,(B)和(C)两条绝热线不能相交】热力学基础-1合肥学院《大学物理Ⅰ》自主学习材料13-5.一台工作于温度分别为327℃和27℃的高温热源与低温热源之间的卡诺热机,每经历一个循环吸热2000J,则对外做功()(A)2000 J ;(B)1000 J ;(C)4000 J ;(D)500 J 。
热力学统计物理第六章

l
l
l
N al 0 l
E lal 0 l
[lnlnBB.E.E
lNal[lEn(]l
精l 品a课la)件llnlnalla]l
al
l
0
33
…… ……
即:能级1上有a1个粒子, 能级2上有a2个粒
子,……。
精品课件
l
al
2
a2
1
a17 1
1、玻耳兹曼系统εl 上的ωl 个量子态时,第一个粒
子可以占据ω 个量子态中的任何一个态,有ωl 种可能的
占据方式。由于每个量子态能够容纳的粒子数不受限制,在第 一个粒子占据了某一个量子态以后,第二个粒子仍然有ωl种
的占据方式,这样al 个编了号的粒子占据ωl个la量l 子态共有
种可能的占据方式,
精品课件
18
(2) 各个能级都考虑在内,系统总的占据方式数:
al l
l
(3) 现在考虑将N个粒子互相交换,不管是否在同一能级上,交换
数是N!,在这个交换中应该除去在同一能级上al 个粒子的交换al !
因此得因子
N!/ al!
A
A AA
⑤⑥ A
A
AA
两个玻色子占据3个量子态有6种方式
精品课件
10
(2)费米系统:即自旋量子数为半整数的粒子组成的系统
粒子不可分辨,每个个体量子态上最多能容纳一个 粒子(费米子遵从泡利原理)。
系统由两个粒子组成(定域子)。粒子的个体量子 态有3个, 讨论系统有那些可能的微观状态
量子态1 量子态2 量子态3
❖ 微观粒子的状态杂乱无章,一个系统的力学状态也是 杂乱无章的,有很多个可能的状态,那么,每个状态 出现的概率为多少呢,与什么因素有关
化学热力学基础习题

化学热力学基础习题硫(一氧化碳,克)= 197.9焦耳摩尔-1克-1,硫(H2,克)= 130.6焦耳摩尔-1克-1 .(1)计算298K下反应的标准平衡常数k;(2)计算标准配置中反应自发向右进行的最低温度。
15当298K已知时,反应为:C(石墨)+2S(对角线)→CS2(l),△fH(S,对角线)= 0kj mol,△fH(CS2,l) =-87.9kj mol-1,S(C,石墨)= 5.7j mol-1 k-1,S(S,对角线)= 31.9j mol-1 k-1,S(CS2,l) = 151.0j mol-1 k-1。
尝试计算298K时△fG(CS2,l)和反应自发发生的最低温度。
16当298K已知时,反应为:(1)fe2o 3+3C→2Fe+3co 2(g)。
22(2)Fe2O3(s)+3H 2(g)→2Fe(s)+3H2O(g),(Fe2O 3,s)=-824.2 kJ·mol-1,△fH(二氧化碳,克)=-393.5千焦摩尔-1,△千焦(H2O,△fHG) =-241.8 kj mol-1,S(Fe2O3,s) = 87.4 j mol-1 k-1,S(C,石墨)= 5.7 j mol-1 k-1,S(Fe,s) = 27.3 j mol-1 k-1,S(CO2,g) = 213.7 j mol-1 k-1,S(H2,g) = 130.6 j mol-1 k-1,S(H2O,g) = 188.7 j mol-117当298K已知时,反应为:碳酸镁→氧化镁+二氧化碳(g),△ FH(碳酸镁,s)=-1110.0 kj·mol-1,△fHS(MgO,s)=-601.7kJ mol-1,△fH(CO2,g)=-393.5千焦摩尔-1,(氧化镁,s)= 26.9千焦摩尔-1千焦-1,(碳酸镁,S)= 65.7焦耳摩尔-1克-1,S硫(二氧化碳,克)= 213.7焦耳摩尔-1克-1 .在较低的标准配置(298K 和850K)下,反应能自发地向右进行吗?18当298K已知时,反应为N2(g)+2O2(g)2NO2的rG(g)= 102.6千焦摩尔-1,△-1-1RS =-120.7j·mol·k,尝试计算398K时的标准平衡常数k41300K下的反应2co(s)△RG = 112.7 kJ·mol-1,400K(Cu2O(s)+102(g)2-1rG = 101.6kJ千焦摩尔.试计算:(1)反应的△相对湿度和△相对湿度;(2)当p(O2)= 100千帕时,反应自发进行的最低温度。
现在化学基础-第六章_热力学第二定律习题解答

第六章 热力学第二定律习题解答1.1mol 理想气体在300K 下,分别经过下列三种过程从350dm 膨胀到3100dm ,计算以下各过程的Q W U H ∆∆、、、和S ∆。
(1)可逆膨胀;(2)膨胀时实际做功等于最大功的50%;(3)向真空膨胀。
解:{}{}21311rev 11001ln18.314300ln J 1.73kJ 501.73kJ 1.73kJ1.7310J K 5.76J K300(2) 1.7350%kJ=0.865kJ 0.865kJ000.865kJ =5.76J K (3)05.76J V W nR T V W Q U H Q S TW W U H Q W S W Q U H S ---⎧⎫-==⨯⨯⨯=⎨⎬⎩⎭=-=∆=∆=⨯∆==⋅=⋅-=⨯=-∆=∆==-=∆⋅==∆=∆=∆=()1K-⋅2.在101.325kPa 下,将150g,0℃的冰放入1kg,25℃的水中熔化,假设这是一个孤立系统,计算该过程的熵变。
已知0℃时冰的熔化热为11sm6020J molH-∆=⋅ ,水的比热容为114.184J Kg--⋅⋅。
解:{}33327311.3,m ,rev 122731506020J=50.210J181kg 250100025 4.184J=-104.510J 50.210150 4.1841000(25) 4.1840,11.3d p p Q Q Q Q t t t nC TnC Q S S S S TT+⎧⎫=⨯⨯⎨⎬⎩⎭=-⨯⨯⨯<⨯+⨯⨯+⨯-⨯==∆=∆+∆+∆=++⎰冰吸水放冰吸水放总冰水水冰全部熔化需吸热:℃水冷却到℃放热为:系统终态为的液水℃27311.3m 27325311d 50.210{4.184150[ln(27311.3)ln(273)] 4.1841000[ln(27311.3)ln(27325)]}J K 12.42J K273TTS ++--⨯∆=+⨯+-+⨯⨯+-+⋅=⋅⎰总3.10mol 理想气体从40℃冷却到20℃,同时体积从3250dm 变化到350d m ,如果该气体的定压摩尔热容为1129.20J Km ol--⋅⋅,求此过程的S ∆。
《工程热力学》(第四版)习题提示及答案06章习题提示与答案

习题提示与答案第六章 热能的可用性及火用分析6-1 汽车用蓄电池中储存的电能为1 440W ·h 。
现采用压缩空气来代替它。
设空气压力为6.5 MPa 、温度为25 ℃,而环境的压力为0.1MPa ,温度为25 ℃,试求当压缩空气通过容积变化而作出有用功时,为输出1 440 W ·h 的最大有用功所需压缩空气的体积。
提示:蓄电池存储的电能均为可转换有用功的火用 ,用压缩空气可逆定温膨胀到与环境平衡时所作出的有用功替代蓄电池存储的电能,其有用功完全来源于压缩空气的火用 ,即W u =me x ,U 1。
单位质量压缩空气火用 值()()()010010011,x s s T v v p u u e U ---+-=,空气作为理想气体处理。
答案:V =0.25 m 3。
6-2 有一个刚性容器,其中压缩空气的压力为3.0 MPa ,温度和环境温度相同为25 ℃,环境压力为0.1 MPa 。
打开放气阀放出一部分空气使容器内压力降低到1.0 MPa 。
假设容器内剩余气体在放气时按可逆绝热过程变化,试求:(1) 放气前、后容器内空气比火用U e x,的值;(2) 空气由环境吸热而恢复到25 ℃时空气的比火用U e x,的值。
提示:放气过程中刚性容器中剩余气体经历了一个等熵过程,吸热过程为定容过程;空气可以作为理想气体处理;各状态下容器中空气的比 火用()()()00000x s s T v v p u u e U ,---+-=。
答案:e x ,U 1=208.3 kJ/kg ,e x ,U 2=154.14 kJ/kg ,e x ,U 3=144.56kJ/kg 。
6-3 有0.1 kg 温度为17 ℃、压力为0.1 MPa 的空气进入压气机中,经绝热压缩后其温度为207 ℃、压力为0.4 MPa 。
若室温为17 ℃,大气压力为0.1 MPa ,试求该压气机的轴功,进、出口处空气的比 火用 H e x,。
热力学基础练习题答案版

热⼒学基础练习题答案版热⼒学基础练习题1、热⼒学第⼀定律ΔU=Q+W 只适⽤于( D )(A) 单纯状态变化 (B) 相变化(C) 化学变化 (D) 封闭物系的任何变化2、关于焓的性质, 下列说法中正确的是( D )(A) 焓是系统内含的热能, 所以常称它为热焓(B) 焓是能量, 它遵守热⼒学第⼀定律(C) 系统的焓值等于内能加体积功(D) 焓的增量只与系统的始末态有关3、第⼀类永动机不能制造成功的原因是( A )(A) 能量不能创造也不能消灭(B) 实际过程中功的损失⽆法避免(C) 能量传递的形式只有热和功(D) 热不能全部转换成功4、下列叙述中不具状态函数特征的是( D )A.系统状态确定后,状态函数的值也确定B.系统变化时,状态函数的改变值只由系统的初终态决定C.经循环过程,状态函数的值不变D.状态函数均有加和性5、下列叙述中,不具可逆过程特征的是( C )A.过程的每⼀步都接近平衡态,故进⾏得⽆限缓慢B.沿原途径反向进⾏时,每⼀⼩步系统与环境均能复原C.过程的初态与终态必定相同D.过程中,若做功则做最⼤功,若耗功则耗最⼩功6、在下列关于焓的描述中,正确的是( C )A.因为ΔH=Q,所以焓是恒压热PB.⽓体的焓只是温度的函数C.⽓体在节流膨胀中,它的焓不改变D.因为ΔH=ΔU+Δ(PV),所以任何过程都有ΔH>0的结论7、下⾯关于标准摩尔⽣成焓的描述中,不正确的是( C )C.⽣成反应的温度必须是298.15KD.⽣成反应中各物质所达到的压⼒必须是100KPa8、选出下列性质参数中属于容量性质的量 ( C )A.温度TB.浓度cC.体积VD.压⼒p9、关于节流膨胀, 下列说法正确的是( B )(A) 节流膨胀是绝热可逆过程 (B) 节流膨胀中系统的内能变化(C) 节流膨胀中系统的焓值改变(D) 节流过程中多孔塞两边的压⼒不断变化10、如图,在绝热盛⽔容器中,浸⼊电阻丝,通电⼀段时间,通电后⽔及电阻丝的温度均略有升⾼,今以电阻丝为体系有:( B )(A) W =0,Q <0,U <0 (B). W>0,Q <0,U >0(C) W <0,Q <0,U >0 (D). W <0,Q =0,U >011、若将⼈作为⼀个体系,则该体系为 ( C )A.孤⽴体系B.封闭体系C.敞开体系D.⽆法确定12、刚性绝热箱内发⽣⼀化学反应,则反应体系为 ( A )A.孤⽴体系B.敞开体系C.封闭体系D.绝热体系13、下列性质属于强度性质的是 ( D )A.内能和焓B.压⼒与恒压热容C.温度与体积差A.状态⼀定,值⼀定B.在数学上有全微分性质C.其循环积分等于零D.所有状态函数的绝对值都⽆法确定15、关于等压摩尔热容和等容摩尔热容,下⾯的说法中不正确的是 ( B )A.Cp,m 与Cv,m不相等,因等压过程⽐等容过程系统多作体积功B.Cp,m –Cv,m=R既适⽤于理想⽓体体系,也适⽤于实际⽓体体系C.Cv,m=3/2R适⽤于单原⼦理想⽓体混合物D.在可逆相变中Cp,m 和Cv,m都为⽆限⼤16、对于理想⽓体,⽤等压热容Cp计算ΔH的适⽤范围为 ( C )A.只适⽤于⽆相变,⽆化学变化的等压变温过程B.只适⽤于⽆相变,⽆化学变化的等容变温过程C.适⽤于⽆相变,⽆化学变化的任意过程D.以上答案均不正确17、H=Q p此式适⽤于哪⼀个过程:( B )(A)理想⽓体从101325Pa反抗恒定的10132.5Pa膨胀到10132.5Pa (B)在0℃、101325Pa下,冰融化成⽔(C)电解CuSO4的⽔溶液(D)⽓体从(298K,101325Pa)可逆变化到(373K,10132.5Pa )2=2NH3的反应进度ξ=1mol时,它表⽰系统中 ( A )A.有1molN2和3molH2变成了2molNH3B.反应已进⾏完全,系统中只有⽣成物存在C.有1molN2和3molH2参加了反应D.有2molNH3参加了反应19、对于化学反应进度,下⾯表述中正确的是 ( B )A.化学反应进度之值,与反应完成的程度⽆关B.化学反应进度之值,与反应式写法有关C.对于指定反应,化学反应进度之值与物质的选择有关D.反应进度之值与平衡转化率有关20、对于化学反应进度,下⾯表述中不正确的是 ( B )A.化学反应进度随着反应进⾏⽽变化,其值越⼤,反应完成的程度越⼤B.化学反应进度之值与反应式写法⽆关C.对于指定的反应,反应进度之值与物质的选择⽆关D.化学反应进度与物质的量具有相同的量纲21、欲测定有机物的燃烧热Q p ,⼀般使反应在氧弹中进⾏,实测得热效为Q V。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
06章一、填空题1、热力学第二定律的微观实质可以理解为:在孤立系统内部所发生的不可逆过程,总是沿着熵增加的方向进行。
2、热力学第二定律的开尔文表述和克劳修斯表述是等价的,表明在自然界中与热现象有关的实际宏观过程都是不可逆的,开尔文表述指出了____功能转换_________的过程是不可逆的,而克劳修斯表述指出了____热传导______的过程是不可逆的。
3.一定量的某种理想气体在某个热力学过程中,外界对系统做功240J,气体向外界放热620J,则气体的内能减少 (填增加或减少),E2—E1= -380J。
4.一定量的理想气体在等温膨胀过程中,内能不变,吸收的热量全部用于对外界做功。
5.一定量的某种理想气体在某个热力学过程中,对外做功120J,气体的内能增量为280J,则气体从外界吸收热量为400 J。
6、在孤立系统内部所发生的过程,总是由热力学概率较小的宏观状态向热力学概率较大的宏观状态进行。
7、一定量的单原子分子理想气体在等温过程中,外界对它作功为200J.则该过程中需吸热_____-200__J。
8、一定量的气体由热源吸收热量526610J41810J⋅⨯,则气体对外作⋅⨯,内能增加5功____5.6⨯__J。
10849、工作在7℃和27℃之间的卡诺致冷机的致冷系数为,工作在7℃和27℃之间的卡诺热机的循环效率为。
10、2mol单原子分子理想气体,经一等容过程后,温度从200K上升到500K,则气体吸收的热量为___7479__J。
11、气体经历如图1所示的一个循环过程,在这个循环中,外界传给气体的净热量是 90 J。
12、一热机由温度为727℃的高温热源吸热,向温度为527℃的低温热源放热。
若热机可看作卡诺热机,且每一图1循环吸热2000J,则此热机每一循环作功 400 J。
13、1mol的单原子分子理想气体,在1atm的恒定压强下,从0℃加热到100℃,则气体的内能改变了 1246.5 J。
(摩尔气体常量R=8.31J·mol-1·K-1)二、选择题1、下列说法正确的是:[ A ](A)孤立系统中的可逆过程,其熵不变;孤立系统中的不可逆过程,其熵要增加;(B)一切系统状态的改变,系统的熵都要增加;(C)一切系统状态的改变,系统的熵减少;(D)孤立系统处于平衡态时,系统的熵趋于最大值,系统的无序度最低。
2、一摩尔的单原子分子理想气体,在一个大气压的恒压下,从0ºC被加热到100ºC,此时气体增加的内能约为[ D ](A)3.2J; (B) 46J; (C) 120J; (D)1250J。
3、5R2是[ C ](A)理想气体定体摩尔热容;(B)双原子分子理想气体定体摩尔热容;(C)刚性双原子分子理想气体定体摩尔热容;(D)气体定体摩尔热容。
4、1mol刚性双原子分子理想气体,当温度为T时,其内能为[ C ](A)RT23;(B)kT23;(C)RT25;(D)kT25。
5、在温度分别为327℃和27℃的高温热源和低温热源之间工作的热机,理论上的最大效率为[ B ](A)25% (B)50%(C)100% (D)75% 。
6、对于室温下定体摩尔热容.V mC为2.5R的理想气体,在等压膨胀的情况下,系统对外所作的功与从外界吸收的热量之比/W Q等于 [ ]图2(A )1/3 (B )1/4 (C )2/5 (D) 2/7。
7、对于理想气体系统来说,在下列过程中,哪个过程系统所吸收的热量、内能的增量和对外作的功三者均为负值的过程 [ ] (A )等容降压过程; (B)等温膨胀过程; (C)等压压缩过程; (D)绝热膨胀过程。
8、根据热力第二定律可知 [ ](A )功可以全部换为热,但热不能全都转换为功;(B)热可以从高温物体传到低温物体,但不能从低温物体传到高温物体; (C)不可逆过程就是不能向相反方向进行的过程; (D )一切自发过程都是不可逆的。
9、设热源的绝对温度是冷源的绝对温度的n 倍,则在一个卡诺过程中,气体将把从热源得到的热量1Q 中的多少传递给冷源? [ ](A) 1nQ ; (B) 1(n 1)Q -; (C)1Q n; (D)1Q n 1-。
10、一理想气体初始温度为T,体积为V,此气体由初始状态经绝热膨胀到体积为2V;又经等容升温到温度为T,最后经等温压缩恢复到体积V.则此过程中 [ ](A) 气体向外界放热; (B)气体对外界做功; (C) 气体内能增加; (D)气体内能减少。
11、如图2所示,1mol 理想气体从状态A 沿直线到达B,21212,2p p V V ==,则此过程系统做的功和内能的变化为 [ ](A )W>0,ΔE>0 ;(B) W<0,ΔΕ<0(C)W>0,ΔE =0 ;(D )W<0,ΔΕ>0。
三、判断题1、第二永动机是不可能实现的。
( √ )图32、内能的增量21V ,m 21ME E C (T T )μ-=-只适用于理想气体准静态过程。
( √ )3、平衡过程一定是可逆过程。
( × )4、第一永动机是可能实现的。
( × )5、系统经历一个循环过程后,它的内能为零。
( × )6、孤立系统的一切自发过程都是向着熵增大的方向进行。
( √ )7、功2V 1V w pdv =⎰的适用范围是理想气体准静态过程。
( × )8、一切自然过程都是不可逆过程。
( √ ) 9、在等体过程中系统所做的功为零。
( √ ) 10、5R 2是刚性双原子分子理想气体定体摩尔热容。
( √ )四、解答题1、如图3表示一氮气循环过程,求一次循环过程气体对外做的功和循环效率。
再一次循环过程中 温度不变 内能不变 W 为围成的面积 W=2.0*10 3由理想气体状态方程 T1、T22、64g 氧气(可看成刚性双原子分子理想气体)的温度由0℃升至50℃,〔1〕保持体积不变;(2)保持压强不变。
在这两个过程中氧气各吸收了多少热量?各增加了多少内能?对外各做了多少功? 1mol 氧气体积不变 Q=5/2R(T2-T1) 压强不变 Q=7/2R(T2-T1) 由理想气体状态方程 W=3、 一定量氢气在保持压强为4.00×510Pa 不变的情况下,温度由000C ⋅升高到0500C ⋅时,吸收了6.0×410 J 的热量。
(1) 求氢气的量是多少摩尔?图4(2) 求氢气内能变化多少? (3) 氢气对外做了多少功? 1.Q=7/2α(T2-T1) 2.由理想气体内能方程 = 3.由理想气体状态方程 W=4、一热力学系统由如图4所示的状态a 沿acb 过程到达状态b 时,吸收了560J 的热量,对外做了356J 的功。
(1) 如果它沿adb 过程到达状态b 时,对外做了220J 的功,它吸收了多少热量? (2)当它由状态b 沿曲线ba 返回状态a 时,外界对它做了282J 的功,它将吸收多少热量?是真吸了热,还是放了热? (1).Q=△E+W△E=204J Q1=404J (2).5、一台家用冰箱,放在气温为300K 的房间内,做一盘—13℃的冰块需从冷冻室取走52.0910J ⨯的热量。
设冰箱为理想卡诺致冷机。
(1)做一盘冰块所需要的功是多少?(2)若此冰箱能以212.0910J s -⨯⋅的速率取出热量,求做一盘冰块需多少时间?此冰箱的电功率是多少瓦?6、使一定质量的理想气体的状态按图5中的曲线沿箭头所示的方向发生变化,图线的BC 段是以P 轴和V 轴为渐近线的双曲线。
(1)已知气体在状态A 时的温度A T =300K ,求气体在B ,C 和D 状态时的温度。
(2)从A 到D 气体所做的总功是多少? (3)ABCD 过程中气体的内能增量是多少?图7图6(4)ABCD 过程中气体所吸收的热量各是多少?7、一定量的某种理想气体进行如图6所示的循环过程。
已知气体在状态A 的温度为027A t C =。
求: (1)气体在状态B 、C 的温度; (2)各过程中气体对外所作的功;(3)经过整个循环过程,内能的改变量和气体从外界吸收的总热量。
8、如图7为一循环过程的T —V 图线。
该循环的工质是γ mo1的理想气体。
其,V m C 和γ均已知且为常量。
已知a 点的温度为1T ,体积为1V ,b 点的体积为2V ,ca 为绝热过程。
求: (1) c 点的温度; (2) 循环的效率。
第6章一、填空题1、增大;2、功热转换,热传导;3、减少,-380;4、不变,对外做功;5、400;6、较小,较大;7、-200;8、51.5210J -⨯; 9、14 , 6.67% 。
10、7479 ; 11、90J ;12、400; 13、1246.5。
二、选择题1、(A );2、(D);3、(C );4、(C );5、(B );6、(D);7、(C);8、(D );9、(C); 10、(A); 11、(C)。
三、判断题1、∨ ;2、∨;3、×;4、 ×;5、×;6、∨;7、×;8、∨;9、∨;10、∨。
