什么是析氢过电位
整理-电化学基本概念

电化学基本概念1. 导体(Conductor):能导电的物质称为导体。
有些导体依靠其中的电子传递电流,称为电子导体或第一类导体(如金属,石墨,PbO2、Fe3O4等金属氧化物);有些导体靠离子的移动来实现其导电任务,称为离子导体或第二类导体(如电解质溶液,熔融电解质,固体电解质)。
一般来说,离子导体的导电能力比电子导体小得多。
2. 电极反应(Electrode Reaction):电子导体能够独立地完成导电任务;而要想让离子导体导电,必须有电子导体与之相连接。
但流经两类导体的电荷载体不一样,为了使电流持续不断地通过离子导体,在两类导体界面上必然会有得电子或失电子的反应发生。
这种在两类导体界面界进行的有电子得失的化学反应称为电极反应或电化学反应。
★自发电池 / 电解池3. 阴极(Cathode):电流通过两类导体界面时,使正电荷从电极进入溶液(发生还原反应)的电极。
4. 阳极(Anode):电流通过两类导体界面时,使正电荷从溶液进入电极(发生氧化反应)的电极。
5. 法拉第(Faraday):一摩尔电子的电量。
摩尔常数N A =6.02×1023;每个电子的电量 e 0 = 1.602×10-19库仑(Coulomb);一库仑为一安培·秒(Ampere-second);所以:1法拉第 = 6.02×1023×1.602×10-19≈96500库仑1法拉第 = 6.02×1023×1.602×10-19÷3600≈26.8安时(Ampere-hour)6. 法拉第定律(Faraday Law):在整个电路中各处的电流是相等的,因此电极上通过的电量与电极反应的反应物和反应产物之间有如下的精确关系:若反应为M z + + z e- = M,则生成1摩尔 M 所需的电量为 z 法拉第。
★法拉第定律成立的前提是:电子导体中不包含离子导电的成分,而离子导体中也不包含电子导电的成分。
析氢腐蚀与吸氧腐蚀

扩散控制的腐蚀过程中,由于 腐蚀速度只决定于氧的扩散速 度,因而在一定范围内,腐蚀 电流将不受阳极极化曲线的斜 率和起始电位的影响。如图4-9 中A、B、C三种合金的阳极极 化曲线不同,但腐蚀电流都一 样。也就是说,这种情况下腐 蚀速度与金属本身的性质无关。 例如,钢铁在海水中的腐蚀, 普通碳钢和低合金钢的腐蚀速 度没有明显区别。
,氧还原反应中的电子数n =4,代入式(4-12)可得氧的极限扩
散电流约:iL= 4×96500×10-9×0.3/10-4=1.16A/m2。
腐蚀速度约为lmm/a也就是说,这种条件 下,不管腐蚀电池的电动势大小如何,腐 蚀速度被氧的阴极扩散速度限制在lmm/a 以内。
但是,如果搅拌溶液,或者在流动的溶液 中,特别是海水飞溅区的腐蚀,由于氧的 扩散速度大大加快,金属的腐蚀速度可能 由氧的阴极还原反应即氧的离子化反应速 度控制。
若含S的钢中加入Cu或Mn,其作用有二,一 是其本身是阴极,可加速Fe的溶解;另一方面 却可抵消S的有害作用。因为溶解的Cu+又沉 积在Fe表面,与吸附的S2-离子形成Cu2S,在 酸中不溶(溶度积为10-48)。因此可消除S2-对电 化学反应的催化作用。加入Mn也可抵消S的有 害作用,因为一方面可形成低电导的MnS;另 一方面减少了铁中的S含量,而且MnS比FeS 更易溶于酸中。
(2) 加入氢过电位大的成分,如Hg、Zn、Pb等。 (3) 加入缓蚀剂,增大析氢过电位。如酸洗缓蚀剂若丁,
有效成分为二邻甲苯硫脲。
(4) 降低活性阴离子成分,如Cl-、S2-等。
7.2 吸氧腐蚀
7.2.1 吸氧腐蚀的必要条件 以氧的还原反应为阴极过程的腐蚀,称为
氧还原腐蚀或吸氧腐蚀。发生吸氧腐蚀的 必要条件是金属的电位比氧还原反应的电 位低: EM < (4-8) 在中性和碱性溶液中氧还原反应为: O2+2H2O+4e 4OH-
各种金属的氢过电位

各种金属的氢过电位在化学中,氢过电位指的是一种物理量,代表了一种金属在水中或弱酸溶液中,与氢离子结合形成氢气的倾向程度。
当金属的氢过电位比水中的氢离子的还原电位更高时,金属会被电化学反应中的氢离子还原,从而被溶解。
氢过电位对于金属的腐蚀和防护等相关行业十分重要,下面将对几种金属的氢过电位进行粗略介绍。
镍(Ni)镍是一种优良的耐腐蚀材料,其氢过电位较高,可达-0.25V。
因此,镍可在酸碱环境下常年使用,并广泛用于冶金、冶炼、化工、制药等行业。
另外,镍还被广泛用于合金材料和电镀技术中。
铜(Cu)铜是另一种重要的金属材料,其氢过电位约为-0.34V。
铜广泛用于制作电线、电缆、地铁轨道、建筑外墙装饰等行业,而且在机械加工和电子行业中也很有用。
铝(Al)铝是一种轻便而坚固的材料,具有许多良好的性质,如导电、导热、抗腐蚀和可塑性等。
它的氢过电位约为-1.66V,比较低,但这并不影响其在航空、轨道交通、建筑等领域中的广泛应用。
锌(Zn)锌是常用的金属材料之一,其氢过电位为-0.76V,低于铜和镍,但高于铁。
锌在防腐蚀、合金材料、电池、家用电器等领域有着广泛的应用。
铁(Fe)铁是一种广泛使用的金属,其氢过电位为-0.44V。
虽然相对其他金属,它的氢过电位较低,但是在建筑物、轨道交通和汽车制造等领域中仍然有着重要的作用。
不过,铁的腐蚀性比较强,因此要对其进行保护,尤其是在潮湿环境下。
以上是几种常见金属的氢过电位介绍,有需要的读者可以在实际应用中了解更多详细信息。
在金属选择和腐蚀防护等方面,了解金属的氢过电位是非常有用的,可以帮助避免不必要的损失和其他问题。
材料腐蚀与防护-金属的电化学腐蚀原理(2)

此时,两电极的稳定电位差0.05+0.83=0.88V,
铜-锌腐蚀原电池示意图
电池刚接通时,毫安表指示的起始瞬间电流 值
电流变化
瞬间电流很快下降,经过一段时间 后,达到一个比较稳定的电流值, I2=0.15mA ???
腐蚀极化图
+E EeC
β
假定任何电流下,阴极阳极的极 化率为常数,称为Evans图(U. R. Evans)。 S所对应的电位Emix,称为混合电 位。由于Emix电位下的金属处于 腐蚀状态,故混合电位就是金属 的自腐蚀电位Ecorr,对应的电流 称为腐蚀电流,用Icorr表示。 I 腐蚀电位是一种不可逆非平 衡电位,需由实验测得,腐蚀 电流表示金属腐蚀的速率,对 于均匀腐蚀和局部腐蚀都适用。
CA
PA E A E A 100% 100% 100% e e PC PA PR EC E A ER EC E A
PR ER ER 100% 100% 100% e e PC PA PR EC E A ER EC E A
S2O62 +2e 2SO42
3.溶液中中性分子的还原反应 吸氧反应 氯的还原反应
如:
O2 +H2O+4e 4OH Cl2 2e 2Cl
4.不溶性化合物的还原反应
如:
Fe(OH)3 +e Fe(OH)2 OH
电路接通
腐蚀电池接通前后电位变化
过电位
电极电位的偏离值称为极化值。 通常引入一新术语--过电位或超电位(取正值)来表征电 极极化的程度。
氢的析出
根据a值的大小,可将电极材料分为如下三类:
高过电位金属:a=1.0~1.5V, 如:Pb, Hg, Ti,Cd, Zn,Ga,Bi,Sn 等
中过电位金属:a=0.5~0.7V, 如:Fe , Co, Ni, Cu, W, Au 等
低过电位金属:a=0.1~0.3V, 如:Pt,Pd,Ru等铂族金属。
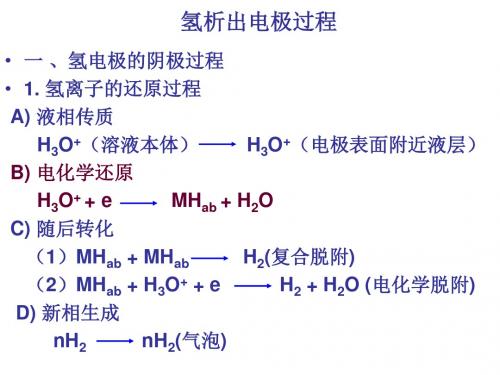
氢析出电极过程
• 一 、氢电极的阴极过程
• 1. 氢离子的还原过程
A) 液相传质
H3O+(溶液本体) B) 电化学还原
H3O+(电极表面附近液层)
H3H2O
(1)MHab + MHab (2)MHab + H3O+ + e D) 新相生成
H2(复合脱附) H2 + H2O (电化学脱附)
溶液温度升高,反应活化能降低,析氢过电位降低。
氢析出电极过程机理有:缓慢放电机理;复合脱附机理; 化学脱附机理。
nH2
nH2(气泡)
二、 析氢过电位及影响因素
析氢过电位是在某一电流密度下,氢实际析出的电位与 氢的平衡电位的差值。析氢,高过电位与电流密度存在 塔菲尔关系。
η=a+ blgJ ——Tafel公式
a: 单位电流密度(如1A/cm2)下的析氢过电位。
a 值大小反映了电极过程的不可逆程度,值越大,越不可逆。 a 值大小与电极材料、表面状态、溶液组成、温度等有关。
过电位与自由基

• [练习]教材P98的9题.下列电池的电动势 E0=0.46V,φZn2+/Zn=-0.76V,则氢电极的电极液 的pH=______[答案:5.1] • [分析]E0=φ+-φ-=φ(H+/H2)φZn2+/Zn=φ(H+/H2)+0.76 • φ(H+/H2)=-0.3V • φ(H+/H2)=0.0592/2 lg[H+]2=0.3 • [H+]=10-5.1mol·L-1 pH=5.1
• 塔菲尔公式 • 公式名称:塔菲尔公式 公式名称 塔菲尔公式 • 拼音:tafeiergongshi 拼音 • 英文名称: 英文名称:Tafel's equation • 说明:塔菲尔(Tafel)1905年在研究氢超电势时, 年在研究氢超电势时, 说明 塔菲尔( 塔菲尔 ) 年在研究氢超电势时 发现在一定范围内,超电势( )与电流密度( ) 发现在一定范围内,超电势(η)与电流密度(i)有如 下关系: 下关系: • η=a+b*log|i|。 。 • 此式称为塔菲尔公式, 、 称为塔菲尔常数 称为塔菲尔常数, 此式称为塔菲尔公式,a、b称为塔菲尔常数,它们 决定于电极材料、电极表面状态、温度和溶液组成等。 决定于电极材料、电极表面状态、温度和溶液组成等。 测定a、 值是研究电极反应动力学的一种重要途径 值是研究电极反应动力学的一种重要途径, 测定 、b值是研究电极反应动力学的一种重要途径,也 是电解工业推算槽电压与电极电流密度关系的依据之一。 是电解工业推算槽电压与电极电流密度关系的依据之一。 该公式适用于电流密度较高的区域。 非常小时 非常小时, 该公式适用于电流密度较高的区域。在i非常小时,此 式不适用。 很小 超电势也很小(η<± 很小、 式不适用。在i很小、超电势也很小 ±0.03伏)时,超 伏时 电势与电流密度呈线性关系, 为比例常数。 电势与电流密度呈线性关系,即η=ki。k为比例常数。 。 为比例常数
[物理]第四章析氢腐蚀与吸氧腐蚀
![[物理]第四章析氢腐蚀与吸氧腐蚀](https://img.taocdn.com/s3/m/77bcf7d2ba4cf7ec4afe04a1b0717fd5360cb2f7.png)
★和析氢腐蚀一样,对吸氧腐蚀影响因素的讨论 也只局限在电极反应,而没有涉及腐蚀过程的 产物。如金属氧化物、氢氧化物或更复杂化合 物(如铁锈)。它们在金属表面形成膜,必然对 腐蚀过程造成重大影响。
4、影响吸氧腐蚀的因素
★氧极限扩散电流密度id为:
3、吸氧腐蚀的控制过程及特点
1)如果腐蚀金属在溶液中的电位较正,腐蚀过程 中氧的传递速度又很大,则金属腐蚀速度主要由 氧在电极上的放电速度(吸氧阴极反应速度)决 定,属于活化极化控制。
2)如果腐蚀金属在溶液中的电位非常负,如Zn、 Mn等,阴极过程将由氧去极化(吸氧反应)和 氢离子去极化(析氢反应)两个反应共同组成。
几种钢的氧扩散控制腐蚀速度
钢
的
腐
热处理的影响
蚀
0.39
冷拉,500oC退火
0.39
900oC正火20分
0.39
850oC淬火
各试样在300oC~800oC回火
2Had H2
3)H2分子聚集形成气泡离开电极表面。
由于反应途径和控制步骤不同,其反应动力 学机制就会不同。
如果某一步骤进行得较缓慢,就会使整个氢 去极化反应受到阻滞,由阳极来的电子就会在阴 极积累,使阴极电位向负方向移动,产生一定的 析氢过电位H。
研究表明,第一步是整个电极反应最慢的步 骤。
4、析氢腐蚀的阴极H+ 还原反应的动力学特征
5、析氢腐蚀的影响因素
★溶液方面
1)pH值 溶液pH值对析氢腐蚀速度影响很大,随pH值下降,
腐蚀速度迅速增大。 pH值下降造成两方面的影响。一 方面pH值下降使析氢反应平衡电位Eec正移,腐蚀倾向 增大;另一方面pH值下降又使阴极极化过电位减小, 同样使腐蚀速率增大。
材料的腐蚀与防护重点

1.腐蚀:⑴材料的腐蚀:指材料体系与环境之间发生作用而导致材料的破坏或变质的现象⑵金属材料的腐蚀:金属受到环境的高温化学氧化、电化学溶解等作用,使金属单质变为化合物(冶金的逆过程),导致金属受到损失和破坏的现象自然条件下,金属总是存在着自发回归低能稳定态的倾向——与周围介质(通常为氧)反应形成低能态的化合物,在这个过程中,金属失去电子被氧化,发生腐蚀,因此可以将金属腐蚀理解为冶金的逆过程⑶非金属材料的腐蚀:非金属受到环境的化学或物理作用,导致非金属构件变质或破坏的现象。
2.材料体系与环境的作用包括化学反应、电化学反应、物理溶解等。
3.金属及其合金的腐蚀主要是化学和电化学作用引起的破坏,有时伴随有机械、物理或生物作用。
4.材料的破坏:材料的重量损失、开裂、穿孔、溶解、溶胀等。
材料的变质:材料的服役性能变差,如力学强度下降,弹性降低、韧性减小、脆性增大。
5.金属腐蚀:⑴危害:①腐蚀造成重大的直接经济损失②间接经济损失③人身伤亡和环境污染④阻碍了科学技术的发展⑵控制方法:①合理的结构设计②正确选材和发展新型耐蚀材料③研究可行的表面处理工艺④改善环境和使用合适的缓蚀剂⑤电化学保护⑶有利的一面:①电化学加工②制备信息硬件的印刷线路③腐蚀金相试样6.腐蚀分类:⑴按照腐蚀环境:干燥气体腐蚀(干腐蚀)、电解液中的腐蚀、非电解质中的腐蚀、熔融金属的腐蚀(物理腐蚀)⑵按照腐蚀机理:化学腐蚀(化学腐蚀是指金属表面与非电解质直接发生化学反应而引起的破坏)、电化学腐蚀(金属的电化学腐蚀指的是金属在水溶液中与离子导电的电解质发生电化学反应产生的破坏)⑶按照腐蚀形态:①普遍性(全面)腐蚀:全面腐蚀是指发生在金属表面的全部或大部损坏,也称普遍性腐蚀②局部腐蚀:局部腐蚀是指只发生在金属表面的狭小区域的破坏。
其危害性比均匀腐蚀严重得多分类:小孔腐蚀(又称坑蚀和点蚀,在金属表面上极个别的区域被产生小而深的孔蚀现象)、缝隙腐蚀(在电解液中金属与金属或金属与非金属表面之间构成狭窄的缝隙,缝隙内离子的移动受到了阻滞,形成浓差电池,从而使金属局部破坏的现象)、电偶腐蚀(两种电极电位不同的金属或合金互相接触,并在一定的介质中发生电化学反应,使电位较负的金属发生加速破坏的现象)、晶间腐蚀(金属在特定的腐蚀介质中,沿着材料的晶界出现的腐蚀,使晶粒之间丧失结合力的一种局部破坏现象)、选择性腐蚀(多元合金在腐蚀介质中,较活泼的组分优先溶解,结果造成材料强度大大下降的现象)③应力作用下的腐蚀断裂:应力腐蚀是金属在特定的介质中和在静拉伸应力(包括外加载荷、热应力、冷加工、热加工、焊接等所引起的残余应力等)下,所出现的低于强度极限的脆性开裂现象磨损腐蚀:是由机械因素(湍流、漩涡、多相流体冲击、空化作用、微振摩擦等)和腐蚀介质联合作用而产生的金属材料破坏现象7.阳极反应:金属原子从金属转移到介质中并放出电子的过程,即氧化过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
什么是析氢过电位,和析氧过电位,有什么用?
能够给我讲清楚电吗,机理,为什么析氢过电位会略低,析氧过电位会略高,这样与电解有什么关系吗?
实际的电极反应在进行的时候,会发生阴极电位比理论值低,阳极电位比理论值高的情况,这就叫做过电位.如果阴极析出的是氢气,就叫析氢过电位,析氧过电位也一样.过电位是由于电极的极化而产生的,就是说实际的电极反应已经偏离了理想的电极反应.
析氢过电位(一定程度上)可以用塔菲尔常数衡量,塔菲尔常数越大,过电位越大.常见金属塔菲尔常数较大的有Pb1.56,Hg1.41,Zn1.24,Sn1.20等.
详细的东西我分两部分讲。
A.电化学有一个很有名的方程叫Nernst(能斯特)方程,大意是电极的电位与电极周围的离子浓度有关,氧化形式的离子浓度越高,或还原形式的离子浓度越低,则电极的电位就越高,反之亦然。
B.实际的电极在工作过程中,会发生偏离理想电极模型的情况,这就叫极化。
电极的极化有两种:
1.浓差极化。
由于实际电极反应要消耗附近的溶液的溶质(这是理想电极不考虑的),造成浓度下降,而溶液的浓度扩散不及时,导致电极周围溶液浓度下降。
对析氢电极(阴极),是氧化态浓度下降;对析氧电极(阳极),是还原态浓度下降。
于是由Nernst方程,析氢电位会下降,而析氧电位会上升。
2.活化极化。
由于电极反应并不是如理想中的那样迅速,所以当电位达到理论电位,电极反应的速率却仍然很慢。
要使速率达到可观的水平,必须升高电位,这就叫活化过电位,而这种效果在气体的析出上非常明显。
塔菲尔(Tafel)认为活化过电位η与电流密度i有η=a+blgi的关系,其中a,b叫塔菲尔系数。
不同金属的b值相差不大而a相差明显,因此常以a作为活化过电位大小的判据。
由于过电位的存在,因此在实际的电解操作中,要把这些问题也考虑进去。
比如电解水,理论上O2/H2O的电位是1.23V,但实际上一般需要达到1.36V左右,这就是O2的析出存在活化过电位的结果
自腐蚀电位(Ecorr)是一个特定的腐蚀体系在没有外加电流的情况下测得的金属电位。
Ecorr负值越大,腐蚀倾向越大;其正值越大,腐蚀倾向越小。
在电解池中,析氢是还原反应,析氧是氧化反应,当电极电势越负时,电子能量越高,电子越容易从电极迁移至溶液,析氢越容易发生。
同理,电极电势越正,电子能量低,电子从溶液转移至电极,析氧越容易发生。
故析氢电位越负,越容易析氢;析氧电位越正,越容易析氧。
