化工原理第六章吸收解读
《化工原理吸收》课件

03 常用的模拟方法包括物理模型模拟、数学模型模 拟和实验模拟等。
吸收过程的优化策略
01
吸收过程的优化策略是通过调整操作条件和设备参数
来提高吸收效果的方法。
02
优化策略通常包括选择合适的吸收剂、优化操作条件
、改进设备结构和操作参数等。
增加流速可以提高溶质的 传递速率,但同时会增加 设备的投资和能耗。
04
吸收设备与流程
吸收设备的类型与特点
填料塔
结构简单,易于制造, 适用于气体流量较小、 溶液组成较低的情况。
板式塔
传质效率高,处理能力 大,适用于气体流量较 大、溶液组成较高的情
况。
喷射器
结构简单,操作方便, 适用于气体流量较小、 溶液组成较低的情况。
THANK YOU
感谢各位观看
溶解度与相平衡的关系
物质在气液两相中的溶解度差异是吸收过程得以进行的驱动力。
亨利定律与相平衡
亨利定律:气体在液体中的溶解度与该气体在气液界 面上的分压成正比。
输标02入题
亨利定律的数学表达式:(Henry's Law):(c = kP)
01
03
亨利定律的应用:通过测量气体的溶解度和气液界面 上的分压,可以计算出亨利常数,进而了解物质在特
03
优化策略的目标是提高吸收效果、降低能耗和减少环
境污染等。
06
吸收的实际应用
工业废气的处理
工业废气处理
吸收法可用于处理工业生产过程中产生的废气,如硫氧化物 、氮氧化物等有害气体。通过吸收剂的吸收作用,将有害气 体转化为无害或低害物质,达到净化废气的目的。
化工原理第六章第三节

称为“气相总传质单元高度” ,用
表示
HOG
HOG
V KY a
NOG
Y1
Y2
Y
dY Y*
——气相总传质单元数
Z HOGNOG
2020/10/10
Z HOLNOL
—液相总传质单元高度,m ;
HOL
—液相总传质单元数,无因次 ;
NOL
依此类推,可以写出通式:
HOL
L K xa
NOL
X1
X2
X
dX *
X
dX *
X
KY a, KX a
气相总体积吸收系数及液相总体积吸收系数
物理意义 在:推动力为一个单位的情况下,单位时间单 位体积填料层内吸收的溶质量。
2、传质单元高度与传质单元数
1)传质单元高度与传质单元数的概念
2020/10/10
V 的单位
[kmol / s]
KY a
[kmol /(m2 s)][m2 / m3 ][m2 ] [m]
X
填料层高度=传质单元高度×传质单元数
试写出用膜系数及相应的推动力表示的填料层高度的计算式。
2020/10/10
Z HG NG
HG
V k y a
—气膜传质单元高度,m
NG
Y1
Y2
Y
dY Yi
—气膜传质单元数
Z HL NL
HL
L k x a
—液膜传质单元高度,m
NL
X1
X2
dX Xi X
3)每小时用水量
L 2Lmin 2 25.8 51.6kmol/ h 928.8kg / h
三、塔径的计算 D 4VS
u
—空塔气速
化工原理 第六章 吸收
由 y * mx得,
Y* mX 1 Y * 1 X
*
mX Y 1 (1 m)X
当溶液浓度很低时,X≈0, 分母约等于1. 上式简化为:
Y mX
*
亨利定律的几种表达形式也可改写为
P * x , c HP E y Y * ℃ 下 , 测 得 氨 在 水 中 的 平 衡 数 据 为 : 0.5gNH3/100gH2O浓度为的稀氨水上方的平衡分压为400Pa, 在该浓度范围下相平衡关系可用亨利定律表示,试求亨利系
——逆流吸收塔操作线方程
在m—n截面与塔顶截面之间作组分A的衡算
VY LX 2 VY2 LX
L L Y X (Y2 X 2 ) V V
——逆流吸收塔操作线方程
表明 : 塔内任一截面的气相浓度Y与液相浓度X之间成直线 关系,直线的斜率为L/V。
吸收操作线总是位于平衡线的上方,
s
EM s
1000 7.32 104 kmol / m3 Pa 7.59 10 4 18
E 7.59 10 4 m 3 0.749 P 101.33 10
三、用气液平衡关系分析吸收过程
1、判断过程的方向
例:在101.3kPa,20℃下,稀氨水的气液相平衡关系为 :
L L Y1 X 1 Y2 X 2 V V
吸收率 A 混合气中溶质A 被吸收的百分率
Y2 Y1 (1 A )
2、吸收塔的操作线方程式与操作线
在 m—n截面与塔底截面之间作组分A的衡算
VY LX1 VY1 LX
L L Y X (Y1 X 1 ) V V
操作线位于平衡线下方,则应进行脱吸过程。
并流吸收塔的操作线:
化工原理下册,吸收

Y * mX
三、亨利定律各系数间的关系 1. m和E的关系 p A Ex, y* mx 由 得
p y* E m
A
又由分压定律
p y*P
E m P
A
得 所以
y*P y* E m
2. H和E的关系 设 MA——溶质的摩尔质量,kg/kmol; • MS——溶剂的摩尔质量,kg/kmol; • L——溶液的密度,kg/m3; • mA——溶质在液相中的质量浓度,kg/m3; • mS——溶剂在液相中的质量浓度,kg/m3; • cS——溶剂的摩尔浓度,kmol/m3。
得 所以
dpA N A RT constant dz D
pA与z成线性关系,且pA随z减小。
或
D N A dz dp A RT
定积分上式,得
z
z
0
N A dz
pA2
p A1
D dp A RT
D pA2 所以 N A 0 dz RT p A1 dp A D p A2 p A1 所以 N A z RT D p A1 p A2 NA RTz 显然,上述结论完全适用于组分B。
二、摩尔比 1.定义:
x 液相中溶质的摩尔数 X 1 x 液相中溶剂的摩尔数
y 气相中溶质的摩尔数 Y 1 y 气相中惰性气体的摩尔 数
2.摩尔比表示的亨利定律 由
得
x X 1 x
X x 1 X
,
,
y Y 1 y Y y 1 Y
Y* X m 1 Y * 1 X
二、分类 • 物理吸收,H2O吸收CO2 • 化学吸收,NaOH溶液吸收CO2
• •
单组分吸收,H2O吸收乙醇 多组分吸收,液态烃吸收气态烃
第六章吸收化工原理

【例6-1】 总压为101.325kPa 、温度为20℃时,1000kg 水中溶解15kg NH 3,此时溶液上方气相中NH 3的平衡分压为2.266kPa 。
试求此时之溶解度系数H 、亨利系数E 、相平衡常数m 。
解:首先将此气液相组成换算为y 与x 。
NH 3的摩尔质量为17kg/kmol ,溶液的量为15kg NH 3与1000kg 水之和。
故0156.018/100017/1517/15=+=+==BA A A n n n n n x022403251012662...Pp y *A*===436.10156.00224.0*===x ym由式(6-11) E =P ·m =101.325×1.436=145.5kPa或者由式(6-1)3.1450156.0266.2*===xp E A kPa溶剂水的密度ρs =1000kg/m 3,摩尔质量M s =18kg/kmol ,由式(6-10)计算H382.0183.1451000=⨯=≈ssEMH ρkmol/(m 3·kPa )H 值也可直接由式6-2算出,溶液中NH 3的浓度为 ()()869.01000/10001517/15//=+=+==ss A AA A A m m Mm V n c ρkmol/m 3所以 383.0266.2869.0*===AA p c H kmol/(m 3·kPa )【例6-2】 在20℃及101.325kPa 下CO 2与空气的混合物缓慢地沿Na 2CO 3溶液液面流过,空气不溶于Na 2CO 3溶液。
CO 2透过厚1mm 的静止空气层扩散到Na 2CO 3溶液中。
气体中CO 2的摩尔分数为0.2。
在Na 2CO 3溶液面上,CO 2被迅速吸收,故相界面上CO 2的浓度极小,可忽略不计。
CO 2在空气中20℃时的扩散系数D 为0.18cm 2/s 。
问CO 2的扩散速率是多少?解:此题属单方向扩散,可用式6-17计算。
化工原理 第六章 吸收

M液 M剂
表6-1某些气体水溶液的亨利系数值(E×10-6/kPa)
由表6-1中的数值可知:不同的物系在同一个温度下 的亨利系数E值不同;当物系一定时,亨利系数随温度升 高而增大,温度愈高,溶解度愈小。所以亨利系数值愈大, 气体愈难溶。在同一溶剂中,难溶气体的值很大,而易溶 气体的值很小。
编辑ppt
体,则混气中的A组分有:
cA
nA V
pA RT
(6-5)
编辑ppt
第二节 吸收中的气液相平衡
二、气液相平衡关系 气液相平衡关系是指气液两相达到平衡时,被吸收的 组分(吸收质)在两相中的浓度关系,即吸收质在吸收剂 中的平衡溶解度。 1.气体在液体中的溶解度 在恒定的压力和温度下,用一定量的溶剂与混合气体 在一密闭容器中相接触,混合气中的溶质便向液相内转移, 而溶于液相内的溶质又会从溶剂中逸出返回气相。随着溶 质在液相中的溶解量增多,溶质返回气相的量也在逐渐增 大,直到吸收速率与解吸速率相等时,溶质在气液两相中 的浓度不再发生变化,此时气液两相达到了动态平衡。平 衡时溶质在气相中的分压称为平衡分压,用符号 表示; 溶质在液相中的浓度称为平衡溶解度,简称溶解度;它们 之间的关系称为相平衡关系。
化工原理
第六章 吸 收
编辑ppt
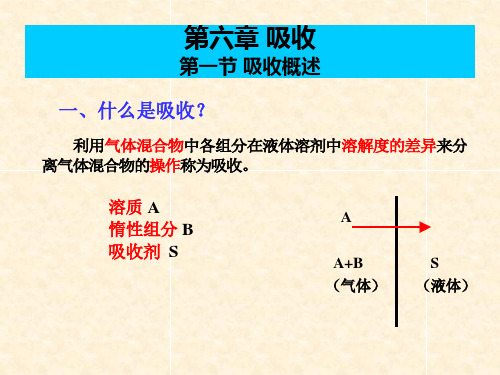
第一节 概 述
一、吸收综述 吸收就是分离气体混合物的单元操作,即是用适当的液体吸收剂处理 气体混合物,利用混合气中各组分在液体溶剂中溶解度的不同而分离气体 混合物的操作,其实质是一种典型的气、液相扩散传质过程。 吸收系统包括气、液两个相,气相由可溶于吸收剂的气体组分(称为吸 收质或溶质)和不溶或难溶于吸收剂的惰性组分(称为惰性气或载体)组成, 液相则是液体吸收剂(或称为溶剂);吸收操作所得到的溶液称为吸收液, 其成分为吸收剂和溶解于其中的吸收质;排除的气体称为吸收尾气,其主 要成分应为惰性组分和残余的溶质。 吸收的原理:就是利用混气中,各组分在吸收剂中有不同的溶解度的 特点,选择适宜的吸收剂对混合气中组分进行选择性吸收,以达到从混合 气中分离或提纯组分之目的。 与吸收操作相反,使吸收质从吸收剂中分离出来的操作称为解吸或脱 吸。其目的是循环使用吸收剂或回收溶质,实际生产中吸收过程和解吸过 程往往联合使用。 吸收和蒸馏一样也牵涉到气、液两相间的质量传递,但蒸馏是依据混 液中各组分挥发度的不同而得以分离;吸收则基于混气中各组分在吸收剂 中的溶解度不同而得以分离;蒸馏属双向传质,吸收为单相传质。
化工原理第六章吸收

吸收
§1 §2 §3 §4 §5
气体吸收的相平衡关系 传质机理与吸收速率 吸收塔的计算 吸收系数 脱吸及其他条件下的吸收
概述
1、定义 吸收:利用混合气体各组分在液体中溶解度 差异,使某些易溶组分进入液相形成 溶液,不溶或难溶组分仍留在气相, 实现混合气体分离。 解吸:也称为脱吸,与吸收相反的过程,即 溶质从液利。
2.1.2 亨利定律
体系:单组分、低浓、恒温、物理吸收。 总压P<5×105Pa,一定温度下溶质在液相中 的溶解度(平衡)与其在气相中的分压成正比。
亨利系数(E): (单位与分压单位一致) ① 理想溶液:P不高,T恒定,亨利定律 与拉乌尔定律一致,即:E=p0
② 非理想溶液: E≠p0,但在一定浓度范 围内(低浓),E=const. E=f(T)。
混合气中某些组分在气液相界面溶解、在气相和液
相内由浓度差推动的传质过程。
分离
气相 1.定义:
液相
气相 NH3 + 空气 水 NH3
2.依据:溶解度不同
吸 收
NH3: 气相
液相
٭吸收质(溶质):A ٭惰性组分(载体):B
٭吸收剂:S ٭吸收液:S+A
٭尾气:B+(A)
2、吸收分离操作的目的与任务 制取液体产品:如盐酸、硝酸,碳化氨水吸收CO2 制碳酸氢氨等。 分离混合气体吸收获得某些组分:如用液态烃吸收 裂解气中的乙烯、丙烯等。 气体净化除去混合气体中杂质:如合成氨原料气脱 CO2等; 尾气处理和废气净化:脱SO2、NOx等 分离基础:各组分溶解度的差异
例2: 已知20℃时,1atm下氨在水中的溶 解度数据(p85)。绘制p*~x及Y*~X曲 线,计算E、m,并指出服从亨利定律的范围。
天津大学版 化工原理 第六章 脱吸及其它条件下吸收 ppt 课件

同理: dG Ld ( x ) L dx
1 x
而
1 x dG N AdA K y ( y y )a dz K x ( x x )a dz
L dx K x ( x x )a dz 1 x x1 Ldx z x 2 K x a ( 1 x )( x x )
2、吸收过程是非等温的,沿塔高有温度分布;
3、膜传质系数将与浓度、流动状况、温度有关,不再是常数;
填料塔微元段内吸收的溶质量:
dG d ( V y ) d ( L x ) V V 1- y L L 1- x
y dy dy dG Vd ( )V V 2 1 y 1 y (1 y )
(2)最小气液比和载气流量的确定 当吸收液与载气在解吸塔中 V, Y L, X 逆流接触如图所示时,吸收 液流量,吸收液进出口组成 V, Y 及载气进塔组成通常由工艺 m' n' 规定,所要计算的是载气流 L, X 量V及填料层高度。 采用处理吸收操作线类似的 V, Y L, X 方法,可得到解吸操作线方 图 5-22 逆流解吸塔示意图 程
(二)变温平衡曲线的确定 如图,塔内各截面处的组成xi各对应 一条等温平衡线。 作法: 1、确定xi与ti 的对应关系,这样可在指定 的xi下,算出ti ; 2、 取一系列xi值,得 到相应ti值;3、在x-y座标上做出一系列ti 下的等温平衡曲线;4、xi与ti线的交点纵坐 标即为 5、 连接所有交点得到的曲线即 为该过程的变温平衡曲线。
4、化学吸收时:溶质从 气相主体到气液相界面 的传质机理和传质系数 并未受影响,与物理吸 收相同;液相中反应对 传质的影响可分为以下 两个方面。 (1)反应使液相主体中A组分浓度大为降低,从而 使传质推动力增大,在多数工业化学吸收中趋于 零;
