化学反应工程总结
化学反应工程知识点梳理(精华版)
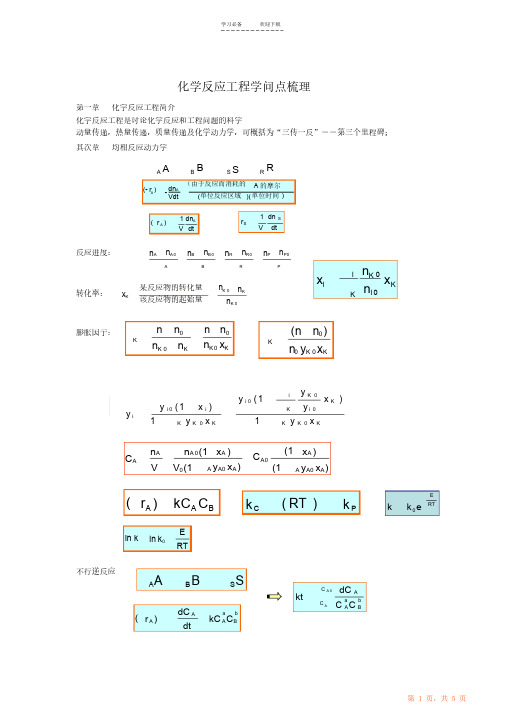
化学反应工程学问点梳理第一章化学反应工程简介化学反应工程是讨论化学反应和工程问题的科学动量传递,热量传递,质量传递及化学动力学,可概括为“三传一反”--第三个里程碑; 其次章均相反应动力学AA- dn A VdtBSSRBR(由于反应而消耗的 A 的摩尔数) (- r ) A (单位反应区域 )( 单位时间) dn dt1 V 1 dn S r SA ( r )A V dt反应进度:n A n A 0An Bn B 0Bn Rn R 0Rn P n P0Pn K i 0x ix K 某反应物的转化量 该反应物的起始量n i 0n K 0 n K 0n K转化率:x KKn n K 0 n 0 n Kn n 0 (n n 0 )膨胀因子:KKn K 0 x Kn y x 0 K 0 Ky i K 0 y ( 1x )i 0 K y ( 1 x i )y i i 0 Ky i1y x 1y x KK 0 K KK 0 Kn A Vn A 0 (1 x A ) (1 x A ) A y A0 x A)C AC A0V 0 (1A y A0 x A)(1ERT( r A ) kC A C Bk C( RT )k Pkk e0 E RTln kln k 0不行逆反应AABBSSdC C A 0 A kta b BC CC AAdC A dtab ( r A )kC ACB均相催化反应 CC 为催化剂浓度dC Adt( r )(kC )C A C A自催化反应 → A + C 2C + RdC A dt( r A )kC A C CR+S串联反应 PA + B总收率n P n A0 n P 0n AP单位时间内生成 单位时间内消耗 P 的摩尔数A 的摩尔r p ( r A )瞬时收率dC P / dt dC A / dtdC P dC A得率 yieldX ( n Pn P 0 ) / n A 0P总挑选性 目的产物 P 所生成的摩尔数与副产物S 生成的摩尔数之比,用 S0 表示:n P n S n P 0n S 0S 0αA2 αA1 AαS S 平行反应( 副 )αP P A(主)dC A dt( r A ,1) k 1C A( r A,2) k 2 C A( r A )( r A,1) ( r A,2 )(k 1k 2 )C AdC dtdC P dtp P S S r P( r A ,1 )k 1C Ar Sk 2 C AA,1A ,1A ,2( k 1 k 2 ) tC AC A 0ek 1k 2AP串联反应S (均为一级反应)dC PdtdC S dtr Pk 1 C A k 2 C P r Sk 2 C P第三章 抱负均相反应器间歇反应器 (BSTR) 反应时间dx r dC x A C A A A t C 等容过程,液相反应A 0( )C A 0( r )A A 实际操作时间 (operating time)= 反应时间 (t) + 帮助时间 auxiliary time(t')反应体积 V 是指反应物料在反应器中所占的体积V = v0 (t + t')VV 实际的反应器体积为:实际为装料系数 (the volume charge coefficient) ,通常在 ~ 平推流反应器 PFR 空时反应器的容积进料的体积流量V v 0反应期的容积dV vV Rt反应器中物料 的体积流量V v 0C A0 ( C A r A )C A0 x A 全混流反应器 (CSTR)( r A )50000 V F A 0dx Ar A )V v 0 C A 0x A VF A0x A r A )F v C R 0 0 R24 M 0( C A 0( Rdx dx dx x A x A x A A A At C A 0C A 0C A0绝热操作恒容间歇反应器的设计式为:nE x A 0( r A )x A 0kCAx A 0n nRTk 0 e C A0(1 x A )1 x A tI ( x A )dx An 1x A 0k C 0A02dx A dlD ( r A ) 4F A02变温平推流反应器F A 0dx A ( r A )dV P( r A ) D dl4化学反应工程讨论的目的是实现工业化学反应过程的优化全混流V mF A 0 x A 0 r AV B F A 0 t BC A 0d x A r Ax A mC A 0BR :CST R:V PF A 0 d A x r Ax A 平推流PF R:PC A 0多级 CSTR 串联的优化 对于一级不行逆反应应有x A1 kC A0 (1 0 x A1 ) x A2 x A1x Am kC A 0 (1 x Am 1x Am )V v C ...R 0 A 0kC A 0 (1 x A 2 )x Ai 1 x Ai Aix Ai 1 x Ai Ai 111 V R x Aiv 0 k 1 (1 x Ai 11x Ai 10 (i 1,2,.....m 1)x x 2x Ai )1 ln( k / k )k 2( k 1 )k2 k 1k 2C P max C A01 2 k 2PFR : X 同间歇釜optP maxk 1 C P max C A 01X 1P max12CSTR:2[( k 2 / k 1 )1]optk k 1 2全混流反应器的热衡算方程V ( r A )(v 0 c PH r )UAT m UA UAT m UA T (1) (T 0)Q rT (1) (T 0)v 0 c Pv 0 c Pv 0 c Pv 0 c P第四章非抱负流淌停留时间分布E(t) = P{t < residencetime< t + t}停留时间分布函数F ( t ) = P { residence time < t }t F (t)E(t )dt2(t t ) E (t )dt2 t22 2(t t ) E (t )dtt E (t ) d t t方差E (t) dtPFR0 t t tt 0 1t t t tE(t )t tF (t)2 t22(t t ) E(t)dt ( t t )CSTRttF(t) 1 et2t2 21et最大tE(t) tr2( ) [2 Rr( R 层流流淌)2]F (t) 22t 2轴向扩散模型tE z E z 2 uL / E 2( ) uL 2( ) (1 uLe Z) 2 Pe 1 2 ) (1 Pe 2( e ) Pe。
反应工程总结

第一章 绪论 1、化学反应工程是化学工程学科的一个分支,通常简称为反应工程。
其内容可概括为两个方面,即反应动力学和反应器设计与分析。
2、传递现象包括动量、热量和质量传递,再加上化学反应,这就是通常所说的三传一反。
3、反应组分的反应量与其化学计量系数之比的值为定值,ξ叫做反应进度且恒为正值。
、本书规定反应物的化学计量系数一律取负值,而反应产物则取正值。
8、工业反应器有三种操作方式: ① 间歇操作;② 连续操作;③ 半间歇(或半连续)操作 9、反应器设计的基本内容一般包括:1)选择合适的反应型式 ;2)确定最佳操作条件 ;3)根据操作负荷和规定的转化程度,确定反应器的体积和尺寸 。
10.反应器按结构原理的特点可分的类型: 管式,釜式 ,塔式,固定床,流化床,移动床,滴流床反应器。
第二章 3、温度对反应速率的影响 如果反应速率方程可以表示为:r=f1 (T)f2(c ),f1(T)是温度的影响。
当温度一定时,其值一定。
通常用阿累尼乌斯方程(Arrhenius ‘ law )表示反应速度常数与温度的关系, 即, 为指前因子,其因次与k 相同;E 为反应的活化能;R 为气体常数。
两边取对数,则有 : lnk=lnA0-E/RT ,lnk 对 1/T 作图,可得-直线,直线的斜率=-E/RT 。
注意:不是在所有的温度范围内上面均为直线关系,不能外推。
其原因包括:(1)速率方程不合适; (2)反应过程中反应机理发生变化;(3)传质的影响;(4)指前因子A0与温度有关。
速率极大点处有: 对应于极大点的温度叫做最佳温度Top 。
速率为零点处有: rA=0 6、多相催化与吸附 1)、催化剂的用途:①加快反应速度②定向作用(提高选择性)-化学吸附作用结果 2)、催化剂的组成:主催化剂-金属或金属氧化物,用于提供反应所需的活性中心。
助催化剂-提高活性,选择性和稳定性。
助催化剂可以是 ①结构性的;② 调变性的。
载体-用于 ① 增大接触表面积;②改善物理性能。
化学反应工程考试要点总结

化学反应工程考试总结一、填空题:1.所谓“三传一反”是化学反应工程学的基础,其中“三传”是指质量传递、热量传递和动量传递,“一反”是指反应动力学。
2.各种操作因素对于复杂反应的影响虽然各不相同,但通常温度升高有利于活化能高的反应的选择性,反应物浓度升高有利于反应级数大的反应的选择性。
3.测定非理想流动的停留时间分布函数时,两种最常见的示踪物输入方法为脉冲示踪法和阶跃示踪法。
4.在均相反应动力学中,利用实验数据求取化学反应速度方程式的两种最主要的方法为积分法和微分法。
5.多级混合模型的唯一模型参数为串联的全混区的个数N ,轴向扩散模型的唯一模型参数为Pe(或Ez / uL)。
6.工业催化剂性能优劣的三种最主要的性质是活性、选择性和稳定性。
7.平推流反应器的E函数表达式为,()0,t tE tt t⎧∞=⎪=⎨≠⎪⎩,其无因次方差2θσ=0 ,而全混流反应器的无因次方差2θσ= 1 。
8.某反应速率常数的单位为m3 / (mol⋅ hr ),该反应为 2 级反应。
9.对于反应22A B R+→,各物质反应速率之间的关系为(-r A):(-r B):r R=1:2:2 。
10.平推流反应器和全混流反应器中平推流更适合于目的产物是中间产物的串联反应。
11.某反应的计量方程为A R S→+,则其反应速率表达式不能确定。
12.物质A按一级不可逆反应在一间歇反应器中分解,在67℃时转化50%需要30 min, 而在80 ℃时达到同样的转化率仅需20秒,该反应的活化能为 3.46×105(J / mol ) 。
13.反应级数不可能(可能/不可能)大于3。
14.对于单一反应,在相同的处理量和最终转化率条件下,选择反应器时主要考虑反应器的大小;而对于复合反应,选择反应器时主要考虑的则是目的产物的收率;15.完全混合反应器(全混流反应器)内物料的温度和浓度均一,并且等于(大于/小于/等于)反应器出口物料的温度和浓度。
化学反应工程知识点回顾

化学反应⼯程知识点回顾第⼀章知识点1.化学反应⼯程学的范畴和任务2.化学反应⼯程学的基本⽅法3.化学反应⼯程学的学科系统和编排第⼆章均相反应动⼒学基础知识点 1、概念:①化学计量⽅程:反应物 - ,产物 + ②化学反应速率等温定容反应dtdc r AA -=-反应速率之⽐等于各计量系数的⽐值。
③反应转化率反应程度膨胀因⼦δA 关键组分A 的膨胀因⼦物理意义:每反应掉⼀个摩尔A 所引起反应体系总摩尔数的变化量。
④反应速率⽅程:反应级数 a 、b 由实验确定 k 遵循Arrhenius ⽅程i α1A A dn r V dt-=-00-=K KK K n n x n 0kk k n nξα-=1sii A A αδα==∑a bA AB r kC C -=2、单⼀反应的速率⽅程重点:求取动⼒学参数 1)不可逆反应微分⽅程: 积分⽅程: 2)可逆反应微分⽅程: 反应平衡时: 3)均相催化反应微分⽅程积分⽅程4)⾃催化反应当C A = C M0/2 时,反应速率最⼤ 3、复合反应:平⾏反应串联反应总收率选择性exp[]a E k k RT=-a bA A A BdC r kC C dt-==-0A A C Aa b C ABdC kt C C =?'A A A SdC r kC k C dt-=-=-0A Ae Se r kC k C '-=-=()AA C A dC r kC C dt-=-=A A A C dC r kC C dt-=-=0max 0001ln[]A M M A C t C kC C =-0121()ln ln1A C A A C k k C t C x +==-A B P R +→+A B S +→A B P R S+→→+0000()/()///--Φ==P P P P P A A n n p C C pn a C a 0000()/()/;;()/()/--==--p p p p p p A A A A n n P C C PS S n n a C C a第三章理想反应器1返混的基本定义2⼏个时间的定义反应持续时间t r--在间歇反应器中反应达到⼀定转化率所需时间(不包括辅助时间)。
化学反应工程期末总结公式

化学反应工程期末总结公式一、引言化学反应工程是化学工程学科的一门重要课程,主要研究化学反应的基本原理、反应动力学以及工业生产中的应用,是化学工业生产过程中不可或缺的一环。
在本学期的学习过程中,通过课堂教学、实验操作、文献阅读等方式,我对化学反应工程的基本知识以及实践应用有了更深入的了解。
本文将对本学期所学的内容进行总结和回顾,以期更好地巩固和应用所学知识。
二、理论知识1. 反应动力学反应动力学是研究化学反应速率及其影响因素的学科。
在化学反应工程中,我们需要了解反应动力学的基本原理,包括反应速率方程、活化能、反应速率常数等等。
了解这些基本概念可以帮助我们预测和控制反应过程中的各项参数。
2. 反应器设计反应器是进行化学反应的装置,反应器设计是化学反应工程中的重要内容。
在反应器设计中,我们需要考虑如何选择适当的反应器类型、确定反应器的尺寸和形状、设计反应器的加热与冷却系统等等。
反应器设计的好坏直接影响着反应的效率和产率。
3. 反应工艺优化反应工艺优化是化学反应工程中的关键环节,通过对反应条件的调节和优化,可以提高反应的选择性、产率和效率。
在反应工艺优化中,我们需要了解如何确定最佳反应温度、确定最佳反应物配比、考虑催化剂的选择和回收等等。
反应工艺优化是提高化学反应工程生产效益的重要途径。
三、实验操作本学期我参与了多个化学反应工程实验的操作,通过实际操作加深了对化学反应工程理论知识的理解和应用。
以下是本学期所参与的几个实验。
1. 酯化反应实验在酯化反应实验中,我们使用乙酸和乙醇作为反应物,通过酯化反应制备乙酸乙酯。
在实验操作过程中,我们需要确定合适的反应温度、反应物配比和催化剂用量,以提高酯化反应的效率和产率。
2. 氧化反应实验在氧化反应实验中,我们使用硫酸铜作为催化剂,将苯乙烯氧化为苯乙烯醇。
实验中,我们需要选取合适的反应温度、氧化剂用量和反应物浓度,以提高氧化反应的选择性和产率。
3. 加氢反应实验在加氢反应实验中,我们使用负载型催化剂,将丙二酸二丁酯加氢转化为丙二醇。
化学反应工程总结

安徽工业大学《化学反应工程》期末总结简答题1. 温度和浓度对平行反应瞬时选择性的影响规律答:(1)浓度的影响与主、副反应级数有关,α=β,与浓度无关;α>β,浓度增高,瞬时选择性增加;α< β,浓度增高,瞬时选择性降低(2)温度的影响与主副反应活化能有关:E主=E副,与温度无关E主>E副,温度增高,瞬时选择性增加;E主< E副,温度增高,瞬时选择性降低2. 提高连串反应中间产物收率的措施?答:(1)采用合适的催化剂;(2)采用合适的反应器和操作条件;(3)采用新的工艺(如反应精馏,膜反应器等)3. 气固催化反应的7个步骤,3个过程答:1反应物由气流主体扩散到催化剂外表面;2反应物由催化剂外表面扩散到内表面;3反应物在催化剂表面活性中心上吸附;4吸附在活性中心的反应物进行化学反应;5产物在催化剂表面活性中心上脱附;6产物由催化剂内表面扩散到外表面;7产物由催化剂外表面扩散到气流主体。
①1,7为外扩散过程②2,6为内扩散过程③3,4,5为化学动力学过程4. 催化剂内气体扩散的形式及判据(分子扩散、努森扩散)?答:①当λ/2ra≤10-2时,分子间的碰撞机率大于分子和孔壁的碰撞机率,扩散阻力主要来自分子间的碰撞,这种扩散称之为分子扩散。
分子扩散与孔径无关。
②当λ/2ra≥10时,分子和孔壁的碰撞机率大于分子间的碰撞机率,扩散阻力主要来自分子和孔壁间的碰撞,这种扩散称之为努森扩散。
分子扩散与孔径有关。
5. 多相催化反应过程中内外扩散影响的判定?答:(1)在管式反应器中装入催化剂,催化剂体积为V,原料流量为Q,同时改变V和Q,使空速保持不变,计算流体的质量速度G。
保持T、cA0、空速τ不变的条件下改变G,测出口转化率X。
当出口转化率超过某一值G0时,G值再增加,出口转化率不再改变。
说明G ≥G0时,外扩散对反应过程已无影响;间歇反应器,外扩散与搅拌装置的搅拌速度有关,当r≥r0 ,外扩散无影响。
化学反应工程知识点复习

三传一反
动量传递 热量传递 质量传递 反应工程
2·1 概 述
• 均相反应--在均一液相或气相中进行的反应 • 均相反应动力学是解决均相反应器的选型、操
作与设计计算所需的重要理论基础 • 公式:P15
1、化学反应速率及其表示
对于均相反应aA+bB=rR+sS反应速率定义为:
rA
1 V
dpA dt
k1 pA
k2 pP
k1 pA
2.5k2 pA0
pA
积分,得
(k1 2.5k2 )t
ln
pAe pA0 pA pAe
以(-ln(pA-pAe))对t作图
y 0.1633t 2.5035
k1 2.5k2 0.1633
K
k1 k2
2.5( pA0 pAe
pAe )
2.5(1 0.2) 0.2
10
k1 0.131 k2 0.0131
rA 0.131pA 0.0327 pA0 pA
2.2.2 复合反应
复合反应是指同时存在两个以上独立进行反应的反应过 程。
从相同的反应物按各自的计量关系同时地发生的过程称为 平行反应。
如果这些反应是依次发生的,这样的复合反应称为串联反 应。
反应的反应级数或总反应级数:指浓度函数中各组分 浓度的幂数之和。
对可逆反应,有正反应的反应级数和逆反应的反应级数 。
分子数:
对于基元反应:aA+bB=rR+sS
(rA ) k AcA cB
• 分子数:基元反应中反应物分子或离子的个数。 对于基元反应来讲α,β必须是正整数,α+β是基
元反应的分子数,不能大于3(根据碰撞理论, α+β的取值不能大于3,必须是一个小于等于3 的正整数)。
化学反应工程 各章小结

一、基本概念反应程度;转化率;化学膨胀因子;收率和选择率;反应速率表示方式;空速;接触时间;动力学方程形式;床层空隙率ε;催化剂颗粒有关参数(g g b p t S V θρρρ、、、、、)及相互关系;吸附等温方程;最佳温度和最佳温度曲线。
二、核心内容1.连续系统反应速率的表示方式及其相互关系2.气-固相催化反应本征动力学方程的建立。
第二章本章小结一、基本概念内扩散有效因子ζ;总体速率方程通式;催化剂颗粒内气体扩散方式;努森扩散;综合扩散;有效扩散系数D eff ;曲节因子δ;西勒模数φ;外扩散有效因子ζex ;Damköhler 准数。
二、核心内容1.球形催化剂颗粒内组分的浓度分布和温度分布微分方程;2.等温一级不可逆反应内扩散有效因子的解析解及总体反应速率方程;3.影响内扩散有效因子的基本因素;4.气-固相催化反应总体速率方程;5.气-固相催化反应器的型式和特点。
第三章本章小结一、基本概念返混;平推流模型;全混流模型;反应器设计基本方程;间歇反应器、平推流反应器、全混流反应器和多级全混流反应器的特点。
二、核心内容1.间歇反应器计算;2.平推流反应器计算;3.全混流反应器计算;4.多级串联全混流反应器计算及其优化。
5.反应器型式选择;第四章 本章小结一、基本概念宏观混合;微观混合;连续反应过程的考察方法;停留时间分布函数和分布密度;阶跃法;脉冲法;停留时间分布数字特征;轴向混合模型及其模型参数E z ;多级串联全混流模型及其模型参数m 。
二、核心内容1.停留时间分布的测定方法及其数字特征;2.轴向混合模型和多级串联全混流模型停留时间分布的数字特征及其模型参数;3.轴向混合反应器和多级串联全混流反应器转化率计算。
一、基本概念带化学反应的气液平衡;溶液中气体溶解度估算;传质模型的主要特征;吸收准数M;化学吸收增强因子β;液相反应利用率η;C不同反应在气膜和液膜中的浓度分布;临界浓度()BL C二、核心内容1.气体在液膜中的扩散-反应方程;2.不同反应扩散-反应方程及β的求解;3.不同反应气液相间的化学吸收速率方程(总体反应速率方程);提高化学吸收速率的基本措施;4.气液反应器型式和特点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、 绪论 1. 研究对象是工业反应过程或工业反应器 研究目的是实现工业反应过程的优化
2. 决策变量:反应器结构、操作方式、工艺条件 3. 优化指标——技术指标:反应速率、选择性、能耗 掌握转化率、收率与选择性的概念 4.
工程思维方法
二、化学反应动力学
1. 反应类型:简单反应、自催化、可逆、平行、串联反应
基本特征、分析判断
2. 化学反应速率的工程表示
)
)((反应区反应时间反应量
反应速率=
3. 工业反应动力学规律可表示为:
)()(T f C f r T i C i ⋅=
a) 浓度效应——n 工程意义是:反应速率对浓度变化的敏感程度。
b) 温度效应——E 工程意义是:反应速率对温度变化的敏感程度。
已知两个温度下的反应速率常数k ,可以按下式计算活化能E :
E ——cal/mol ,j/mol
T ——K
R = 1.987cal/mol.K = 8.314 j/mol.K
工程问题
三、PFR 与CSTR 基本方程
1. 理想间歇:⎰⎰-=--==Af A Af A x x A
A
A c c A A R r dx c r dc v V t 00)()(00 2. 理想PFR : ⎰⎰-=--==Af A Af A x x A A A c c A A R p r dx c r dc v V 00)
()(00τ 3. CSTR : )
()(00A A
A A A A R p r x c r c c v V -=
--==
τ 4. 图解法
四、简单反应的计算
n=1,0,2级反应特征 0(1)A A A c c x =-
浓度、转化率、反应时间关系式 PFR →CSTR ,CSTR →PFR
基本关系式 PFR (间歇) CSTR
00()Af A c R A p c A
V dc v r τ
==--⎰
0()
A A
R m A c c V v r τ-=
=-
n=0
0A A p c x k τ= 0A A p c x k τ=
n=1 1ln 1p A k x τ=- 0A A m A c c kc τ-= n=2 011p A A k c c τ=- 02
A
A A m c c kc τ-=0 x Af x A
τ/c A0 τ
五、可逆反应
A
P
)()(02121A A A P A A C C k C k C k C k r --=-=-
))((21Ae A C C k k
-+= )()(021A Ae A x x C k k -+=
温度效应: 浓度效应:
⇒=-0)(A r ]
)
1(ln[10201
2A A
eq x x k k R E E T --= ])
x (x k k E E ln[R E E A A opt --=110201212
PFR 积分式
CSTR :由基本方程导出
k 1
k 2
六、平行反应
A
2
1
1
2
1
1
n
A
n
A
n
A
S
P
P
C
k
C
k
C
k
r
r
r
+
=
+
=
β,
C
C A
pf
C
C
dC
C
C
C Af
A
-
-
=
-
=
⎰
β
β
()
A
A
C
p
P
pf A
C
A A
dC
r
C dC
r dC
ββ
==-=-
-
⎰
温度效应:温度升高有利于活化能大的反应
浓度效应:浓度升高有利于级数大的反应
计算:由基本方程PFR、CSTR推出
①反应器选型与组合优化:
各种情况分析。
β~C A曲线——对应面积=C P
β~X A曲线——对应面积=C P/C A0②最优加料方式:p193-194
平行反应
P 1
1
1
m
B
n
A
p
C
C
k
r=
A+B
S 2
2
2
m
B
n
A
s
C
C
k
r=
k1
k2
P(主反应)
S(副反应)
A P S
A
A
C
k
r
1
)
(=
-
P
A
P
C
k
C
k
r
2
1
-
=
P
S
C
k
r
2
=
温度效应:温度升高有利于活化能大的反应(同平行反应)
浓度效应:凡是使A
P
C
C/增大的因素对串连反应选择率总是不利的。
①串联反应的计算
PFR CSTR
t k
A
A
e
C
C1
-
=物料衡算
)
e
e(
C
k
k
k
C t k
t k
A
P
2
1
1
2
1-
--
=
-
S
P
A
A0
②串联反应的最优反应时间、转化率与最大收率
PFR CSTR
1
2
1
2
ln
k
k
k
k
opt-
=
τ
2
1
1
k
k
opt
=
τ
opt
k
opt
e
xτ1
1-
-
=
opt
opt
opt k
k
x
τ
τ
1
1
1+
=
1
2
2
)
(
2
1
max
,
max
k
k
k
A
p
k
k
c
c
-
=
=
ϕ
2
2
1
1
2
max
,
max
]1
)
[(
1
+
=
=
k
k
c
c
A
p
ϕ
k1k2
A +P
P +P
P A A C kC r =-)(
2
2)(0
00P A T opt A C C C C +=
=
000T P A P A C C C C C =+=+
P
P A
A T C C C C kt C //ln
000==
九、变分子反应
①空速SV 的物理意义与因次 ②膨胀率的定义0
1===-=
A A A x x x A V V V ε
③膨胀因子的物理含义a
b a s p A )
()(+-+=
δ
④变分子反应中停留时间t 与空时τ的大小关系
反应器组合优化
十、循环反应器的计算
v v R R
=
R
RC C C Af
A A ++=
101
⎰-+-==τAf A C C A
A
r dC R v V 1)()1(0
十一、返混
1. 不同年龄的物料相互之间的混合——返混(CSTR ) 相同年龄的物料相互之间的混合——混合(间歇反应器)
2. 返混的起因:①空间上的反向流动②不均匀的速度分布
3. 返混的结果:反应器内的浓度变化(↑↓P A C C )
4. 改善措施:分割——横向分割和纵向分割
5. )(t f 和)(t F 含义
6. 数学期望-
t 与方差2
t
σ 无因次方差2
2
2
-=
t
t σσθ
7. CSTR -
--=t
t
e
t
t f 1
)( t
t e t F --=1)( 12=θσ
PFR )(t f 和)(t F 02=θσ
8. 固相反应的计算
dt t f c t c c c A A A A
)()(00
0⎰∞-
= ⎰∞
-
=0)()(dt t f t x x A A 9. 微观混合对反应结果的影响
(1) 大于一级的反应,上凹曲线,不利
(2) 小于一级的反应,下凹曲线,有利 (3) 一级反应的情况,线性关系,无关
十二、外部传递过程与内部传递过程
=∆十三、工程思维方法
3
121Re Sc A Sh =工程问题
动力学问题
十二、热量传递与反应器的热稳定性1. 定态条件r g
Q Q =
热稳定条件
g r
s
s
dQ dQ dT dT < 2. 放热曲线与移热曲线,影响因素。
多态—A 、B 、C 点的稳定性
3. 临界着火状态与临界着火温度Tig
4. 临界熄火状态与临界熄火温度Tex
5. 最大允许温差 E
RT T T T c 2
max
)(=-=∆
b T Q
T
ig
T si T 1
2
ex
T se T 3
4。
