物质的分类概要
初中化学《物质的分类》的知识点

初中化学《物质的分类》的知识点本文档将详细介绍初中化学中关于物质的分类的知识点。
1. 物质的基本性质- 物质是构成一切事物的基本单位。
- 物质具有质量和体积。
- 物质可以通过化学反应进行转化。
2. 物质的分类方式根据物质的不同特征,可以将物质分为以下几类:2.1. 由物质的组成分类- 单质:由同一种元素组成的物质,如金属、非金属元素等。
- 单质:由同一种元素组成的物质,如金属、非金属元素等。
- 单质:由同一种元素组成的物质,如金属、非金属元素等。
- 化合物:由两种或多种元素按一定比例结合而成的物质,如水、二氧化碳等。
- 化合物:由两种或多种元素按一定比例结合而成的物质,如水、二氧化碳等。
- 化合物:由两种或多种元素按一定比例结合而成的物质,如水、二氧化碳等。
2.2. 由物质的状态分类- 固体:具有一定形状和体积的物质,分子之间的排列紧密。
- 固体:具有一定形状和体积的物质,分子之间的排列紧密。
- 固体:具有一定形状和体积的物质,分子之间的排列紧密。
- 液体:没有一定形状,但有一定体积的物质,分子之间比固体间距离较大。
- 液体:没有一定形状,但有一定体积的物质,分子之间比固体间距离较大。
- 液体:没有一定形状,但有一定体积的物质,分子之间比固体间距离较大。
- 气体:没有一定形状和体积的物质,分子之间间距很大。
- 气体:没有一定形状和体积的物质,分子之间间距很大。
- 气体:没有一定形状和体积的物质,分子之间间距很大。
2.3. 由物质的成分分类- 无机物:由无机元素组成的物质,如水、盐等。
- 无机物:由无机元素组成的物质,如水、盐等。
- 无机物:由无机元素组成的物质,如水、盐等。
- 有机物:由有机元素组成的物质,通常与生物有关,如葡萄糖、脂肪等。
- 有机物:由有机元素组成的物质,通常与生物有关,如葡萄糖、脂肪等。
- 有机物:由有机元素组成的物质,通常与生物有关,如葡萄糖、脂肪等。
2.4. 由物质的颗粒大小分类- 溶液:由溶质和溶剂组成的混合物,其中溶质颗粒较小,溶解于溶剂中。
高三化学物质的分类知识点

高三化学物质的分类知识点化学作为一门基础科学,对于我们的生活和工业生产都起着重要的作用。
而化学物质的分类是化学研究的基础,对于我们理解和应用化学知识非常重要。
本文将介绍高三化学中常见的物质分类知识点。
第一部分:常见物质分类1.无机物和有机物无机物是指不含碳元素或含碳元素但结构简单的化合物。
常见的无机物如水、氧气和氯化钠等。
有机物则是指含有碳元素并且结构复杂的化合物,其中包括有机酸、糖类和蛋白质等。
2.元素和化合物元素是指由相同类型的原子组成的纯物质。
元素可以进一步分为金属元素和非金属元素。
化合物是由两个或更多种不同元素组成的物质,例如水(H2O)和二氧化碳(CO2)等。
3.离子化合物和非离子化合物离子化合物是由正负电荷的离子组成的,例如氯化钠(NaCl)和硫酸铜(CuSO4)等。
非离子化合物则是由共价键连接的原子组成的,例如水和二氧化碳等。
第二部分:物质分类的依据1.化学成分物质的分类可以依据其化学成分来进行。
根据元素的不同组合和原子比例,物质可以分为一种元素、两种元素或多种元素的化合物。
2.物理性质物质的物理性质也可以作为进行分类的依据。
物理性质包括颜色、形状、密度和溶解性等。
例如,我们可以根据颜色将物质分为红色、蓝色或黄色等。
3.化学性质物质的化学性质也是进行分类的重要依据。
化学性质包括燃烧性、氧化性和酸碱性等。
通过对物质进行不同的化学反应和试剂的检测,可以确定其化学性质,进而进行分类。
第三部分:物质分类的应用1.高分子材料高分子材料是一类由大量重复单元组成的聚合物。
例如塑料、橡胶和纤维等。
这些材料的分类依据可以是化学结构、性质和用途等。
2.功能材料功能材料是指在特定条件下具有特殊性能和功能的材料。
例如磁性材料、光学材料和电子材料等。
这些材料的分类依据可以是其特定的功能和性质。
3.生物材料生物材料是指源于自然界的具有特殊生物活性和生物相容性的物质。
例如蛋白质、酶和细胞等。
这些材料的分类依据可以是其来源和应用领域。
物质的分类与性质知识点总结

物质的分类与性质知识点总结一、物质的分类1.按照物质的组成部分分类物质可以分为纯物质和混合物。
纯物质是由同一种元素或者化合物组成的物质,它们具有固定的化学组成和一定的化学性质。
混合物是由两种或两种以上的物质混合而成的物质,它们的化学组成和性质可以变化。
2.按照物质的形态分类物质可以分为固体、液体和气体。
固体具有固定的形状和体积,分子间相对稳定,有一定的结构和规则排列方式。
液体具有固定的体积,但没有固定的形状,在容器中自由流动。
气体具有没有固定形状和体积的特点,可以自由扩散。
3.按照物质的电导性分类物质可以分为导电物质和非导电物质。
导电物质能够传导电流,如金属、溶解了电解质的水。
非导电物质不能传导电流,如纯水、木材等。
4.按照物质的溶解性分类物质可以分为可溶性物质和不溶性物质。
可溶性物质可以在溶剂中充分溶解,如食盐、糖等。
不溶性物质不能在溶剂中溶解,如石油、石蜡等。
二、物质的性质1.物理性质物质的物理性质是指物质所特有的、不改变其化学组成的性质。
例如,颜色、形状、密度、熔点、沸点、导电性等。
通过物质的物理性质可以进行物质的鉴定和分类。
2.化学性质物质的化学性质是指物质与其他物质发生化学变化时所表现出的性质。
例如,可燃性、氧化性、还原性等。
物质的化学性质决定了它在化学反应中的行为和变化。
3.燃烧性质物质的燃烧性质是指物质与氧气或其他氧化剂接触时能够发生燃烧反应的性质。
例如,可燃物质如木材、纸张等在适当的条件下能够与空气中的氧气发生燃烧反应。
4.酸碱性质物质的酸碱性质是指物质在水溶液中的酸碱程度。
酸性物质具有酸性,如柠檬汁、硫酸等;碱性物质具有碱性,如氢氧化钠、氨水等;中性物质的酸碱程度接近于中性,如纯水。
5.氧化还原性质物质的氧化还原性质是指物质与其他物质发生氧化还原反应时所表现出的性质。
氧化反应是指物质失去电子或增加氧化态,还原反应是指物质获得电子或减少氧化态。
三、物质分类与性质的应用1.环境保护了解不同物质的分类与性质,有助于我们正确处理和利用各种物质,避免产生有害物质对环境造成污染。
初三化学知识点:物质的分类

初三化学知识点:物质的分类1500字物质是构成世界的基本单位,根据其物理性质、化学性质和组成方式,可以将物质分为不同的类别。
在化学中,通常根据其组成方式和化学性质分类物质。
以下是关于物质分类的一些知识点。
1. 纯物质和混合物:纯物质是由同一种物质组成的,具有确定的物理性质和化学性质。
例如,金属银、纯净水等都是纯物质。
混合物是由两种或多种不同的物质混合而成的,其成分可以是不固定的。
例如,空气、淡盐水都是混合物。
2. 元素和化合物:元素是由同一种原子组成的物质,不能通过化学方法分解为其他物质。
目前已知的元素共有118种,如氧气、铜、银等。
化合物是由两种或更多种元素以固定的比例结合而成的物质,可以通过化学方法分解为其组成元素。
例如,水(H2O)、盐(NaCl)等都是化合物。
3. 金属、非金属和半金属:金属是一类常见的物质,具有良好的导电性、热传导性和延展性。
例如,铁、铜、铝等都是金属。
非金属是指性质与金属相反的物质,通常具有较低的导电性和热传导性。
例如,碳、硫、氧等都是非金属。
半金属具有一些金属和非金属的性质。
例如,硅、锑等都是半金属。
4. 酸、碱和盐:酸是指具有酸性质的物质,能够与碱发生中和反应。
酸通常具有酸味、能够腐蚀物质和导电性等特点。
例如,硫酸(H2SO4)、盐酸(HCl)等都是酸。
碱是指能够与酸发生中和反应并产生盐和水的物质,通常具有苦味和腻感。
例如,氢氧化钠(NaOH)、氢氧化钙(Ca(OH)2)等都是碱。
盐是一类化合物,由阳离子和阴离子组成,通常是酸和碱反应后的产物。
例如,氯化钠(NaCl)、硫酸钠(Na2SO4)等都是盐。
5. 有机物和无机物:有机物是由碳元素与氢元素以及其他非金属元素组成的物质,通常具有复杂的结构和多种功能。
例如,葡萄糖、甲烷等都是有机物。
无机物是除了有机物以外的所有物质,包括无机酸、无机盐、无机气体等。
例如,氯气、氧气、盐酸等都是无机物。
总结起来,物质的分类有纯物质和混合物、元素和化合物、金属、非金属和半金属、酸、碱和盐以及有机物和无机物等。
物质的分类知识总结

物质的分类知识总结
高一化学物质的分类知识总结(一)
1、掌握两种常见的分类方法:交叉分类法和树状分类法。
2、分散系及其分类:
(1)分散系组成:分散剂和分散质,按照分散质和分散剂所处的状态,分散系可以有9种组合方式。
(2)当分散剂为液体时,根据分散质粒子大小可以将分散系分为溶液、胶体、浊液。
3、胶体:
(1)常见胶体:Fe(OH)3胶体、Al(OH)3胶体、血液、豆浆、淀粉溶液、蛋白质溶液、有色玻璃、墨水等。
(2)胶体的特性:能产生丁达尔效应。
区别胶体与其他分散系常用方法丁达尔效应。
胶体与其他分散系的本质区别是分散质粒子大小。
(3)Fe(OH)3胶体的制备方法:将饱和FeCl3溶液滴入沸水中,继续加热至体系呈红褐色,停止加热,得Fe(OH)3胶体。
高一化学物质的分类知识总结(二)
一、物质的分类:
二.几种分散系的比较:
分散系溶液浊液胶体
分散质粒子的直径<1nm >100nm 1nm~100nm
分散质粒子
单个小分子
或离子巨大数目的
分子集合体
高分子或
多分子集合体
实例蔗糖溶液、NaCl溶
液
油水、石灰乳淀粉溶胶、AgI胶体
外观均一、透明不均一、不透明均一、透明稳定性稳定不稳定介稳定
能否透过滤纸能不能能
能否透过半透膜能不能不能
鉴别无丁达尔效应静置分层或沉淀丁达尔效应。
物质的分类总结
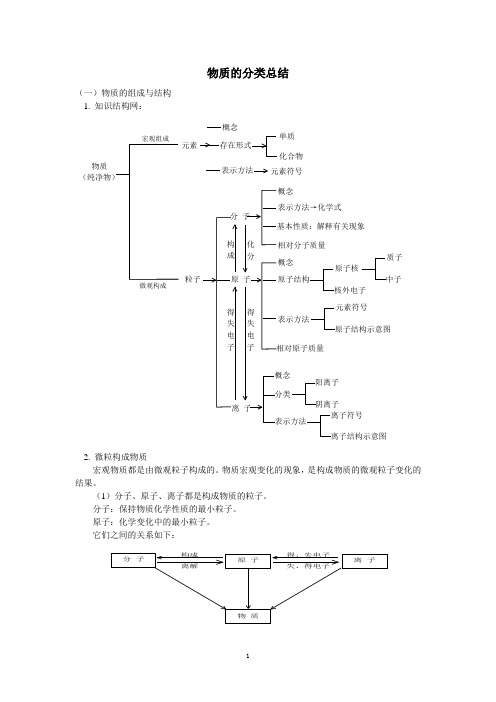
物质的分类总结(一)物质的组成与结构 1. 知识结构网:物质 (纯净物)元素存在形式单质化合物表示方法元素符号 分 子概念表示方法→化学式基本性质:解释有关现象相对分子质量 概念 原子结构表示方法原子核核外电子质子中子相对原子质量 元素符号原子结构示意图概念 分类表示方法阳离子阴离子离子符号离子结构示意图离 子原 子粒子得失电子得失电子概念宏观组成微观构成构成化分2. 微粒构成物质宏观物质都是由微观粒子构成的。
物质宏观变化的现象,是构成物质的微观粒子变化的结果。
(1)分子、原子、离子都是构成物质的粒子。
分子:保持物质化学性质的最小粒子。
原子:化学变化中的最小粒子。
它们之间的关系如下:(2)原子的构成①质子数=核电荷数=原子序数=核外电子数,原子不显电性。
②质子数+中子数=相对原子质量(数值),原子的质量集中在原子核上。
③核外电子是分层排布的(认识原子结构示意图)。
(3)离子原子得到或失去电子后即变成离子。
原子得到电子→阴离子。
原子失去电子→阳离子。
(4)元素元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
①已经发现的元素有一百余种。
地壳里和生命细胞中含量最多的元素是氧。
地壳里含量较多的元素还有:硅、铝、铁、钙、钠、钾、镁等;生命细胞中含量较多的元素还有:碳、氢、氮、钙、磷等。
②在原子结构中,核内质子数决定元素的种类,核外电子的排布,特别是最外层电子数与元素的性质密切相关。
元素只论种类,不论个数。
④一些常见元素的名称和符号(见教科书上册P73表4—3)3. 几组重要概念比较:(1)分子与原子的比较分子和原子,离子与原子的本质区别①区别两个“最小”。
分子是保持物质化学性质的最小粒子。
分子在物理变化中不可分,分子间的距离可变化;分子在化学变化中可分,分子中的原子可重新组合,构成新的分子。
原子是化学变化中的最小粒子。
原子在化学变化中不可分,但原子可重新的组合。
②认清“不变”的实质。
在化学变化中原子不变(不可分),实则是原子核不变,而核外电子(尤其是最外层电子)一定要发生变化,否则就不能生成新物质。
物质的分类知识点总结

物质的分类知识点总结一、物质的基本概念物质是构成万物的基本要素,是宇宙中自然存在的一切实体的总称,是占据一定空间,有一定质量的任何事物的总称,是构成一切物体的基本成分。
物质是由微观粒子组成的,包括原子、分子等微粒。
物质是具有一定质量、占据一定空间、具有可观察性和可度量性的,是人们认识和利用的客观存在。
物质性质是物质的固有属性,成为物质被认识的依据。
物质的三态:固、液、气。
物质的基本概念包括物质的组成、性质和分类。
二、物质的组成1.原子原子是构成一切物质的基本微粒,是化学元素的最小单位,化学反应中不会分解的微粒。
原子是由质子、中子和电子组成。
2.分子分子是原子按照一定比例结合而成的,分子的组成是由原子组成的。
分子在化学反应中会发生改变,化学反应中发生的都是分子的变化。
分子的构成有原子殊,分子中原子的种类与比例确定了分子的性质。
3.离子离子是由失去或者获得电子而具有电荷的粒子,可以是单个原子,也可以是分子,称为单一离子,或者多个原子或分子部分组成的有电荷的团体,称为复合离子。
离子在水溶液中自由移动,具有导电性和电化学反应性。
三、物质的性质1.物质的物理性质物质的物理性质是指不改变物质本质情况下,其所具有的固有性质,可以通过物理方法进行观察和度量。
物质的物理性质包括:颜色、气味、密度、熔点、沸点、导电性、磁性等。
2.物质的化学性质物质的化学性质是指物质在与其他物质发生化学反应时所表现出的性质。
物质的化学性质是通过化学反应和实验才能得以确认。
物质的化学性质包括:与其他物质发生反应、氧化还原性、酸碱性、水解性等。
3.物质的结构性质物质的结构性质是指物质内部微观结构和组成的性质。
物质的结构性质决定了物质的各种物理和化学性质。
物质的结构性质包括:原子和分子的结构、离子的组合方式等。
四、物质的分类1.物质的分类方法物质的分类可以通过不同的角度和属性来进行分类,包括化学性质、物理性质、组成结构等方面的分类。
物质的分类方法包括:按组成结构分类、按化学性质分类、按物理性质分类等。
物质的分类标准

物质的分类标准物质的分类是指根据物质的不同特征将其划分为不同的类别。
这些特征可以包括化学类型、晶体结构、溶解性、电化学性质、组成方式、物理状态和元素组成等。
准确地了解这些分类标准有助于我们更好地理解物质的性质和行为。
1.物质的化学类型化学类型是指物质分子中原子之间通过共享电子而形成的键的类型。
根据原子间共享电子的方式,可以将物质分为共价化合物、离子化合物和金属化合物。
共价化合物是指原子间通过共享电子对形成键的物质,如氧气、二氧化碳等;离子化合物是指原子间通过得失电子形成离子键的物质,如食盐、氢氧化钠等;金属化合物是指由金属原子间通过共享电子形成的金属键的物质,如金属氧化物、金属硫化物等。
2.物质的晶体结构晶体结构是指物质分子或离子在空间中排列的规律性。
根据晶体中原子或离子的排列方式,可以将物质分为晶体和非晶体。
晶体是指具有高度规律性的原子或离子排列的物质,如石英、金属等;非晶体是指没有明显规律性的原子或离子排列的物质,如玻璃、橡胶等。
此外,还可以根据晶体中原子的种类和结合方式将晶体分为离子晶体、共价晶体、金属晶体和分子晶体等。
3.物质的溶解性溶解性是指物质在溶剂中溶解的程度。
不同物质在不同溶剂中的溶解度不同,因此可以根据溶解性对物质进行分类。
常见的溶解性分类标准包括水溶性和有机溶性。
水溶性是指物质在水中的溶解度,可以将物质分为可溶、微溶和不溶等;有机溶性是指物质在有机溶剂中的溶解度,可以将物质分为易溶、可溶和难溶等。
此外,也可以根据溶解过程中的热效应等特征对物质进行分类。
4.物质的电化学性质电化学性质是指物质在电场作用下的行为和反应。
根据物质在电场作用下的行为,可以将物质分为导体、半导体和绝缘体。
导体是指能够自由导电的物质,如金属;半导体是指导电性能介于导体和绝缘体之间的物质,如硅、锗等元素;绝缘体是指几乎不导电的物质,如橡胶、玻璃等。
此外,还可以根据物质在电场作用下的氧化还原性质等方面对物质进行分类。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(4)电泳: 在 电场 作用下,胶体粒子在分散剂中 作定向移动 。如 带正电荷的Fe(OH)3胶体粒子向 阴极 移动。
按组成元素分
含氧酸 ( H2CO3、H2SO4) 无氧酸( HCl )
一元酸 ( HCl 、HNO3)
酸
按电离出H+ 的个数分
二元酸 ( H2CO3、H2SO4)
三元酸 ( H3PO4)
按性质分
强酸( HCl 、 H2SO4 、HNO3) 中强酸 ( H3PO4)
弱酸 ( H2CO3)
可溶性碱 ( NaOH、Ba(OH)2) 按溶解性分
1057.6万种,10年加倍怎么能学
超过2000万种
完呢?
超过3000万种
什图 么书 你馆 很里 快有 就许 找许 到多 你多 需的 要书 的籍 书, ?为
沃尔玛超市
?
你超 能市 够里 迅有 速成 挑千 出上 你万 所种 需商 要品 的, 东为 西什
么
一、物质的分类及应用
1.分类方法
物质分类的方法很多,根据研究需要,可以从多种角度对物质进行分类, 并得到不同的分类结果(同一种物质属于不同的类别),因此在对物质分类时,
必须指明分类的依据.
为了便于研究和掌握物质的性质,人们按照一定的分
交叉分类法 类标准对物质进行分类,常用的分类方法有
树状分类法
和
。
(1)交叉分类法:
Na2CO3
钠盐
Na2CO3
碳酸盐
特点:物质类别之间有部分交叉
(2)树状分类法
碱
盐酸 非金属ຫໍສະໝຸດ 金属化 合 单质 物
纯 净 物
物质
氧化物 其他
混合物
(2)树状分类法:
H2SO4 + Na2CO3== Na2SO4+ H2O+CO2
酸+指示剂 酸+碱性氧化物
盐+水
1.酸 酸+碱 盐+水
酸+盐 新盐+新酸 某些含氧酸 水+酸性氧化物
2.NaOH
2NaOH+ H2SO4 ==Na2SO4+2H2O 2NaOH+CuSO4 ==Na2SO4+Cu(OH)2 2NaOH + CO2 ==Na2CO3+H2O
碱+指示剂
2.碱
碱+酸性氧化物 盐+水 碱+酸 盐+水
碱+盐 新盐+新碱
难溶性碱 水+碱性氧化物
CO2+H2O==H2CO3 (1).CO2 CO2+2NaOH==Na2CO3+H2O
CO2+ CaO == CaCO3
(2).CaO
CaO+H2O==Ca(OH)2 CaO+H2SO4==CaSO4+H2O
3氧化物
酸性氧化物 碱性氧化物
酸性氧化物+H2O 含氧酸(除SiO2) 酸性氧化物+ 碱 盐+ H2O 酸性氧化物+碱性氧化物 含氧酸盐 碱性氧化物(K2O,Na2O,CaO,BaO)+H2O 碱性氧化物+酸 盐+水
碱性氧化物+酸性氧化物 含氧酸盐
可溶性碱
[思考·感悟] 1.由同种元素组成的物质一定是纯净物 吗?
其他氧化物:NO CO
化合物
酸
含氧酸 无氧酸
H2SO4 HNO3 HCl H2S
碱 NaOH(可) Cu(OH)2(不)
盐
正盐
含氧酸盐 无氧酸盐
K2CO3 NaCl
酸式盐 NaHCO3
碱式盐 Cu2(OH)2CO3
1. H2SO4
H2SO4 + CaO ==CaSO4+H2O H2SO4 + 2NaOH ==Na2SO4+2H2O
初中四大基 本反应类型
后物质的多少
置换反应
化 学
复分解反应
反 应
按反应中是否 离子反应
有离子参加
非离子反应
氧化还原反应 按反应中是否
有电子转移 非氧化还原反应
纯净物
金属:Cu Au Hg
单质
非金属:Cl2 I2 C
稀有气体:Ne Ar He
酸性氧化物SO3 CO2
氧化物 碱性氧化物CuO Fe2O3
第二章 化学物质及其变化
第一讲 物质的分类
人类已知的化合物数目
❖ 1900 ❖ 1945 ❖ 1970 ❖ 1975 ❖ 1980 ❖ 1985 ❖ 1990 ❖ 1999 ❖ 2000
55万种化合物
110万种,45年加倍
236.7万种,25年加倍
414.8万种
593万种,10年加倍
785万种
天哪,这
[提示] 不一定,如由O2与O3组成的气体只 有一种氧元素组成,但属于混合物。
二、分散系、胶体 1.分散系的分类 (1)按照分散质粒子的大小:
(2)按照分散质和分散剂的状态:
2.胶体的性质 (1)丁达尔效应:
当一束光通过胶体时,胶体内会出现一条 光亮的通路 , 这是由 胶体粒子对光线散射 而形成的,利用该性质可区 分胶体与溶液。
(2)介稳性: 胶体的稳定性介于溶液和浊液之间,在一定条件下能稳 定存在,属于介稳体系,其原因是: ①胶体粒子 所带电荷 相同,相互排斥; ②胶体粒子的布朗运动。
(3)聚沉: 胶体粒子聚集成较大颗粒,从而形成沉淀从分散剂里析 出的过程叫做聚沉。使胶体聚沉的方法有: ① 加入电解质 ; ② 加入带相反电荷的胶体 ; ③ 加热 。
难溶性碱( Mg(OH)2、Cu(OH)2)
按电离出 碱 OH-的个数
分
一元碱( NaOH、KOH) 二元碱( Mg(OH)2、 Ba(OH)2 ) 多元碱( Fe(OH)3、Al(OH)3)
按性质分
强碱( NaOH、Ba(OH)2、KOH) 两性氢氧化物 ( Al(OH)3)
弱碱(NH3·H2O )
碱式盐 Cu2(OH)2CO3 正盐 NaCl、 BaSO4
金属氧化物 ( Na2O、CaO) 按组成分
非金属氧化物 ( SO2、CO2 )
氧化物 按性质分
酸性氧化物(CO2、SO2、 Mn2O7
能和碱反应生成盐和水的氧化物
碱性氧化物 ( Na2O、CaO)
能和酸反应生成盐和水的氧化物
两性氧化物 ( Al2O3 )
其他氧化物 ( H2O2 )
[特点提醒] 氧化物分类中注意两点: (1)金属氧化物不一定属于碱性氧化物,如Na2O2属于过
氧化物,Al2O3属于两性氧化物,Mn2O7属于酸性氧 化物。 (2)非金属氧化物不一定属于酸性氧化物,如CO、NO、 NO2等
化合反应 按反应物和生成物 的类别以及反应前 分解反应
按是否溶 于水分
可溶盐 难溶盐
NaCl、AgNO3、CuSO4 CaCO3、BaSO4、ZnS
钠盐 硫酸盐
按组成 离子分
钾盐 碳酸盐
……
氨盐 硝酸盐
盐
按酸根是 含氧酸盐 KNO3、KMnO4、FeSO4
否含氧分 无氧酸盐 NaCl、ZnS、CaCl2
按组 成分
酸式盐 KHSO4、 Ca(H2PO4)2
