细菌生长曲线的测定实验报告
大肠杆菌生长曲线实验报告
测定微生物的数量有多种不同的方法,可根据要求和实验室条件选用。本实验用比浊法测定,由于细菌悬液的浓度与光密度(OD值)成正比,因此可利用分光光度计测定菌悬液的光密度来推知菌液的浓度,并将所测的OD值与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线,此法快捷、简单。
测量时要等数字变化不大时再读取,可以读三次,最后取平均值,这样能保证实验结果更加准确。
721型分光光度计要先预热,实验过程中最好使用同一台仪器,同一个比色皿,这样可以减少仪器误差,分光光度计的使用操作要规范。比色皿经蒸馏水清洗后,必须经待测样品润洗。比色皿的毛面用吸水纸擦干,而光面只能用吸水纸吸干,以免光面被划破。比色皿用擦镜纸擦干净,上面不要残留有纸纤维和水珠等。
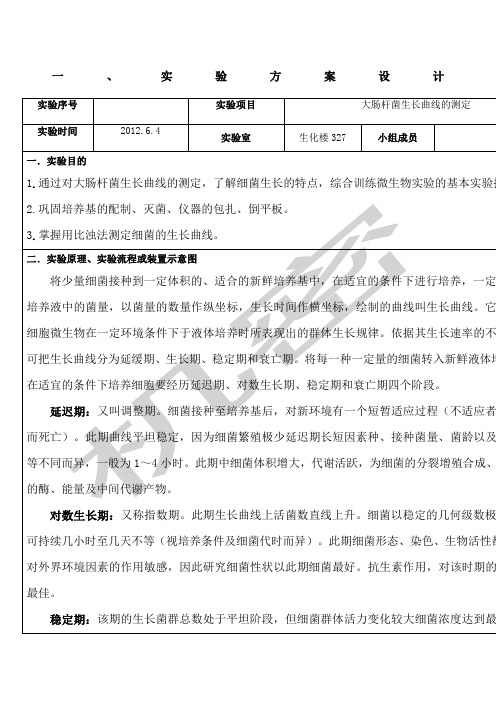
延迟期:又叫调整期。细菌接种至培养基后,对新环境有一个短暂适应过程(不适应者可因转种而死亡)。此期曲线平坦稳定,因为细菌繁殖极少延迟期长短因素种、接种菌量、菌龄以及营养物质等不同而异,一般为1~4小时。此期中细菌体积增大,代谢活跃,为细菌的分裂增殖合成、储备充足的酶、能量及中间代谢产物。
对数生长期:又称指数期。此期生长曲线上活菌数直线上升。细菌以稳定的几何级数极快增长,可持续几小时至几天不等(视培养条件及细菌代时而异)。此期细菌形态、染色、生物活性都很典型,对外界环境因素的作用敏感,因此研究细菌性状以此期细菌最好。抗生素作用,对该时期的细菌效果最佳。
改进措施:在试验过程中应严格按照标准的操作要求,在上述步骤时更加应该规范操作。
指导教师评语及评分:
签名:
年 月 日
2.营养肉汤培养基灭菌:将步骤一包好的培养基置于高压蒸汽灭菌锅121℃灭菌30min.
微生物实验报告:测定细菌生长曲线

测定细菌生长曲线一、实验目的1.了解细菌生长曲线特征,测定细菌繁殖的代时;2.学习液体培养基的配制以及接种方法;3.反复练习无菌操作技术;4.了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5.掌握利用细菌悬液混浊度间接测定细菌生长的方法;二、实验原理将一定量的菌种接种在液体培养基内,在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数做纵坐标,以培养时间做横坐标,可绘成一条曲线,称为生长曲线。
单细胞微生物发酵具有4个阶段,即调整期(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法。
本实验才用比浊法,由于细胞悬液的浓度与混浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的菌液的浓度。
将所测得的光密度值(OD600)与对应的培养时间做图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌和死菌,因此所测生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G表示,其计算公式为:G=(t2-t1)/[(lgW1-lgW2)/lg2]式中t2和t1为所取对数期两点的时间,W1和W2分别为对应时间测得的细胞含量或OD。
三、实验器材大肠杆菌,枯草杆菌菌液及平板;培养基(100mL/250mL三角瓶×10瓶/大组):牛肉膏蛋白胨葡萄糖培养基;取液器(5000ul, 1000ul 各一支),无菌1000ul吸头若干,无菌5000ul吸头若干,比色皿10个及共用参比杯一个,培养箱3台,722s分光光度计;四、实验步骤1.活化菌种将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块;2.接种6人大组分为3个小组,按表1接种。
细菌生长曲线之测定

實驗六細菌生長曲線之測定◎ Exp 11. Turbidity of bacteria一、目的:在進行細菌生長曲線之測定前,必須先了解 U-2001 Spectropho-tometer 操作方法,才能將細菌的數量以吸光值的方式表示出來。
二、原理:請詳讀整理 p. 90-92,學會調整 Optical density (O.D.) 【Exp 13.會用到】。
三、器材:1. culture:(每組)24 hr Escherichia coli (broth)2. medium: (每組)Nutrient broth3. equipment :1 ml pipette,pipette aid,cuvette,拭鏡紙,廢菌液杯,裝蒸餾水的洗瓶,滅菌空試管,U-2001 Spectrophotometer,振盪器。
四、實驗步驟※由助教先示範操作方法,再由學生自行操作與測量待測液之吸光值。
1. 了解 U-2001 Spectrophotometer 操作方法:a. 溫機約 15 分鐘。
b. MENU → (主目錄) 選 1. Photometer →輸入波長 600 nm 及 ABS →Forward →c. Nutrient broth 歸零 autozero → (前、後二支 cuvette) ※1d. 取出後面之 cuvette ,倒入待測液※2,等到右上方數據穩定後,按下 Start →記錄。
※1 cuvette 有石英管 (測波長 340 nm 以下)、玻璃管、塑膠管等材質,本實驗使用塑膠材質之比色管。
※2 每次測定前需先用蒸餾水滴洗cuvette,再以待測液潤濕,倒掉,再裝入待測液,測完倒掉,用蒸餾水滴洗。
測定之前cuvette 須用拭鏡紙擦乾,手握管的非透明處;廢菌液請滴洗入廢菌液杯中,集中處理) 。
2. 每組取一管助教所準備之E. coli當待測液,實際演練U-2001Spectrophotometer 操作,測出其原液 O.D. 【Exp 13. 將會利用到此操作,故須熟悉其操作步驟】。
实验报告微生物的生长曲线实验

实验报告微生物的生长曲线实验实验报告
实验目的:
本实验旨在通过监测微生物的生长曲线,研究微生物的生长规律,并探讨其对环境因素的响应。
实验材料及方法:
1. 材料:
- 微生物培养基
- 无菌培养瓶或试管
- 微量移液器或移液管
- 无菌平板
- 培养箱或恒温摇床
- 显微镜
2. 方法:
(这里使用编号列表来列出具体的实验步骤)
实验步骤:
1. 实验前准备:
(这里写明实验前的准备工作,如准备培养基、灭菌操作等)
2. 微生物获取:
(这里描述如何获取微生物样品,如从环境中采样、有选择地分离微生物菌落等)
3. 微生物培养:
(这里阐述微生物的培养过程,包括制备培养基、接种微生物样品等步骤)
4. 生长曲线检测:
(这一部分是实验的重点,需要详细记录实验过程和结果。
可以使用表格、图表等方式展示数据)
5. 结果分析:
(根据实验结果,对微生物生长曲线进行分析和解读,可结合图表进行说明)
6. 讨论与结论:
(根据实验结果的分析,进行讨论并得出结论,可以对实验中可能存在的问题进行分析,提出进一步改进的建议)
实验结论:
通过本实验对微生物的生长曲线进行监测,我们得出了如下结论:
(这里简洁地总结实验结果得出的结论,为了增加字数可以进一步展开阐述,如讨论生长曲线的不同阶段、影响微生物生长的环境因素等等)
实验报告结束。
注意:本实验报告以“实验报告”的格式为基础,根据实验内容进行适当的调整。
其中,具体的实验步骤和结果可以根据实际情况进行修改和补充,以确保文章的准确性和完整性。
实验三微生物生长曲线的测定

实验三微生物生长曲线的测定Document serial number【UU89WT-UU98YT-UU8CB-UUUT-UUT108】实验三微生物生长曲线的测定一、实验目的目的1、了解细菌生长曲线特点及测定原理2、学习用比浊法测定细菌的生长曲线?二、实验原理将少量细菌接种到一定体积的、适合的新鲜培养基中,在适宜的条件下进行培养,定时测定培养液中的菌量,以菌量的对数作纵坐标,生长时间作横坐标,绘制的曲线叫生长曲线。
它反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。
依据其生长速率的不同,一般可把生长曲线分为延缓期、对数期、稳定期和衰亡期。
这四个时期的长短因菌种的遗传性、接种量和培养条件的不同而有所改变。
因此通过测定微生物的生长曲线,可了解各菌的生长规律,对于科研和生产都具有重要的指导意义。
测定微生物的数量有多种不同的方法,可根据要求和实验室条件选用。
本实验采用比浊法测定,由于细菌悬液的浓度与光密度(OD值)成正比,因此可利用分光光度计测定菌悬液的光密度来推知菌液的浓度,并将所测的OD值与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线,此法快捷、简便。
三、实验材料1、菌种2、培养基:肉膏蛋白胨培养基3、仪器和器具721分光光度计,比色杯,恒温摇床,无菌吸管,试管,三角瓶。
4、流程种子液→标记→接种→培养→测定四、实验步骤1、种子液制备取细菌菌种1支,以无菌操作挑取1环菌液,接入肉膏蛋白胨培养液中,培养18h作种子培养液。
2、标记编号取盛有30mL无菌肉膏蛋白胨培养液的三角瓶6个,分别编号为0、4、8、12、16、20。
3、接种培养用2mL无菌吸管分别准确吸取1mL种子液加入已编号的6个三角瓶中,于37℃下振荡培养。
然后分别按对应时间将三角瓶取出测定OD 值。
4、生长量测定将未接种的肉膏蛋白胨培养基倾倒入比色杯中,选用600nm波长分光光度计上调节零点,作为空白对照,并对不同时间培养液从0h起依次进行测定,对浓度大的菌悬液用未接种的牛肉膏蛋白胨液体培养基适当稀释后测定,使其OD值在.~以内,经稀释后测得的OD值要乘以稀释倍数,才是培养液实际的OD值。
[精品]细菌生长曲线的测定
![[精品]细菌生长曲线的测定](https://img.taocdn.com/s3/m/26b67aef5122aaea998fcc22bcd126fff7055d68.png)
[精品]细菌生长曲线的测定细菌生长曲线的测定是细菌学中的一项重要实验。
它可以帮助我们了解细菌的生长繁殖规律及其影响因素,为控制细菌繁殖提供理论依据。
本次实验将介绍如何通过外观观察、菌落计数及测定细菌生物量的方法,获得细菌在液体培养基中的生长曲线。
实验步骤:一、准备实验材料和试剂1、选取一种细菌菌株,本次实验选择了大肠杆菌(Escherichia coli);2、配置好液体培养基,一般为普通营养琼脂培养基、肉汤培养基等;3、消毒好实验室的工作台面及实验仪器;4、准备好移液管、试管、比色管和加热消毒的线圈镊子等实验用具。
二、制备不同浓度的菌液1、挑选一根菌棒,从培养基上接入一些带有细菌的菌落,将菌落均匀涂抹于培养基表面;2、将含有细菌的培养基放置在恒温摇床中,在适宜的温度下进行培养;3、当细菌生长至一定程度(一般在对数生长期)时,用无菌的移液管,在培养基中取出一定量的菌液;4、分别将不同体积的菌液加入到含有培养基的试管中,制备成不同浓度的菌液。
三、测定不同浓度菌液对应的OD600值1、将制备好的不同浓度菌液放入洗涤过的比色管中;2、由于细菌太小,肉眼观察不能得出其数量的增多或减少,因此需要使用分光光度计在600nm处测量各个浓度的菌液的吸光度(OD)值;3、重复测量3次,取平均值计算OD600;4、根据OD600值和菌液中细胞数量的线性关系,可通过OD600值推算出细胞数。
2、每隔2-3个小时,取出一定量的菌液,测量其OD600值,记录下菌液对应时间的值;3、采用计数培养法,每隔一定时间取出一定体积的菌液,进行菌落数的计数;4、利用OD600值曲线和菌落数曲线绘制出细菌生长曲线。
实验注意事项:1、实验期间需在无菌条件下操作,防止细菌的外界感染对实验结果的影响;2、实验者需佩戴适当的防护手套及实验服,以免对人体造成伤害;3、制备好菌液后需要及时放置在摇床中,防止菌落外的细菌感染进去;4、测量OD600值时比色管必须清洗干净,用甲醇或无菌去离子水。
细菌增殖曲线的测定
实验3 细菌增殖曲线的测定一.实验目的:通过细菌数量的测量了解大肠杆菌的生物特征和规律,绘制生长曲线图二.实验原理大多数细菌的繁殖速率很快,在合适的条件下,一定时期的大肠杆菌细胞每20min分裂一次。
将一定量的细菌转入新鲜液体培养基中,在适宜的条件下培养细胞要经历延迟期、对数期、稳定期和衰亡期四个阶段。
以培养时间为横坐标,以细菌数目的对数或生长速率为纵坐标作图所绘制的曲线称为该细菌的生长曲线。
不同的细菌在相同的培养条件下其生长曲线不同,同样的细菌在不同的培养条件下所绘制的生长曲线也不相同。
测定细菌的生长曲线,了解其生长繁殖规律,这对人们根据不同的需要,有效地利用和控制细菌的生长具有重要意义。
三.菌种与培养基菌种:大肠杆菌培养基:牛肉膏蛋白胨培养基四.仪器光电比色计,摇床,冰箱五.操作步骤1、将在种子培养基中培养20 h的培养液3000rpm离心10min倾去上层液,加入无菌的生理盐水,成均匀液,细胞数系109/m1。
2.取盛发酵培养液的三角瓶,各接10%菌液作种子,在摇床上相同位置34℃振荡培养,之后于培养1h、2h、3h、4h、5h、6h、7h、8h、10h、24h各取1ml的菌液。
3.用蒸馏水为空白对照,将上述菌液于波长600nm处比色,但要求消光度在0.2~0.8之间,若超过,用未接种培养液适当稀释。
六.实验结果:1.结果(1) 将测定的OD600值填入下表培养时间(h)对照0 1 2 3 4 5 6 7 8 10 24 光密度值OD600(2)以菌悬液0D值为纵坐标,培养时间为横坐标,绘出大肠杆菌培养的增殖曲线.OD600值培养时间(h)七.思考题(1) 细菌生长繁殖所经历的四个时期中,哪个时期其代时最短?若细胞密度为103/m1,培养4.5h后,其密度高达2×108/m3,请计算出其代时。
(2) 次生代谢产物的大量积累在哪个时期?根据细菌生长繁殖的规律,采用哪些措施可使次生代谢产物积累更多?。
细菌的生化实验报告
细菌的生化实验报告细菌的生化实验报告细菌是微生物界中最为常见的一类生物,它们以其微小的身躯和巨大的生物活动而闻名。
在本次实验中,我们旨在探索细菌的生化特性和其在环境中的作用。
通过实验,我们对细菌的生长、代谢和适应能力有了更深入的了解。
实验一:细菌的生长曲线在这个实验中,我们选择了大肠杆菌作为研究对象。
我们将大肠杆菌接种在培养基上,并在一定时间间隔内记录细菌的生长情况。
通过测量培养液中的细菌数量,我们绘制了细菌的生长曲线。
结果显示,细菌的生长曲线呈现出典型的“S”形曲线。
在实验初期,细菌数量增长较为缓慢,这是由于适应期的存在。
随着时间的推移,细菌进入了指数增长期,细菌数量迅速增加。
然而,随着培养基中营养物质的消耗和代谢产物的积累,细菌的生长速率逐渐减缓,进入了平台期。
这是由于细菌的生长受到了环境条件的限制。
实验二:细菌的代谢特性在这个实验中,我们研究了细菌的代谢特性,特别是其对碳源的利用能力。
我们选择了葡萄糖、乳糖和蔗糖作为碳源,通过测量细菌在不同碳源下的生长情况,评估了细菌对不同碳源的利用能力。
结果显示,大肠杆菌对葡萄糖的利用能力最强,其次是乳糖,而对蔗糖的利用能力较弱。
这表明细菌对碳源的利用能力存在差异,可能与其代谢途径和酶的分布有关。
此外,我们还观察到在不同碳源条件下,细菌的生长速率和产生的代谢产物也有所不同。
这提示我们,在实际应用中,选择合适的碳源可以促进细菌的生长和代谢活性。
实验三:细菌的适应能力在这个实验中,我们研究了细菌的适应能力,特别是其对环境压力的响应。
我们将大肠杆菌分别接种在不同的培养基中,其中一组培养基中添加了抗生素,另一组培养基中添加了高温。
结果显示,添加抗生素的培养基中,细菌的生长受到了明显的抑制。
抗生素通过抑制细菌的代谢活性和细胞分裂,从而阻碍了细菌的生长。
而在高温条件下,细菌的生长速率明显减慢,部分细菌甚至无法生存。
这表明细菌对环境压力的适应能力有限,过高的温度和抗生素的存在可能对细菌产生不可逆的影响。
细菌生长特点及生长曲线的测定
实验原理(分光光度计与比浊法)
朗伯-比尔定律 A=-lg(I/I。)=-lgT=kLc
比浊法虽只能测相对数量,但便捷。某些情况 下,我们重在数量的变化而不在数量本身
三、实验内容
1、分光光度计的使用
2、大肠杆菌生长曲线的测定与绘制
四、实验材料
1. 试剂
蛋白胨、氯化钠、酵母浸粉等。 2. 仪器 托盘天平、高压蒸汽灭菌锅、分光光度计、恒温箱、恒温振荡 器。 3. 玻璃器皿 试管、烧杯、量筒、锥形瓶、培养皿、移液管等。 4. 其它物品
药匙、称量纸、pH试纸、记号笔、棉花、纱布、耐高温皮筋、 报纸等。
恒温振荡器(摇床)
五、实验流程
接种→培养→取样→比浊
★实验安排(4人一组) 第一组:LB 培养基,1:100
第二组: LB 培养基,1:50
第三组: LB 培养基,1:20 第四组: LB 培养基,1:100 第五组: LB 培养基,1:10 第六组: LB 培养基,1:5
二、实验原理
理想中生长曲线
1.4 1.2 1 0.8 0.6
0.4
数 量
n y=2
0.2 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 时间
理想中生长曲线
1.4 1.2 1 0.8 0.6
0.4 0.2 0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 时间
八、讨论
1.接种龄如何影响大肠杆菌生长?
2.培养基营养成分/浓度如何影响大肠杆菌生长? 3.实验为何观察不到稳定期和衰退期? (请3选1,作答在实验报告上)
★实验安排(4人一组) 第一组:LB 培养基,1:100
第二组: LB 培养基,1:20
实验4测定细菌生长曲线
仪器:
摇床、分光光度计、取液器。
微生物材料
大肠杆菌菌液、枯草杆菌菌液
培养基
肉汤蛋白胨液体培养基
用具
玻璃比色皿,三角瓶,酒精灯,接种环。
2021/6/16
6
五、准备步骤
准备菌种:将大肠杆菌和枯草杆菌分别接到于肉汤 蛋白胨液体培养基中,37℃振荡培养14-18h。 另准备大肠杆菌和枯草杆菌斜面种子各1支。
• 将所测的光密度值(OD)与其对应的培养时间作图, 即可绘出该菌在一定条件下的生长曲线(注意:由于 光密度表示的是培养液的总数,包括活菌与死菌所测 的生长曲线衰亡期不明显)。
2021/6/16
4
微生物的典型生长曲线图 Ⅰ.延滞期,Ⅱ.指数期,Ⅲ.稳定期,Ⅳ.衰亡期
2021/6/16
5
四、实验仪器、材料和用具
细菌的生长曲线分为:迟缓期、对数期、稳定期和 衰退期。其表示细菌从开始生长到死亡全过程的动 态。测定微生物的生长曲线对于了解和把握生物的
生长规律是很有帮助的。
2021/6/16
3
• 测定微生物生长曲线的方法有血球计数法、平板菌落 计数法、称重法和比浊法等。
• 比浊法:由于细菌悬液的浓度与混浊度成正比。故可 用分光光度计测定菌悬液的光密度来推知菌液的浓度。
接种:分别取5ml大肠杆菌或枯草杆菌液接种到装有 100ml培养液的三角瓶中,放摇床37℃,200rmp振 荡培养。同时分别从大肠杆菌或枯草杆菌斜面取菌 接种于100ml培养液中,同样条件培养。
2021/6/16
7
测定(OD)
每小时吸取200ul培养液到2800ul蒸馏水中摇匀, 以蒸馏水为对照,选420nm波长进行光密度(OD值) 的测定(注意应测定0h的光密度值)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
竭诚为您提供优质文档/双击可除细菌生长曲线的测定实验报告篇一:细菌生长曲线实验九测定细菌生长曲线[实验目的]1.了解细菌生长曲线特征:2.学习液体培养基的配制以及注意事项。
3.学习液体种子和固体种子的不同接种方法和注意事项。
4.利用细菌悬液浑浊度间接测定细菌生长。
[仪器和材料]1.实验材料(1)大肠杆曲,枯草杆曲培养液及大肠杆菌平板。
(2)牛肉膏蛋门胨葡萄糖培养基(150ml/250ml三角瓶x4瓶/大组),配方:牛肉膏5g,蛋白胨10g,nacl5g,葡萄糖10g,加水至1000ml,ph7.5。
2.实验仪器取液器(5000μl,1000μl,200tμl各一支);培养箱.摇床,722s分光光度汁;1000μl无菌吸头100个;5000μl 无菌吸头2(:细菌生长曲线的测定实验报告)个;1ml或4ml 玻璃或塑料比色皿4个,共用参比杯一个。
[实验原理]将一定量的细菌接种在液体培养基内.在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,称为生长曲线(图91)。
单细胞微生物发酵具有4个阶段,即调整(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的.测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与浑浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(测oD550或oD620或oD600或oD420,可任选一波长)与对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以g表示。
其计算公式为;g=(t2-t1)/[(1gw1—lgw2)/lg2]式中tl和t2为所取对数期两点的时间;w1和w2分别为相应时间测得的细胞含量(g/L)或oD。
[实验步骤]1.准备菌种:将大肠杆菌,枯草杆菌分别接种到装有牛肉膏蛋白胨葡萄糖培养基的三角瓶中,37℃,200r/min 振荡培养14-18h.另外准备大肠杆菌单菌落平板l块(37c 培养24h)。
2.接种:分别将1.5ml(1%接种量)和4-5ml(3%接种量)大肠杆菌菌液和一个大肠杆菌单菌落接人含150ml培养液的三角瓶中.37℃,200r/min振荡培养;把4.5ml枯草杆菌(3%接种量)接入含150ml培养液的三角瓶中,37℃,200r /min振荡培养。
3.测量;每培养1h取样一次.净培养(不包括取样时间)10h结束培养,测量培养液ph值。
零小时也要测。
如果选用4ml比色皿取500μl培养液到2000μl蒸馏水中(稀释5倍),以蒸馏水为对照,测oD650。
或oD620或oD600或oD420任选一波长),如果选用lml比色皿,可以取1000μl培养液,以蒸馏水为对照,直接测oD620、oD600或oD420(任选一波长),当oD值大于0.6时,下一样品要稀释1倍测量.[实验结果].b.subtilis3%61.72;e.coli(plate)35.61。
②液体种子比较均匀,用相同的液体培养基转接后条件变化小,因此迟缓期几乎没有出现;实验结果代时长于理论值,主要是实验条件的影响,培养基、接种量、培养容器、温度条件等均影响到理论值。
e.coli/b.subtilis生长曲线比较1.81.61.41.210.80.60.40.201234567891011时间(h)[试验讨论](1)全班同时取样,时间以教室挂钟为准,取样时间越短越好,要求在10~15min内完成),同时开始振荡,取样期间假定细菌暂停生长.取样时间从发酵总时间中扣除.(2)为减少误差,须固定参比杯,不要旋动波长旋钮;每组固定同一台分光光度计,固定同一取液器oD(600nm) 篇二:微生物大实验实验报告(自动保存的)中央民族大学生命与环境科学学院微生物综合性设计实验报告化学抑杀菌剂的效果评价evaluationofbactericideeffectofchemicalinhibition20 XX年11月30日卡那霉素、氨苄青霉素和四环素对细菌抑杀效果的评价杨芳(中央民族大学生命与环境科学学院北京100081)摘要:目的了解抗生素对微生物生长的影响,学习抗菌谱试验的基本方法;自主设计方案,掌握评价化学抑杀剂作用效果方法;掌握评价化学抑杀剂作用效果方法。
方法本实验主要采用倾注法测菌悬液浓度、滤纸片法测定抗生素的最小抑制浓度(mIc)及ph值对抗生素作用效果的影响和t检验法对实验结果进行统计学分析。
结果本次试验所用大肠杆菌和枯草芽孢杆菌菌悬液浓度分别为1.3?107cFu/mL、7.1?107cFu/mL;对大肠杆菌卡那霉素、氨苄青霉素和四环素的mIc分别为0.006mg/mL、0.098mg/mL和0.781mg/mL,对枯草芽孢杆菌卡那霉素、氨苄青霉素和四环素的mIc分别为0.024mg/mL、0.391mg/mL和0.195mg/mL;卡那霉素对大肠杆菌为杀灭作用,对枯草芽杆菌为抑制作用、四环素对大肠杆菌为抑制作用,对枯草芽孢杆菌为杀灭作用、青霉素对枯草芽孢杆菌为抑制作用,因大肠杆菌出现抗性,所以青霉素对大肠杆菌的作用不明显。
结论对同一药剂,低浓度的药剂对细菌抑杀效果不明显而随着浓度的增大其抑杀效果越来越明显;同一浓度的同一药剂对不同细菌有不同的抑杀效果;不同药剂对同一细菌的抑杀效果是不同的。
关键字:最小抑制浓度;抗生素;大肠杆菌;枯草芽孢杆菌Kanamycin,ampicillinandtetracyclineevaluationofthe inhibitionofbacterialkillingeffectsYangfang(collegeoflifeandenvironmentalscience,minzuuniversi tyofchina,beijing,100081)Abstract:objectiveunderstandtheimpactofantibioticsonmicrobia lgrowth,learnbasicmethodsofspectrumantimicrobialtes ting;designindependently,masterevaluateeffectsofche micalagentstokillsuppressionmethods;graspevaluateef fectsofchemicalagentstokillsuppressionmethods.metho dsThisexperimentmeasuredusepourbacterialsuspensionc oncentration,filterpaperassayantibioticminimuminhib itoryconcentration(mIc)andtheeffectofphontheeffects ofantibioticsandt-testoftheexperimentalresultswerea nalyzedstatistically.ResultsThetestsusedescherichia coliandbacillussubtilisbacteriasuspensionconcentrationwas1.3?107cFu/mL,7.1?107cFu/mL.escherichiacolikanamyci n,ampicillinandtetracyclinemIcwas0.006mg/mL,0.098mg /mLand0.781mg/mL.bacillussubtilis,kanamycin,ampicil linandtetracyclinemIcwas0.024mg/mL,0.391mg/mLand0.1 95mg/mL;kanamycinkillingeffectone.coli,bacillussubt ilisfortheinhibitionofe.colitetracyclineinhibitiono fbacillussubtilistokill,penicillinistheinhibitionof bacillussubtilis,escherichiacolioccurduetoresistanc e,sotheroleofescherichiacolipenicillinisnotobvious. conclusionsForthesamedrug,alowconcentrationofdrugsu ppressionkilllittleeffectonbacteriaandwiththeincrea singconcentrationofitssuppressionkillmoreandmoreobv iouseffect;samedruginthesameconcentrationofdifferentsuppressionkillbacteriahavedifferenteffect s;differentagentsofthesamesuppressionofbacterialkil lingeffectsaredifferent.Keywords:mIc;Antibiotic;e.coli;bacillussubtilis一、引言:1.实验目的:1.1了解抗生素对微生物生长的影响,学习抗菌谱试验的基本方法;1.2巩固已学习的微生物实验技能,学以致用;1.3自主设计方案,通过滤纸片法研究一些常用抗生素的抑杀菌效果,掌握评价化学抑杀剂作用效果方法;1.4掌握评价化学抑杀剂作用效果方法;1.5培养学生的团队合作意识;1.6培养学生总结实验结果和撰写科研论文的能力。
2.实验原理:2.1抗生素在人们日常生活中常用到各种抗病原体药物,包括各种抗生素和中药类复方抗菌药物等。
抗生素是由微生物(包括细菌、真菌、放线菌属)产生、能抑制或杀灭其他微生物的物质。
抗生素既不参与细胞结构也不是细胞内的贮存性养料对产生菌本身无害但对某些微生物有拮抗作用,是微生物在种间竞争中战胜其他微生物保存自己的一种防卫机制。
抗生素分为天然品和人工合成品,前者由微生物产生,后者是对天然抗生素进行结构改造获得的部分合成产品。
