高中化学 甲烷的性质及化学方程式
人教版高中化学必修二课件最简单的有机化合物——甲烷

光照
CH4+2Br2
CH2Br2+2HBr
光照
CH4+3Br2
CHBr3+3HBr
光照
CH4+4Br2
CBr4+4HBr
22
二、甲烷的性质
(3)甲烷的受热分解 CH4 高温 C+2H2
结构 决定 性质 决定用途
23
二、甲烷的性质
应用: 三氯甲烷和四氯甲烷是工业上重
要的溶剂。 氢气是合成氨和合成汽油等工业
放在光亮处。片刻后,比较2支试管 中的物质,二者是否出现了区别?
1.你从实验中得到哪些信息? 2.从所得的实验信息中你能得到哪些 启示?
10
二、甲烷的性质
现象与结论:
室温时,混合气体无光照时,不发生反应;光照时
现象 混合气体的黄绿色变浅,试管壁上出现油滴,试管
中有少量白雾,试管内的液面上升。
结论
1 说明试管内的混合气体在光照的条件下发生了化 学反应。 2 试管壁上出现液滴,说明反应中生成了新的油状 物质,且不溶与水。 3 试管内液面上升,说明随着反应的进行,试管内 的气压在减小,即气体总体积在减小。
思考:1molCH4完全生成1molCCl4需多少molCl2?
生成多少molHCl? 4mol 4mol
光照下甲烷与氯气发生取代反应
CH4 + Cl2 光照 CH3Cl +HCl CH4 + 2Cl2 光照 CH2Cl2 + 2HCl CH4 + 3Cl2 光照 CHCl3 +3 HCl CH4 + 4Cl2 光照 CCl4 + 4HCl
7
二、甲烷的性质
2、化学性质:
通常情况下,甲烷稳定,如与强酸、强 碱和强氧化剂等一般不发生反应。
甲烷的性质

甲烷甲烷分子式CH4。
最简单的有机化合物。
甲烷是没有颜色、没有气味的气体,沸点-161.4℃,比空气轻,它是极难溶于水的可燃性气体。
甲烷和空气成适当比例的混合物,遇火花会发生爆炸。
化学性质相当稳定,跟强酸、强碱或强氧化剂(如KMnO4)等一般不起反应。
在适当条件下会发生氧化、热解及卤代等反应。
甲烷在自然界分布很广,是天然气、沼气、坑气及煤气的主要成分之一。
它可用作燃料及制造氢、一氧化碳、炭黑、乙炔、氢氰酸及文字甲醛等物质的原料。
413kJ/mol、109°28′,甲烷分子是正四面体空间构型,上面的结构式只是表示分子里各原子的连接情况,并不能真实表示各原子的空间相对位置。
1.物质的理化常数:国标编号21007CAS号74-82-8中文名称甲烷英文名称methane;Marsh gas别名沼气分子式CH4 外观与性状无色无臭气体分子量16.04 蒸汽压53.32kPa/-168.8℃闪点:-188℃熔点-182.5℃沸点:-161.5℃溶解性微溶于水,溶于醇、乙醚密度相对密度(水=1)0.42(-164℃);相对密度(空气=1)0.55 稳定性稳定危险标记4(易燃液体) 主要用途用作燃料和用于炭黑、氢、乙炔、甲醛等的制造2.对环境的影响:一、健康危害侵入途径:吸入。
健康危害:甲烷对人基本无毒,但浓度过高时,使空气中氧含量明显降低,使人窒息。
当空气中甲烷达25%-30%时,可引起头痛、头晕、乏力、注意力不集中、呼吸和心跳加速、共济失调。
若不及时脱离,可致窒息死亡。
皮肤接触液化本品,可致冻伤。
二、毒理学资料及环境行为毒性:属微毒类。
允许气体安全地扩散到大气中或当作燃料使用。
有单纯性窒息作用,在高浓度时因缺氧窒息而引起中毒。
空气中达到25~30%出现头昏、呼吸加速、运动失调。
急性毒性:小鼠吸入42%浓度×60分钟,麻醉作用;兔吸入42%浓度×60分钟,麻醉作用。
危险特性:易燃,与空气混合能形成爆炸性混合物,遇热源和明火有燃烧爆炸的危险。
甲烷的理化性质及危险特性表

甲烷的理化性质及危险特性表
该表提供了甲烷的理化性质及危险特性的一般信息。
甲烷是一种无色无味的气体,化学式为CH4,分子量为16.04 g/mol。
其密度为0.717 kg/m³,沸点为-161.5°C,熔点为-182.5°C,不溶于水。
甲烷是一种极易燃、易爆炸的气体,其燃点为580°C。
其致命浓度为5-15%(体积分数)。
甲烷的主要危险特性包括易燃气体和高压气体。
对人体来说,呼吸系统是其主要影响目标器官。
在环境方面,甲烷不会对臭氧层造成破坏。
为了确保安全,建议在使用甲烷时保持良好通风。
请注意,以上信息只是一般性的描述,并不涵盖所有甲烷的特性。
在具体场景中,应该根据实际情况采取适当的防护措施。
甲烷

重要的有机化合物 认识有机化合物
绝大多数含碳的化合物。 有机物一定含碳元素。
但含碳的化合物,不一定是有机物。 碳的氧化物、碳酸及其盐、氰化物等 属于无机化合物。
根据初中化学的学习,已经了解到有 机化合物具有一些共同的性质,如大多数 有机化合物熔沸点低、难溶于水、可以 燃烧。那么它们还有那些具体性质呢?甲 烷是最简单的有机化合物,本节以此为例, 进行进一步研究。 (知识点一)
(1)反应装置(如图)
(2)反应条件:光照 (3)实验现象:
量筒内液面上升
气体颜色变浅 量筒内壁有油状液体生成
甲烷与氯气光照条件下的反应
光照
→
CH4 + Cl2
光照
CH3Cl + HCl
CH4 + Cl2 CH3Cl + Cl2
光照 光照
CH3Cl + HCl CH2Cl2 + HCl
CH2Cl2 + Cl2 CHCl3 + Cl2
光照
光照
CHCl3 + HCl CCl4 + HCl
甲烷在光照条件下和氯气的反应 四步反应同时存在,反应产物共 5 种,所有产物中物质的量最多 有—— HCl, 其中有—— 4 种是有机物, 的为—— 难 溶于水 有机产物(氯代产物)均—— Cl2 CHCl3 CCl4 为油状 2 其中CH ———— 、———— 、———— CH3Cl 是气体。 液体产物,————
取代反应:有机物分子里的某些
原子或原子团被其他原子或原子团 所代替的反应。
当堂巩固
1、将甲烷与氯气等体积混合后光照,其产物有 ( D )种 A 、1 B 、2 C 、4 D 、5
2.下列物质在一定条件下,可与CH4发生化学反应的 ( AC ) A氯气 B盐酸 C氧气 D酸性KMnO4溶液
化学必修二最简单的有机化合物—甲烷

几种烷烃的球棍模型及对应的结构式
H H | | H- C - C - H | | H H
H H H | | | H- C - C - C - H | | | H H H
乙烷
丙烷
几种烷烃的球棍模型及对应的结构式
丁烷 丁烷: H H H H
| | | | H- C - C - C - C - H | | | | H H H H
第一课时
一、甲烷在自然界的存在
沼气
油田气
煤矿坑道气(瓦斯)
天然气
甲烷是池沼底部产生的沼气和煤矿的坑道所产生的 气体的主要成分。这些甲烷都是在隔绝空气的情况下, 由植物残体经过微生物发酵的作用而生成的。
沼气(甲烷)的制取和利用
可燃冰 是甲烷的水合物,易 燃烧,其储量较大,将成为 理想的替代能源
练习:请看图写出分子式和结构简式。
甲烷CH4 分子式: 结构简式: CH4
乙烷C2H6
丙烷C3H8
CH3CH3
CH3CH2CH3
练习:请看图写出分子式和结构简式。
丁烷C4H10 CH3CH2CH2CH3
异丁烷C4H10 CH3CHCH3 | CH3
两种丁烷( C4H10 )分子组成和相对分子质量完 全相同,但性质却有差异。
2、结构简式: 例:
H H H H H | | | | | H—C—C—C—C—C—H | | | | H H H H
H—C—H | H
省略C—H键 把同一C上的H合并 省略主链上C—C键
CH3—CH—CH2—CH2—CH3 CH3 CH3CHCH2CH2CH3
或者:
CH3
CH3 CH(CH3)CH2 CH2 CH3
甲烷与氯气反应的化学方程式:
人教版高中化学必修二《最简单的有机化合物—甲烷》

最简单的有机化合物—甲烷知识点一.有机化合物和烃概念组成元素有机化合物大部分含有碳元素的化合物一定含有C,常含有H,O,有的还含有N,P,S,Cl等(写元素符号,下同)。
烃仅含有C,H的有机物有机化合物都含有碳元素,但含有碳元素的物质不一定都是有机物,如CO、CO2、碳酸盐、碳酸氢盐都属于无机物。
知识点二.甲烷1.存在和用途(1)存在:甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。
(2)用途:天然气是一种高效、低耗、污染小的清洁能源,还是一种重要的化工原料。
2.组成与结构(1)表示方法化学式电子式结构式分子结构示意图球棍模型比例模型CH4(2)结构特点甲烷分子是以碳原子为中心,氢原子为顶点的正四面体结构,其中C—H键的键长和键角相同。
3.物理性质颜色 状态 气味 密度(与空气相比) 水溶性 无色气态无味小极难溶4.化学性质通常状况下,甲烷比较稳定,与KMnO 4等强氧化剂不反应,与强酸、强碱也不反应。
但在特定的条件下,甲烷也能发生某些反应。
(1)氧化反应纯净的甲烷在空气中安静的燃烧,火焰呈淡蓝色,放出大量的热,反应的化学方程式为 CH 4+2O 2――→点燃CO 2+2H 2O 。
(2)取代反应①取代反应:有机化合物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
②甲烷与氯气的取代反应实验操作实验现象a.气体颜色变浅,最后消失b.试管内壁有油状液滴出现c.试管内液面逐渐上升d.试管中有少量白雾③取代产物水溶性:甲烷的四种氯代产物均不溶于水。
状态:常温下除一氯甲烷是气体,其余三种均为液体。
④取代反应和置换反应的区别。
知识点三.烷烃1.烷烃定义及通性:烃的分子里所有的碳原子均达到“饱和”的链烃即所有的碳原子间均以单键的形式连接叫做饱和链烃,也叫烷烃。
通式:C n H2n+2(n≥1),如乙烷、丙烷、丁烷等。
通性:①n≤4为气体,溶沸点、密度随碳原子数增大而增大②通常状况下,很稳定,与酸、碱和氧化剂都不发生反应,也难与其它物质化合。
高中化学有机化合物之甲烷知识点汇总

高中化学有机化合物之甲烷知识点汇总一、甲烷的存在、结构及物理性质1.存在甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。
2.分子结构甲烷的分子式是CH4;电子式是;结构式是。
实验证明,甲烷分子具有正四面体结构,其中四个C—H键长度和强度相同,夹角相等。
3.物理性质颜色状态气味密度(与空气相比) 水溶性无色气体无味比空气小极难溶警示有机化合物必须含有碳元素,但含有碳元素的化合物不一定是有机化合物,如CO、CO2,碳酸及其盐等。
【讨论】1.(1)CH4是正四面体结构,CH3Cl、CH2Cl2、CHCl3、CCl4也都是正四面体结构吗?(2)如果甲烷是平面结构,则CH2Cl2有几种结构?实际上有几种结构?答案(1)CH4是正四面体结构,碳原子处于正四面体的中心,四个氢原子处于正四面体的四个顶点上。
根据甲烷是正四面体结构推理,有机物分子中碳原子以4个单键与其他原子或原子团相结合,如,若a、b、c、d相同,则构成正四面体结构,如CCl4;若a、b、c、d不相同,则构成四面体,但不是正四面体,如CH3Cl、CH2Cl2、CHCl3。
(2)如果甲烷是平面结构,则CH2Cl2有2种结构,分别是,实际为空间四面体结构,所以二氯甲烷只有一种结构。
二、甲烷的化学性质通常状况下,甲烷比较稳定,与高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应。
但在特定的条件下,甲烷也会发生某些反应。
1.氧化反应(燃烧)(1)化学方程式:CH4+2O2点燃――→CO2+2H2O 。
(2)现象:甲烷在空气中安静地燃烧,火焰呈淡蓝色。
2.取代反应(1)取代反应有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应。
(2)甲烷与氯气的取代反应①实验探究②产物性质CH3Cl CH2Cl2 CHCl3 CCl4状态气体均为油状液体水溶性都不溶于水点拨无论CH4和Cl2的比例如何,发生取代反应的产物都是CH3Cl、CH2Cl2、CHCl3、CCl4和HCl的混合物。
表- 甲烷的理化性质及危险特性
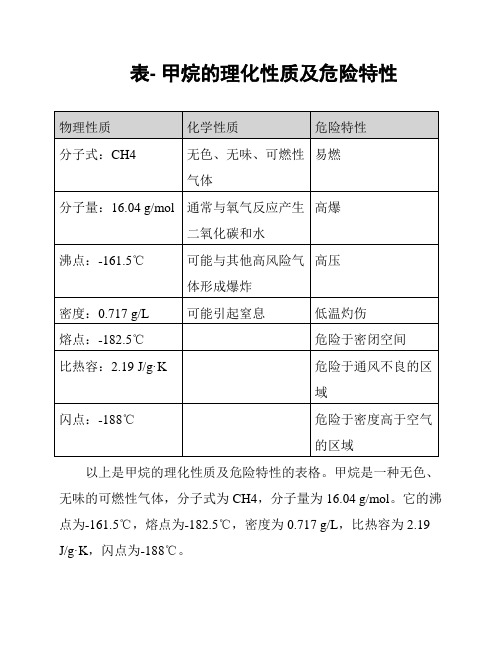
表- 甲烷的理化性质及危险特性
以上是甲烷的理化性质及危险特性的表格。
甲烷是一种无色、无味的可燃性气体,分子式为CH4,分子量为16.04 g/mol。
它的沸点为-161.5℃,熔点为-182.5℃,密度为0.717 g/L,比热容为2.19 J/g·K,闪点为-188℃。
甲烷在常温常压下与氧气反应产生二氧化碳和水,同时也可能与其他高风险气体形成爆炸。
它是易燃物质,具有高爆特性,并且可能引发高压、低温灼伤等危险。
甲烷还可能引起窒息,危险于密闭空间和通风不良的区域,以及密度高于空气的区域。
在处理甲烷时,需要注意其危险特性,并采取适当的安全措施以确保人员和环境的安全。
以上是关于甲烷的理化性质及危险特性的描述。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲烷的性质及化学方程式
1.甲烷的物理性质
甲烷是无色无味、极难溶于水、密度比空气小的气体。
2.甲烷的化学性质
(1)具有稳定性
通常情况下,甲烷性质比较稳定,与强酸、强碱不反应,与高锰酸钾溶液等强氧化剂也不反应。
(2)氧化反应——可燃性
将甲烷在空气中点燃,观察燃烧现象并检验燃烧产物。
甲烷的检验定义:
甲烷在自然界的分布很广,是天然气、沼气、油田气及煤矿坑道气的主要成分。
它可用来作为燃料及制造氢气、碳黑、一氧化碳、乙炔、氢氰酸及甲醛等物质的原料。
分子式为CH4。
甲烷是最简单的有机物,别名:天然气,沼气,可燃冰。
也是含碳量最小(含氢量最大)的有机物,是沼气,天然气,瓦斯,坑道气和油田气的主要成分.
物理性质:
颜色:无色,燃烧后有蓝色火焰
气味:无味
熔点:-182.5℃
沸点:-161.5℃
溶解度:在20℃、0.1千帕时,100单位体积的水,能溶解3个单位体积的甲烷。
化学性质:
点燃纯净的甲烷,在火焰的上方罩一个干燥的烧杯,很快就可以看到有水蒸气在烧杯壁上凝结。
倒转烧杯,加入少量澄清石灰水,振荡,石灰水变浑浊。
说明甲烷燃烧生成水和二氧化碳。
化学方程式为:CH4+2O2=点燃==CO2+2H2O
甲烷的检验:
点燃待检验的气体,在火焰上方罩一个干燥的烧杯,若有水珠出现,且滴入澄清石灰水后变混浊,则证明甲烷存在。
甲烷燃烧的化学方程式
完全燃烧:CH4+2O2=CO2+2H2O
不完全燃烧:2CH4+3O2=2CO+4H2O
甲烷的存在与用途
(1)甲烷的存在
甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。
我国的天然气主要分布在中西部地区及海底。
(2)甲烷的主要用途
以甲烷为主要成分的天然气和沼气都是理想的清洁能源。
甲烷还可用作化工原料。
归纳总结:
甲烷分子空间构型为正四面体形,碳原子位于中心,4个氢原子位于顶点,4个C—H键的
甲烷燃烧的化学方程式是什么
甲烷燃烧因为区分完全燃烧和不完全燃烧两种情况,所以甲烷燃烧的化学方程式如下:
CH4+2O2=CO2+2H2O(完全燃烧生成CO2和水);
2、2CH4+3O2=2CO+4H2O(不完全燃烧时生成CO和水)。
甲烷介绍
甲烷,化学式CH4,是最简单的烃,由一个碳和四个氢原子通过sp3杂化的方式组成,因此甲烷分子的结构为正四面体结构,四个键的键长相同键角相等。
在标准状态下甲烷是一无色无味气体。
一些有机物在缺氧情况下分解时所产生的沼气其实就是甲烷。
从理论上说,甲烷的键线式可以表示为一个点“·”,但实际并没有看到过有这种用法,可能原因是“·”号同时可以表示电子。
所以在中学阶段把甲烷视为没有键线式。
甲烷主要是作为燃料,如天然气和煤气,广泛应用于民用和工业中。
作为化工原料,可以用来生产乙炔、氢气、合成氨、碳黑、硝氯基甲烷、二硫化碳、一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氢氰酸等。
甲烷的化学性质
通常情况下,甲烷比较稳定,与高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应。
但是在特定条件下,甲烷也会发生某些反应。
甲烷的卤化中,主要有氯化、溴化。
甲烷与氟反应是大量放热的,一旦发生反应,大量的热难以移走,破坏生成的氟甲烷,只得到碳和氟化氢。
因此直接的氟化反应难以实现,需用稀有气体稀释。
碘与甲烷反
应需要较高的活化能,反应难以进行。
因此,碘不能直接与甲烷发生取代反应生成碘甲烷。
但它的逆反应却很容易进行。
以氯化为例:可以看到试管内氯气的黄绿色气体逐渐变淡,有白雾生成,试管内壁上有油状液滴生成,这是甲烷和氯气反应的所生成的一氯甲烷、二氯甲烷、氯仿(或三氯甲烷)、四氯化碳(或四氯甲烷)、氯化氢和少量的乙烷(杂质)的混合物。
