氨 硝酸 硫酸PPT
【学海导航】安徽省高中化学(第1轮)总复习 第4章第16课时 氨 硝酸 硫酸(1)课件 新人教版

氨和铵盐
• 1.氨气和氨水氨气是无色、有刺激性气味
的气体,密度比空气小,易液化,极易溶
于水(常温常压下,1体积水约能溶解700
体积的氨气)。氨气能与水、氯化氢、氧
气等物质发生反应,其中与水反
• 应的产物NH3·H2O是一种弱碱。 • 氨水的性质:氨水是氨气溶于水形成的混
•
(4)氨的氧化反应是一个放热反应 有
红棕色气体产生
•
(5)4NH3+5O催2△化剂
4NO+6H2O
•
(6)NH4+ NO3-
•
已知甲、乙、丙均为常见气体,
其中甲在空气中含量最多,乙在相同条件下
密度最小,丙有刺激性气味,且一个丙分子 由四个原子构成。
• (1)实验室中可用下图A或B装置与相应的 药品制得丙。
Cu(OH)2↓,所以n(OH-)=2n(Cu2+),
• 因此V(NaOH)=
=0.06 L=60
mL。
(n NaOH)
(c NaOH)
答案:A .60 mL
• 如图所示,向一定量的铁粉中加入一定体 积12 mol·L-1的硝酸,加热充分反应后, 下列微粒在体系中一定存在的是B( )
• ①NO3- ②Fe3+ ③H+ ④NO ⑤NO2 • A.只有①
• (4)氨水密度小于水,当把氨水稀释 时,随质量分数的减小,氨水的密度增 大。
• +O(H5- )弱N O(碱4与性易,挥具发有的碱酸的反通应性产:生NH白3烟·H,2O可 用于检验氨气、氨水的存在)。氨水是很好
的沉淀剂,能使Al3+、Fe3+、Mg2+分别转化
成Al(OH)3、Fe(OH)3、Mg(OH)2沉 淀,但氨水中滴加Ag+溶液开始出现沉淀
人教高中化学必修1全册课件:第四节《氨硝酸硫酸》第一课时

一、氨 阅读材料:
2004年4月20日上午10时,杭州市一 制冷车间发生液氨泄漏事件,整个厂区 是白茫茫的一片,方圆数百米,空气中 弥漫着一股浓烈的刺激性气味。厂区内 寒气逼人。
思考:氨气有哪些物理性质?
[实 验4—8] 氨的性质,注意观察现象。
现象:烧杯中的水由玻璃导管进入 烧瓶形成红色的喷泉。
NH4Cl △= NH3 ↑ + HCl ↑ NH4HCO3 △= NH3 ↑ + H2O ↑ + CO2 ↑ (NH4)2CO3 △= 2NH3 ↑ + H2O ↑ + CO2 ↑
由上面的反应可以看出, NH4Cl 、 NH4HCO3、 (NH4)2CO3 受热都能分解,都有NH3产生,但不是所有的铵盐受热分 解都能产生NH3的,例如NH4NO3的分解:
2NH4Cl+Ca(OH)2=△=2NH3↑+2H2O+CaCl2
(3)制取装置:
固固加热装置
棉花的作用: 防止空气对流,保证 氨气纯度
④集气方法:向下排空气法
⑤验满方法: ①将湿润的红色石蕊试纸置于试管口(试纸变蓝) ②将蘸有浓盐酸的玻璃棒靠近试管口(白烟)
⑥干燥方法: 碱石灰(CaO和NaOH混合物)等碱性干燥剂 注意:无水CaCl2不能用来干燥NH3(形成CaCl2.8NH3)
小结:浓硫酸的脱水性是指浓硫酸能把有机物中 的氢氧原子按2∶1(H2O)的个数比脱去。
吸水性、脱水性的比较
性质
吸水性
脱水性
吸收物质中的游 吸收对 离水、水蒸气、 将有机物中的氢、氧
象 结晶水,直接与 元素按水的比例脱去 水分子结合
本
质
与水发生水合作 用,放出热量
莫第四章第4节_《氨、硝酸、硫酸》课件

③ 氨的还原性----氨的催化氧化
催化剂
4NH3+5O2
H2
△
4NO+6H2O
O2
H2O
硝酸的制取过程
N2 NH3 催化氧化 NO
O2
NO2
HNO3
思考: 1.上述反应中,氮元素发生氧化反应
和发生还原反应的是哪几步?
3、氨的用途
制氮肥 铵盐
制硝酸 纯碱
氨的用途
有机合成 工业原料
致冷剂
巩固: 1.某同学在实验室中发现了一瓶有刺激性气 味的气体,判断可能是氨气,下列提供的 方法中,你认为能帮他检验是否为氨气的 方法是( AC ) A、将湿润的红色石蕊试纸放在瓶口 B、将干燥的红色石蕊试纸放在瓶口 C、用蘸有浓盐酸的玻璃棒靠近瓶口 D、将湿润的蓝色石蕊试纸放在瓶口
(NH4)2SO4 + 2NaOH===Na2SO4+2NH3↑+2H2O
NH4NO3 + NaOH===NaNO3+NH3 ↑+H2O
NH4+的检验: 讨论后回答:取样、操作(试剂)、现象、 结论。 (1)取少量样品与碱混合于试管中共热,用 湿润的红色石蕊试纸靠近试管口,若试纸 变蓝,则证明样品中含有NH4+;
金属单质+浓硫酸
硫酸盐 + SO2↑+ H2O
常温下,浓H2SO4可使 Fe、Al等金属钝化
浓硫酸作干燥剂
1. 不能干燥碱性气体:NH3 2.不能干燥还原性气体:
H2S、HI、HBr
3.能够干燥: SO2、HCl、 CO2、 H2、 O2等
思考题: 如何用实验方法证明木炭与浓硫酸
反应的产物? 提供以下试剂与装置(装置可多次使用):
高一化学第四节氨、硝酸、硫酸
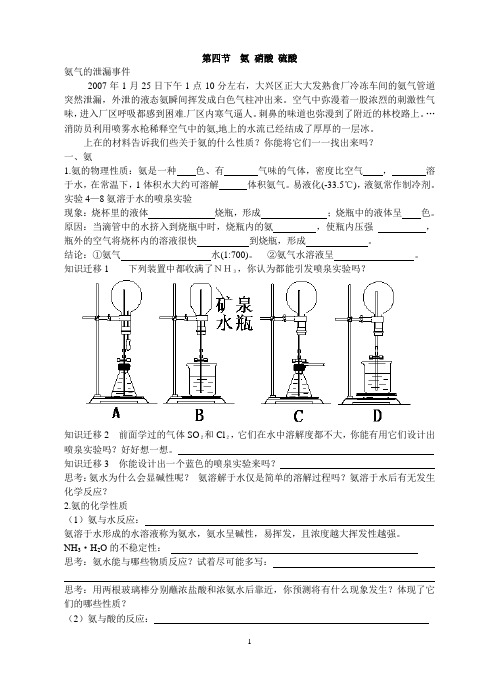
第四节氨硝酸硫酸氨气的泄漏事件2007年1月25日下午1点10分左右,大兴区正大大发熟食厂冷冻车间的氨气管道突然泄漏,外泄的液态氨瞬间挥发成白色气柱冲出来。
空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难.厂区内寒气逼人。
刺鼻的味道也弥漫到了附近的林校路上。
…消防员利用喷雾水枪稀释空气中的氨,地上的水流已经结成了厚厚的一层冰。
上在的材料告诉我们些关于氨的什么性质?你能将它们一一找出来吗?一、氨1.氨的物理性质:氨是一种色、有气味的气体,密度比空气,溶于水,在常温下,1体积水大约可溶解体积氨气。
易液化(-33.5℃),液氨常作制冷剂。
实验4—8氨溶于水的喷泉实验现象:烧杯里的液体烧瓶,形成;烧瓶中的液体呈色。
原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨,使瓶内压强,瓶外的空气将烧杯内的溶液很快到烧瓶,形成。
结论:①氨气水(1:700)。
②氨气水溶液呈。
知识迁移1 下列装置中都收满了NH3,你认为都能引发喷泉实验吗?知识迁移2 前面学过的气体SO2和Cl2,它们在水中溶解度都不大,你能有用它们设计出喷泉实验吗?好好想一想。
知识迁移3 你能设计出一个蓝色的喷泉实验来吗?思考:氨水为什么会显碱性呢?氨溶解于水仅是简单的溶解过程吗?氨溶于水后有无发生化学反应?2.氨的化学性质(1)氨与水反应:氨溶于水形成的水溶液称为氨水,氨水呈碱性,易挥发,且浓度越大挥发性越强。
NH3·H2O的不稳定性:思考:氨水能与哪些物质反应?试着尽可能多写:思考:用两根玻璃棒分别蘸浓盐酸和浓氨水后靠近,你预测将有什么现象发生?体现了它们的哪些性质?(2)氨与酸的反应:氨与酸反应生成铵盐。
铵盐又叫铵态氮肥。
思考:有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?铵盐可以做氮肥体现了铵盐的什么物理性质?铵盐的性质①铵盐都易溶于水②铵盐受热易分解NH4HCO3受热:NH4Cl受热:③铵盐与碱反应(NH4)2SO4 + NaOH:实质:(离子方程式)NH4HCO3 + NaOH:实质:(离子方程式)一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。
人教版高中化学精品系列 必修一 氨气 课件
△
2NH3+H2SO4 ==(NH4)2SO4
催化剂
2 NO + O2 === 2NO2 3NO2 + H2O === 2HNO3 + NO
催化剂
△
制硝酸
2NH3+CO2 ==== CO(NH2)2+ H2O
NH3(g)
放热 吸热
制尿素
NH3(l) 制冷剂
NH3 水
酚酞
【实验现象】 : 烧杯中的水进入烧 瓶中,形成红色的 喷泉。 ——“ 喷 泉 实 验 ”
①烧瓶里为什么会形成喷泉? ②胶头滴管的作用是什么? ③烧瓶中的溶液为什么变成红色?
①烧瓶内外产生压强差。
②引发“喷泉”实验 ③水溶液呈碱性,有OH-离子存在。
一、氨(NH3): 1.氨的物理性质: 颜色: 无色 气味: 有刺激性气味 状态: 气体 密度: 比空气的密度小 水溶性:极易溶于水(1:700)
氨易液化.
2.氨气的化学性质: ⑴氨与水反应: NH3+H2O NH3· H2O 一水合氨
氨的溶解更主要的是化学反应。 氨溶于水时,大部分氨与水结合, 形成一水合氨(NH3· H2O)。
NH3· H2O可以部分电离形成NH4 和OH ,所以氨水显弱碱性。
NH3· H2O
NH3+H2O
+
NH4
NH3· H2O
++OH-
NH4++OH-
【小结】:氨水的成分 分子:NH3、H2O、NH3· H2 O 离子:NH4+、OH-等
【探究实验】:
将氨的酚酞溶液倒入栓有小气球的试管 中,加热。
高中化学必修1 第四章 第四节 氨 硝酸 硫酸

(2)强氧化性: 浓硝酸和稀硝酸都能与铜发生反应: • 4HNO3(浓)+ Cu ═ Cu(NO3)2 + 2NO2 ↑ + 2H2O
H2SO4 ═
Zn H2SO4 +
Cu(OH)2 CuO BaCl2
2H+ + SO42变红
ZnSO4 + H2↑
CuSO4 + 2H2O CuSO4 + H2O BaSO4 +
@皮皮课件
紫色石蕊试液
2HCl
17
第二章 硫酸和硝酸的氧化性
2.2 硫酸 A.浓硫酸的特性:
① 吸水性:
向蔗糖中加入浓硫酸时,蔗糖变黑,体积 膨胀,变成疏松多孔的海绵状炭,并放出 刺激性气味。
@皮皮课件
20
第二章 硫酸和硝酸的氧化性
2.2 硫酸
小贴士
有些气体可以用浓硫酸干燥,有些气体却不能用浓硫酸干燥:
能用浓硫酸干燥的气体: H2、O2、N2、CO、CO2、CH4、SO2、HCl、Cl2
不能用浓硫酸干燥的气体:
① 碱性气体(NH3) ② 还原性气体(H2S、HI、HBr)
@皮皮课件 21
• 氧化非金属单质:
加热盛有浓硫酸和木炭的试管,碳就被氧化成二 氧化碳,而硫酸被还原为二氧化硫。
C + 2H2SO4(浓)
==
CO2↑ +
2SO2↑ + 2H2O
@皮皮课件
24
第二章 硫酸和硝酸的氧化性
2.4 硫酸的用途
@皮皮课件
25
第二章 硫酸和硝酸的氧化性
2.5 硝酸
(1)不稳定性(易分解): 4HNO3 ═ 4NO2 + 2H2O + O2↑
高一化学人教版必修1课件:第四章 第四节 第一课时 氨 (33张PPT)

C.加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在管口
D.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在管口 解析:铵盐与氢氧化钠溶液共热产生氨气,B、C、D 均能够
检验出氨气,但 A 将铵盐直接加热,会产生干扰氨气检验的
生成物(如碳酸氢铵),导致无法准确地检验,A 不可行。
答案:A
氨气的实验室制法
1.实验室能否用加热氯化铵的方法制取氨气? 提示:不能,氯化铵受热分解生成的氨气和氯化氢遇冷 会重新结合生成氯化铵。 2.实验室制取氨气时常在收集氨气的试管口塞一团疏松 的棉花团,其目的是什么?
提示:防止氨气与空气的对流,以收集到较纯净的氨气。
1.氨气的干燥装置 通常用碱石灰干燥氨气,不能用五氧化二磷、浓硫酸和无 水氯化钙干燥。
• You have to believe in yourself. That's the secret of success. 人必须相信自己,这是成功的秘诀。
•
形成喷泉的条件 使容器内外产生较大压强差的两类情况 (1)容器内气体极易溶于水或容器内气体易与溶液中的溶质发 生化学反应。 ①喷泉形成原理:
气体与水或其 气体溶解或发 容器内压 外部液体进入 他液体接触 ―→ 生化学反应 ―→ 强减小 ―→ 形成喷泉
②常见气体与吸收剂的组合
气体
HCl
NH3
CO2、Cl2、 H2S、SO2
NO2+O2
吸收剂 水或NaOH溶液 水或盐酸 NaOH溶液
水
(2)容器内的液体由于受热挥发(如浓盐酸、浓氨水、酒精等)
2.尾气处理 多余的氨要吸收掉(可在导管口放一团用水或稀硫酸浸湿 的棉花球)以避免污染空气。在尾气吸收时要防止倒吸,常采 用的装置有:
人教版高中化学必修一课件高一化学《第四章第四节氨硝酸硫酸(第3课时)》.pptx

2019/11/17
18
二、硫酸和硝酸的氧化性
浓硝酸、浓硫酸、浓盐酸性质对比
有 有 无 稳定 易挥发 无 无
有有 有有
浓有 稳定 难挥发 有 有 有 不稳定 易挥发 无 无
2019/11/17
2019/11/17
10
二、硫酸和硝酸的氧化性
△ C+4HNO3(浓)===CO2↑+4NO2↑+2H2O
当硝酸与金属或非金属(如碳、硫等)及 某些有机物反应时,反应物反应条件不 同,硝酸被还原得到的产物也不同.硝酸 中的+5价的氮得电子,被还原成较低得 氮的化合物。如: +4+3+2+10-3 NO2HNO2NON2ON2NH3
保存:
密封于棕色瓶中,并放在阴暗处!
2019/11/17
7
二、硫酸和硝酸的氧化性
浓硝酸与铜的反应:
现象:1、产生红棕色气体;2、溶液由无色变为
绿色;3、铜在不断的溶解。
固+液→气
浓HNO3
2019/11/17
NaOH溶液
8
二、硫酸和硝酸的氧化性
3、硝酸具有强氧化性:
还C原u+剂4H氧N化O3剂(浓)=Cu(NO3)2+2NO2↑+2H2O
空白演示
在此输入您的封面副标题
新课标人教版高中化学课件系列
必修化学1 第四章非金属及其化合物 第四节氨硝酸硫酸 第3课时
2019/11/17
2
二、硫酸和硝酸的氧化性
二、硝酸
(一)硝酸的物理性质:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)实验室制取氨气的化学方程式______________。 ①用图1装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是 __________________________。 该实验的原理是_______________________。 ②如果只提供如图2的装置,请说明引发喷泉的方法 ____________________________________。
22
3
B.NO遇O 转化为NO
2
2
C.硝酸工厂用NH 氧化制NO
3
D.由NH 制碳酸氢铵
3
【解析】选A。氮的固定是指将游离态的氮转化为化合态的氮的过程,只有A符合条件。
2.下列气体不能用排水集气法收集的是( )
A.H 2
B.NH 3
C.O 2
D.NO
【解析】选B。H 、O 、NO均难溶于水,可用排水法收集,NH 极易溶于水,只能
催化剂
====
NH4
△
====
7.(8分)A、B、C、D均为中学所学的常见物质且均含有同一 种元素,它们之间的转化关系如图所示(反应条件及其他物 质已经略去):
(1)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液
能使蓝色的湿润石蕊试纸变红,则A为
。写出C→D
转化的化学方程式:
。
(2)若A为活泼金属元素的单质,D为强碱,焰色反应显黄
D.能与碱反应放出氨气NH4
【解析】选C。铵盐都是白色晶体,易溶于水,均含
有 ,都能与碱反应放出氨气,A、B、D属于铵盐的通
性,故选C。
NH4
4.(2011·舟山高一检测)同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH ,② 3
NO ,进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为( ) 2
5.氨(NH )是重要的含氮化合物。为了在实验室制取干燥的氨气,甲、乙、丙三位同学分 3
别设计了如图三套实验装置:
(1)实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”)_____________; (2)写出实验室制取氨气的化学方程式 __________________________________________; (3)该实验装置与实验室制备_________的装置相同。
【思路点拨】明确各装置的特点是解答该类题目的关键:
A——NH 的发生装置;B——干燥NH ;
3
3
C——NH 的性质检验;D——除去N 中的NH ;
3
2
3
E——收集N 。
2
【自主解答】A中装有氯化铵和氢氧化钙的混合物,发生反 应的化学方程式是
2NH Cl+Ca(OH) CaCl +2NH ↑+2H O,因为C 中发生反
4 应3CuO+2NH
3
23Cu=+=N△=22=+3H2O3,所以2氨气在B处要干燥,D中收集到的物质是冷却的
过量氨气的水溶液,即△氨水,可
用红色石蕊试纸或酚=酞=溶==液检验,试纸变蓝或使酚酞溶液
变红。
答案:(1)2NH Cl+Ca(OH)
4
2
(2)除去氨气中的水蒸气
CaCl2=+=2△=N=H3↑+2H2O
2NH3;高剂氨温水高压催化
显弱碱性,原因是NH3·H2O
+OH-;浓氨水易挥
发,挥发出来的氨气在加热、催化剂条件下被氧化生N成H一4
氧化氮,继而被氧化为红棕色的二氧化氮。
答案:Ⅰ. N2+3H2
2NH3
Ⅱ.NH3·H2O Ⅲ.4NH3+5O2
+OH4NO+6H高剂2温O高压催化
2NO+O2
2NO2
(2)利用如下图所示的装置,可以验证NH 和HCl的有关性质。实验前a、b、c活塞均关闭。 3
(已知HCl极易溶于水且能快速溶解)
①若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是 _________。 ②若先打开a、c活塞,再挤压胶头滴管,在烧瓶Ⅱ中可观察到的现象是___________。 ③通过挤压胶头滴管和控制活塞的开关,在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产 生“喷泉”现象,其操作方法是___________________________________。
43 盐酸。其他要么不反应,要么反应不生成气体或产生气体很少。 (3)图1、2是上部压强减小导致喷泉,图3是下部压强增大导致喷泉,人造喷泉及火山爆 发均与图3原理相似。
答案:(1)2NH Cl+Ca(OH)
4
2
CaCl2=+=△2=N=H3↑+2H2O
①打开止水夹,挤压胶头滴管 NH 溶于少量水中,使圆底
22
3
用排空气法收集。
3.通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是( )
A.NH 3
B.Cl 2
C.NO
D.HCl
【解析】选C。NH 是碱性气体,只能用碱石灰干燥,Cl 、HCl能与碱石灰反应,应用
3
2
浓硫酸干燥,NO既不与浓硫酸反应,又不与碱石灰反应,故选C。
4.下列关于氨水的叙述中,正确的是( )
A.氨水显中性
B.氨水不能使酚酞指示剂变色
C.氨水中含两种分子
D.氨水中溶质的质量分数越大,溶液密度越小
【解析】选D。氨水中含有三种分子:NH 、H O 和NH ·H O;三种离子:NH +、
32
32
4
OH-和少量的H+,氨水显碱性,可使酚酞指示剂变红色;溶质是NH ,溶质的质量分
3
数越大,溶液密度越小。
答案:(1)2NH Cl+Ca(OH)
4
2
CaCl2=+=△2=N=H3↑+2H2O
(2)a 氨气密度比空气密度小
(3)极易溶于水 与水反应生成碱
(4)②、④
【典例】已知氨气可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以 实现该反应。
(1)A中装有氯化铵和氢氧化钙的混合物,发生反应的化学方程式是: ___________________。 (2)B中加入的是碱石灰,其作用是________________。 (3)实验时在C中观察到的现象是_______________, 发生反应的化学方程式是___________。 (4)D中收集到的物质是____________,检验该物质的方法和现象是____________。
(3)黑色粉末逐渐变为红色
3CuO+2NH 3Cu+N +3H O
3
22
(4)氨水 用红色石蕊△ 试纸或酚酞溶液检验,试纸变蓝或
使酚酞溶液变红 ====
【典例】某实验小组在实验室中制取氨气并设计实验验证氨气的某些性质。 (1)实验室制取氨气的化学方程式为____________,干燥氨气要用________,检验氨气时 可以用_____________。
3
烧瓶内压强减小,烧杯内的水进入圆底烧瓶,形成喷泉
②打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中
冒出,移去热毛巾
(2)D (3)减小 增大 3
【典例2】某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已 略去)。请回答:
(1)实验室制备氨气的化学方程式为 ___________________________________________。 (2)用装置B收集氨气时,应选择氨气的进气口是_____________(选填“a”或“b”),并 说明选择的理由是:________。 (3)打开装置B中的止水夹,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是 _______,____________。
【错因剖析】
【标准答案】
(碱1石)C灰a(OH湿)润2+的2红N色H4石C蕊l 试C纸=aC=△l2=+=2NH3↑+2H2O
(2)①挤压装水的胶头滴管,打开a、b活塞 ②产生“白烟” ③挤压装水的胶头滴管后,再打开a、c,然后再关闭a, 打开b
1.起固定氮作用的化学反应是( )
A.N 与H 在一定条件下反应生成NH
【自主解答】(1)实验室制取氨气的方程式为
2(2N)氨H4气C比l+空Ca气(O的H密)2度小,=Ca=可△C=l用2=+向2下N排H3空↑气+2法H收2O集。,导气管
要伸入烧瓶底部。 (3)能形成喷泉,证明氨气极易溶于水,酚酞变红,说明水 溶液显碱性。 (4)①不利于氨气的吸收,②、④能防止倒吸,③会发生倒 吸。
(2)利用图3装置,在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是 __________。 A.Cu与稀盐酸 B.NaHCO 溶液与NaOH溶液
3 C.CaCO 与稀硫酸
3 D.NH HCO 与稀盐酸
43 (3)从产生喷泉的原理分析,图1、2是__________上部烧瓶内的压强。图3是__________ 下部锥形瓶内气体的压强(均填“增大”或“减小”)。人造喷泉及火山爆发的原理与上 述装置图_________原理相似。
问题。
Ⅰ.请用化学方氨水,氨水能使无色的酚酞试剂变红。请用电离方程式表示其原
因:
;
Ⅲ.氨气可以跟多种物质发生反应,请将如图实验中有关反应的化学方程式填在横线上:
__________、___________。
【解析】工业合成氨的反应为N2+3H2
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是 __________(填序号)。
【思路点拨】解答该题要注意以下三点: (1)书写实验室制取氨气的反应方程式时易漏加热符号或忘记配平; (2)密度比空气小的气体可用向下排空气法收集; (3)极易溶于水的气体可形成喷泉,吸收时要注意防倒吸。
