抗菌药物最小抑菌浓度的测定
中国关于最低抑菌浓度的标准

中国关于最低抑菌浓度的标准
中国关于最低抑菌浓度的标准是抗菌药物能够抑制培养基中细菌生
长的最低浓度。
这个浓度的测定对于抗菌药物的选择和用药量的确定具有重要意义。
在临床上,根据细菌培养和药敏试验的结果,医生可以选择适当的抗菌药物和用药剂量,以达到治疗疾病的目的。
最低抑菌浓度(Minimum Inhibitory Concentration,MIC)是衡量抗菌药物抗菌活性的重要指标之一。
它反映了抗菌药物抑制细菌生长的能力。
一般情况下,抗菌药物的浓度越高,对细菌的抑制作用越强。
但是,不同种类的抗菌药物对不同种类的细菌的MIC是不同的。
因此,医生需要根据药敏试验的结果和患者的具体情况来选择适当的抗菌药物和用药剂量。
除了MIC,还有另一个重要的指标叫做最小杀菌浓度(Minimum Bactericidal Concentration,MBC)。
MBC是指抗菌药物能够杀灭培养基中细菌的最低浓度。
一般情况下,MBC高于MIC,因为抑制细菌生长所需的抗菌药物浓度要低于杀死细菌所需的抗菌药物浓度。
在实际临床应用中,医生还需要考虑患者的个体差异、病情严重程度、药物不良反应等因素来选择适当的抗菌药物和用药剂量。
同时,对于一些严重的细菌感染,如败血症、肺炎等,可能需要联合使用多种抗菌药物进行治疗。
总之,最低抑菌浓度是抗菌药物选择和用药量确定的重要依据之一,医生需要根据患者的具体情况和药敏试验的结果来选择适当的抗菌药物
和用药剂量。
1。
琼脂稀释法测定抗菌药物最低抑菌浓度(MIC)资料解读

琼脂稀释法测定抗菌药物最低抑菌浓度(MIC)|琼脂稀释法琼脂稀释法是将不同剂量的抗菌药物,加入融化并冷至50℃左右的定量MH琼脂中,制成含不同递减浓度抗菌药物的平板,接种受试菌,孵育后观察细菌生长情况,以抑制细菌生长的琼脂平板所含最低药物浓度为MIC。
本法优点是可在一个平板上同时作多株菌MIC测定,结果可靠,易发现污染菌;缺点是制备含药琼脂平板费时费力。
1.培养基制备使用MH琼脂,按商品说明书进行配制,pH7.2~7.4。
淋病奈瑟菌使用GC琼脂基础加1%添加剂;其它链球菌使用含5%(V/V)绵羊血的MH琼脂(当试验磺胺药时,使用溶解的马血)。
2.含药琼脂平板制备根据实验设计,将已倍比稀释的不同浓度的抗菌药物分别加入已加热溶解,并在45~50℃水浴中平衡的MH琼脂中,充分混匀倾倒灭菌平皿,琼脂厚度3~4mm。
通常按1∶9比例配制药物琼脂平板,根据需要来选择药物浓度范围。
配制好的含药琼脂平板应装入密封塑料袋中,置2~8℃冰箱可贮存5天。
3.接种物制备与接种制备浓度相当于0.5麦氏标准比浊管的菌悬液,再1∶10稀释,以多点接种器吸取制备好菌液(约1~2μl)接种于琼脂平板表面,每点菌数约为104CFU,形成直径为5~8mm的菌斑。
接种好后置35℃孵育16~20h(甲氧西林耐药葡萄球菌、万古霉素耐药肠球菌孵育时间应满24h),观察结果。
奈瑟菌属、链球菌属细菌置5%二氧化碳、幽门螺杆菌置微需氧环境中孵育。
4.结果判断将平板置于暗色、无反光物体表面上判断试验终点,以抑制细菌生长的最低药物浓度为MIC。
在含甲氧苄胺嘧啶或磺胺琼脂平板上可见轻微细菌生长,与生长对照比较抑制80%以上细菌生长的最低药物浓度作为终点浓度。
如果出现有2个以上菌落生长于含药浓度高于终点水平的琼脂平板上,或低浓度药物琼脂平板上不长而高浓度药物琼脂平板上生长现象,则应检查培养物纯度或重复试验。
读书的好处1、行万里路,读万卷书。
2、书山有路勤为径,学海无涯苦作舟。
最新几种测定抗菌药物最低抑菌浓度(MIC)方法

几种测定抗菌药物最低抑菌浓度(MIC)方法1.1.常量肉汤稀释法1.1.1.抗菌药物贮存液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
抗菌药物直接购自厂商或相关机构。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表5。
配制好的抗菌药物贮存液应贮存于-60℃以下环境,保存期不超过6个月。
1.1.2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.1.3. 培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM 肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
1.1.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5麦氏比浊标准的菌悬液。
抗生素最低抑菌浓度

抗生素最低抑菌浓度(MIC)和半数抑菌浓度(MIC)测定方法几种测定抗菌药物最低抑菌浓度(MIC)方法:1.1.常量肉汤稀释法1.1.1.抗菌药物贮存液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
抗菌药物直接购自厂商或相关机构。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表5。
配制好的抗菌药物贮存液应贮存于-60℃以下环境,保存期不超过6个月。
1.1.2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.1.3. 培养基 NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
1.1.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5麦氏比浊标准的菌悬液。
抗菌药物最小抑菌浓度的测定
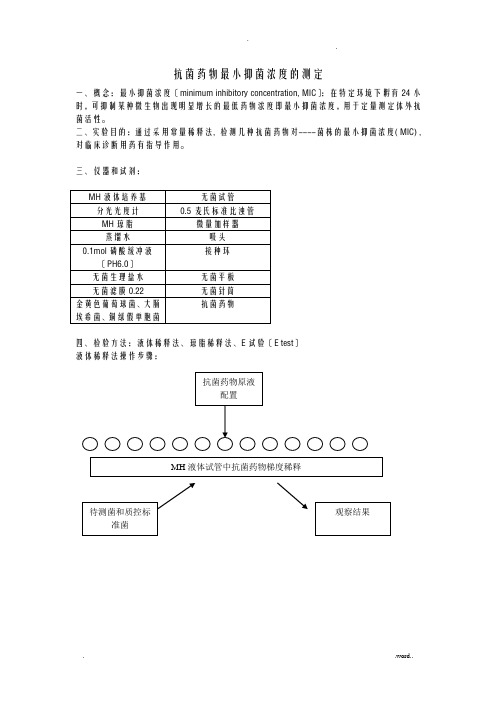
抗菌药物最小抑菌浓度的测定一、概念:最小抑菌浓度〔minimum inhibitory concentration, MIC〕:在特定环境下孵育24小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性。
二、实验目的:通过采用常量稀释法, 检测几种抗菌药物对----菌株的最小抑菌浓度( MIC) , 对临床诊断用药有指导作用。
三、仪器和试剂:四、检验方法:液体稀释法、琼脂稀释法、E试验〔E test〕液体稀释法操作步骤:1..抗菌药物原液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
所需抗菌药物溶液量或粉剂量可公式进展计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平准确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:〔182.6 mg×750μg/ml〕/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表1。
配制好的抗菌药物贮存液应贮存于-20℃环境,并注意抗菌药物的保存期限。
表1 稀释法中常用的抗菌药物容积稀释法2.药敏试验用抗菌药物浓度X围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度X围应包含耐药、中介和敏感分界点值,特殊情况例外。
3.培养基NCCLS推荐使用Mueller-Hinton〔MH〕肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中参加2%〔W/V〕氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白〔MH〕肉汤中,35℃孵育2-6h。
最低抑菌浓度(MIC)测定

word附件3.4最低抑菌浓度(MIC)测定1.菌悬液的制备刮取18~20小时的培养物,在管壁上充分研磨后混悬于1ml缓冲液中,借助比浊仪,调菌悬液浓度至104/ml,于1小时用多点接种仪接种(放置室温应大于25℃)。
2.MIC测定(1)抗菌药物储存液制备⏹抗菌药物称量及配制:根据各抗菌药物的纯度称取,以目前所用抗菌药物为例。
抗菌素纯度称量(mg)加溶剂(ml)储存液浓度(μg/ml)四环素100% 3.2 1 3200大观霉素63.4% 40.38 1 25600头孢曲松81.5% 2.45 1 2000环丙沙星84.4 3.8 1 3200⏹分装与保存:每管200μl,-70℃可保存一年。
(2)抗菌药物工作液制备青霉素:四环素:大观霉素:头孢曲松:环丙沙星:(3)抗菌药物梯度培养皿的制备⏹培养皿编号:按各抗菌药物浓度编号。
⏹将配制好的各抗菌药物工作液150μl加到各培养皿中,与15ml 50℃预温的培养基充分混匀,平放在超净台,半开培养皿盖至培养基凝固后,用塑料袋密封保存于4℃冰箱。
(4)菌悬液接种与培养⏹多头接种针以及菌液板用高压法灭菌处理,其他配件用酒精消毒处理;使用前必须确认完全烘干。
⏹按照仪器要求将菌悬液接种于各抗菌药物梯度培养皿,接种菌后置超净台直至菌悬液渗入。
⏹置35℃~36℃、5%~10% CO2一定湿度的环境中培养。
⏹记录放置时间。
⏹培养18~24小时观察结果。
(5)结果判读⏹观察细菌生长情况:-记录结果读取时间。
-在适宜的光线下,观察对照培养皿的菌落生长情况,并对所有菌株进行初步鉴定(涂片染色和氧化酶试验)。
-比较观察对照平皿和抗菌药物平皿,进行判读:接种点有1个以上菌落或呈菌苔状为生长;接种点无任何菌落或呈薄雾印迹为无生长。
⏹MIC判读与记录:-MIC是指抗菌药物能够抑制细菌生长的最小抑菌药物浓度,表示单位为 g/ml 。
-记录各抗菌药物浓度平皿上细菌生长情况,在《WHO参考菌株及MIC 实验结果记录表》用(+)表示生长,(-)表示无生长。
几种测定抗菌药物最低抑菌浓度(MIC)方法

几种测定抗菌药物最低抑菌浓度(MIC)方法近年来,随着抗生素的广泛使用以及细菌耐药性的增加,抗菌药物的最低抑菌浓度(MIC)的测定变得日益重要。
MIC是指抗菌药物能够抑制细菌生长的最低浓度,是评估抗菌药物对细菌耐药性的一种重要方法。
下面介绍几种测定抗菌药物MIC的方法。
1. 琼脂扩散法琼脂扩散法是一种经典的MIC测定方法。
该方法基于抗生素与菌株相互作用抑制菌株生长的原理。
实验中将不同浓度的抗生素溶液加入琼脂平板中,并在琼脂表面均匀涂布细菌悬液。
待菌株在琼脂表面生长形成克隆后,观察克隆周围清晰的无菌区域大小,根据无菌区域所对应的抗生素浓度计算MIC值。
该方法简单易行,但由于该方法目测判断,因此存在主观性差异和读片误差的问题。
2. 荧光素二磷酸盐3-(4,5-二苯基噻唑)(Alamar blue)法荧光素二磷酸盐3-(4,5-二苯基噻唑)法是一种高通量及准确性较高的MIC测定方法。
该方法基于菌株呼吸代谢消耗的荧光素二磷酸盐3-(4,5-二苯基噻唑)的发光信号变化来评估抗生素的MIC值。
实验中将不同浓度的抗生素溶液加入微孔板中,并添加细菌悬液及荧光素二磷酸盐3-(4,5-二苯基噻唑),经过一定时间后读取板上的荧光信号,测算MIC 值。
该方法准确性高,可用于筛选大量样本的抗菌药物敏感性,但需要特殊设备和耗费较多经费。
3. 壳聚糖纳米粒子微滴法壳聚糖纳米粒子微滴法是一种新兴的MIC测定方法。
该方法基于壳聚糖纳米粒子本身具有抑菌作用及微滴原理,实验中将不同浓度的抗生素与含菌液的溶液制成微滴,并添加壳聚糖纳米粒子,待微滴凝胶后进行观察,根据微滴内的细菌生长情况评估折射率值,进而计算MIC值。
这种方法具有较高的准确性和可靠性,但需要特殊仪器和技术支持。
4. 测序MIC法随着测序技术的发展,现已出现测序MIC法。
该方法基于高通量测序技术,对菌株进行全基因组测序,确定细菌株中抗生素耐药基因的编码序列,并进行序列比对和分析,确定抗生素的MIC值。
最小抑菌浓度

细菌含量测定
(1)用生理盐水将上述菌液做10倍梯度稀释(0.5ml菌液+4.5ml生理盐水)。
(2)取10-5、10-6、10-7三个滴度的菌液各0.1ml滴在琼脂平板中央,轻轻拍打,使其均匀摊开,不要接 触平皿边缘,每个梯度做2个平板,放入37℃温箱培养16~24h。
(3)计算菌落数:挑选长有30~300个菌落的平板来计数。两个平板的计数结果取其平均值为细菌浓度, 要求生长浊度达9×108个/ml。计算示例:10-6两个平板上生长菌落数分别为68、70个,平均69个/0.1ml,则 1ml含活菌落数690×106个/ml,即生长浊度为6.9×108个/ml。
最小抑菌浓度
用试管稀释法测定细菌对药物的敏感性
目录
01 浓度测定
02 两种菌介绍
基本信息
最小抑菌浓度(minimal inhibit concentration)指用试管稀释法测定细菌对药物的敏感性。完全抑制细 菌生长的最高稀释管1毫升所含的药量。亦即被测细菌对该药的敏感度。因药物和细菌的种类不同,需具体规定药 物的稀释范围使用培养基的种类、加菌量,培养条件和判定结果的时间。
方法与步骤
1、实验前的准备 (1)器具的清洗:将试管、平皿、锥形瓶、枪头等实验器具洗净、包好,121℃、20min高压灭菌,放烘箱 烘干备用。 96孔细胞培养板(不可高压灭菌)用洗液浸泡、超声、冲洗干净后,泡75%酒精备用(用前取出放超净台吹 干,紫外杀菌2h以上)。 (2)试剂的配制: 图1①磷酸缓冲液(PBS)的配制:见图1。 ②生理盐水的配制:称取0.9g NaCI于锥形瓶中,加入100ml蒸馏水,溶解。 ③MH琼脂、肉汤的配制:按照实际说明书的要求,称取一定量LB琼脂于锥形瓶中,加入100ml蒸馏水,溶解。 按照试剂说明书的要求,称取一定量MH肉汤粉于锥形瓶中,加入100ml蒸馏水,溶解。取琼脂和肉汤分装于小试 管中,每管2ml。 将配好的琼脂、肉汤包装好,121℃、20min高压灭菌。待琼脂稍冷后,在超净台倒平板(15~20ml琼脂平 板),凝固后置37℃恒温培养箱过夜做无菌检查,合格后和肉汤一起置于4℃冰箱保存备用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
抗菌药物最小抑菌浓度的测定
一、概念:最小抑菌浓度(minimum inhibitory concentration, MIC):在特定环境下孵育24小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性。
二、实验目的:通过采用常量稀释法, 检测几种抗菌药物对----菌株的最小抑菌浓度( MIC) , 对临床诊断用药有指导作用。
三、仪器和试剂:
四、检验方法:液体稀释法、琼脂稀释法、E试验(E test)液体稀释法操作步骤:
1..抗菌药物原液制备
抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表1。
配制好的抗菌药物贮存液应贮存于-20℃环境,并注意抗菌药物的保存期限。
表1 稀释法中常用的抗菌药物容积稀释法
2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
3.培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5麦氏比浊标准的菌悬液。
用MH肉汤将上述菌悬液进行1∶100稀释后备用。
注意应在15分钟内接种完配制好的接
种物,并取一份接种物在非选择性琼脂平板上传代培养,以检查接种物纯度。
5.稀释抗菌药物的制备及菌液接种取无菌试管(13×100mm)13支,排成一排,除第1管加入1.6mlMH肉汤外,其余每管加入MH肉汤1ml,在第1管加入抗菌药物原液(如1280μg/ml)0.4ml混匀,然后吸取1ml至第2管,混匀后再吸取1ml至第3管,如此连续倍比稀释至第11管,并从第11管中吸取1ml弃去,第12管为不含药物的生长对照。
此时各管药物浓度依次为256、128、64、32、16、8、4、2、1、0.5、0.25μg/ml。
然后在每管内加入上述制备好的接种物各1ml,使每管最终菌液浓度约为5×105CFU/ml。
第1管至第11管药物浓度分别为128、64、32、16、8、4、2、1、05、0.25、0.125μg/ml。
另外设对照3支,别为肉汤对照、质控菌对照和待测菌生长对照。
6.孵育将接种好的稀释管塞好塞子,置35℃普通空气孵箱中孵育16~20h;嗜血杆菌和链球菌在普通空气孵箱中孵育20~24h;对可能的耐甲氧西林葡萄球菌和耐万古霉素肠球菌应持续孵育满24h。
7.结果判断与解释在读取和报告所测试菌株的MIC前,应检查生长对照管的细菌生长情况是否良好,同时还应检查接种物的传代培养情况以确定其是否污染,质控菌株的MIC值是否处于质控范围。
以肉眼观察,药物最低浓度管无细菌生长者,即为受试菌的MIC。
甲氧苄胺嘧啶或磺胺药物的肉汤稀释法终点判断,与阳性生长对照管比较抑制80%细菌生长管药物浓度为受试菌MIC。
【MIC参考范围】
表2稀释法质控标准菌株MIC预期值范围(ug/ml)。
