T4 DNA 连接酶
两大方法帮你搞定质粒构建

两大方法帮你搞定质粒构建质粒构建是分子生物学研究中最常用的实验技术。
原理依赖于限制性核酸内切酶,DNA 连接酶和其他修饰酶的作用,分别对目的基因和载体 DNA 进行适当切割和修饰后,将二者连接在一起,再导入宿主细胞,实现目的基因在宿主细胞内的正确表达。
质粒构建方式多样,常规的 T4 连接酶,以及最近更受欢迎的重组酶方式。
下面小编就总结一下 T4 连接酶与重组酶构建质粒方法,通过比较,其最大的不同点可能在于目的基因的设计以及连接体系。
壹一. T4 DNA Ligase 即 T4 DNA 连接酶,可以催化粘端或平端双链 DNA 或 RNA 的5’-P 末端和3’-OH 末端之间以磷酸二酯键结合,该催化反应需 ATP 作为辅助因子。
1. 质粒载体的制备既可以选择单酶切也可以选择双酶切,一般推荐使用双酶切。
其实目的就只有一个,尽量使载体的末端具有特异性,防止自连。
[可选酶切体系]VECTOR 3 ugCutSmart Buffer 5 ul限制性内切酶 1 1 ul限制性内切酶 2 1 ul酶切体系一般选择 50ul,试剂加好之后37°C 孵育 6~8 小时,或适当延长时间,保证质粒酶切完全。
每隔一段时间振荡一下并离心以防液滴蒸发至管盖上。
酶切后载体通过切胶回收线性化载体。
2.根据目的序列构建引物后,引物设计原则简单总结一下:(1)前向引物:5’ 端-保护碱基序列+限制性内切酶 1 酶切位点序列+基因正向引物序列 -3’ 端(2)反向引物:5’ 端-保护碱基序列+限制性内切酶 2 酶切位点序列+基因反向引物序列 -3 ’端如果目的基因片段较长的话,可以选择 PCR 方式扩增目的基因片段[可选 PCR 扩增体系]ddH2O:14ul10xTaq buffer:2ul10um DNTP:1ul10um primer F:0.5ul10um primer R:0.5ul模板 DNA:1ulTaq 酶:1ul[可选 PCR 扩增条件](1)95℃:5min(2) 35cycle95℃:30s55℃:30s(退火温度可以根据目的引物TM值决定,一般退火温度根据引物TM值降低5度)72℃:40s(3)72℃:10min(4)16℃:hold引物扩增之后,首先要进行琼脂糖凝胶电泳验证条带大小,然后通过胶回收,获得纯化目的片段产物.由于加入保护碱基,回收产物需要进行双酶切,双酶切方法与质粒酶切方法相同。
T4 DNA 连接酶 #EL0011 Thermo scientific

T4 DNA Ligase ——Thermo scientific #EL0011产品信息特点快速–室温下10分钟内完成粘末端的连接反应。
•该酶在Fermentas公司限制酶、PCR和RT缓冲液(添加ATP)中活性。
•配套提供聚乙二醇溶液以有效进行平末端连接。
应用克隆酶切产生的DNA片段。
•克隆PCR产物。
•连接双链寡聚核苷酸街头或连接物。
•定点诱变。
•扩增片段长度多态性(AFLP)。
•连接酶介导的RNA 检测(3)。
•双链DNA,RNA 或DNA/RNA 复合体中缺口的修复。
•线性DNA自身环化。
说明T4� DNA Ligase催化双链DNA或RNA中毗邻的5’ -磷酸基团和3’-羟基末端之间形成磷酸二酯键。
酶还可以修复双链DNA、RNA或DNA/RNA复合体中的单链切口,连接DNA 的粘性和平末端,但是该酶对单链核酸无酶活性(1, 2)。
T4 DNA Ligase需要辅因子ATP。
浓度1 Weiss u/µl = 200 CEU*/µl5 Weiss u/µl = 1000 CEU*/µl30 Weiss u/µl = 6000 CEU*/µl*一个粘性末端连接单位的是指在16°C 、30分钟内50%连接HindIII酶切的lamda DNA产物所需要的酶的量。
来源含有T4噬菌体克隆基因30的大肠杆菌。
分子量55.3 kDa,单体。
活性单位定义1个活性单位是指在ATP-PPi交换反应中,37°C、20分钟内将1nmol [32PPi]转换为Norit 可吸收形式所需的酶量(Weiss单位**(4)。
酶活性分析混合物:66 mM Tris-HCl (pH 7.6), 6.6 mM MgCl2, 0.066 mM ATP, 10 mM DTT, 3.3�µM [32PP i].** 1个Weiss单位相当于约200个粘性末端连接单位。
dna序列连接方式

dna序列连接方式DNA序列连接方式DNA序列连接是指将两个或多个DNA序列通过特定的方法连接在一起,形成一个新的DNA序列。
DNA序列连接在生物学研究和基因工程中具有重要的应用价值。
本文将介绍几种常见的DNA序列连接方式。
一、末端连接方式末端连接是指将两个DNA序列的末端通过酶催化反应连接在一起。
常用的末端连接酶有T4 DNA连接酶和DNA连接酶I。
在末端连接过程中,需要将两个DNA序列末端加工,使其能够与连接酶结合并形成连接。
1. T4 DNA连接酶法T4 DNA连接酶是一种常用的DNA连接酶,能够催化DNA链的连接。
在T4 DNA连接酶法中,首先需要将两个DNA序列的末端加工,使其具有单链突起。
然后将DNA序列和连接酶一起反应,形成连接产物。
最后通过热变性或酶切等方法,使连接产物恢复为双链结构。
2. DNA连接酶I法DNA连接酶I是一种与T4 DNA连接酶相似的酶,也能够催化DNA链的连接。
DNA连接酶I法与T4 DNA连接酶法类似,首先需要将两个DNA序列的末端加工,使其具有单链突起。
然后将DNA序列和连接酶一起反应,形成连接产物。
最后通过热变性或酶切等方法,使连接产物恢复为双链结构。
二、中间连接方式中间连接是指将两个DNA序列的中间部分连接在一起,形成一个新的DNA序列。
常用的中间连接方法有接头连接法和PCR连接法。
1. 接头连接法接头连接法是一种将两个DNA序列的中间部分连接的方法。
在接头连接过程中,首先需要在两个DNA序列的中间部分引入相应的接头序列。
然后通过连接酶的作用,将两个DNA序列的接头连接在一起,形成一个新的DNA序列。
2. PCR连接法PCR连接法是一种利用聚合酶链式反应(PCR)将两个DNA序列连接在一起的方法。
在PCR连接过程中,首先需要设计特定的引物,使其能够同时扩增两个DNA序列。
然后通过PCR反应,将两个DNA序列连接在一起,形成一个新的DNA序列。
三、重组连接方式重组连接是指通过DNA重组技术将两个DNA序列连接在一起,形成一个新的DNA序列。
NEB T4DNA连接酶

T4 DNA 连接酶货号规格价格#M0202L 100,000 units 3,029.00元#M0202M (高浓度5x)100,000 units 3,029.00元#M0202S 20,000 units 699.00元#M0202T (高浓度5x)20,000 units 699.00元#M0202V 10,000 units 349.00元■ 提高反应效率■粘性末端和平齐末端均可连接■限制性酶切片段的克隆(3)■将linker 或adapter 连接到DNA 片段的平齐末端■室温或16 ℃均有活性概述该酶催化契合的双链DNA或RNA的5´-磷酸末端和3´-羟基末端形成磷酸二酯键。
该酶不仅能够催化平滑末端或粘性末端DNA之间的连接,还可以修复双链DNA、RNA或DNA/ RNA杂交双链中的单链切口(1) 。
来源纯化自E. coli C600 pcl857 pPLc28 lig8(2) 。
反应条件1 X T4 DNA 连接酶缓冲液[ 50 mM Tris-HCl(pH 7.5 @ 25 ℃),10 mM MgCl2,10 mM DTT,1 mM ATP]。
推荐DNA 5' 末端浓度为0.1-1.0 μM。
质保声明无核酸内切酶和外切酶污染。
每批T4 DNA 连接酶均通过模拟克隆实验进行检测,该实验可以检测出连接后DNA 末端的任何损伤。
结果表明超过99.9% 的DNA 末端保持完好。
单位定义(粘性末端活性单位)1 单位指在20 μl 1X T4 DNA 连接酶反应缓冲液中,16 ℃反应条件下,30 分钟能使50% 的经HindIII 消化的λDNA 片段[5' 端浓度为0.12 μM (300 μg/ml)]连接所需的酶量。
浓度400,000 units/ml 和2,000,000 units/ml。
贮存条件50 mM KCl, 10 mM Tris-HCl (pH 7.4), 0.1 mM EDTA, 1 mM DTT, 200 μg/ml BSA 和50% 甘油,-20°C 贮存。
重组T4DNA连接酶的发酵及纯化工艺研究

重组T4DNA连接酶的发酵及纯化工艺研究引言DNA连接酶是DNA修复和复制中必不可少的酶类,其中T4DNA连接酶是一种重要的DNA连接酶。
目前,人们已经成功地对T4DNA连接酶进行基因工程改造,生产了大量的重组T4DNA连接酶。
然而,由于其生产工艺和纯化过程较为复杂,限制了其在实际应用中的大规模生产和应用。
因此,本文针对重组T4DNA连接酶的生产工艺和纯化过程进行了研究,以期提高其产量和纯度,进而为其应用提供更可靠的基础。
材料与方法1. 扩展表达载体的构建将T4DNA连接酶的基因序列克隆入适当的表达载体中,包括信号肽和标签序列。
2. 表达质粒的构建利用热激酶、酒精盐析、离子交换等方法构建表达质粒。
3. 培养基的配制配制适合重组蛋白表达的培养基,包括抗生素。
4. 细胞的发酵将表达质粒转入大肠杆菌等宿主细胞中,在适当的培养温度、时间和pH值下进行发酵。
5. 细胞的破碎利用超声波、压力破碎等方法将细胞破碎,以释放重组T4DNA连接酶。
6. 蛋白分离与纯化采用针对性纯化方法,如亲和层析、离子交换层析、凝胶过滤层析等,分离和纯化T4DNA连接酶。
7. 酶活性检测利用连接酶测定试剂盒等方法,检测重组T4DNA连接酶的酶活性。
8. 结果分析对生产工艺和纯化过程进行总结和回顾,进行产量和纯度的统计分析。
结果与讨论通过以上操作,我们成功地构建了重组T4DNA连接酶的表达质粒,并利用大肠杆菌等宿主细胞进行了发酵。
为了提高产量和纯度,我们采用了亲和层析、离子交换层析、凝胶过滤层析等多种纯化方法。
最终,我们获得了较为纯净的T4DNA连接酶,并通过连接酶测定试剂盒的检测,证明了其酶活性。
本研究的结果表明,通过合理的表达质粒构建和发酵条件控制,可实现重组T4DNA连接酶的高效产生。
而多种纯化方法的综合应用,则可提高其纯度。
同时,对于T4DNA连接酶的纯化过程,可以根据酶的特点和产出情况进行针对性的调整,以达到更好的效果。
结论本研究对重组T4DNA连接酶的生产工艺和纯化过程进行了系统的研究,取得了实验上较为可靠的结果。
t4连接酶发展历史

t4连接酶发展历史T4连接酶是一种重要的酶类,它在生物学研究领域具有重要的地位。
本文将探讨T4连接酶的发展历史,并从人类视角进行叙述。
T4连接酶最早是在20世纪40年代被发现的。
当时,科学家们对DNA的复制和修复机制非常感兴趣,而T4连接酶恰好是其中的一个重要环节。
在当时,科学家们还没有完全理解DNA的结构和功能,因此对于T4连接酶的研究进展缓慢。
随着科学技术的进步,人们对DNA的研究逐渐深入。
在20世纪60年代,科学家们成功地解析了DNA的结构,并发现了T4连接酶与DNA的特殊关系。
T4连接酶能够将两条DNA链连接在一起,形成一个完整的DNA分子。
这一发现引起了科学界的广泛关注,并为后续的研究奠定了基础。
在接下来的几十年里,科学家们对T4连接酶进行了深入的研究。
他们发现T4连接酶不仅可以连接DNA链,还能够修复DNA中的损伤。
这一发现对于人类的健康和疾病治疗具有重要意义。
通过研究T4连接酶的工作机制,科学家们希望能够找到治疗DNA损伤相关疾病的新方法。
随着时间的推移,科学家们对T4连接酶的研究取得了更多的突破。
他们发现T4连接酶不仅存在于T4噬菌体中,还广泛分布于其他生物体中。
这一发现使得T4连接酶的研究更加复杂和多样化。
科学家们开始探索T4连接酶在不同生物体中的功能和作用机制,希望能够揭示更多关于DNA复制和修复的秘密。
今天,T4连接酶仍然是生物学研究的热点之一。
科学家们利用现代技术手段对T4连接酶进行深入研究,并取得了许多重要的成果。
通过进一步的研究,科学家们希望能够更好地理解T4连接酶的结构和功能,为人类的健康和疾病治疗提供更多的可能性。
T4连接酶的发展历史是一个由科学家们不懈努力和不断探索的过程。
通过对T4连接酶的研究,科学家们不仅深入了解了DNA的复制和修复机制,还为疾病治疗提供了新的思路和方法。
T4连接酶的研究将继续在未来发展,并为人类的生命科学研究做出更大的贡献。
PH0642 T4连接酶 T4 DNA Ligase 实验操作手册与方法
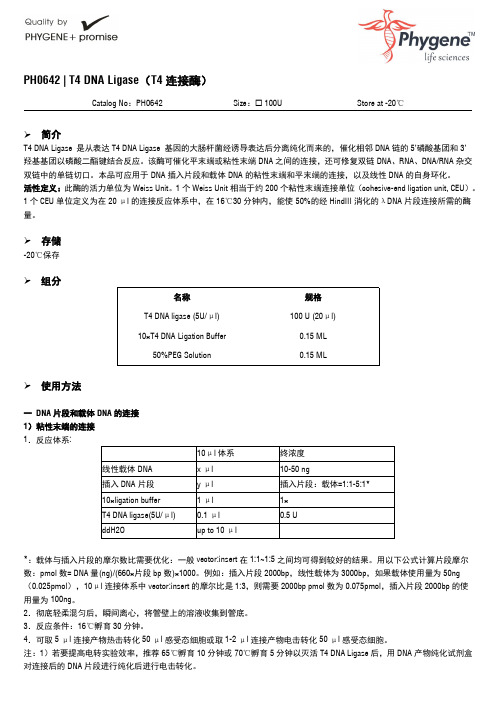
10μl 体系 x μl y μl 1 μl 0.1 μl up to 10 μl
终浓度 10-50 ng 插入片段:载体=1:1-5:1* 1× 0.5 U
*:载体与插入片段的摩尔数比需要优化:一般 vector:insert 在 1:1~1:5 之间均可得到较好的结果。用以下公式计算片段摩尔 数:pmol 数= DNA 量(ng)/(660×片段 bp 数)×1000。例如:插入片段 2000bp,线性载体为 3000bp,如果载体使用量为 50ng (0.025pmol),10μl 连接体系中 vector:insert 的摩尔比是 1:3,则需要 2000bp pmol 数为 0.075pmol,插入片段 2000bp 的使 用量为 100ng。 2.彻底轻柔混匀后,瞬间离心,将管壁上的溶液收集到管底。 3.反应条件:16℃孵育 30 分钟。 4.可取 5 μl 连接产物热击转化 50 μl 感受态细胞或取 1-2 μl 连接产物电击转化 50 μl 感受态细胞。 注:1)若要提高电转实验效率,推荐 65℃孵育 10 分钟或 70℃孵育 5 分钟以灭活 T4 DNA Ligase 后,用 DNA 产物纯化试剂盒 对连接后的 DNA 片段进行纯化后进行电击转化。
2.彻底轻柔混匀后,瞬间离心,将管壁上的溶液收集到管底。 3.反应条件:16℃孵育 30 分钟。 4.65℃孵育 10 分钟或 70℃孵育 5 分钟灭活 T4 DNA Ligase。连接产物可以直接进行限制性内切酶酶切反应。
注意事项
1. T4 DNA Ligase 的最终用量不要超过推荐的用量,否则影响连接效率。 2. PEG 可以极大提高平末端的连接效率,我们推荐加入终浓度为 5% PEG Solution 以提高平末端的连接效率。 3. 为了提高转化效率,转化时建议所加入连接产物的量不要超过感受态细胞体积的 10%。 4. 由于 T4 DNA Ligase 中含有甘油,比较粘稠容易挂壁,建议使用前短暂离心将液体收集到管底,取样时枪头尽量不要深入 液面太深以免粘在枪头上造成损失。
T4连接酶

产品பைடு நூலகம்途:
DNA片段和载体DNA的连接。(参见欣百诺实验方 案)。
DNA片段和Linker或Adaptor DNA的连接。
使用建议:
粘末端的连接反应: 插入片段和载体的摩尔浓度比特别重 要,此比例在2-6之间最好,低于2:1就会导致较低的连接效 率,高于6:1则会导致多个插入。摩尔比请按载体与插入片段 DNA浓度及分子大小来计算。
1ml
质量保证:
经多次柱纯化,SDS-PAGE胶检测仅可见清晰单一的目的 条带;PCR方法检测无大肠杆菌DNA残留,无核酸内、外 切酶污染。
活性定义:
在20 ml的连接反应体系中, 6 mg的λDNA-Hind III的分解 物在16℃下反应30分钟时, 有90%以上的DNA片段被连接 所需要的酶量定义为1个单位。
仅供科研使用,不能应用于人体
技术咨询电话:400-600-0940
近岸蛋白质科技有限公司
地址:上海市浦东新区张江高科技园区蔡伦路720号2号楼 电话:021-50798060 邮箱:product@
保存温度:-20oC 产品包装:
T4 DNA连接酶 (350U/μl)
80μl
2×Quick Ligation Buffer
1ml
10×T4 DNA Ligation Buffer
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
T4 DNA Ligase即T4 DNA连接酶,可以催化粘端或平端双链DNA或RNA的5’-P末端和3’-OH末端之间以磷酸二酯键结合,该催化反应需A TP作为辅助因子。
同时T4 DNA连接酶可以修补双链DNA、双链RNA 或DNA/RNA杂合物上的单链缺刻(single-strand nicks)。
用途:T4 DNA Ligase常用于DNA片段和载体、linker或adaptor等的连接。
也可以用于缺刻修复及Ligase 介导的RNA检测。
来源:本T4 DNA Ligase由大肠杆菌表达,表达基因的来源为T4嗜菌体。
活性定义:One unit is defined as the amount of enzyme required to give 50% ligation of HindIII fragments of lambda DNA in 30 min at 16℃in 20 μl of the assay mixture containing 50 mM Tris, pH 7.5, 10 mM MgCl2, 10 mM DTT, 1 mM ATP, 25 μg/ml BSA and a 5'-DNA termini concentration of 0.12 μM(300 μg/ml)。
200U等于1个Weiss unit,以Weiss unit计,本产品共1000单位。
纯度:不含DNA内切酶、外切酶和磷酸酯酶,不含RNA酶,满足常规连接反应要求。
酶储存溶液:20 mM Tris, pH 7.5, 50 mM KCl, 1 mM DTT, 0.1 mM EDTA and 50%(v/v)glycerol。
10X Ligation Buffer:400 mM Tris, pH 7.8, 100 mM MgCl2, 100 mM DTT, 5 mM A TP。
失活或抑制:65℃孵育10分钟可以导致T4 DNA Ligase失活;NaCl或KCl浓度大于200mM时强烈抑制T4 DNA Ligase。
包装清单:
保存条件:
-20℃保存。
注意事项:
对于普通的转化大肠杆菌的操作,不必对连接产物进行纯化,连接产物可以直接用于转化。
但用电转方法转化大肠杆菌时,通常宜先用DNA纯化试剂盒或酚氯仿抽提方法等纯化DNA,然后再进行电转。
需进行平端连接或快速连接时,推荐使用碧云天的快速DNA连接试剂盒(D7002/D7003)。
T4 DNA Ligase 可以进行平端连接,但效率较低。
普通的连接反应不必进行凝胶电泳观察。
如果需要对于连接产物进行凝胶电泳观察,推荐先在65℃孵育10分钟使T4 DNA Ligase失活,以避免T4 DNA Ligase和DNA结合导致的条带位置迁移(band shift)。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明
使用说明:
1. PCR产物或酶切片段和普通载体的连接:
a. 取1-2μg载体酶切过夜,或至少酶切3-5小时以上。
尽量确保酶切充分,否则后续会导致产生很多
自连的克隆。
b. 载体酶切完毕后,可以使用试剂盒进行纯化,例如碧云天的PCR纯化试剂盒/DNA纯化试剂盒
(D0033)。
也可以采用常规的酚氯仿抽提乙醇沉淀方法纯化载体。
对于酶切产生较大片段(大于50-
60bp)的情况推荐采用切胶回收的方式。
c. 对于PCR产物:PCR产物凝胶电泳后,切胶回收预期大小的DNA片段。
凝胶中DNA片段的回收可以使
用试剂盒进行操作,例如碧云天的DNA凝胶回收试剂盒(D0056)。
也可以采用反复冻融等方法回收
DNA片段。
d. 对于回收的PCR产物或其它需酶切的质粒或DNA片段,用适当内切酶酶切,随后纯化酶切产物。
注:这一步的酶切不必酶切特别充分,通常酶切效率能达到80-90%以上即可。
即本步骤的酶切
通常酶切1-2小时即可。
酶切产物可以使用试剂盒进行纯化,例如碧云天的PCR纯化试剂盒/DNA纯化试剂盒(D0033)。
也可以采用常规的酚氯仿抽提乙醇沉淀方法纯化载体。
e. 取约25-100ng经过酶切和纯化的载体,加入3倍摩尔数的待插入片段。
参考下表设置连接反应体
系。
注1:很多时候由于载体量和待插入片段的量都比较少,在回收后很难定量。
此时可根据回收前电泳条带的亮度进行大致的估计。
通常以DNA分子量标准的某一条带为参考,估计或通过灰度半定量您的目的条带和该参考条带的亮度的比例关系。
然后再按照预计的纯化或凝胶回收时的得率计算出最终得到的载体量和待插入片段量的比例关系。
注2:通常每个反应使用0.2-0.5μl连接酶已经足够,如果希望进一步提高连接效率,可以把连接酶的用量提高至1μl。
f. 用移液器轻轻吹打混匀或轻微Vortex混匀,室温离心数秒,使液体积聚于管底。
g. 20-25℃孵育连接1-2小时,或16℃孵育连接过夜。
注1:对于双平端连接必须连接过夜。
对于双平端连接,直接使用T4 DNA Ligase连接效率较低,推荐使用碧云天的快速DNA连接试剂盒(D7002/D7003)。
注2:为快速获得预期克隆可以参考如下方法:对于20μl的粘端连接反应,在连接1-2小时后可以取10μl直接转化大肠杆菌,其余10μl可以16℃孵育连接过夜。
如果第二天顺利获得克隆,即可进入下一步实验;如果第二天转化的大肠杆菌未获得预期的克隆,则可以取连接过夜的剩余连接产物再次转化大肠杆菌。
h. 随后即可直接取连接产物用于转化感受态细菌。
2. PCR产物和T载体的连接:
a. PCR产物凝胶电泳后,切胶回收预期大小的DNA片段。
凝胶中DNA片段的回收可以使用试剂盒进行
操
作,例如碧云天的DNA凝胶回收试剂盒(D0056)。
也可以采用反复冻融等方法回收DNA片段。
b. 按照T载体的说明书取适量T载体,加入3倍摩尔数的待插入片段。
参考下表设置连接反应体系。
注1:很多时候由于载体量和PCR产物的量都比较少,在回收后很难定量。
此时可根据回收前电泳条带的亮度进行大致的估计。
通常以DNA分子量标准的某一条带为参考,估计或通过灰度半定量您的目的条带和该参考条带的亮度的比例关系。
然后再按照预计的纯化或凝胶回收时的得率计算出最终得到的载体量和PCR产物的量的比例关系。
注2:通常每个反应使用0.2-0.5μl连接酶已经足够,如果希望进一步提高连接效率,可以把连接酶的用量提高至1μl。
c. 用移液器轻轻吹打混匀或轻微Vortex混匀,室温离心数秒,使液体积聚于管底。
d. 20-25℃孵育连接1-2小时,或16℃孵育连接过夜。
注:为快速获得预期克隆可以参考如下方法:对于20μl的粘端连接反应,在连接1-2小时后可以取10μl直接转化大肠杆菌,其余10μl可以16℃孵育连接过夜。
如果第二天顺利获得克隆,即可进入下一步实验;如果第二天转化的大肠杆菌未获得预期的克隆,则可以取连接过夜的剩余连接产物再次转化大肠杆菌。
e. 随后即可直接取连接产物用于转化感受态细菌。
3. Linker或RNAi片段和载体的连接:
a. 载体的酶切和纯化同步骤1a和1b。
b. Linker或RNAi片段的退火可以选择适当的DNA退火缓冲液,例如碧云天的Annealing Buffer for
DNA Oligos(5X)(D0251),进行退火反应。
c. 长度大于8bp的Linker或退火的RNAi片段,可以按照5:1至10:1的比例和载体进行连接反应。
例如
载体为0.03pmol,则插入片段可以为0.15至0.3pmol。
长度小于8bp的linker,比例需调整为10:1 以上。
d. 除插入片段的用量外,随后按照步骤1e,1f,1g,和1h进行。
4. DNA自身环化的连接:
参考步骤1e,待插入片段换成适量的水即可。
其余步骤按照步骤1f,1g,和1h进行。
5. 其它类型的DNA片段连接参考上述方法进行。
常见问题:
1. 连接反应后转化效率很低或阳性克隆非常少。
a. 可能感受态细菌转化效率太低,用质粒作为阳性对照同时检测感受态的转化效率。
b. 可以尝试提高载体或插入片段的纯度。
对于平端连接需注意适当延长连接时间。
c. 可能载体酶切不够充分,用未经连接的载体转化作为阴性对照。
d. 用存放DNA的溶液进行转化,作为阴性对照,检测感受态细菌是否存在问题。
