常见弱电解质
常见弱电解质电离平衡常数表
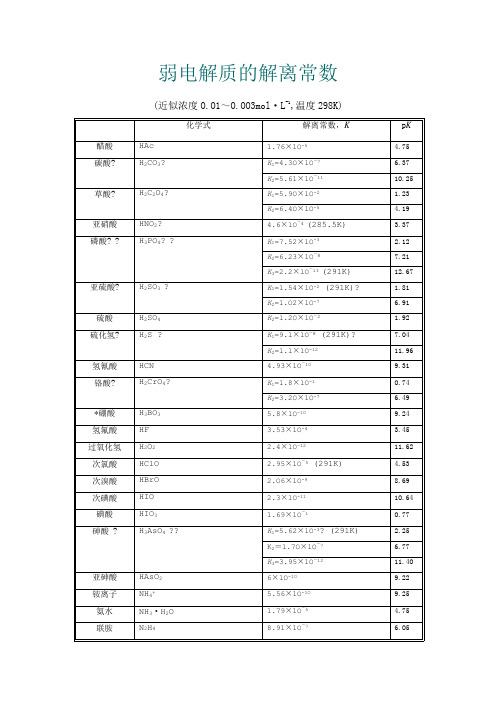
弱电解质的解离常数(近似浓度O.O1~O.OO3mol·L-1,温度298K)化学式解离常数,K p K 醋酸HAc 1.76×1O-5 4.75 碳酸?H2CO3?K1=4.3O×lO-7 6.37K2=5.61×1O-111O.25 草酸?H2C2O4?K1=5.9O×lO-2 1.23K2=6.4O×lO-5 4.19 亚硝酸HNO2? 4.6×1O-4 (285.5K) 3.37 磷酸??H3PO4??K1=7.52×lO-3 2.12K2=6.23×1O-87.21K3=2.2×lO-13 (291K) 12.67 亚硫酸?H2SO3 ?K1=1.54×lO-2 (291K)? 1.81K2=1.O2×lO-7 6.91 硫酸H2SO4K2=l.2O×lO-2 1.92 硫化氢?H2S ?K1=9.l×lO-8 (291K)?7.O4K2=l.l×1O-1211.96 氢氰酸HCN 4.93×1O-1O9.31 铬酸?H2CrO4?K1=1.8×lO-1O.74K2=3.2O×1O-7 6.49 *硼酸H3BO3 5.8×1O-1O9.24 氢氟酸HF 3.53×1O-4 3.45 过氧化氢H2O2 2.4×1O-1211.62 次氯酸HClO 2.95×1O-5 (291K) 4.53 次溴酸HBrO 2.O6×1O-98.69 次碘酸HIO 2.3×1O-111O.64 碘酸HIO3 1.69×1O-1O.77 砷酸 ?H3AsO4 ??K1=5.62×lO-3? (291K) 2.25K2=l.7O×lO-7 6.77K3=3.95×1O-1211.4O 亚砷酸HAsO26×1O-1O9.22 铵离子NH4+ 5.56×1O-1O9.25 氨水NH3·H2O 1.79×1O-5 4.75 联胺N2H48.91×1O-7 6.O5羟氨NH2OH9.12×1O-98.O4 氢氧化铅Pb(OH)29.6×1O-4 3.O2 氢氧化锂LiOH 6.31×1O-1O.2 氢氧化铍?Be(OH)2 1.78×1O-6 5.75 BeOH+ 2.51×1O-98.6 氢氧化铝A1(OH)3 5.O1×1O-98.3 Al(OH)2+ 1.99×1O-1O9.7 氢氧化锌Zn(OH)27.94×1O-7 6.1 氢氧化镉Cd(OH)2 5.O1×1O-111O.3 *乙二胺?H2NC2H4NH2?K1=8.5×lO-5 4.O7K2=7.l×lO-87.15 *六亚甲基四胺(CH2)6N4 1.35×1O-98.87*尿素CO(NH2)2 1.3×1O-1413.89 *质子化六亚甲基四胺(CH2)6N4H+7.1×1O-6 5.15甲酸HCOOH ? 1.77×1O-4 (293K) 3.75 氯乙酸ClCH2COOH 1.4O×1O-3 2.85 氨基乙酸NH2CH2COOH 1.67×1O-1O9.78 *邻苯二甲酸C6H4(COOH)2K1=1.12×1O-3 2.95K2=3.91×1O-6 5.41 柠檬酸??(HOOCCH2)2C(OH)COOH? ??K1=7.l×1O-4 3.14K2=1.68×1O-5 (293K) 4.77K3=4.1×1O-7 6.39 -酒石酸?(CH(OH)COOH)2?K1=1.O4×1O-3 2.98K2=4.55×1O-5 4.34 *8-羟基喹啉?C9H6NOH?K1=8×lO-6 5.1K2=1×1O-99.O 苯酚C6H5OH ? 1.28×1O-1O (293K)9.89*对氨基苯磺酸?H2NC6H4SO3H?Kl=2.6×lO-l O.58K2=7.6×1O-4 3.12*乙二胺四乙酸(EDTA)? (CH2COOH)2NH+CH2CH2NH+(CH2COOH)2?K5=5.4×1O-7 6.27K6=l.12×1O-111O.95。
高中化学选修4 常见的弱电解质

D.水的电离是一个吸热过程
【规律方法】
(1)酸或碱:在纯水中加入酸
或碱,均抑制水的电离,若温度不变KW不变。
(2)温度:升温,由于水电离吸热,升温将促
进水的电离,使平衡右移, c(H + ) 、 c(OH - ) 同时 增大, pH变小,但由于 c(H+)与 c(OH-)始终保 持相等,故仍显中性。
(3)水的电离过程是可逆的吸热过程。
2.水的离子积常数
(1)KW只与温度有关,与溶液的浓度无关。因为水 的电离过程是一个吸热过程,所以温度升高, KW 必然 增大。100 ℃时,纯水中:c(H+)=c(OH-)=1.0×10-6 mol·L-1, KW=1.0×10- 12。 25 ℃时,纯水中: KW =
B项KW只与温度有关,温度不变时,KW不变;C项H2O
是弱电解质,应用 “ ” ; D项 KW = 10 - 14 只适用于 25 ℃的稀的电解质水溶液及纯水。
要点二
影响水的电离平衡的因素 H2O H++OH- ΔH>0 KW 增大 不变 不变
条件变化 升高温度 加酸 加碱
移动方向 向右移动 向左移动 向左移动
由上表可以看出,随着温度的升高,水的离子积 增大 。室
温下,KW=c(H+)·c(OH-)=1.0×10-14。
如何计算酸(或碱)溶液中的水电离出的H+(或OH-) 浓度?为什么实际计算中这部分可忽略不计?
【思考 · 提示】
当酸 ( 碱 ) 溶于水时,酸 ( 碱 )
电离出的 H + (OH - ) 增大了溶液中的 c(H + )[ 或
高中常见弱电解质有哪些

高中常见弱电解质有哪些常见的弱电解质有CH3COOH、HF、H2CO3、H2SO3、、H2S、HClO、HCN、氢氧化铝、氢氧化、HgCl2、水等。
弱电解质一般有:弱酸、弱碱,少部分盐。
扩展资料决定电解质强弱的因素:(1)键型电解质的键型不同,电离程度就不同。
已知典型的离子化合物,如强酸、强碱和大部分盐类,在极性水分子作用下能够全部电离,导电性很强,我们称这种在水溶液中能够完全电离的'物质为强电解质。
而弱极性键的共价化合物,如弱酸、弱碱和少数盐类,在水中仅部分电离,导电性较弱,我们称这种在水溶液中只能部分电离的物质为弱电解质。
(2)键能相同类型的共价化合物由于键能不同,电离程度也不同。
例如,HF、HCl、HBr、HI就其键能来说是依次减小的,它们分子内核间距的依次增大。
(3)溶解度电解质的溶解度也直接影响着电解质溶液的导电能力。
有些离子化合物,如BaSO4、CaF2等,尽管它们溶于水时全部电离,但它们的溶解度很小,使它们的水溶液的导电能力很弱,但它们在熔融状态时导电能力很强,因此仍属强电解质。
(4)浓度电解质溶液的浓度不同,电离程度也不同。
溶液越稀,电离程度越大。
盐酸和硫酸只有在稀溶液中才是强电解质,在浓溶液中,则是弱电解质。
由蒸气压的测定知道10 mol/L的盐酸中有0.3%是共价分子,通常当溶质中以分子状态存在的部分少于千分之一时就可认为是强电解质,因此10 mol/L的盐酸中HCl是弱电解质。
(5)溶剂溶剂的性质也直接影响电解质的强弱。
对于离子化合物来说,水和其他极性溶剂的作用主要是削弱晶体中离子间的引力,使之解离。
guo常见的弱电解质

3、影响水的电离平衡移动的因素
H2 O
H+ +OH-
水的电离是可逆的过程,那么哪些条件 改变会影响水的电离呢?请根据上节课 学习的弱电解质的电离平衡影响因素探 讨下列问题。
讨论完成表格: H2O
改变条件 平衡 移动 方向
C(H+)
OH-+ H+
C(OH-) 水的电离 (抑制或促 进)
α
Kw
升高温度
c(H2O)= n(H2O)/V(液) =m(H2O)/[M(H2O)V(液)] =[V(液)ρ(H2O)]/[M(H2O)V(液)] =1000/18=55.56 mol /L
一定的温度下,纯水的浓度是定值。
电离常数:K =
C(H+)×C(OH-)
C(H2O)
K W=
K 电离× C(H2O)= C(H+)×C(OH-)为常数。
1×10-13 mol/L 1×10-13 mol/L
5、常温下,0.05mol/L的硫酸溶液中水电离出 的c(H+)和c(OH-)各是多少?
1×10-13 mol/L 1×10-13 mol/L
【小结】 (1)Kw取决于温度,不仅适用于纯水,还适用于稀 溶液。常温下,纯水或稀溶液中,Kw= C(H+)×C(OH-)=1×10-14 (2)在稀溶液中,Kw中的C(OH-) 、 C(H+)指溶 液中总的离子浓度。 (3)不论任何溶液,水电离出的C(H+)=C(OH-)
结论:
1)水的电离是吸热过程。 2)温度越高,Kw越大。
课堂练习: 1、若25℃纯水中Kw=1×10-14,求由水电离出 来的 c(H+)? 1×10-7 mol/L 2、若100℃纯水中Kw=1×10-12,由水电离出 +)? 1×10-6 mol/L 来的 c(H 3、25℃时,某稀溶液中,c(H+)=1×10-6 mol/L, 问c(OH-)是多少? 1×10-8 mol/L 4、常温下,0.1mol/L的NaOH溶液中水电离 出的c(H+)和c(OH-)各是多少?
常见的弱电解质

C(H2O)
电离平衡常数:K =
C(H+)×C(OH-)
C(H2O)
在一定温度下,纯水和稀溶液中C(H2O)可视为一定值 因此有:
Kw= K • C(H2O)= C(H+) • C(OH-)
2、水的离子积
在一定温度时:
C(H+) C(OH-)=Kw, Kw称为水
•
的离子积常数,简称水的离子积。
-14 25℃时,Kw=1×10
(2013•上海)部分弱酸的电离平衡常数如表,下列选项错误的是 ( )
弱酸 HCOOH HCN H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11
电离常数(25℃)
Ka=1.77×10
-4
Ka=4.9×10
-10
A.2CN-+H2O+CO2→2HCN+CO32B.2HCOOH+CO32-→2HCOO-+H2O+CO2 C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
+) 减小 ,Kw_____ 动,α水____ ,则 C ( H 不变
必然会____ 减小 。
【总结】
抑制水电离
增大C(H+)
增大C(OH )
降低温度 减小C(H+)
促进水电离
减小C(OH-)
升高温度
[练习] 1.下列说法正确的是 A.盐酸溶液中无OHB.NaOH溶液中无H+
(
D)
C.NaCl溶液中既无H+也无OHD.常温下,任何物质的稀溶液中都有H+
2、在酸碱溶液中,水电离出来的C(H+) 和C(OH-)是否相等?
常见弱电解质 (12张)

实用文档
[练习] 1.某温度下纯水中C(H+) = 2×10-7 mol/L, 则此时溶液中的C(OH-) = _2_×_1_0_-_7_m_o_l_/L_。 若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = 8×10-9 mol/L 。
6、在常温下,由水电离产生的 C(H+)=1×10-13 mol/L的溶液,则该溶 液的酸碱性如何?
答:可能是酸性也可能是碱性
4、在常温下,0.1mol/L的盐酸溶液中水电 离出的C(H+ )和C(OH-)是多少?
水电离出的C(OH-)=1×10-14/0.1 =1×10-13mol/L= C(H+ )
5、在常温下, 0.1mol/L的NaOH溶液中水电 离出的C(H+)和C(OH-)是多少?
水电离出的C(H+ ) =1×10-14/0.1 =1×10-13mol/L= C(OH-)
专题3 溶液中的离子反应
常见的弱电解质
弱酸、弱碱、水
1、水是一种极弱的电解质,能微弱的电离:
H2O+H2O
H3O++OH-
( H2OH++OH-)电离平衡常数:K电离=
C(H+)×C(OH-)
C(H2O)
纯水和稀溶液中C(H2O)可视为一定值
K W= K 电离× C(H2O)= C(H+)×C(OH-) K W——水的离子积常数
4、不论是在中性溶液还是在酸、碱性溶液, 水电离出的C(H+)=C(OH-)
2、影响水电离平衡的外界因素
H2O
H++OH-
增大C(H+)
抑制水电离 增大C(OH-)
第3课时 常见的弱电解质
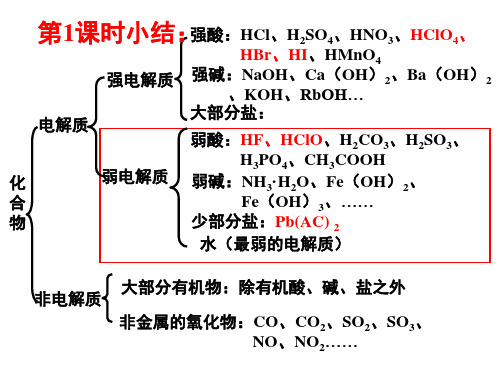
9.一定温度下,冰醋酸加水稀释 的过程中,溶液导电能力(I)随加 水的体积(V)变化如图所示,
下列说法正确的是 ( D)
A.“O”点导电能力为0的理由是冰醋酸是固 体,内部的离子不能自由移动
B.a、b、c三点中,a点c(H+)最大,因为电解 质溶液浓度越大,离子浓度就越大 C.a、b、c三点中,b点水电离的程度最大 D.若使b点处溶液中c(H+)减小,可向溶液中 加水或加冰醋酸
第1课时小结:强酸:HCl、H2SO4、HNO3、HClO4、
HBr、HI、HMnO4 强电解质 强碱:NaOH、Ca(OH)2、Ba(OH)2
、KOH、RbOH…
电解质
大部分盐:
弱酸:HF、HClO、H2CO3、H2SO3、
化
弱电解质
H3PO4、CH3COOH 弱碱:NH3·H2O、Fe(OH)2、
化合物类型
物质类别
阴、阳离子
电离方程式用等号
离子化合物、部分 共价化合物
强酸、强碱、绝大多 数盐、大多数活泼金 属氧化物等
阴、阳离子、弱 电解质分子 电离方程式用 可逆符号
部分共价化合物
弱酸、弱碱、少部分 盐、水
【温故】
在一定的条件下(如温度、
浓度一定),当 溶液中的弱电解
质分子电离成离子的速率与离
D.Mg2+ Cu2+ SO42- Cl-
8.已知一种c(H+)=1×10-3mol·L-1的酸和一 种c(OH-)=1×10-3mol·L-1的碱溶液等体
积混和后溶液呈酸性.其原因可能是 B
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应 C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
2、已知0.1mol・L-1的醋酸溶液中存在电离平 衡
常见弱电解质电离平衡常数表

弱电解质的解离常数(近似浓度O.O1~O.OO3mol·L-1,温度298K)化学式解离常数,K p K 醋酸HAc 1.76×1O-5 4.75 碳酸H2CO3K1=4.3O×lO-7 6.37K2=5.61×1O-111O.25 草酸H2C2O4K1=5.9O×lO-2 1.23K2=6.4O×lO-5 4.19 亚硝酸HNO2 4.6×1O-4 (285.5K) 3.37 磷酸H3PO4K1=7.52×lO-3 2.12K2=6.23×1O-87.21K3=2.2×lO-13 (291K) 12.67 亚硫酸H2SO3 K1=1.54×lO-2 (291K) 1.81K2=1.O2×lO-7 6.91 硫酸H2SO4K2=l.2O×lO-2 1.92 硫化氢H2S K1=9.l×lO-8 (291K) 7.O4K2=l.l×1O-1211.96 氢氰酸HCN 4.93×1O-1O9.31 铬酸H2CrO4K1=1.8×lO-1O.74K2=3.2O×1O-7 6.49 *硼酸H3BO3 5.8×1O-1O9.24 氢氟酸HF 3.53×1O-4 3.45 过氧化氢H2O2 2.4×1O-1211.62 次氯酸HClO 2.95×1O-5 (291K) 4.53 次溴酸HBrO 2.O6×1O-98.69 次碘酸HIO 2.3×1O-111O.64 碘酸HIO3 1.69×1O-1O.77 砷酸H3AsO4 K1=5.62×lO-3 (291K) 2.25K2=l.7O×lO-7 6.77K3=3.95×1O-1211.4O 亚砷酸HAsO26×1O-1O9.22 铵离子NH4+ 5.56×1O-1O9.25 氨水NH3·H2O 1.79×1O-5 4.75联胺N2H48.91×1O-7 6.O5 羟氨NH2OH9.12×1O-98.O4 氢氧化铅Pb(OH)29.6×1O-4 3.O2 氢氧化锂LiOH 6.31×1O-1O.2 氢氧化铍Be(OH)2 1.78×1O-6 5.75 BeOH+ 2.51×1O-98.6 氢氧化铝A1(OH)3 5.O1×1O-98.3 Al(OH)2+ 1.99×1O-1O9.7 氢氧化锌Zn(OH)27.94×1O-7 6.1 氢氧化镉Cd(OH)2 5.O1×1O-111O.3 *乙二胺H2NC2H4NH2K1=8.5×lO-5 4.O7K2=7.l×lO-87.15 *六亚甲基四胺(CH2)6N4 1.35×1O-98.87*尿素CO(NH2)2 1.3×1O-1413.89 *质子化六亚甲基四胺(CH2)6N4H+7.1×1O-6 5.15甲酸HCOOH 1.77×1O-4 (293K) 3.75 氯乙酸ClCH2COOH 1.4O×1O-3 2.85 氨基乙酸NH2CH2COOH 1.67×1O-1O9.78 *邻苯二甲酸C6H4(COOH)2K1=1.12×1O-3 2.95K2=3.91×1O-6 5.41 柠檬酸(HOOCCH2)2C(OH)COOH K1=7.l×1O-4 3.14K2=1.68×1O-5 (293K) 4.77K3=4.1×1O-7 6.39 -酒石酸(CH(OH)COOH)2K1=1.O4×1O-3 2.98K2=4.55×1O-5 4.34*8-羟基喹啉C9H6NOH K1=8×lO-6 5.1K2=1×1O-99.O苯酚C6H5OH 1.28×1O-1O (293K)9.89*对氨基苯磺酸H2NC6H4SO3H K l=2.6×lO-l O.58K2=7.6×1O-4 3.12*乙二胺四乙酸(EDTA) (CH2COOH)2NH+CH2CH2NH+(CH2COOH)2K5=5.4×1O-7 6.27K6=l.12×1O-111O.95弱电解质的解离常数(近似浓度O.O1~O.OO3mol·L-1,温度298K)化学式解离常数,K p K 醋酸HAc 1.76×1O-5 4.75 碳酸H2CO3K1=4.3O×lO-7 6.37K2=5.61×1O-111O.25 草酸H2C2O4K1=5.9O×lO-2 1.23K2=6.4O×lO-5 4.19 亚硝酸HNO2 4.6×1O-4 (285.5K) 3.37 磷酸H3PO4K1=7.52×lO-3 2.12K2=6.23×1O-87.21K3=2.2×lO-13 (291K) 12.67 亚硫酸H2SO3 K1=1.54×lO-2 (291K) 1.81K2=1.O2×lO-7 6.91 硫酸H2SO4K2=l.2O×lO-2 1.92 硫化氢H2S K1=9.l×lO-8 (291K)7.O4K2=l.l×1O-1211.96 氢氰酸HCN 4.93×1O-1O9.31 铬酸H2CrO4K1=1.8×lO-1O.74K2=3.2O×1O-7 6.49 *硼酸H3BO3 5.8×1O-1O9.24 氢氟酸HF 3.53×1O-4 3.45 过氧化氢H2O2 2.4×1O-1211.62 次氯酸HClO 2.95×1O-5 (291K) 4.53 次溴酸HBrO 2.O6×1O-98.69 次碘酸HIO 2.3×1O-111O.64 碘酸HIO3 1.69×1O-1O.77 砷酸H3AsO4 K1=5.62×lO-3 (291K) 2.25K2=l.7O×lO-7 6.77K3=3.95×1O-1211.4O 亚砷酸HAsO26×1O-1O9.22 铵离子NH4+ 5.56×1O-1O9.25 氨水NH3·H2O 1.79×1O-5 4.75联胺N2H48.91×1O-7 6.O5 羟氨NH2OH 9.12×1O-98.O4 氢氧化铅Pb(OH)29.6×1O-4 3.O2 氢氧化锂LiOH 6.31×1O-1O.2 氢氧化铍Be(OH)2 1.78×1O-6 5.75 BeOH+ 2.51×1O-98.6 氢氧化铝A1(OH)3 5.O1×1O-98.3+ 1.99×1O-1O9.7 Al(OH)2氢氧化锌Zn(OH)27.94×1O-7 6.1 氢氧化镉Cd(OH)2 5.O1×1O-111O.3 *乙二胺H2NC2H4NH2K1=8.5×lO-5 4.O7K2=7.l×lO-87.15 *六亚甲基四胺(CH2)6N4 1.35×1O-98.87 *尿素CO(NH2)2 1.3×1O-1413.89 *质子化六亚甲(CH2)6N4H+7.1×1O-6 5.15 基四胺甲酸HCOOH 1.77×1O-4 (293K) 3.75 氯乙酸ClCH2COOH 1.4O×1O-3 2.85 氨基乙酸NH2CH2COOH 1.67×1O-1O9.78 *邻苯二甲酸C6H4(COOH)2K1=1.12×1O-3 2.95K2=3.91×1O-6 5.41 柠檬酸(HOOCCH2)2C(OH)COOH K1=7.l×1O-4 3.14K2=1.68×1O-5 (293K) 4.77K3=4.1×1O-7 6.39 -酒石酸(CH(OH)COOH)2K1=1.O4×1O-3 2.98K2=4.55×1O-5 4.34 *8-羟基喹啉C9H6NOH K1=8×lO-6 5.1K2=1×1O-99.O 苯酚C6H5OH 1.28×1O-1O (293K) 9.891、一些固体的密度(常温常压)物质 密度(kg / m ) 物质密度(kg / m )铂 21.4×10 铝 2.7×10 金 19.3×10 花岗岩 (2.6-2.8)×10 铅 11.3×10 砖 (1.4-2.2)×10 银 10.5×10 冰(0℃) 0.9×10 铜 8.9×10 蜡0.9×10 钢、铁7.9×10干松木0.5×102、一些液体的密度(常温常压)物质 密度(kg / m ) 物质密度(kg / m )水银 13.6×10植物油 0.9×10硫酸 1.8×10 煤油 0.8×10 海水 1.03×10 酒精 0.8×10 纯水1.0×10 汽油0.71×103、一些气体的密度(常温常压)物质 密度(kg / m ) 物质密度(kg / m )二氧化碳 1.98 一氧化碳 1.25氧 1.43 氦 0.18 空气1.29氢0.09注:1g/cm =1×10 kg/m333 3 3 3 3 333333333333 3 3 3 3333333。
