初中化学常见化学物质的性质及转化关系
初中化学知识总结(常见物质的性质和用途)

初中化学知识总结(常见物质的性质和⽤途)初中化学知识总结(常见物质的性质和⽤途)物质物理性质化学性质⽤途氧⽓O2通常情况下,氧⽓是⼀种⽆⾊、⽆味的⽓体。
不易溶于⽔,⽐空⽓略重,可液化和固化。
氧⽓是⼀种化学性质⽐较活泼的⽓体,能与许多物质发⽣化学反应,在反应中提供氧,具有氧化性,是常⽤的氧化剂2Mg+O2点燃2MgO 3Fe+2O2点燃Fe3O42Cu+O2△2CuO 4Al + 3O2点燃 2Al2O32H2+ O2点燃 2H2O 4P + 5O2点燃 2P2O5S + O2点燃 SO2C + O2点燃 CO22C + O2点燃 2CO(1)供呼吸。
病⼈的急救。
(2)利⽤氧⽓⽀持燃烧并放热的性质,⾦属的⽓焊和⽓割、作⽕箭发动机的助燃剂、制液氧炸药等。
空⽓1、空⽓的成分按体积分数计算:氮⽓78%,氧⽓21%,稀有⽓体0.94%,CO20.03%2、环境污染知识:排放到空⽓中的⽓体污染物较多的是⼆氧化硫、⼆氧化氮、⼀氧化碳3、测定空⽓成份或除去⽓体⾥的氧⽓,要⽤易燃的磷,磷燃烧后⽣成固体,占体积⼩易分离。
不能⽤碳、硫代替磷。
碳、硫跟氧⽓反应⽣成⽓体,难跟其他⽓体分离。
分离液态空⽓制取氧⽓,此变化是物理变化,不是分解反应氢⽓H2通常状况下,纯净的氢⽓是⽆⾊、⽆⽓味的⽓体,是密度最⼩的⼀种⽓体(1)氢⽓的可燃性注意:点燃氢⽓前⼀定要先检验氢⽓的纯度。
(2)氢⽓的还原性(1)充灌探空⽓球。
(2)做燃料有三个优点:资源丰富,燃烧后发热量⾼,产物⽆污染。
(3)冶炼⾦属,⽤氢⽓做还原剂。
⽔H2O净化⽔的⽅法:吸附、沉淀、过滤、蒸馏。
单⼀操作相对净化程度由⾼到低的顺序是:蒸馏,吸附沉淀,过滤,静置沉淀。
a.与某些氧化物反应:H2O + CaO == Ca(OH)2b. 分解反应:2H2O 通电== 2H2↑+O2↑;(正极O2 负极H2 ,体积⽐1:2)⽔污染途径:⼯业“三废”排放;⽣活污⽔的排放;农业上的农药、化肥等。
初中常见物质的化学性质及化学方程式

点燃 高温 点燃 点燃 点燃 点燃 点燃 点燃 点燃 通电 MnO 2 初中常见物质的化学性质及化学方程式一、物质与氧气的反应⑴单质与氧气的反应: 1. 镁在空气中燃烧:2Mg+O 2 2MgO(实验现象:发出耀眼的白光,放出热量,生成一种白色粉末状固体。
) 2. 铁在氧气中燃烧:3Fe+2O 2 Fe 3O 4(实验现象:剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体。
)3. 铜在空气中受热:2Cu+O 24. 铝在空气中燃烧:4Al+3O 2 2Al2O 3 5. 氢气中空气中燃烧:2H 2+O 2 2H 2O6. 红磷在空气中燃烧:4P+5O 2 2P 2O 5(实验现象:产生黄色火焰,放出热量,冒出大量白烟。
)7. 硫粉在空气中燃烧: S+O 2 SO 2(实验现象:发出微弱的淡蓝色火焰,放出热量,生成一种有刺激性气味的无色气体。
硫粉在氧气中燃烧:发出明亮的蓝紫色火焰。
)⑵化合物与氧气的反应:8. 甲烷在空气中燃烧:CH 4+2O 2 CO 2+2H 2O9. 酒精在空气中燃烧:C 2H 5OH+3O 2 2CO 2+3H 2O二.几种气体的制法:(1)实验室制氧气的反应原理:10. 加热氯酸钾(有少量的二氧化锰):2KClO 3 2KCl+3O 2↑11. 加热高锰酸钾:2KMnO 4 K 2MnO 4+MnO 2+O 2↑12.分解过氧化氢:2H 2O 2 2H 2O+O 2↑(2)实验室制二氧化碳的反应原理:13. CaCO 3+2HCl CaCl 2+H 2O+CO 2↑二氧化碳的工业制法原理:14. 高温煅烧石灰石:CaCO 3 CaO+CO 2↑(3)实验室制氢气的反应原理:15. Zn+H 2SO 4 ZnSO 4+H 2↑三、水的电解: 16. 水在直流电的作用下分解:2H 2O 2H 2↑+O 2↑四、碳的化学性质(1)常温下,碳的化学性质不活泼高温点燃点燃点燃高温高温(2)可燃性17.碳在氧气中充分燃烧:C+O2CO218. 碳在氧气中不充分燃烧:2C+O22CO(3)还原性19.木炭还原氧化铜:C+2CuO 2Cu+CO2↑20. 木炭还原二氧化碳:C+CO22CO五、二氧化碳的化学性质(1)二氧化碳既不能燃烧,也不能支持燃烧,而且也不能供给呼吸(2)二氧化碳与水反应,生成碳酸: CO2+H2O H2CO3 (H2CO3 CO2↑+H2O)(3)二氧化碳与澄清石灰水发生反应(检验二氧化碳):Ca(OH)2+CO2 CaCO3↓+H2O(4)氧化性:CO2 +C 2CO六、一氧化碳的化学性质(1)可燃性:2CO+O22CO2(2)还原性:Cu+CO2(3)毒性七、金属的化学性质(1)金属+氧气金属氧化物(化学方程式见氧气的化学性质)(2)活泼金属+盐酸、稀硫酸盐+氢气镁、锌、铁、铝和盐酸、稀硫酸反应:Mg+2HCl MgCl2+H2↑Mg+H2SO4MgSO4+H2↑Zn+2HCl ZnCl2+H2↑Zn+H2SO4ZnSO4+H2↑Fe+2HCl FeCl2+H2↑Fe+H2SO4FeSO4+H2↑2Al+6HCl 2AlCl3+3H2↑2Al+3H2SO4Al2(SO4)3+3H2↑(3)金属+盐溶液另一种金属+另一种盐铁和硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu锌和硫酸铜溶液反应:Zn+CuSO4ZnSO4+Cu铜和硝酸银溶液反应:Cu+2AgNO3Cu(NO3)2+2Ag八、酸的化学性质(1)酸+酸碱指示剂酸能使紫色石蕊溶液变红,使无色酚酞溶液不变色。
初中化学知识点总结课件

注意:原子团只是化合物中的一部分,不能脱离物质单独存在,
因此含原子团的物质必定有三种或三种以上元素,二种元素组成的物质不含原子团。原子团
在化学反应中可再分为更小的粒子原子。
离子:带电的原子或原子团叫离子。带正电的离子叫阳离子;带负电的离子叫阴离子。 离子里:质子数=核电荷数=电子数±带电量 离子符号的写法:离子的电荷数标在右上角,电荷的数值等于它对应的化合价 阳离子:Na+ Mg2+ Al3+ 、H+ NH4+、Fe2+ Fe3+ Ca2+ 阴离子:OH- S2-、 F- Cl- SO4 2- CO32- NO3- MnO4- PO43- MnO42- ClO3- 核外电子排布的规律:核外电子按能量由低到高从里往外排,第一层最 多容纳2个电子,第二、三层最多容纳8个电子。 按顺序背诵:质子数从1~18的元素符号和名称: 氢氦锂铍硼 碳氮氧氟氖 钠镁铝硅磷 硫氯氩
碱:电离时生成的阴离子全部是氢氧根离子的化合物。碱通常由金属离子和氢氧根离子构成 溶碱有五种:钾钙钠钡氨(KOH,Ca(OH)2 ,NaOH 、Ba(OH)2 ,氨水)它们的溶液无色。 有颜色的碱(不溶于水):红褐色的氢氧化铁(Fe(OH)3 ↓ )、蓝色的氢氧化铜(Cu(OH)2 ↓) 其他固体碱是白色。碱的名称通常有“氢氧化某”,化学式的最后面是“OH” 可溶性碱的溶液PH值大于7,紫色石蕊试液遇溶碱变蓝色,无色酚酞试液遇溶碱变红色 鉴定可溶性碱溶液(鉴定OH- ) 方法一:加紫色石蕊试液变蓝色,加无色酚酞试液变红色是碱. 方法二:加铁盐溶液有红褐色沉淀生成;加铜盐溶液有蓝色沉淀的是碱。
酸:电离时生成的阳离子全部是氢离子的化合物。酸溶液的PH值小于7 酸的名称中最后一个字是“酸”,通常化学式的第一种元素是“H ”,酸由氢和酸根离子组成 紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色 根据酸的组成,通常有以下两种分类方法: 酸的电离方程式:酸=nH+ +酸根离子n- a.根据酸分子电离所能生成的氢离子的个数分为: 一元酸(HCl、HNO3 ) 二元酸(H2 SO4 、H2 S、H2 CO3 ) 三元酸(H3 PO4 ) b.根据酸分子里有无氧原子分为: 含氧酸(H2 SO4 ,HNO3 , H3 PO4 名称为:某酸) 无氧酸(HCl, H2 S名称为:氢某酸 ) 鉴定酸(鉴定H+ )的方法有: ①加紫色石蕊试液变红色的是酸溶液; ②加活泼金属Mg、Fe、Zn等有氢气放出
初中化学常见物质的性质、用途归纳
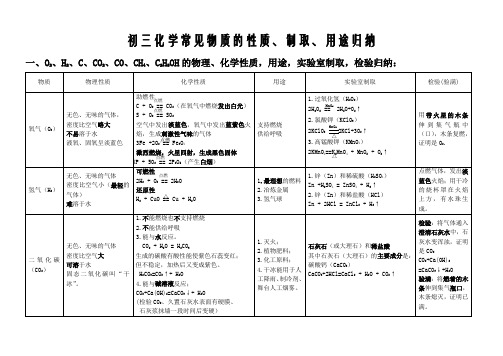
高梁、玉米、薯类发酵、蒸馏
二、常见的酸、碱、盐的性质、特性、用途:
物质
物理性质、特性
用途
盐酸 (HCl)
盐酸是 HCl 的水溶液(不能把 HCl 当
作盐酸);浓盐酸的挥发性,打开瓶塞, ①金属除锈
瓶口有白雾生成。敞口放置质量和质
3. NaHCO3 受热分解:
2NaHCO3 == Na2CO3 + H2O + CO2↑
高温
1. 高温煅烧分解:CaCO3 == CaO + CO2↑
2. 能与酸反应制 CO2:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
氧化钙 (CaO)
1.白色固体; 2.俗名:生石灰; 3.属于金属氧化物
1.最理想的燃料 2.冶炼金属 3.氢气球
1.锌(Zn)和稀硫酸(H2SO4) Zn +H2SO4 = ZnSO4 + H2↑ 2.锌(Zn)和稀盐酸(HCl) Zn + 2HCl = ZnCl2 + H2↑
点燃气体,发出淡 蓝色火焰;用干冷 的烧杯罩在火焰 上方,有水珠生 成。
检验:将气体通入
澄清石灰水中,石
如:H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2↑
1.能使紫色石蕊试液变蓝,使无色酚酞变红。
2.非金属氧化物 + 碱 → 盐 + 水。 可用于吸收 CO2、SO2 等气体。
如:CO2 + 2NaOH = Na2CO3 + H2O(NaOH 置露空气中变质的反应方程式)
初中化学常见物质的性质

十、碱
1、氢氧化钠、氢氧化钙的物理性质、用途
颜色、状态
氢氧化钠 白色固体,极易溶于水(溶解放热)
氢氧化钙 白色粉末,微溶于水
俗名
烧碱、火碱、苛性钠(具有强腐蚀性)
熟石灰、消石灰
制法
Ca(OH)2+Na2CO3== CaCO3↓ +2NaOH
CaO +H2O== Ca(OH2)(放热)
用途
①氢氧化钠固体可用作中性或碱性气体的干燥剂。 碱石灰干燥剂就是 NaOH 和 CaO的混合物。 ②化工原料:制肥皂、造纸。 ③去除油污:炉具清洁剂中含有氢氧化钠。
Ca(OH)2+ Na2CO3 =CaCO3↓+2NaOH;2NaOH + CuSO4=Cu(OH)2↓+ Na2SO4; 6NaOH + Fe2(SO4)3 == 2Fe(OH)3↓+3Na2SO4;2NaOH +(NH4)2SO4 ==3Na2SO4 +2 NH3↑ +2H2O; (NH4+的检验,用润湿
石蜡
在氧气中燃烧发出白光,瓶壁上有水珠生成,产生使澄清石灰水变浑浊的气体,放热。
二、水
⑴物理性质:在通常的情况下,水是无色、无味的液体,在 4OC 时密度最大,为 1g / cm3。
⑵化学性质:①通电分解
2H2O
通电
====
2H2↑ + O2↑
②水+某些金属氧化物→碱(可溶性碱), 如:H2O + CaO==Ca(OH2)
⑸Zn + 2HCl= ZnCl2 + H2↑(盐酸有挥发性);⑹Zn + H2SO4=ZnSO4 + H2↑(稀硫酸不挥发,此反应制氢气最好) ⑺⑻铁分别跟稀盐酸、稀硫酸反应(铁与稀盐酸、稀硫酸反应较慢):
九级化学物质转化关系图

一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2H2SO4H2O2→→P2O5+ Mg Al Zn Fe→ H2→H2O ↘MgO HClKClO3↗↓↘Al2O3 Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡1 / 32 /3 ↗BaCl 2 → BaSO 4↓(白)BaO → Ba(OH)2 ↗↘ + CuS O 4↘Cu(OH)2↓(蓝)6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO ↗ CO 2↙ ↘ Ca(HCO 3)2 → CaCO 3→CaOCuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O↗Na 2CO 3 ↗ NH 3 → NH 3.H 2O NaHCO 3 →CO 2 NH 4HCO 3 → H 2O↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 37、铝、镁、锌、铁、铜及其化合物↗ZnSO 4↖ ↗ AlCl 3↖Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙Fe Al↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙ Fe Al↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4Fe(OH)3 Fe 2O 3 ←――――→ Fe↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 2 8、常见物质的相互转化关系(即注明必要的反应物、反应条件)CO 2 CO C 或O 2 O 2 H 2O H 2O 2Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2CaCO 3 ⑸ ⑹ ⑺ ⑻CaCO3Na2CO3CO2CO2NaOHNa2CO3CO2O2H2ONaOH NH4ClNH3⑼⑽⑾⑿3 / 3。
初中化学常见物质的性质和用途

初中化学常见物质的性质和用途常见物质的性质和用途:1.水(H2O):性质:水是一种无色、无味、无臭的液体。
它的分子由两个氢原子和一个氧原子组成,呈现出特殊的极性质,并且具有高的比热容和高的表面张力。
用途:水是生命的基础,广泛应用于日常生活中的饮用、洗涤、煮食等方面。
此外,水还应用于农业灌溉、工业制造、能源生产等众多领域。
2.氧气(O2):性质:氧气是一种无色、无味、无臭的气体。
它是空气中最常见的组分之一,具有高的氧化性,能够支持燃烧和维持动植物的呼吸过程。
用途:氧气广泛应用于医疗领域,用于治疗呼吸系统疾病或急救情况下的氧疗。
此外,氧气还用于工业中的氧化、切割、焊接等领域。
3.二氧化碳(CO2):性质:二氧化碳是一种无色、无味的气体,具有较高的密度。
它在自然界中广泛存在,是植物进行光合作用的重要物质之一用途:工业上,二氧化碳被用作冷却剂、溶剂、气体保护剂等。
此外,它还用于特殊场合下的灭火、人造饮料的气泡制造等。
4.氨(NH3):性质:氨是一种无色、有刺激性气味的气体。
它具有较强的碱性,能够与酸反应,产生相应的盐类。
用途:氨用于制造化肥、合成尼龙等化学物质。
此外,氨的溶液被用作清洁剂、玻璃表面涂层等。
5.盐酸(HCl):性质:盐酸是一种无色、刺激性气味的挥发液体,呈酸性。
它具有很强的腐蚀性,能够溶解许多金属。
用途:盐酸广泛用于实验室中的化学分析、金属表面的清洗等领域。
此外,盐酸也用于工业上的冶炼、染料制备等过程。
6.硝酸(HNO3):性质:硝酸是一种无色、刺激性气味的液体,呈酸性。
它可以与多种物质发生剧烈的反应,具有很强的腐蚀性。
用途:硝酸被广泛应用于农业中的肥料制备、爆炸物品生产、矿石的提取等领域。
此外,硝酸还可用于电子工业、药物制造等。
7.硫酸(H2SO4):性质:硫酸是一种无色、黏稠的液体,呈酸性。
它具有很强的腐蚀性和漂白性。
用途:硫酸被广泛用于工业中的废水处理、金属表面涂层等。
此外,它还可以用于制造肥料、玻璃、洗涤剂等。
人教版化学中考复习物质的转化(34页)

用 无水硫酸铜
检验。注意:点燃前要先检验氢气的 纯度
。
(3)还原性:还原黑色的氧化铜,现象为黑色氧化铜变成 红色 ,试管口有 水珠 生成,其反
应的化学方程式为 H2+CuO Cu+H2O
;其实验步骤为:通氢气 加热 撤灯 继续通氢气至冷
却。
(4)用途:填充气球、作高能燃料(三个突出优点:①原料来源广泛;②产物是水,无污染;③燃烧时放 热高)、冶炼金属等。
23
例7 [2018·杭州模拟] 根据图30-8过程判断正确的选项是 ( A. 向F溶液中滴加硝酸银会产生白色沉淀 B. D溶液中只有一种阳离子 C. Cu可以通过一步反应变成C D. G的相对分子质量是233 g
) 图30-8
24
例8 下列各转化关系中,在一定条件下,不能一步实现的是 ( )
25
例9
“登高取物”游戏规则:梯子上下相邻的物质之间能发生反应的,游戏者可以上 升一格,最终登顶者可以获得“足球”奖励。甲同学根据规则能顺利获奖,乙同 学根据规则从CaCO3、CuSO4、KNO3、BaCl2中选择合适物质填入①②两处, 也顺利获奖。
(1)②是
。
(2)写出图中有CuO参加的一个化学反应方程 26
下列判断合理的是
()
A. 丙可能是碳酸钠溶液
B. 丁可能是氢氧化钙溶液
C. 乙必须通过置换反应转化为铁 D. 甲和丁的反应一定是中和反应
图30-7
22
【答案】A
【解析】经分析可知,碳酸钠和氢氧化钙都会和两种物质反应,所以甲和 丙要从碳酸钠和氢氧化钙中选,丙可能是碳酸钠溶液;由图可知,丁会与四 种物质发生反应,这五种物质中只有硫酸能与其他四个物质发生反应,故 丁一定是硫酸;五种物质中只有氧化铁会转化成铁,但是不一定都是置换 反应,比如一氧化碳还原氧化铁;中和反应必须是酸和碱反应,此题中丁是 硫酸,属于酸,但是甲可能是氢氧化钙,也可能是碳酸钠,所以不一定是中和 反应。
