pdl1胃判读标准
教你解读PD-L1表达检测结果!

教你解读PD-L1表达检测结果!作者:闵PD-1/PD-L1抑制剂目前已广泛应用于各种肿瘤的常规治疗中,与此相伴的PD-L1表达也被很多病人知晓,但PD-L1的TPS/CPS评分、如何判读表达高低也让很多病人摸不着头脑,不知从何了解,本篇就简单介绍PD-L1表达的相关内容。
PD-L1表达如何检测PD-L1表达作为最常用的免疫治疗生物标志物,目前主要使用组织样本,采用IHC免疫组化技术检测,获批上市可以使用的检测试剂盒包括有DAKO公司的22c3、28-8试剂盒、罗氏的SP142,SP263试剂盒等等,当下最为常用的检测试剂盒为DAKO公司的22c3试剂盒。
DAKO试剂盒对样本质量有严格要求,组织样本通常需要肿瘤细胞含量30%以上并且能找到至少100个癌细胞,样本合格时检测结果才有参考价值。
PD-L1表达结果如何判读PD-L1表达虽然也使用IHC免疫组化法检测,但不同于诸如TTF-1等常规病理指标简单的用“+/-”判读,PD-L1表达的结果通常使用TPS评分或CPS评分来判读。
TPS定义肿瘤细胞在任何强度下显示部分或完整的膜染色的细胞数占总肿瘤细胞数的百分比。
TPS评分的重点在主要观测对象为肿瘤细胞,计算的是染色的肿瘤细胞占全部肿瘤细胞的百分比,即代表有PD-L1表达的肿瘤细胞的占比。
CPS定义PD-L1染色细胞(包括肿瘤细胞、淋巴细胞、巨噬细胞)的数目之和除以肿瘤细胞总数,乘以100得出结果。
不同于TPS只计算肿瘤细胞情况,CPS几乎将所有染色的细胞都纳入计算,统计的是有PD-L1表达的细胞与肿瘤细胞之间的关系。
举个例子,假如100个肿瘤细胞,其中25个被染色(即有PD-L1表达),那么TPS评分即25%,若除了这25个肿瘤细胞被染色以外,还有25个淋巴细胞被染色,那么CPS评分则为(25+25)/100*100等于50。
如何选择TPS和CPS评分以可瑞达(派姆单抗,K药)为例,不同的癌种使用不同的评分,归纳如下:(以上资料来源FDA批准的可瑞达适应症,不同药物的临界值可能会有差异,以实际使用药物适应症要求为准。
【系列讲座】PD-L1免疫组化检测结果判读标准解读

【系列讲座】PD-L1免疫组化检测结果判读标准解读以PD-1/PD-L1 抗体为代表的免疫检查点抑制剂是近些年肿瘤免疫治疗研究的热点,目前已有多种 PD-1/PD-L1 抗体获得了美国 FDA 批准,用于治疗黑色素瘤、肺癌、尿路上皮癌等多个瘤种。
患者对抗PD-1/PD-L1 抗体的治疗应答与体内PD-L1 的表达水平有关,因而PD-L1 表达水平检测对于指导临床治疗和筛选获益人群具有重要价值。
近日在上海举办的肺癌免疫治疗新进展专家会上,Ventana 美国总部的病理学家张利平博士对美国 FDA 批准的 PD-1/PD-L1 抗体和相关检测产品做了介绍,比较了 4 种 PD-L1 检测克隆的特点,并以其中两个克隆号(Ventana SP263 和 Ventana SP142)为例,对其检测结果的判读标准进行了解读。
FDA批准的PD-1/PD-L1抗体和相关检测目前,美国FDA 批准的PD-1/PD-L1 抗体包括Nivolumab、Pembrolizumab、Atezolizumab、Avelumab 及Durvalumab。
各个药物目前已批准的适应证有所差异,其中值得注意的是Pembrolizumab 近期被批准用于微卫星高度不稳定(MSI-H)的实体瘤的治疗,而无需考虑肿瘤的组织学类型。
除了 Avelumab 以外,其余四个药物都有对应的 PD-L1 检测,相应的检测技术见下表:四种PD-L1检测克隆的比较上述 4 种 PD-L1 检测克隆中仅 Dako IHC 22C3 为伴随诊断,其余均为补充诊断。
两类诊断技术的开发、研制和临床验证过程一致,其区别在于伴随诊断对于安全、有效地使用相应药物是必需的,而补充诊断不是必需的,但可以帮助临床医生对个体患者的治疗风险/益处进行评估。
国际肺癌研究协会(IASLC)牵头发起的 Blueprint 项目对上述 4 种PD-L1 IHC 检测克隆进行了比较。
PD-L1在幽门螺杆菌胃炎不同阶段的表达及意义

·论著·PD L1在幽门螺杆菌胃炎不同阶段的表达及意义罗粟风 张 丹 吕俊衍 文 玉 施春晶 普光宇 姜 鑫 马岚青 【摘要】 目的 旨在深入了解程序化细胞死亡配体 1(PD L1)在幽门螺杆菌(犎狆)胃炎不同阶段的表达及意义。
方法 依据纳入标准及排除标准,选择2019年4月至2020年1月在昆明医科大学第一附属医院接受胃镜检查的12例患者,参照《京都胃炎分类》及《中国慢性胃炎共识意见(2017年,上海)》的标准,在胃镜下钳取胃窦部组织送病理检查,并行14C尿素呼气试验。
依据活体组织病理检查、犎狆特殊染色法及14C尿素呼气试验的结果,将患者分为犎狆阴性非萎缩性胃炎组即正常组(A组)、犎狆阳性非萎缩性胃炎组(B组)、犎狆阳性萎缩性胃炎组(C组)、犎狆阳性萎缩性胃炎伴肠化生组(D组),每组3例,采用免疫组织化学染色法、蛋白质印迹法(Westernblotting)检测各组胃窦部组织中PD L1的表达情况。
结果 Westernblotting结果显示,B组、C组、D组的胃黏膜活体组织中PD L1蛋白表达水平均明显高于A组,差异均有统计学意义(犘均<0.0001);C组的PD L1蛋白表达水平明显高于B组,差异有统计学意义(犘<0.01);D组与C组的PD L1蛋白表达水平差异无统计学意义(犘>0.05)。
免疫组织化学染色结果显示,A组未见明显的PD L1阳性表达细胞,B、C、D组均有明显的PD L1阳性表达细胞,且阳性表达细胞数量均较A组明显增多。
结论 犎狆感染可明显上调胃黏膜组织中PD L1的表达水平,且PD L1的表达随着犎狆胃炎的进展逐渐呈现出升高趋势。
【关键词】 程序性死亡配体1;幽门螺杆菌胃炎;萎缩性胃炎DOI:10.3969/j.issn.1673 534X.2021.06.010 基金项目:国家自然科学基金(81760108、81560099);云南省重点项目(2018FA039);云南省教育厅科学研究基金(2019Y0353);昆明医科大学研究生创新基金(2020S025) 作者单位:650032 昆明医科大学第一附属医院消化内科 罗粟风、张丹对本文有同等贡献,并列第一作者 通信作者:马岚青,Email:531229897@qq.com犈狓狆狉犲狊狊犻狅狀犪狀犱狊犻犵狀犻犳犻犮犪狀犮犲狅犳狆狉狅犵狉犪犿犿犲犱犱犲犪狋犺犾犻犵犪狀犱1犻狀犱犻犳犳犲狉犲狀狋狊狋犪犵犲狊狅犳犎犲犾犻犮狅犫犪犮狋犲狉狆狔犾狅狉犻犵犪狊狋狉犻狋犻狊犔犝犗犛狌犳犲狀犵,犣犎犃犖犌犇犪狀,犔犢犝犑狌狀狔犪狀,犠犈犖犢狌,犛犎犐犆犺狌狀犼犻狀犵,犘犝犌狌犪狀犵狔狌,犑犐犃犖犌犡犻狀,犕犃犔犪狀狇犻狀犵.犇犲狆犪狉狋犿犲狀狋狅犳犌犪狊狋狉狅犲狀狋犲狉狅犾狅犵狔,狋犺犲犉犻狉狊狋犃犳犳犻犾犻犪狋犲犱犎狅狊狆犻狋犪犾狅犳犓狌狀犿犻狀犵犕犲犱犻犮犪犾犝狀犻狏犲狉狊犻狋狔,犓狌狀犿犻狀犵650032,犆犺犻狀犪【犃犫狊狋狉犪犮狋】 犗犫犼犲犮狋犻狏犲 Thispaperaimstogainadeeperunderstandingoftheexpressionandsignificanceofprogrammeddeathligand1(PD L1)indifferentstagesof犎犲犾犻犮狅犫犪犮狋犲狉狆狔犾狅狉犻(犎狆)gastritis.犕犲狋犺狅犱狊 Accordingtotheinclusioncriteriaandexclusioncriteria,twelvepatientswhounderwentgastroscopyintheFirstAffiliatedHospitalofKunmingMedicalUniversityfromApril2019toJanuary2020wereselected.Accordingto《Kyotoclassificationofgastritis》and《ConsensusopinionsonchronicgastritisinChina(2017,Shanghai)》standard,thegastricantrumtissuewasobtainedunderagastroscopeforpathologicalexamination,andthe14Cureabreathtestwasdetected.Accordingtotheresultsofbiopsy,犎狆specialstainingand14Cureabreathtest,thepatientswereassignedtothe犎狆 negativenon atrophicgastritisgroup(GroupA),the犎狆positivenon atrophicgastritisgroup(GroupB),the犎狆 positiveatrophicgastritisgroup(GroupC),andthe犎狆positiveatrophicgastritiswith·044·国际消化病杂志2021年12月第41卷第6期 IntJDigDis,December25,2021,Vol.41,No.6Copyright©博看网 . All Rights Reserved.intestinalmetaplasiagroup(GroupD),3casesineachgroup.ImmunohistochemicalstainingandWesternblottingwereusedtodetecttheexpressionofPD L1ingastricantrumtissuesineachgroup.犚犲狊狌犾狋狊 TheWesternblottingresultsshowthatthePD L1proteinexpressioningastricmucosaltissuesofGroupsB,C,andDissignificantlyhigherthanthatofGroupA,withstatisticallysignificantdifferences(all犘<0.0001).TheexpressionlevelofPD L1proteininGroupCissignificantlyhigherthanthatinGroupB,withastatisticallysignificantdifference(犘<0.01).ThereisnostatisticallysignificantdifferenceinPD L1proteinexpressionbetweenGroupDandGroupC(犘>0.05).TheresultsofimmunohistochemicalstainingindicatethattherearenoobviousPD L1positiveexpressingcellsinGroupA,andthereareobviousPD L1positiveexpressingcellsinGroupsB,C,andD,andthenumberofpositiveexpressingcellsissignificantlyhigherthanthatinGroupA.犆狅狀犮犾狌狊犻狅狀 犎狆infectioncansignificantlyup regulatetheexpressionlevelofPD L1ingastricmucosaltissue,andtheexpressionofPD L1graduallyshowsanupwardtrendwiththeprogressof犎狆gastritis.【犓犲狔狑狅狉犱狊】 Programmeddeathligand1;犎犲犾犻犮狅犫犪犮狋犲狉狆狔犾狅狉犻gastritis;Atrophicgastritis 幽门螺杆菌(犎狆)感染在胃黏膜萎缩和肠化生的发生、发展中起着重要作用,约1%的犎狆胃炎可进展为胃癌[1]。
pd1治疗后疗效评价标准

pd1治疗后疗效评价标准
PD-1 治疗后的疗效评价标准可以根据治疗前后的疾病进展情况和生存状况来评估。
1. 完全缓解(Complete response, CR):所有可评估的病灶消失,持续至少四周。
2. 部分缓解(Partial response, PR):最大病灶直径减少至少30%,持续至少四周。
3. 疾病稳定(Stable disease, SD):病灶大小没有显著缩小或增大,持续至少六周。
4. 疾病进展(Progressive disease, PD):病灶大小增大至少20%,或出现新的病灶。
此外,还可以根据患者的生存状况和生活质量来评估疗效:
1. 生存期延长(Overall survival, OS):患者在治疗后的存活时间。
2. 无进展生存期延长(Progression-free survival, PFS):患者在治疗后的疾病进展前的存活时间。
3. 生活质量改善:治疗后患者的生活质量是否有所改善。
这些评估标准通常由医生根据病人的临床病情和影像学检查结果来进行评估,并结合其他患者指标来综合评估治疗效果。
一文读懂PD-L1检测与判读的质控要求(建议收藏)

一文读懂PD-L1检测与判读的质控要求(建议收藏)随着免疫治疗药物在国内的适应症越来越广泛,以及PD-L1抗体DAKO 22C3、DAKO 28-8和艾德E1L3N在国内的获批,PD-L1免疫组化检测在病理诊断工作中尤为重要,但不同药物所使用的PD-L1抗体的针对不同检测平台、不同克隆号的抗体甚至不同瘤种,其判读标准都存在差异,从而也会导致判读结果的主观性。
要实现PD-L1的精准检测和判读,需从多个方面进行质量控制。
一、检测前的质量控制推荐优先在石蜡包埋肿瘤组织标本切片中进行PD-L1免疫组织化学检测:手术切除标本和活检标本均可用于PD-L1 检测。
手术标本选择代表性蜡块进行PD-L1检测,应避免选择含有坏死组织、挤压细胞及固定不佳等标本块。
表1 PD-L1 IHC前处理条件推荐PD-L1检测前需要对HE染色的切片进行评估,观察是否存在脱片、皱褶、未染色等现象,这些情况可导致切片上肿瘤细胞数量减少、非特异性染色或假阴性等结果。
评估HE切片中肿瘤细胞数量和(或)肿瘤相关免疫细胞:22C3及28-8检测系统要求HE染色切片中至少存在100个活肿瘤细胞;SP142检测系统要求包含至少50 个活肿瘤细胞和(或)肿瘤相关间质。
如HE染色切片不合格,无法进行下一步检测,应再次切片或重新挑选蜡块。
二、PD-L1检测的对照选择目前各种文献、指南均推荐使用扁桃体或胎盘组织作为PD-L1免疫组化检测的阳性对照。
一般胎盘组织PD-L1表达阳性强度要高于扁桃体,但表达强度基本一致;而扁桃体表达呈现出强弱不等的表达。
在扁桃体中,大多数生发中心巨噬细胞呈现弱到中等强度的点状胞膜染色,大多数上皮隐窝细胞呈现中等到强的染色,而大多数淋巴细胞(外套层和生发中心B细胞)和浅表上皮细胞无染色,这种不同强度的表达方式有助于对肿瘤组织进行判读。
可以根据习惯采用适合的阳性对照组织,但原则上应采用上述2种组织,这样检测结果才能具有可比性。
图1扁桃体组织的PD-L1检测结果。
PD-L1判读与尿路上皮癌(UC)

PD-L1判读与尿路上皮癌(UC) 作为泌尿系统最常见的恶性肿瘤,尿路上皮癌(UC)异质性大,不同组织学亚型具有不同的病理学及分子特征,传统化疗方案效果有限,患者易复发、易转移,总体预后较差1。
随着越来越多以PD-1/PD-L1免疫检查点抑制剂为代表的免疫治疗药物获批用于晚期或转移性UC治疗,打破了UC多年来的诊疗瓶颈,为UC患者提供了长期生存的可能。
近日,浙江大学医学院附属第一医院肿瘤内科郑玉龙教授、病理科滕晓东教授就UC免疫治疗新进展及PD-L1 (SP263)检测在UC中的应用与判读标准进行了线上分享。
会议主席广东省人民医院病理医学部刘艳辉教授指出:“近年来,免疫检查点抑制剂在UC等肿瘤治疗中取得了积极进展,为临床提供更多诊疗选择的同时也对病理诊断提出了新的要求。
如何建立统一规范化的PD-L1检测体系及判读标准,帮助临床准确评估患者PD-L1表达水平以筛选出潜在免疫治疗获益人群成为病理医生目前的一大课题。
” PD-L1高表达或成为UC一二线免疫治疗重要参考标准 目前,复发风险仍是非肌层浸润性UC的一个挑战,5年内有近30%至70%的浅表复发风险以及1%至30%的疾病进展为肌层浸润性疾病2。
由于潜在的肾功能不全、功能状态差或合并症,多达50%的晚期UC患者不宜接受顺铂治疗2。
“UC早期易复发,近半数患者对一线铂类药物治疗不耐受,且几乎所有患者会发生疾病进展,而二线化疗方案无振奋性的生存改善,这导致UC长期处于系统性治疗困境。
”郑玉龙教授介绍道,“免疫治疗的出现打破了这一困境,其显著提升了UC患者的生存获益。
值得注意的是,多项临床研究表明,PD-L1高表达者在免疫治疗中显示出了更好的疗效。
” 一项度伐利尤单抗(Durvalumab)单药治疗局部晚期或转移性UC的多中心I/II期开放性临床研究(Study 1108)结果显示,所有入组患者中,PD-L1高表达者接受治疗后客观缓解率(ORR)达27.6%,而PD-L1低表达者仅5.1%;对于二线铂类治疗失败的PD-L1高表达者ORR达27.4%,而PD-L1低表达者仅4.1%。
胃癌中PD-L1蛋白表达及分布特征的病理学意义

网络出版时间:2019-9-127:21 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20190912.0720.010.html胃癌中PD L1蛋白表达及分布特征的病理学意义王岳君,王娜娜,杨苗苗,王 源,孙晶璐,章俊生,孟 刚摘要:目的 检测胃癌中程序性死亡配体 1(programmeddeathligand 1,PD L1)蛋白的表达,总结其在癌组织及癌间质中肿瘤浸润单核细胞(tumorinfiltratingmononuclearcells,TIMCs)中的表达水平及分布特征,探讨影响胃癌PD L1蛋白表达的病理学因素,以提高其判读的准确性及可重复性。
方法 收集安徽医科大学第四附属医院2015~2019年期间110例行胃癌根治切除术标本,运用免疫组化MaxVision两步法检测PD L1蛋白表达,观察其在癌组织及TIMCs中的表达水平及分布特征,计算并比较不同判读方法下PD L1蛋白表达及其检测阳性率的差异,并分析其与临床病理学特征及临床预后的关系。
结果 运用CPS、TPS及MIDS三种不同的判读方法,胃癌中PD L1蛋白的检测阳性率分别为46 4%、24 5%、42 7%,三者一致性较好(P<0 05)。
其中运用CPS检测的阳性率最高,且呈高表达者最多。
CPS、TPS及MIDS三者检测阳性率与胃癌肿瘤实质性坏死、TIMCs数量、肿块大小呈正相关(P<0 05),其中CPS检测PD L1表达还与癌组织浸润深度相关(P<0 05),但与患者性别、年龄、肿瘤病变部位、组织学类型等均无关。
PD L1蛋白高表达者在胃癌组织的分布以弥漫性分布特征为主,低表达者以斑驳样分布特征为主,且无论表达高低均存在癌巢与间质接触面区域PD L1着色强度较高的苔藓样分布特征。
TIMCs中PD L1阳性表达亦以苔藓样分布特征为主,着色细胞主要是淋巴细胞、巨噬细胞等,且接触面并列分布的癌细胞也更易见PD L1阳性表达。
总结:PD-L1免疫组化检测难点与要点
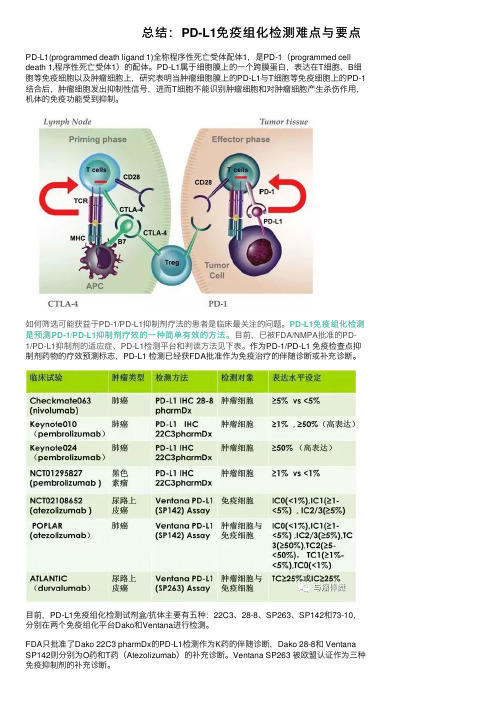
总结:PD-L1免疫组化检测难点与要点PD-L1(programmed death ligand 1)全称程序性死亡受体配体1,是PD-1(programmed cell death 1,程序性死亡受体1)的配体。
PD-L1属于细胞膜上的⼀个跨膜蛋⽩,表达在T细胞、B细胞等免疫细胞以及肿瘤细胞上,研究表明当肿瘤细胞膜上的PD-L1与T细胞等免疫细胞上的PD-1结合后,肿瘤细胞发出抑制性信号,进⽽T细胞不能识别肿瘤细胞和对肿瘤细胞产⽣杀伤作⽤,机体的免疫功能受到抑制。
如何筛选可能获益于PD-1/PD-L1抑制剂疗法的患者是临床最关注的问题。
PD-L1免疫组化检测是预测PD-1/PD-L1抑制剂疗效的⼀种简单有效的⽅法。
⽬前,已被FDA/NMPA批准的PD-1/PD-L1抑制剂的适应症、PD-L1检测平台和判读⽅法见下表。
作为PD-1/PD-L1 免疫检查点抑制剂药物的疗效预测标志,PD-L1 检测已经获FDA批准作为免疫治疗的伴随诊断或补充诊断。
⽬前,PD-L1免疫组化检测试剂盒/抗体主要有五种:22C3、28-8、SP263、SP142和73-10,分别在两个免疫组化平台Dako和Ventana进⾏检测。
FDA只批准了Dako 22C3 pharmDx的PD-L1检测作为K药的伴随诊断,Dako 28-8和 Ventana SP142则分别为O药和T药(Atezolizumab)的补充诊断。
Ventana SP263 被欧盟认证作为三种免疫抑制剂的补充诊断。
当前⾯临的检测难题:1 不同抗体要求使⽤不同的检测平台主流检测平台为两家公司的4种抗体检测平台,分别为DAKO 22C3和28-8检测的AutoStainerLink 48平台和Ventana SP142和SP263检测的Ventana Benchmark Ultra平台。
2 不同的抗体检测结果判读标准不同⽬前主要PD-L1检测抗体使⽤的判读⽅法有TPS、CPS以及分别计算TC和IC判读⽅法,不同判读⽅法的主要差异在与是否计算肿瘤区域阳性表达的免疫细胞数量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PDL1在胃癌中的表达标准,需要根据PD-L1 CPS评分来判定。
CPS评分即综合阳性评分,是PDL1染色阳性的肿瘤细胞、内皮细胞和淋巴细胞的百分比总分,具体计算方式为:肿瘤细胞染色评分×阳性细胞百分比+内皮细胞染色评分×阳性细胞百分比+淋巴细胞染色评分×阳性细胞百分比。
一般来说,CPS评分越高,患者接受免疫治疗的疗效越好。
根据CPS评分,可以将患者分为CPS≥100、CPS≥50且<100、CPS≥20且<50以及CPS<20四个等级。
其中,CPS≥100的患者接受免疫治疗的效果最佳,预后也最好。
请注意,以上信息仅供参考,具体的PDL1胃判读标准需要根据患者的具体情况和医生的建议来确定。
