高中化学元素及其化合物知识点总结
高中化学的化学元素与化合物总结

高中化学的化学元素与化合物总结在高中化学学习中,化学元素与化合物是重要的基础知识。
化学元素是构成物质的基本单元,而化合物是由不同元素通过化学反应结合而成的物质。
本文将对高中化学的化学元素与化合物进行总结,以帮助学生更好地理解和应用这一知识。
一、化学元素化学元素是由相同类型的原子组成的纯粹物质。
在化学元素周期表中,元素按照原子序数递增的顺序排列,并按照相似性分为不同的族和周期。
每个元素都有独特的原子结构和特性。
1. 元素符号:每个元素都有一个独特的符号,由拉丁文名称的第一个或前几个字母组成。
例如,氢元素的符号是H,氧元素的符号是O。
2. 原子序数和原子量:元素的原子序数是指元素的原子核中所含有的质子的数量,也是元素在周期表中的位置。
原子量是指一个元素的平均原子质量,可以通过许多同位素的相对丰度加权平均得到。
3. 周期表:化学元素周期表是按照元素的原子序数和性质排列的表格。
在周期表中,元素按照原子序数递增的顺序排列,并按照相似性分为不同的族和周期。
二、化合物化合物是由两种或更多种元素通过化学反应形成的物质。
化合物的形成是由于元素之间的化学键形成,如共价键或离子键。
1. 分子式:化合物可以通过分子式来表示。
分子式由元素符号和下标组成,下标表示相应元素原子的数量。
例如,水的分子式是H2O,表示它由两个氢原子和一个氧原子组成。
2. 电离和离子式:某些化合物在溶液中可以电离,形成离子。
离子式用来表示化合物中离子的组成和数量。
例如,氯化钠的离子式是Na+Cl-,表示它在溶液中电离为钠离子和氯离子。
3. 化合物的命名:化合物根据其组成和性质进行命名。
有机化合物通常根据它们的功能基团和碳原子数进行命名,无机化合物通常使用化学元素的名称进行命名。
三、常见化学元素与化合物1. 常见化学元素:常见化学元素包括氢、氧、碳、氮、铁、铜、锌等。
这些元素在自然界和生活中广泛存在,并且在许多化学反应和化合物中起重要作用。
2. 常见化合物:常见化合物包括水、二氧化碳、盐酸、硫酸、葡萄糖等。
高中化学元素及其化合物知识点总结大全非常实用

高中化学元素及其化合物知识点总结大全非常实用一、元素的化学性质1.元素的原子结构:包括元素的原子序数、原子核的构成等;2.元素的化学活性:元素的化合价、化合能力等;3.元素的氧化还原性:元素在化合物中的氧化态和还原态、氧化还原反应的定义和原理等;4.元素的电性和金属性:元素的电负性、电离能、原子半径等;5.元素的地壳丰度和存在形式:元素在地壳中的含量、存在的化合物等。
二、常见化学元素及其性质1.金属元素:铁、铜、锌、锡、铝等金属元素的物理性质、化学性质、应用等;2.非金属元素:氢、氧、氮、碳、硫、磷等非金属元素的物理性质、化学性质、应用等;3.元素周期表:元素的周期规律、周期表的各种分类和用途等;4.难溶于水的元素:炭、硫、硅、铝等元素的溶解性和存在形式等;5.稀有元素:稀有气体、稀土元素、过渡金属等的特性、应用等。
三、化合物的性质与应用1.无机化合物:氧化物、酸、碱、盐等无机化合物的命名规则、性质和应用等;2.配合物:配合物的结构、性质和应用等;3.有机化合物:碳氢化合物、醇、醚、酮、酸、酯等有机化合物的命名规则、性质和应用等;4.聚合物:聚合物的结构、性质和应用等。
四、化学反应1.化学反应类型:化合反应、分解反应、置换反应、还原反应等反应类型的定义及示例;2.化学反应的平衡:化学反应速度、化学平衡常数、平衡常数的计算等;3.化学反应的能量变化:焓变、放热反应、吸热反应等。
五、化学方程式的平衡与计算1.化学方程式的平衡法则:平衡方程式的给定条件、平衡常数的计算、平衡位置的调节等;2.化学方程式的配平方法:试错法、代数法等;3.化学方程式的计算:质量计算、体积计算、摩尔计算等。
六、化学分析方法1.酸碱中和滴定:滴定的概念、滴定反应方程式、滴定的终点判定等;2.氧化还原滴定:氧化还原滴定的概念、滴定反应方程式、滴定的终点判定等;3.光度法:光度法的原理、操作和应用等;4.色谱法:气相色谱法、液相色谱法等的原理和应用等。
高中化学元素知识点
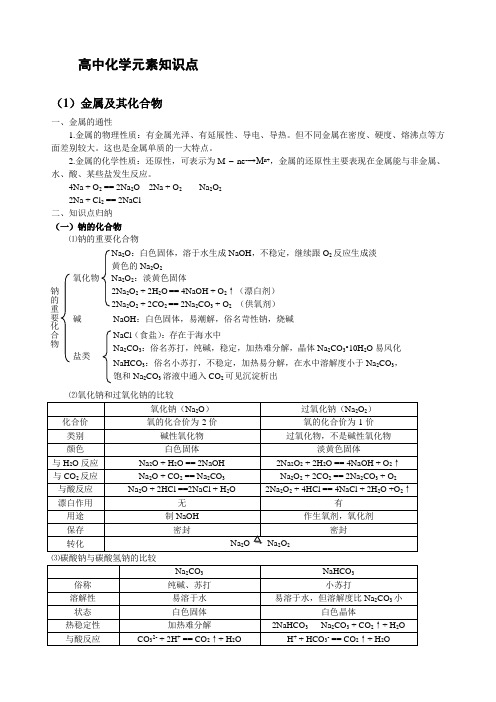
高中化学元素知识点(1)金属及其化合物一、金属的通性1.金属的物理性质:有金属光泽、有延展性、导电、导热。
但不同金属在密度、硬度、熔沸点等方面差别较大。
这也是金属单质的一大特点。
2.金属的化学性质:还原性,可表示为M – ne -→M n+,金属的还原性主要表现在金属能与非金属、水、酸、某些盐发生反应。
4Na + O 2 == 2Na 2O 2Na + O 2 Na 2O 2 2Na + Cl 2 == 2NaCl 二、知识点归纳 (一)钠的化合物 ⑴钠的重要化合物氧化钠(Na 2O ) 过氧化钠(Na 2O 2) 化合价 氧的化合价为-2价氧的化合价为-1价 类别 碱性氧化物 过氧化物,不是碱性氧化物颜色 白色固体 淡黄色固体与H 2O 反应 Na 2O + H 2O == 2NaOH 2Na 2O 2 + 2H 2O == 4NaOH + O 2↑ 与CO 2反应 Na 2O + CO 2 == Na 2CO 3 Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2 与酸反应 Na 2O + 2HCl ==2NaCl + H 2O2Na 2O 2 + 4HCl == 4NaCl + 2H 2O +O 2↑漂白作用 无 有用途 制NaOH 作生氧剂,氧化剂保存 密封密封转化Na 2O → Na 2O 2Na 2CO 3 NaHCO 3 俗称 纯碱、苏打 小苏打溶解性 易溶于水 易溶于水,但溶解度比Na 2CO 3小状态 白色固体 白色晶体热稳定性 加热难分解2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O与酸反应CO 32- + 2H + == CO 2↑+ H 2OH + + HCO 3- == CO 2↑+ H 2O钠的重要化合物氧化物 Na 2O :白色固体,溶于水生成NaOH ,不稳定,继续跟O 2反应生成淡黄色的Na 2O 2Na 2O 2:淡黄色固体 2Na 2O 2 + 2H 2O == 4NaOH + O 2↑(漂白剂) 2Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2 (供氧剂) 碱NaOH :白色固体,易潮解,俗名苛性钠,烧碱 盐类 NaCl (食盐):存在于海水中 Na 2CO 3:俗名苏打,纯碱,稳定,加热难分解,晶体Na 2CO 3•10H 2O 易风化NaHCO 3:俗名小苏打,不稳定,加热易分解,在水中溶解度小于Na 2CO 3,饱和Na 2CO 3溶液中通入CO 2可见沉淀析出与CaCl 2反应 Ca 2+ + CO 32- == CaCO 3↓不反应与NaOH 反应 不反应HCO 3- + OH - == CO 32- + H 2O 与Ca(OH)2反应Ca2++ CO 32- == CaCO 3↓2HCO 3-(过量)+ 2OH - + Ca 2+ == CO 32- +2H 2O + CaCO 3↓相互转化CO 32- + CO 2 + H 2O == 2HCO 3- NaHCO 3 + NaOH == Na 2CO 3 + H 2O 2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O(二) 铝及其重要化合物的性质⑴ 位置和原子结构示意图: 第3周期 第ⅢA 族。
高中化学必背知识点归纳与总结5篇

高中化学必背知识点归纳与总结5篇第1篇示例:高中化学必背知识点归纳与总结1. 元素和化合物(1)元素:元素是由具有相同原子核电荷数目的原子组成的,是化学中最基本的物质,例如氧、氢、铜等。
元素的周期表是化学中最基本的分类方法,根据元素的性质和原子结构进行分类。
(2)化合物:化合物是由两种或两种以上不同元素按照固定的比例结合而成的物质,如水(H2O)、氨(NH3)、二氧化碳(CO2)等。
化合物的命名和化学式是化学学习的基础,需要掌握常见的离子和分子式。
2. 化学反应(1)化学反应类型:化学反应包括合成反应、分解反应、单质燃烧反应、置换反应等。
对于不同类型的反应,需要了解其特点和示例,并能够进行化学方程式的平衡。
(2)化学方程式:化学方程式是描述化学反应过程的符号表示,包括反应物、生成物和反应条件等内容。
掌握化学方程式的书写、平衡和解读是化学学习的基础。
3. 化学键和分子结构(1)化学键:化学键是原子之间通过电子互相吸引而形成的强力联系,分为共价键、离子键和金属键等。
化学键的形成和特点对物质的性质和化学反应有重要影响。
(2)分子结构:分子是由不同原子通过共价键结合而成的物质单位。
分子的结构决定其性质和化学反应方式,需要掌握分子的几何构型和键角度等内容。
(1)化学反应速率:化学反应速率是反应物消耗或生成物产生的速度,受多种因素影响,如浓度、温度、催化剂等。
了解化学反应速率的计算方法和影响因素对实验和应用具有重要意义。
(2)化学平衡:化学平衡是指在一定条件下,反应物与生成物的浓度达到稳定状态,反应速率相等。
化学平衡常用平衡常数和Le Chatelier原理来解释和预测反应的变化。
5. 酸碱理论和溶液平衡(1)酸碱理论:酸碱理论包括布朗斯特德酸碱理论、阿伦尼乌斯酸碱理论等,用于描述和解释酸碱反应的性质和规律。
了解酸碱指示剂、pH值等相关知识对于理解溶液平衡具有重要意义。
(2)溶液平衡:溶液平衡是指在溶液中溶质和溶剂之间的平衡状态,包括饱和溶解度、离子平衡等内容。
高中化学的归纳无机化学中的常见元素和化合物总结

高中化学的归纳无机化学中的常见元素和化合物总结在高中化学学习中,无机化学是一个重要的部分。
它研究无机物质,即不含碳氢键的物质。
在无机化学中,有一些常见的元素和化合物是我们必须熟悉的。
本文将对这些常见的元素和化合物进行总结。
一、常见元素1. 氢(H):氢是宇宙中最常见的元素之一,也是化学元素周期表中的第一个元素。
氢气是无色、无臭的气体,它广泛应用于工业生产、能源储存等方面。
2. 氧(O):氧气是一种重要的气体,占地球大气中的一部分。
它是许多物质的成分之一,如水(H2O),氧化剂等。
3. 氮(N):氮气是空气中的主要成分之一,占据78%的比例。
在化学中,氮还常以氨(NH3)和硝酸(HNO3)等形式存在。
4. 碳(C):碳是有机化合物的基础,其化学性质独特而复杂。
它在地球上的许多物质中广泛存在,如燃料、矿石等。
5. 铁(Fe):铁是一种重要的金属元素,具有良好的导电性和导热性。
它广泛应用于建筑、制造业等领域。
6. 铜(Cu):铜是一种有色金属,具有良好的导电性和导热性。
它广泛应用于电子、通信等领域。
7. 锌(Zn):锌是一种重要的金属元素,它具有耐腐蚀性和导电性。
它在镀锌、防护等方面有广泛应用。
8. 氯(Cl):氯是一种具有腐蚀性的非金属元素,常以氯化钠(NaCl)等形式存在。
它在消毒、净化水等方面有重要作用。
二、常见化合物1. 水(H2O):水是无机化合物中最常见的化合物之一,它由氢和氧元素组成。
水广泛存在于地球上的海洋、河流、湖泊等自然水体中,也是生物体内重要的成分。
2. 盐(NaCl):盐是由钠和氯元素组成的无机化合物,常见的食盐就是氯化钠。
盐在食品调味、融化冰雪等方面有广泛应用。
3. 二氧化碳(CO2):二氧化碳是一种重要的气体,在大气中占据一定比例。
它参与植物的光合作用,同时也是人类活动中产生的主要温室气体。
4. 硝酸(HNO3):硝酸是一种无机酸,它是一种强氧化剂,常用于制造肥料、爆炸物等。
高中化学知识点元素化合物

元素化合物元素化合物这部分知识在中考试题中,占的比重最大,这部分知识具有易懂、好学、难记、难用等特点。
这部分主要是从物质的结构、性质、制法、用途、检验等方面来介绍每一种物质和每一类物质,相互间是一个有机的整体,因此复习思路如下:主要抓住“性质”这个核心,把握内在的联系,就可以更全面、深入、清晰地认识物质。
复习这部分知识首先最好是找出分散在各章节中的重要代表物及其重要知识点(见下),跳出章节的限制,将他们的知识点尽可能连成串,让知识系统化(重点要落实物质的名称、俗名、化学式、物质的性质和用途),可以采用列表对比法(如CO和CO2,H2、CO和CH4)、口诀记忆法(如酸碱盐的溶解性规律)、归类记忆法(常见物质的颜色、状态)、知识网络图等。
另外,要注意总结和归纳物质化学反应的规律,并运用这些规律解决综合性的问题。
这部分重要的知识有:1.熟练掌握元素符号2.熟记元素及原子团的化合价口诀3.熟记酸、碱、盐的溶解性表4.熟记有特征颜色的物质5.熟记在同一溶液中不能共存的离子6.金属活动性顺序的应用7.复分解反应发生的条件8.单质、氧化物、酸、碱、盐的相互反应关系图(六圈图)9.连续反应关系(1)Ca系列:Ca→CaO→Ca(OH)2→CaCO3→CaO(2)C系列:C→CO2→H2CO3→Na2CO3→CO2(3)Cu系列:Cu→CuO→CuCl2→Cu(OH)2→CuSO4→Cu (4)Fe系列:考试层次要求和考试内容(据中考考试说明)1.初步了解的知识①空气、水的污染与防治;②灭火器简介;③水的物理性质;④铁的物理性质;⑤浓硫酸的性质;⑥甲醇、醋酸、煤和石油、能源;⑦生铁和钢;⑧硝酸。
2.了解的知识①空气的成分与水的物理性质和组成;②O2、CO2的物理性质及用途;③O2的工业制法;④C、CO的化学性质;⑤石灰和石灰石的用途;⑥甲烷、酒精的性质和用途;⑦酸、碱的通性;⑧常见盐的性质和用途;⑨化学肥料的特性和种类。
高中化学金属及其化合物知识点

高中化学金属及其化合物知识点金属及其化合物是高中化学重要的知识点,也是高中无机化学考试中的高频考点,我们要做好针对性的复习。
接下来店铺为你整理了高中化学金属及其化合物知识点,一起来看看吧。
高中化学金属及其化合物知识点1(1).钠、铝、铁、铜在自然界中的存在形式。
①.钠铝只以化合态形式存在:钠元素的主要存在形式是氯化钠,铝元素的存在形式有铝土矿。
②.铁铜有两种存在形式:铁的存在形式是游离态的陨铁和化合态的铁矿石(黄铁矿、赤铁矿、磁铁矿),铜的存在形式是游离态的铜和黄铜矿、辉铜矿、赤铜矿和孔雀石。
(2)钠、铝、铁、铜单质的物理性质①.颜色:块状钠铝铁单质是银白色金属,纯铜是紫红色金属;粉末状的铝和铜颜色不变,粉末状的铁屑是黑色,没有粉末状的钠,钠在空气中马上氧化成白色的氧化钠,最终氧化成碳酸钠;冶金工业中铁属于黑色金属,钠、铝、铜属于有色金属。
②.密度:钠的密度比水小,铝、铁、铜的密度比水大;钠、铝的密度小于4.5g/cm3是轻金属,铁、铜的密度大于4.5g/cm3是重金属。
③.熔点:钠的熔点低,钠与水反应产生的热量就可以使其熔化成小球;铝、铁、铜的熔点很高。
④.共性:不透明,有导电性、导热性、延展性;钠钾合金做原子反应堆的导热剂;铝、铁、铜可以做导线,金属的导电性:Ag>Cu>Al ;铝的延展性可以制成包装用的铝箔;铝、铁、铜可以制成各种容器等。
⑤.硬度:钠的硬度很小,可以用小刀切割;纯铝的硬度较小,铁和铜的硬度较大。
⑥.特性:铁可以被磁化,而产生铁磁性。
(3)钠、铝、铁、铜的重要化合物的物理性质①.氧化物的颜色:白色:Na2O 、Al2O3;黑色:FeO 、Fe3O4 、CuO;淡黄色:Na2O2;红棕色:Fe2O3。
②.氧化物的溶解性:Na2O 、Na2O2溶于水生成强碱发生化学变化;Al2O3 、FeO 、Fe2O3 、Fe3O4 、CuO不溶水。
③.氢氧化物的颜色:白色:NaOH 、Al(OH)3、Fe(OH)2;红褐色:Fe(OH)3;蓝色:Cu(OH)2 。
高中化学元素及其化合物知识点总结

高中化学元素及其化合物知识点总结化学元素是构成普遍物质的基本单位,化合物则是由不同元素组成的物质。
化学元素及其化合物对于化学学科具有重要意义,下面是高中化学元素及其化合物的知识点总结。
1. 周期表中的元素周期表是元素分类的基准,其中每一个元素都有自己的原子序数和化学性质。
主要的周期表分为长周期和短周期,长周期中的元素具有更多的能层,而短周期则少得多。
周期表中每个元素的位置可以提供信息,例如元素类别、原子半径和化学性质等等。
2. 元素符号和元素的命名元素符号是元素名称的缩写,通过字符的组合表示元素的特定种类。
元素的命名是根据元素符号、所属类别和原子序数等信息确定的。
例如,纯碱金属钠的符号为Na,最易失去电子的金属钾的符号为K。
3. 离子和离子的确定离子是由正离子和负离子组成的带电粒子。
离子的类型可以根据离子的带电量和元素符号得出。
例如,氯离子可以写成Cl+和Cl-,钙离子可以写成Ca2+。
4. 化合物和化学式化合物是由不同元素组成的物质,而化学式是用符号和数字表示化合物的化学组成,包括分子式、离子式和元素式等多种形式。
5. 密度和物质量密度是物质量和体积的比值,体积可以通过测量量取得,而物质量需要进行称量得出。
密度通常通过单位质量在单位体积内的分布情况计算得出。
6. 原子结构原子由质子、中子和电子组成。
质子具有正电荷,中子带中性,而电子则具有负电荷。
原子结构的核心是由质子和中子组成的,而电子围绕核心旋转以形成原子外层的空间。
元素和化合物的化学性质受到其原子和化学键强度之间相互作用的影响。
原子的化学活性可以由原子序数来预测,而化合物的物理和化学性质则由其化学键类型和键能量来控制。
8. 离子键和共价键离子键是由一个正离子和一个负离子组成的离子组成物,而共价键是由原子间的共享电子对形成的键。
9. 键能键能是指分子或离子的稳定性和化学性质的函数。
化学键的能量取决于原子的电性差异、电子轨道重叠和化学键的方向性,这些都可以影响键强度和稳定性。
