高中化学新教材必修二课件讲义 (1)
人教版高中化学必修二第一章第三节《化学键》课件(共38张PPT)
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
高中化学必修二PPT课件(9份打包) 人教课标版1

化学反应与能量
第二节
化学能与电能
病例分析
你能为她开一个药方吗?
能源
一次能源:直接从自然界取得的 能源。 二次能源:一次能源经过加工、 转换得到的能源。
一次能源:
水能
风能
石油
原煤 二次能源:
天然气
电能
蒸汽
电能(电力):二次能源
一、化学能与电能的相互转化 1,火力发电原理及过程
燃烧
4、考虑氧化反应和还原反应发生的条件和环境, 化学物质的选择。
5、从电学角度考虑仪器选择和组装问题。
【实验一】 分别把锌片和铜片插入到稀H2SO4中, 观察现象。
锌片上有气泡,铜片上没有气泡
Zn+ 2H+ = Zn2+ + H2↑
【实验二】
再用导线把锌片和铜片连接起来,观察 铜片上有无气泡产生? 在导线中间接入一个电流表, 观察电流表的指针是否偏转?
A 正极 负极 Zn Cu B Ag Cu C Cu Zn D Cu Zn
电解质溶液
CuCl2
H2SO4
CuSO4
FeCl2
例5 请根据反应: 2Fe3+ + Fe = 3 设计原电池,你有哪些可行方案?
Fe 2+
Fe-Cu
Fe-C
FeCl3
Fe(NO3)3
Fe-Ag
Fe2(SO4)3
根据反应设计原电池,你有哪些可行方案?
化学能
热能
蒸汽
机械能
发电机
电能
a.我国煤炭资源丰富,廉价方便.
b.电能清洁安全,又快捷方便.
a.排出大量的温室效应气体. b.有废气可能导致酸雨 c.废料废水
人教版高中化学必修二第二章第一节《 化学能与热能》课件(共15张PPT)

旧化学键 断裂
吸收 能量 (吸 热Q1) 反应物
化学反应
新化学键 形成
放出 能量E2 (放 热Q2)
生成物
当Q1<Q2 为放出能量(放热反应) 当Q1>Q2 为吸收能量(吸热反应)
任务2 宏观角度
课本《思考与交流》P33 化学反应不仅有新物质生成,而且还伴随着能量的变化
任务2 宏观角度
课本《思考与交流》P33 化学反应不仅有新物质生成,而且还伴随着能量的变化
点燃
化学反应 H2 + Cl2 == 2HCl
化学键
H—H
断 裂
吸 收 能
量
Cl —Cl
断 裂
吸 收 能
量
H—Cl
形 成
放 出 能
量
·· ··
电子式
H· +
·C····l: →
H
C··l ··
化学反应的实质:旧化学键断裂和新化学键形成。
化学反应中能量变化的主要原因:化学键的断裂和形成。
化学键的断裂与形成(微观角度)
第一节 化学能与热能
课前预习 (电子书包“互动论坛”)
1、煤、石油和天然气等化石燃料的燃烧所产生 的能量以什么形式呈现?从何而来?
2、石灰石经高温煅烧生成生石灰,高温提供的 热能在分解反应中起什么作用?
任务1 微观角度
看电子书包“学习资源”:《 氢气和氯气反应中能 量变化动态演示》 1、从化学键的观点分析,化学反应的本质是什么?
放出能量
生成物总能量
反应过程
生成物总能量
吸收 能量
反应物总能量
反应过程
小结
(1)宏观:化学反应中,化学反应中 能量变化主要取决于反应物的总能量 和生成物的总能量的相对大小。
高中化学必修二课件-1.1元素周期表26-人教版

①③原阴子离的子电的子电式子:式
②阳离子的电子式:
:④离子化合物由的阴电、子阳式离:子的电子式组成。同性不相邻,离子合理分布,
相同离子不能合并。主要有AB型、A2B型、AB2型、A2B2型等。例如: NaCl、MgCl2、CaF2、Na2O、NaOH、 Na2O2等。
第三节 化学键
一、离子键 1、离子键:(1)—(7)
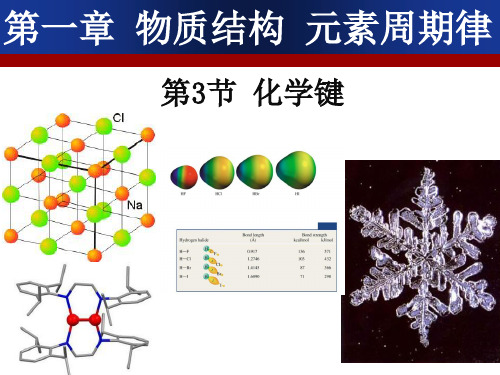
NaCl的微观形成过程和微观分析
e-
第三节 化学键
一、离子键
1、离子键 (1)形成原过子程得:、失电子形成阴、阳离子,阴、阳离子接近至一定距离时,
静电引力与斥力达到平衡,形成了离子键。
(2)离子键的定义:
使阴阳离子形成化合物时的静电的作用叫离子键 。
【思考】1、形成离子键的微粒是什么? 阴、阳离子
质量守恒定律,该式反映了化学反应的本质,既有新的化学键形成。
【学生活动】用电子式分别表示MgO、KF、MgCl2、K2S的形成过程(练习书写并分 组讨论,相互对照并纠错)
第三节 化学键
一、离子键 1、离子键:(1)—(7)
2、离子化合物: (1)—(2) 3、电子式及其应用
【学生活动】 自主学习:对照《新教材新学案》, 明确学习任务,探究、分析、讨论、 总结电子式的相关知识点。
元素周期表
问题导学
从元素周期表我们可以看出,到目前为止,已经发现了一百 多种元素,由这一百多种元素的原子组成了成千上万种物质。 【设问】1、物质是由哪些微粒构成的呢?
分子、原子或离子 2、元素的原子是通过什么作用相互结合构成物质的呢? 通过某种力的作用相互结合构成物质。这就是化学键,把这 种原子间的强烈的相互作用,叫做化学键。
号[ ]括起来,并在右上角标出正电荷数(n+)。例如:NH4+(有配位键) 。
人教版高中化学必修二课件化学能与热能(1)
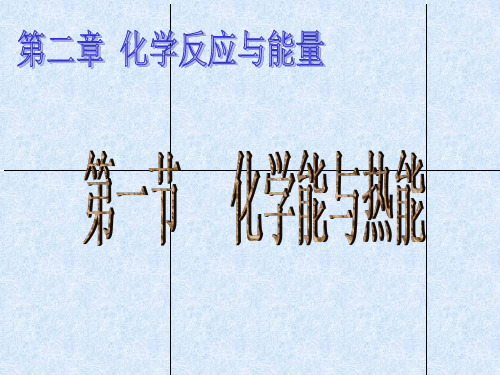
N- H H-I
H-Cl
键能越大
化学键越牢固
含该键的分子越稳定
课堂练习一
在反应H2 + Cl2 =2HCl中,已知 H-H 键能为436kJ,Cl-Cl键能为247kJ, H-Cl键能为431kJ,判断该反应是 放热 反应
• 则(1)化学键断裂时需要吸收能量。吸收总能量为: 436kJ+247kJ=683 kJ, • (2)化学键形成时需要释放能量。释放总能量为: 431kJ+431kJ=862 kJ, • (3)反应中放出的热量的计算: • 862kJ—683kJ=179kJ
E(反应物)-E(生成物)=Q
Q>0为放热反应 Q<0为吸热反应
二、化学能与热能的相互转化
1、两条基本的自然定律
(1)质量守恒定律: (2)能量守恒定律:一种能量可以转化为另一种能量,
(1)放热反应 (2)吸热反应
2、吸热反应和放热反应
总能量保持不变。
小结:
根据能量变化情况角度分: (1)化学上把有热量放出的化学反应叫做放热反应
H—H
断 开
+
断 开
Cl2
Cl —Cl
= 2HCl
形 成
· · · · : · Cl H· + · · → H Cl · ·
· ·
一个化学反应的的过程,本质上就 是旧化学键断裂和新化学键形成的过 程。
· ·
⑵、化学反应中能量变化的主要原因
点燃
H2
H—H
断 开 吸 收 能 量
+
断 开
Cl2
Cl —Cl
2、两位同学讨论放热和吸热反应。甲说加热后才能 发生的化学反应是吸热反应,乙说反应中要持续加热 才能进行的反应是吸热反应。你认为他们的说法正确 吗?为什么?
人教版高中化学必修二课件第一章第二节第1课时原子核外电子的排布

解析:K层即是第一层,只有1个电子的是氢原子,A项 正确;原子M层上有电子,说明L层已排满8个电子,此时M 层上电子数为L层的4倍,为32个,与最多有2n2即18个相矛 盾,B项错误;M层、L层上的电子数均为K层上的4倍,即 为“2、8、8”电子排布,则S2-、Cl-、K+、Ca2+均满足, C项正确;氢原子的核电荷数与最外层电子数相等,D项正 确。
名师点睛:判断10电子微粒的方法:
10电子微粒是高考的热点,因此高一就要夯实基础,但 死记硬背不利于知识的灵活应用。以下是快速确定10电子微 粒的有效方法。
(1)
(2)H+电子数为零,故与其他粒子结合,原粒子的电子 数不增也不减。则:
变式应用 2.下列微粒中,核外电子数相同的是( )
解析:F-中含10个e-,Na+中含10个e-,Ne中含10个e -,K+中含18个e-,⑤为Mg2+,含10个e-。故①②③⑤中 电子数相同。
(7)电子层数和最外层电子数相等的原子是H、Be、Al。 (8)电子层数是最外层电子数2倍的原子是Li、Ca。 (9)最外层电子数是电子层数2倍的原子是He、C、S。 (10)最外层电子数是电子层数3倍的原子是O。
变式应用
1.已知A、B、C三种元素的原子中,质子数为A<B< C,且都小于18,A元素的原子最外层电子数是次外层电子 数的2倍;B元素的原子核外M层电子数是L层电子数的一半; C元素的原子次外层电子数比最外层电子数多1个。试推断:
3.下列各原子结构示意图中所表示的核外电子排布正确的 是( ) C
一、原子核外电子排布规律 (2011年山东临沂模拟)下列说法中肯定错误的是( ) A.某原子K层上只有一个电子 B.某原子M层上电子数为L层上电子数的4倍 C.某离子M层上和L层上的电子数均为K层的4倍 D.某原子的核电荷数与最外层电子数相等
人教版高中化学必修二第一章第一节 《元素周期表 》课件(共15张PPT)

B.原子的核外电子数
C.原子核内的质子数
√D.原子的中子数
1.原子序数为 x 的元素位于第IA族,那么原子序 数为 x+2 的元素肯定不会在( )
√ A.第 IA 族 B.第ⅢB族 C.第ⅢA族 D.0族
【提示】若x为氢元素,则A正确;若x为锂或钠, 则C正确;若x在第4、5、6、7周期,则B项正确。 故答案为D。
3.第ⅠA族和0族元素的原子序数
4.每周期元素的种数
一、元素周期表的结构 “三短”“四长”;“七主”“七副”“0族和Ⅷ族” 二、元素原子结构与其在周期表中位置的关系.
周期序数=电子层数 主族序数=最外层电子数
原子序数
核外电子排布
周期表中位置
1.不能作为元素周期表中元素排列顺序的依据是
A.原子的核电荷数
螺旋式元素周期表
金字塔式元素周期表
1869年,俄国化学家门捷列夫将 元素按照相对原子质量由小到大 依次排列,制出了第一张元素周 期表,这就是现代元素周期表的 雏形。
第一章 物质结构 元素周期律
第一节 元素周期表
【思考与交流】
周期表的结构
阅读教材P4、5页并结合周期表,讨论以下问题
1.元素周期表的编排原则是什么?周期表有多 少横行,多少纵行,多少族?
A.若X是氢,则Y是氦
√C.若X是氟,则W是硫
B.若Y是氦,则Z是钠 D.若Y是氟,则Z是铝
例.已知某主族元素的原子结构示意图如下,判断 其位于第几周期,第几族?
【提示】X为第4周期,第ⅠA族;Y为第5周期,第 ⅦA族。
【记一记】
周期表的结构
1.原子序数=核电荷数=质子数=核外电子数
2.周期序数=电子层数 主族序数=最外层电子数
2020-2021学年高中化学新鲁科版必修第二册 第1章第1节原子结构与元素性质第2课时课件

关键能力·合作学习
知识点一 核外电子排布规律 1.核外电子排布规律解读 (1)“一低” 电子首先排布在能量最低的电子层里。排满能量低的电子层,再排能量高的电 子层。 (2)“两不超” 各电子层电子不超过2n2个;最外层电子不超过8个(第一层为最外层时不超过2 个)。
2.核外电子排布的表示方法 (1)原子结构示意图:为了形象表示原子核外电子分层排布的情况而采用的直观 图示。如氯原子结构示意图为
【母题追问】(1)X元素的原子最外层电子数是次外层电子数的2倍,则该元素的 原子核内质子数是多少? 提示:K层为次外层时,X元素的原子最外层电子数为2×2=4<8;L层为次外层时,X元 素的原子最外层电子数为8×2=16>8,不可能,故X元素的原子核外电子数为2+4=6, 即质子数为6。
(2)当第n电子层作为原子的最外层时,其最多容纳的电子数与(n-1)层相同;当第 n电子层作为原子的次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数 多10个。则n层是K层~N层中的哪一层? 提示:根据核外电子排布规律可知,当n为最外层时,最多可容纳8个电子,则第(n1)层最多也可容纳8个电子,故(n-1)层为次外层时,n层应为M层;当n层为次外层 时,其最多可容纳的电子数比(n-1)层多10个,则证明n层最多可容纳18个电子,也 应为M层。
原子类别 稀有气体
金属元素 原子
非金属 元素原子
与元素性质的关系 最外层电子数为8(He为2), 结构稳定,性质不活泼
最外层电子数一般小于4, 较易失去电子
最外层电子数一般大于或 等于4,较易获得电子,形成 8电子稳定结构
与元素化合价的关系
原子结构为稳定结构,常见 化合价为零
易失去最外层电子,达到 稳定结构,其最高正价为 +m(m为最外层电子数)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
章末检测试卷(一)(时间:90分钟满分:100分)一、选择题(本题包括20小题,每小题3分,共60分,每小题只有一个选项符合题意)1.光导纤维的应用使人们可以在家中坐享“互联网+”带来的变革与实惠,下列物质中可以用来生产光导纤维的是()A.钛合金B.二氧化硅C.晶体硅D.氧化铝答案B解析制造光导纤维的主要原料是二氧化硅。
2.(2015·全国卷Ⅰ,7)我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛。
”这里的“强水”是指()A.氨水B.硝酸C.醋D.卤水答案B解析根据所给四种物质的氧化性的强弱可判断,硝酸具有强氧化性,可溶解大部分金属,“强水”为硝酸。
3.德国科学家曾利用卫星数据和一种先进的仪器,绘制了一幅地球上空二氧化氮的分布图。
从科学家绘制的二氧化氮分布图来看,欧洲和北美洲的一些经济比较发达,注重环保的大城市上空二氧化氮密度很高。
其原因是这些地区的()A.硝酸工业发达B.雷雨天气较多C.机动车辆过多D.燃料以煤为主答案C解析二氧化氮的产生主要原因是硝酸工业发达、雷雨天气较多、机动车辆过多,燃料以煤为主的后果是二氧化碳导致温室效应加剧、生成的二氧化硫导致酸雨,结合题给信息欧洲与北美洲的经济比较发达,注重环保,可知原因是机动车辆过多。
4.氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。
下列叙述与氮元素的循环无关的是()A.工业合成氨的过程是固氮的过程B.自然界中,氨是动物体特别是蛋白质腐败后的产物C.为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气D.在电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收答案C解析将游离态氮转化为化合态氮的过程称为氮的固定,工业上合成氨的过程是将游离态的氮转化为化合态的氮,属于固氮过程,符合氮的循环;自然界中,蛋白质腐败后生成氨,符合氮的循环;用氮气做保护气,讲的是氮气的用途,而不是氮的循环过程,所以不符合氮的循环;在电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收,符合氮的循环。
5.宇宙飞船的运载火箭的推进器引燃后发生剧烈反应,产生大量高温气体,从火箭尾部喷出。
引燃后的高温气体成分有CO2、H2O、N2、NO等,这些气体均无色,但在卫星发射现场看到火箭喷射出大量的红烟,产生红烟的原因是()A.高温下N2遇空气生成NO2B.NO遇空气反应生成NO2C.CO2与NO反应生成NO2D.NO与H2O反应生成NO2答案B解析根据原高温气体均为无色,但现场却能看到红烟可推知,是因为发生反应:2NO+O2===2NO2。
6.(2019·南京高一下学期开学考试)下列有关硅的说法不正确的是()A.硅是人类将太阳能转换为电能的常用材料B.硅的导电性介于金属和绝缘体之间,是良好的半导体材料C.硅的化学性质不活泼,常温下不与任何物质反应D.加热到一定程度时,硅能与氯气、氧气等非金属反应答案C解析A项,晶体硅常用作制造太阳能电池的材料,实现太阳能转化成电能,正确;B项,硅的导电性介于金属和绝缘体之间,是良好的半导体材料,正确;C项,硅的化学性质不活泼,在常温下能与F2、HF等物质发生反应,错误;D项,在加热条件下,硅单质能与氯气、氧气等物质发生反应,正确。
7.早在古代,我国人民就积累了不少对化学物质变化的认识。
例如,晋代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”。
这句话中的丹砂指的是HgS,下列有关说法正确的是()A.这个过程只涉及物理变化△Hg+SB.“积变又还成丹砂”过程中发生反应:HgS=====C.实验室中不慎洒落的水银不能用硫黄处理D.“丹砂烧之成水银”过程中还可能产生SO2答案D解析A项,题述过程中涉及HgS的分解和生成,为化学变化,错误;B项,“积变又还成丹砂”过程中发生反应:Hg +S===HgS ,错误;C 项,由反应Hg +S===HgS 可知,实验室中不慎洒落的水银可用硫黄处理,错误;D 项,“丹砂烧之成水银”过程中发生反应:HgS=====△Hg +S ,分解生成的S 可能燃烧生成SO 2,正确。
8.(2019·黑龙江双鸭山第一中学月考)下列说法不正确的是()A.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO 3)2固体,铜粉仍不溶解B.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性C.铜与稀硝酸反应的离子方程式为3Cu +8H ++2NO -3===3Cu 2++2NO ↑+4H 2OD.HNO 3―→NO ―→NO 2,以上各步变化均能通过一步实验完成答案A解析在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO 3)2固体,铜粉溶解,离子方程式为3Cu +8H ++2NO -3===3Cu 2++2NO ↑+4H 2O ,故A 错误;能使湿润的红色石蕊试纸变蓝的气体一定是氨气,故B 正确;铜与稀硝酸反应的离子方程式为3Cu +8H ++2NO -3===3Cu 2++2NO ↑+4H 2O ,故C 正确;HNO 3――→Cu NO ――→O 2NO 2,故D 正确。
9.(2018·玉溪市红塔区高一期末)下列推断正确的是()A.Na 2O 、Na 2O 2组成元素相同,与CO 2反应产物也相同B.SiO 2、SO 2均是酸性氧化物,都能与NaOH 溶液反应C.NO 2、CO 、NO 都是大气污染气体,在空气中都能稳定存在D.氢氧化钠溶液、纯碱溶液要存放在带磨砂玻璃塞的试剂瓶中答案B解析Na 2O 和Na 2O 2组成元素相同,与CO 2反应产物不同,后者产生氧气前者没有,选项A错误;SiO 2和CO 2都能够与NaOH 溶液反应,且都只生成盐和水,选项B 正确;CO 、NO 、NO 2都是大气污染气体,一氧化氮易与氧气反应生成二氧化氮,在空气中不能稳定存在,选项C 错误;氢氧化钠、纯碱溶液都属于碱性溶液,能够与二氧化硅反应,保存时不能使用玻璃塞,可以使用橡胶塞,选项D 错误。
10.用下列两种途径制取H 2SO 4(某些反应条件和产物已省略),下列有关说法不正确的是()途径①:S ――→浓硝酸H 2SO 4途径②:S ――→O 2SO 2――→O 2SO 3――→H 2OH 2SO 4A.途径①中反应仅体现了浓硝酸的强氧化性B.途径②中可通过控制反应条件,将S 直接氧化为SO 3C.由途径①和②分别制取1mol H 2SO 4,理论上均消耗1mol S ,均共转移6mol 电子D.途径②相较于途径①更能体现“绿色化学”的理念,因为途径②的污染相对于途径①更小答案B解析途径①中反应的化学方程式为S +6HNO 3(浓)=====△H 2SO 4+6NO 2↑+2H 2O ,属于浓硝酸和非金属单质的反应,产物中无盐生成,因此浓硝酸只表现氧化性而不表现酸性,A 项正确;途径②中无论反应条件如何变化,S 均被O 2先氧化为SO 2,再氧化为SO 3,B 项错误;由关系式S ~H 2SO 4~6e -可知,C 项正确;途径①中有副产物NO 2生成,污染环境,D 项正确。
11.如下为火山喷发时硫元素的转化示意图,其中甲、乙在常温下均为气体,丙为液体,丁为固体。
下列关于甲、乙、丙、丁的判断不正确的是()A.甲只具有还原性B.乙、丙均为酸性氧化物C.乙既有氧化性,又有还原性D.丁为黄色或淡黄色固体答案A解析甲、乙、丙、丁分别为H 2S 、SO 2、SO 3、S 。
H 2S 中-2价的S 只有还原性,但其中的H 为+1价,具有氧化性,如H 2S 与活泼金属反应可表现出氧化性,A 项错误;SO 2中的S 为+4价,处于S 的中间价态,C 项正确;单质S 为黄色或淡黄色固体,D 项正确。
12.已知X 、Y 、Z 、W(含同一种元素)之间的转化关系为X ――→O 2Y ――→O 2Z ――→H 2OW ,且X 能与W 发生反应生成一种易溶于水的盐,则X 可能是()A.N 2B.NO 2C.NH 3D.NO答案C解析根据题意可知X 、Y 、Z 、W 均含N 元素,由X 能与W 发生反应生成一种易溶于水的盐,知X 是NH 3,发生反应:4NH 3+5O 2=====催化剂△4NO +6H 2O,2NO +O 2===2NO 2,3NO 2+H 2O===2HNO 3+NO ,HNO 3+NH 3===NH 4NO 3。
13.(2018·江西九江一中期末)氨是一种重要的化工原料,可以制备一系列物质(如图所示)。
下列说法正确的是()A.NH 4Cl 和NaHCO 3都是常用的化肥B.NH 4Cl 、HNO 3和Na 2CO 3受热时都易分解C.NH 3和NO 2在一定条件下可发生氧化还原反应D.图中所涉及的盐类物质均可以与Ca(OH)2发生反应答案C解析NH 4Cl 是常用的化肥,而NaHCO 3是小苏打,不用作化肥,A 项错误;Na 2CO 3受热不易分解,B 项错误;图中涉及的盐类NaCl 与Ca(OH)2不反应,D 项错误;NH 3能和NO 2发生氧化还原反应生成N 2和H 2O ,化学方程式为8NH 3+6NO 2=====一定条件7N 2+12H 2O ,C 项正确。
14.化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是()A.定性检验SO 2-3,将BaCl 2溶液用稀硝酸酸化B.为提高KMnO 4溶液的氧化能力,用盐酸将KMnO 4溶液酸化C.检验溶液中是否含有Fe 2+时,用稀硝酸酸化D.检验溶液中是否含有SO 2-4时,在无其他阳离子干扰的条件下,先用盐酸酸化,再向所得溶液中加BaCl 2溶液答案D解析A 项中HNO 3能将SO 2-3氧化成SO 2-4;B 项中KMnO 4能将Cl -氧化成Cl 2;C 项中HNO 3能将Fe 2+氧化成Fe 3+。
故A 、B 、C 三项的酸化方法均不正确。
15.将a mL NO 、b mL NO 2、x mL O 2混合于同一试管里,将试管口倒插于水中,充分反应后试管内气体全部消失,则用a 、b 表示的x 的代数式是()A.a +b 2B.2a +b 3C.3a +b 4D.4a +b 5答案C解析氮的氧化物与O 2和H 2O 反应生成HNO 3时,只要满足氮的氧化物中的N 失电子数和O 2中的O 得电子数相等,即可全部转化,没有气体剩余。
即:4x =3a +b ,解得x =3a +b4。
16.硝酸与金属反应后所得还原产物与硝酸的浓度和金属的活泼性有关。
10mL 0.5mol·L -1HNO 3与0.048g Mg 恰好完全反应。
