乙醇偏摩尔体积
实验2 偏摩尔体积的测定 操作步骤

实验2偏摩尔体积的测定
注意事项:
1.比重瓶需水平置于比重瓶架上,使得瓶口与水浴槽液面相其
2.保证实验过程中毛细管里始终要充满液体,如因挥发液面降低,应在毛细管上端滴加该溶液,
注意不得存留气泡。
3.比重瓶中装有液体后,避免用手握着瓶身,以免液体受热溢出,可手持瓶口处。
4.称量前一定要把比重瓶外壁用滤纸擦干,称量操作要迅速。
实验步骤
1.调节恒温槽温度为(25.0±0.1)℃。
2.给4只三角瓶编号。
用电子分析天平称重无水乙醇和蒸馏水,分别配制乙醇的质量分数为
0.20,0.40,0.60,0.80的乙醇水溶液,每份溶液的质量在15 g左右。
配完后,盖紧磨口
塞,防止挥发。
3.用电子分析天平精确称量洁净、干燥的比重瓶(m0),然后装满蒸馏水(测量温度下的密度可
查),置于恒温槽中恒温10 min。
用滤纸迅速擦去从毛细管膨胀出来的水。
取出比重瓶,擦干外壁,迅速称重(m1)。
平行测量2次。
4.按步骤3测量每份待测溶液的质量(m2),每份平行测量2次。
数据处理:
1.根据25.0 ℃时水的密度和称重结果,求出比重瓶的容积。
2.根据实验,推导出计算待测液体密度的公式,并计算实验条件下各溶液的比容。
3.用Oringin软件做比容~ 乙醇的质量分数图,并求出w2=0.30的乙醇水溶液的偏摩尔体积,
并计算100 g该溶液的总体积。
(打印比容~ 乙醇的质量分数图,手动做曲线的切线)。
乙醇水溶液偏摩尔体积的测定误差分析

乙醇水溶液偏摩尔体积的测定误差分析
乙醇水溶液偏摩尔体积的测定误差可以从以下几个方面进行分析:
1. 实验设备误差:实验设备的精度会影响到测定结果的准确性。
比如说,如果使用的烧瓶不够干净,残留液体会影响到测定结果;如果使用的量筒精度不够高,容量的误差会导致测定结果的误差。
2. 实验操作误差:实验操作技巧的熟练程度也会对测定结果的准确性产生影响。
比如说,读数不准确、换液的时机不够精准等,都会对测定结果造成误差。
3. 溶液温度误差:由于溶液的体积会随着温度的变化而变化,因此温度是影响测定结果的另一个重要因素。
为了排除温度误差的影响,测定应该在标准温度下进行,或者在实验过程中对液体温度进行实时监测。
4. 溶液浓度误差:最终偏摩尔体积的测定结果还受到溶液浓度的影响。
如果溶液的浓度不够准确,就难以测定出偏摩尔体积的准确值。
为了减少误差的影响,实验中应该尽可能地采取可行的措施来保证实验的准确性,比如对仪器的精度要求严格要求、注意操作方法等。
并在最终计算偏摩尔体积时,要对各种误差因素进行综合考虑,再进行相应的修正。
乙醇水溶液偏摩尔体积

乙醇水溶液偏摩尔体积
乙醇是一种常见的有机化合物,也是一种重要的工业原料。
乙醇在水中易溶解,形成
乙醇水溶液。
在乙醇水溶液中,乙醇分子与水分子会发生相互作用,这种相互作用会影响
溶液的性质。
乙醇水溶液的偏摩尔体积是其中一个与溶液性质相关的物理量。
偏摩尔体积是指单位摩尔物质在溶液中所占的体积,通常用 $\Delta V_{mix}$ 表示。
乙醇和水在形成乙醇水溶液时,分子间会发生相互作用,导致乙醇分子的体积变小,水分
子的体积变大,因此乙醇水溶液的偏摩尔体积与纯乙醇和纯水不同。
乙醇水溶液的偏摩尔体积可以通过实验或计算得到。
实验方法通常是在一定温度下测
量不同浓度的乙醇水溶液的密度,然后计算出偏摩尔体积。
计算方法可以利用混合物的物
态方程和偏摩尔体积的定义,通过解方程组得到。
在计算乙醇水溶液的偏摩尔体积时,需要考虑混合物的物态和溶质的相对浓度。
对于
低浓度的乙醇水溶液,偏摩尔体积随浓度的变化较小,但是随着浓度的增加,偏摩尔体积
会发生明显的变化。
当乙醇浓度超过40%时,偏摩尔体积开始呈现正值。
除了相对浓度,温度也是影响乙醇水溶液偏摩尔体积的重要因素。
通常情况下,温度
升高会使偏摩尔体积减小。
因此,在计算偏摩尔体积时需要考虑温度的影响。
乙醇水溶液的偏摩尔体积对于研究溶液的性质以及乙醇在化学反应中的作用具有重要
的意义。
比如,在测量乙醇水溶液的粘度和表面张力时,就需要考虑偏摩尔体积的影响。
此外,在研究酶催化反应等化学反应中,乙醇水溶液的偏摩尔体积也是一个重要的参量。
习题

习题解析1. 在298 K 时,有一个24H SO (B)的稀水溶液,其密度为331.060 310 kg m -⨯⋅,24H SO 的质量分数B 0.094 7w =。
已知在该温度下,纯水的密度为3997.1 kg m-⋅。
试计算24H SO 的:① 质量摩尔浓度B m ,② 物质的量浓度B c 和③ 物质的量分数B x 。
解:① 质量摩尔浓度是指,在1 kg 溶剂中含溶质的物质的量,查原子量表得24H SO 的摩尔质量1B 0.098 08 kg m ol M -=⋅。
设溶液的质量为1.0 kg ,B BB (B)/(A )(A )n m M m m m ==110.0947 1.0 kg /0.098 08 kg m ol1.067m ol kg(10.0947) 1.0 kg--⨯⋅==⋅-⨯② 物质的量浓度是指,在1 dm 3 溶液中含溶质的物质的量,设溶液质量为1 kgB BB (B)//n m M c V m ρ==(溶液)(溶液)1330.094 7 1.0 kg /0.098 08 kg m ol1.0kg /1.060 310kg m--⨯⋅=⨯⋅3331.02410m o l m1.024mo l d m --=⨯⋅=⋅ (3)设溶液质量为1.0 kg ,B B B An x n n =+1B 0.094 7 1.0 kg/0.098 08 kg m ol0.966 m ol n -=⨯⋅=1A (10.094 7) 1.0 kg/0.018 kg mol50.29 moln -=-⨯⋅=B B B A0.966 m ol 0.018 8(0.96650.29)m oln x n n ===++2.将0.6 m ol 的乙醇(B )和0.4 m ol 的水(A )混合得乙醇的水溶液,溶液的密度为3849.4 kg m -⋅。
已知溶液中乙醇的偏摩尔体积631B 57.510 m m ol V --=⨯⋅,试求溶液中水的偏摩尔体积A V 。
第4章 多组份系统热力学习题及解答

ln
1) 22
2436 (3.337 3.091) 2436 (6.428) 15660J mol1
(答:-8.13×103 J)
4-5 333.15 K 时甲醇的饱和蒸气压是 83.40 kPa,乙醇的饱和蒸气压是 47.00 kPa。 二者可形成理想液态混合物。若混合物的组成为二者的质量分数各为 50%,求 333.15 K 时平衡蒸气组成,以摩尔分数表示。 解:在 333.15K 时,设甲醇气体的摩尔分数为 yA ,则:
(2) pB pB* xB 2.93 0.4588 1.344kPa
(3) p pA pB 5.369 1.344 6.713kPa
(4) yA
pA p
5.369 6.713
0.7998 0.80 , yB
1 yA
1 0.80 0.20
(答:(1)5.36 kPa;(2)1.35 kPa;(3)6.71 kPa;(4)0.80,0.20)
解:1mol
气体
NH3 的化学势: (g)
(g,T)
RT
ln
p p
,(
p
p )
(NH3, g,T ) (NH3, g,T ) RT ln
pNH3 p
,( pNH3
p )
溶液中,溶质 NH3 的化学势:
(NH3, l,T )
(NH3, g,T )
NH3
x
A
p
* A
x
A
pB* (1 xA )
193.3 0.274
193.3 0.2740 66.6 0.726
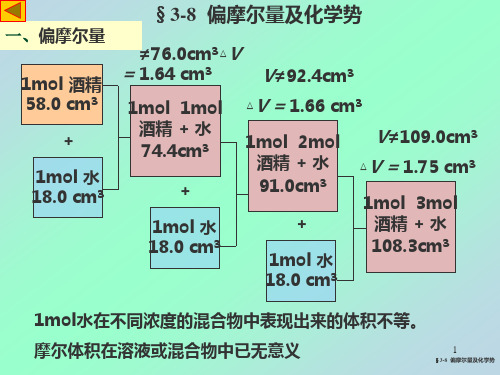
3-8偏摩尔量
3、相平衡条件
5、化学势与T、p的关系
G p
T
V
G S T p
一般
B
p
T
VB
>0
一般
B
T
p
SB
<0
dG = -SdT + Vdp 对于组成恒定的系统:
恒温时 p μB
恒压时 T μB
注意:化学势不是某种形式的能量!
例题:
化学势是一个状态函数,没有确切的物理意义。 化学势是一个表示变化方向的指标。
V GB p T ,nC
Bp
G nB
T
,
p
,nAB
T
,nA
nB
G p
T
,nA
V
nB
T , p ,nAB
T , p ,nAB
VB
10
4. 偏摩尔量之间 的函数关系
二、 化学势
1、化学势的定义
B
def
GB
G nB
T ,P ,n(C,CB)
G=f (T,p,nA,nB……)
对多组分系统 X= f (T, p, nB, nC, …)
全微分为
dX
X T
dT
p,nB;nC
X p
dp
T ,nB;nC
X nB
T ,
dnB
p,nC;nD
X nC
T
,
dnC
p,nB ;nD
定义
X
B
def
X nB
T
,
p,nC
XB 偏摩尔量
该式表示在恒温恒压和除B 组分以外其它组分的含量都 不变的条件下, 任一广延性质X 随B组分物质的量的变化率, 相当于每单位量引起的X 的增量( 折合值, 对应于一定状态)4.
正己烷在乙醇,乙醇—水混合物中的偏摩尔体积

正己烷在乙醇,乙醇—水混合物中的偏摩尔体积
王键去;刘文彬
【期刊名称】《应用化学》
【年(卷),期】1991(8)5
【摘要】汽油与醇混合物作为动力燃料已日益广泛。
为了研究醇中杂质水对这种新型动力燃料有关热力学性质的影响,Letcher等测定了正庚烷-水-醇类三元体系的液-液平衡状态。
本文报道C6H14-C2H5OH和C6H14-C2H5OH-H2O混合物在303.15K的密度,并由此算得正已烷的表观摩尔体积和偏摩尔体积。
【总页数】3页(P96-98)
【作者】王键去;刘文彬
【作者单位】不详;不详
【正文语种】中文
【中图分类】O623.11
【相关文献】
1.偏摩尔体积对乙醇汽油计量的影响 [J], 李杨;谢远伟
2.离子液体在水、乙醇及其混合物中的电导率测定 [J], 王方惠;李春喜;孟洪;王子镐
3.反应法去除近共沸浓度乙醇-水混合物中水的宏观动力学研究 [J], 王华军;杨伯伦;吴江;路士庆
4.催化精馏脱除乙醇-水共沸混合物中水的模拟研究 [J], 周金波;黄剑锋;任海鸥;刘
飞;王玫
5.乙醇水混合物在碳纳米管中的吸附与结构性质 [J], 杜生平;赵文辉;袁岚峰
因版权原因,仅展示原文概要,查看原文内容请购买。
溶液偏摩尔体积的测定.

实验十五 溶液偏摩尔体积的测定一、实验目的1.掌握用比重瓶测定溶液密度的方法。
2.测定指定组成的乙醇—水溶液中各组分的偏摩尔体积。
二、预习要求1.复习课堂讲授内容,真正理解偏摩尔量的物理意义。
2.理解摩尔体积—摩尔分数图与比容—质量百分数图之间的关系。
三、实验原理在多组分体系中,某组分i 的偏摩尔体积定义为,,,()j i mi T p n i j V V n ≠⎛⎫∂= ⎪∂⎝⎭ (1) 若是二组分体系,则有21,1,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (2) 12,2,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (3) 体系总体积V=n1V1,m +n2V2。
m (4)将(4)式两边同除以溶液质量W1,2,1212m mV V W W V W M W M W=+(5) 令1,2,12,,m m V V VW W Wααα=== (6) 式中α是溶液的比容;α1,α2分别为组分1、2的偏质量体积。
将(6)式代入(5)式可得:α=W1%α1+W2%α2=(1-W2%)α1+W2%α2 (7)将(7)式对W2%微分:122122,%%W W αααααα∂∂=-+=+∂∂即 (8) 将(8)代回(7),整理得121%%W W ααα∂=-∂(9) 和 212%%W W ααα∂=+∂ (10)所以,实验求出不同浓度溶液的比容α,作α—W2%关系图,得曲线CC′(见图15.1)。
如欲求M浓度溶液中各组分的偏摩尔体积,可在M点作切线,此切线在两边的截距AB和A′B′即为α1和α2,再由关系式(6)就可求出V1,m 和V2,m 。
四、仪器与药品1.仪器恒温设备1套;分析天平(公用);比重瓶(10mL)2个;工业天平(公用);磨口三角瓶(50mL)4个。
2.药品95%乙醇(分析纯),纯水。
五、实验步骤调节恒温槽温度为(25.0±0.1)℃。
以95%乙醇(A)及纯水(B)为原液,在磨口三角瓶中用工业天平称重,配制含A质量百分数为0%,20%,40%,60%,80%,100%的乙醇水溶液,每份溶液的总体积控制在40mL 左右。
