质量质量守恒定律练习题(整理
初三化学《质量守恒定律》习题(含答案)

质量守恒定律练习题可能用到的相对原子质量:Al---27, O---16, K---39, Cl----35.5 Mn---55 C---12,一、我会选(每小题只有一个正确选项。
每小题2分,共20分)1.下列关于书写化学方程式的说法中,不正确的是( )A.以客观事实为基础B. 反应前后物质的总质量不变C.遵循质量守恒定律D.生成物中的气体一定要标注“↑”2.下列关于化学方程式C+O2=CO2的叙述中,不正确的是( )A.碳加氧气生成二氧化碳B.碳在氧气中充分燃烧生成二氧化碳C每.12份质量的碳和32份质量的氧气完全反应生成44份质量的二氧化碳D.在点燃的条件下,1个碳原子能与1个氧气分子反应生成1个二氧化碳分子3铝在氧气中燃烧这个反应中,铝,氧气,氧化铝质量比是( )A27:32:102 B 108:96 :204 C 27:24 :43 D 4:3 :24 某工地多次食物中毒,经化验误食工业食盐亚硝酸钠所致,亚硝酸钠化学式NaNO2 ,其中N的化合价( )A +2 B+3 C +4 D +55、在我们的日常生活中出现了加碘食盐、增铁酱油、高钙牛奶、富硒茶叶等。
这里的碘、铁、钙、硒应理解为()A、单质B、分子C、元素D、氧化物6 下列物质中,按单质、化合物、混合物顺序排列的是()A、二氧化碳、水、空气B、氢气、海水、可口可乐C、氧化镁、矿泉水、食盐D、汞、冰、生理盐水7、日常生活中发生的下列变化都属于化学变化的一组是()A、玻璃杯被摔碎、米饭变馊B、酒精挥发、湿衣服晾干C、蜡烛燃烧、乒乓球变瘪D、菜刀生锈、牛奶变酸8 化学反应前后肯定没有发生变化的是( )A 原子种类B 元素化合价C 分子个数D 物质种类9.某化合物[R]在空气中燃烧的化学方程式是:2[R]+3O2=2CO2+4H2O,则化合物[R]的化学式为( )A.CH4B.C2H4C.CH3OHD.C2H5OH10 现把10克的A和足量的B混合发生化学反应,完全反应后生成8克C和4克D,则参加反应的和的质量比为( )A 1 :1B 2: 1C 4 :1 D5 :1二填空每空2分。
质量守恒定律(习题及答案)

质量守恒定律(习题)1.下列现象能用质量守恒定律解释的是()A.50 g 糖溶于200 g 水中,制得250 g 糖水B.氧化钙与水反应生成氢氧化钙,反应前后物质总质量不变C.湿衣服晾干后,质量变小D.100 mL 水与100 mL 酒精混合后总体积小于200 mL 2.下列现象不能用质量守恒定律解释的是()A.煤燃烧后留下的灰烬的质量比煤的质量少了B.红磷在密闭的锥形瓶中燃烧,反应前后质量相等C.水结冰前后质量保持不变D.加热高锰酸钾制得氧气后,剩余固体的质量比高锰酸钾质量少了3.用质量守恒定律解释:铜在氧气中加热后,生成物(氧化铜)的质量比原来铜的质量大。
4.在化学反应A+B→C+D 中,参加反应的A 和B 的总质量为14 g,生成D 的质量为6 g,则生成C 的质量是g。
5.在化学反应A→B+C 中,当一定量A 反应一段时间后,生成56 g B 和44 g C,则发生反应的A 质量为()A.12 g B.44 g C.56 g D.100 g 6.在化学反应A+B C 中,若12 g A 参与反应,生成28 g C,其中D 的质量为3 g,则参加反应的 A 和B 的质量比为()A.1:1 B.2:3 C.3:4 D.3:77. a g 高锰酸钾加热全部分解后,生成b g 锰酸钾和c g 二氧化锰,则反应中得到氧气的质量为()A.(a+b-c)g B.(a-b)gC.(a-b-c)g D.(a-c)g8.在化学反应E+F→G 中,m 克E 和n 克F 反应生成G 的质量()A.等于(m+n)g B.小于(m+n)gC.大于(m+n)g D.不大于(m+n)g9.下列关于质量守恒定律的说法正确的是()①在化学反应前后,元素的种类一定不变②在化学反应前后,分子的种类一定不变③在化学反应前后,物质的种类一定不变④在化学反应前后,原子的种类一定不变A.①②B.②③C.③④D.①④10.硝酸银(AgNO3)固体见光或者受热易分解,故用棕色瓶保存,AgNO3固体受热分解时,放出一种有刺激性气味的气体,它可能是()A.SO2B.O2C.N2D.NO211.根据化学方程式不能获得的信息是()A.反应中的反应物和生成物B.反应物、生成物之间的质量关系C.化学反应速率的快慢程度D.反应发生所需要的条件12.关于化学方程式3Fe+2O2 Fe3O4的说法错误的是()A.反应物都是单质B.该反应属于化合反应C.反应后固体质量增加D.3 份质量的铁与2 份质量的氧气反应后生成1 份质量的四氧化三铁【参考答案】1. B2. C3.铜在氧气中加热生成氧化铜,根据质量守恒定律,参加反应的铜和氧气的质量总和等于生成的氧化铜的质量,所以生成物的质量比原来铜的质量大。
(完整版)质量守恒定律经典练习题40道.doc

1、下列图像能较好反映加热高锰酸钾时剩余固体的质量与反应时间的关系的是()A B C D2、碱式碳酸铜受热分解成CuO、 CO2和 H2O三种物质,则碱式碳酸铜的组成是()A、只含有碳、氢、氧元素 B 、一定含有碳、氢、铜元素,可能含有氧元素C、一定含有碳、氢、氧元素,可能含有铜元素 D 、肯定含有碳、氢、氧、铜元素3、化学方程式C x H y O z+5O2=4CO2+4H2O, 可知 x 、 y、 Z 的值分别是()A、 1、 2、 3 B 、 2、 4、 1 C 、 4、 8、 2 D 、 4、 4、 14、将m g 硫在n g 氧气中燃烧,所生成二氧化硫的质量下列答案中你认为最合理的是( m可与n相等,也可不相等) ()A.一定等于 ( m+n)g B .一定小于 ( m–n)gC.可能是小于或等于( m+n)g D .以上答案都正确5、镁在空气中燃烧时不仅与氧气反应生成氧化镁,而且还有部分镁与氮气化合生成氮化镁(Mg3N2),由此可推知,12g 镁在空气中燃烧后所得产物的质量为()A.等于 20 g B .小于20 g C .大于20 g D .无法确定6、质量守恒定律是帮助我们认识化学反应实质的重要理论。
在化学反应aA+bB = cC+dD 中,下列说法正确的是()A.化学计量数 a 与 b 之和一定等于 c 与 d 之和B.若取xg A和xg B反应,生成C 和 D 的质量总和不一定是2xgC.反应物A和B的质量比一定等于生成物 C 和 D 的质量比D.若 A 和 C 都是盐,则该反应一定是复分解反应7、关于质量守恒定律,下列叙述正确的是()A.煤燃烧化为灰烬,该反应不符合质量守恒定律;B.24g 镁在空气中完全燃烧生成40g 氧化镁,实际消耗空气的质量为16g ;C.无数实验证明化学反应都遵循质量守恒定律;D.质量守恒定律只适合于有气体或固体生成的化学反应。
8、根据反应3NO2+H2O=2HNO3+X,推断 X 的化学式为:()A、 N2 B 、 NO C 、 N2O3 D 、 N2 O59、黑火药是我国古代四大发明之一,黑火药爆炸的反应主要是:2KNO3+3C+S=K2S+3CO2↑ +X↑ ,则X的化学式为()A.N 2B.NO2C.N2O5D.N2O10、下列现象不能用质量守恒定律解释的是()A、纸燃烧化为灰烬,灰烬的质量比纸的质量小B、镁条燃烧,生成物的质量比镁条的质量大C、浓硫酸敞口放置一段时间后质量增大D、蜡烛燃烧后质量减小11、西班牙的瑞奥汀河是一条酸河,河水中含有硫酸和硫酸亚铁。
质量守恒定律大题专练(含答案)

质量守恒定律大题专练(含答案)
本文档包含一系列质量守恒定律的大题练,并提供答案。
以下是练及答案的详细内容:
1. 问题:在一个封闭系统中,物质A和物质B发生化学反应生成物质C。
如果物质A的质量为10克,物质B的质量为15克,最终生成的物质C的质量是多少克?
答案:质量守恒定律指出,在封闭系统中,物质的总质量不会发生改变。
因此,物质A和物质B的质量之和等于生成物质C的质量。
在这个例子中,物质C的质量为10克 + 15克 = 25克。
2. 问题:一个木头燃烧产生了灰烬和烟气。
在这个过程中,质量是否守恒?为什么?
答案:质量守恒定律适用于封闭系统,而燃烧过程发生在开放系统中。
当木头燃烧时,一部分木材质量转化为了灰烬,一部分转化为了烟气。
然而,一些部分的质量也以灰烬和烟气的形式逸出系统,因此质量没有完全守恒。
3. 问题:在一个封闭系统中,一个氧气分子和两个氢气分子发生反应生成水分子。
氧气分子的质量为32克,氢气分子的质量为2克。
生成的水分子的质量是多少克?
答案:根据质量守恒定律,反应过程中物质的总质量不会发生改变。
因此,生成的水分子的质量应等于氧气分子和氢气分子质量之和,即32克 + 2克 + 2克 = 36克。
4. 问题:为什么铁锈生成后,金属铁的总质量会增加?
答案:铁锈是由铁与氧气发生化学反应生成的。
当铁与氧气反应时,氧气分子与铁离子结合形成铁锈。
铁离子和氧气的结合增加了铁物质的质量,因此金属铁的总质量会增加。
以上是《质量守恒定律大题专练(含答案)》的内容,希望对您有所帮助。
九年级化学专题复习中考真题练—质量守恒定律(含解析)

九年级化学专题复习中考真题练—质量守恒定律(含解析)一、单选题1.(2023·四川乐山·统考中考真题)已知物质R 由一种或多种物质组成。
取一定质量的R 在足量的氧气中完全燃烧,生成4.4g 二氧化碳和3.6g 水,下列分析不正确的是()A .参加反应的R 和氧气的质量总和一定等于8.0gB .所取R 质量的最小值为1.6gC .R 可能是酒精(25C H OH )D .若R 为CO 和2H 的混合物,则CO 和2H 的分子个数比为1:2【答案】C【解析】A 、依据质量守恒定律,参加反应的物质的总质量等于生成物的质量之和,故参加反应的R 和氧气的质量总和一定等于生成的二氧化碳和水的质量之和,为4.4g+3.6g=8.0g ,故A 正确;B 、依据质量守恒定律,反应前后元素的种类、质量相等,则R 中一定含有碳元素和氢元素,可能含有氧元素,则R 质量的最小值是碳元素和氢元素的质量之和,碳元素的质量等于二氧化碳中碳元素的质量,为:124.4g 100%44⨯⨯=1.2g ;氢元素的质量等于水中氢元素的质量,为:23.6g 100%18⨯⨯=0.4g ,所取R 质量的最小值为:1.2g+0.4g=1.6g ,故B 正确;C 、综上分析,碳原子和氢原子的个数比为:1.2g 0.4g :121=1:4,R 不可能是酒精,故C 错误;D 、若CO 和H 2的分子个数比为1:2,则碳原子和氢原子的个数比为:()122⨯:=1:4,故D 正确。
故选C 。
2.(2023·四川遂宁·中考真题)我国力争在2060年前实现碳中和,二氧化碳的捕获、储存、利用和转化等是实现目标的重要途径。
人工光合固碳装置通过电化学手段将二氧化碳转化为甲酸(HCOOH),该反应的微观示意图如图,下列说法正确的是()A.甲酸由甲酸分子构成B.甲酸中氢元素的质量分数最大C.反应前后氧元素的化合价没有变化D.参加反应的与的微粒个数比为2:3【答案】A【解析】A、由图示可知,甲酸由甲酸分子构成,正确;B、根据甲酸中碳、氢、氧元素的质量比为(12×1):(1×2):(16×2)=6:1:16可知,甲酸中氧元素的质量分数最大,错误;C、生成物中氧气是单质,单质中元素的化合价为0,则反应前后氧元素的化合价一定发生了变化,错误;D、由反应的微观示意图,图中是2个二氧化碳分子和2个水分子在一定条件下反应生成2个甲酸分子和1个氧分子,参加反应的与的微粒个数比为2:2=1:1,错误。
质量守恒定律的习题
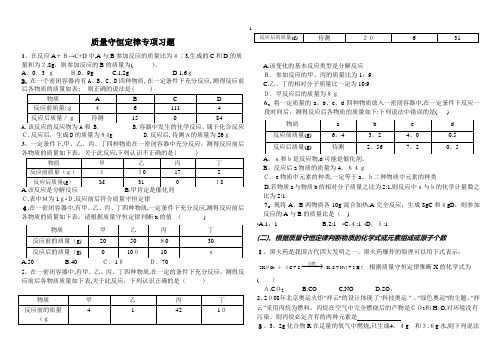
质量守恒定律专项习题1、在反应A +B→C+D 中,A 与B 参加反应的质量比为4∶3,生成的C 和D 的质量和为2.8g ,则参加反应的B 的质量为( )。
A .0.3 g B.0。
9g C.1.2g D 1.6g 2.在一个密闭容器内有A 、B 、C 、D 四种物质,在一定条件下充分反应,测得反应前C.反应后,生成D 的质量为84g D.反应后,待测A的质量为26g 3。
一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表:关于此反应,下列认识不正确的是( )C.表中M为1gﻩD.反应前后符合质量守恒定律4.在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表:请根据质量守恒定律判断x 的值 ( )A.50B.40 C.10 D.705。
在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下充分反应,测得反应前后各物质质量如下表,关于此反应,下列认识正确的是( )A.该变化的基本反应类型是分解反应 B.参加反应的甲、丙的质量比为1:9C.乙、丁的相对分子质量比一定为10:9 D.甲反应后的质量为8g6、将一定质量的a 、b 、c 、d 四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:下列说法中错误的是( )B 。
反应后a 物质的质量为4。
64gC.c 物质中元素的种类,一定等于a 、b二种物质中元素的种类D.若物质a 与物质b 的相对分子质量之比为2:1,则反应中a与b的化学计量数之比为2:17。
现将A 、B 两物质各10g 混合加热,A 完全反应,生成8gC 和4gD ,则参加反应的A 与B 的质量比是( ) ﻩA.1:1 B.2:1 ﻩC.4:1 ﻩD .5:1(二)、根据质量守恒定律判断物质的化学式或元素组成或原子个数1、黑火药是我国古代四大发明之一。
黑火药爆炸的原理可以用下式表示:2K NO 3 + 3C + S −−→−点燃K 2S + N 2↑ + 3x↑, 根据质量守恒定律推断X 的化学式为( )A.C O2 B.CO C.NO D.SO 2 2、2008年北京奥运火炬“祥云"的设计体现了“科技奥运"、“绿色奥运"的主题。
质量守恒定律专项练习题

质量守恒定律专项练习题一、选择题1. 质量守恒定律是指:A. 物体在同一物理系统内的质量始终保持不变B. 两个相互作用的物体间的质量始终保持不变C. 物质可以通过化学反应而被转化成其他物质D. 能量守恒定律2. 质量守恒定律适用于以下哪些情况:A. 封闭系统B. 开放系统C. 半封闭系统D. 所有系统3. 下列哪个过程违反了质量守恒定律?A. 燃烧木材产生的灰烬的总质量大于木材的质量B. 非溶解性固体溶解于液体时,溶液的质量大于纯液体的质量C. 盐水中通过电解分解水,生成氧气和氢气D. 弹簧压缩后松开,弹簧的形变能被转化为动能4. 在一个封闭系统中,有两个物体同时发生化学反应,其总质量发生了变化。
这是否违反了质量守恒定律?A. 是,因为化学反应会转化物质B. 不违反,因为封闭系统并不是理想的封闭系统C. 不违反,因为总质量仅在开放系统中始终保持不变D. 无法判断二、填空题1. 质量守恒定律是能量守恒定律之后改变的。
2. 质量守恒定律适用于系统中物质的转化过程。
三、问答题1. 请介绍一下质量守恒定律的基本原理和适用范围。
质量守恒定律是指在封闭系统中,物质不会被创建或毁灭,只能通过物质的转化改变其形态。
即使在物质的转化过程中,总质量始终保持不变。
这个定律适用于封闭系统中物质转化的各种过程,无论是化学反应、物理变化还是核反应。
2. 举一个违反质量守恒定律的例子,并解释为什么它违反了这个定律。
一个违反质量守恒定律的例子是在非封闭系统中发生的核反应。
核反应可以将一个物质转化为另一种物质,同时产生大量的能量。
这个过程中,原有物质的质量会减少,而新产生的物质的质量会增加,从而违反了质量守恒定律。
综上所述,质量守恒定律是自然界中基本的守恒定律之一,它规定了物质在封闭系统中的转化方式,保证了物质的守恒性。
通过理解和应用质量守恒定律,可以帮助我们更好地掌握物质的转化过程,并应用于实际生活和科学研究中。
质量守恒定律专项练习+答案

质量守恒定律习题1.某同学用在空气中燃烧镁带的实验来探究质量守恒定律镁带完全燃烧后,称量剩下固体的质量比反应前镁带的质量还轻,联系实验过程,分析:原因可能有______,改进措施是______.2.为防止煤气泄漏使人中毒,常在煤气中加入少量的有特殊气味的乙硫醇(C2H5SH)乙硫醇在煤气燃烧过程中也可以充分燃烧,其化学方程式为:2C2H5SH+9O24CO+2x+6H2O则x的化学式为()3.为研究化学反应后反应物与生成物之间的质量关系,三位同学分别做了如下三个实验:实验一:称量镁条,点燃,待反应结束后,再称量;实验二:将盛有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,充分反应后再称量;实验三:将盛有氢氧化钠溶液的试管放入盛有硫酸铜溶液的烧杯中,称量,然后设法使两种溶液混合,充分反应后再称量。
三位同学得到的实验数据如下表:(1)从表面上看,这三个实验中发生化学反应前后物质的质量(填“增大”、“减小”或“不变"):实验一______,实验二_______,实验三______。
(2)造成上述结果的原因可能是____________。
(3)在三个实验中,实验______正确反映了反应物与生成物之间的质量关系;(4)由此可得结论:用实验研究化学反应前后反应物与生成物之间的质量关系时,必须在______体系中进行。
4.2002年12月,广西某地一辆满载砒霜(剧毒物质)的卡车发生交通事故,致使三十余桶砒霜散落在河床和河水中,有关部门采取了紧急有效的措施,防止了大规模污染的发生.已知氢氧化钠能与砒霜发生如下反应(砒霜的化学式用X表示):X+6NaOH=2Na3AsO3+3H2O,则砒霜的化学式为______.5.著名的发明家诺贝尔经过长期的研究与试验,终于发明了安全炸药──三硝酸甘油脂,三硝酸甘油酯的化学式为C3H5N3O9,这种炸药发生爆炸的反应方程式为:4C3H5N3O912CO2↑+10H2O↑+6X↑+O2↑(1)X的化学式是______。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
质量守恒定律练习题
1、二甲醚(CH3OCH3)可由一氧化碳和物质X在一定的条件下制得。
反应的化学方程式
为,则X的化学式为()
A、C2H5OH B 、H 2O2 C 、C2H4 D 、H 2
2、为防止硝酸厂产生的氮氧化物污染环境,通常用NaOH溶液吸收这些氮氧化物,反应的化学方程式为:NO+NO x+2NaOH=2NaNO2+H2O,方程式中x的值是()
A.1 B.2 C.3 D.任意值
3、下列观点符合质量守恒定律的是()
A.煤燃烧后剩余残渣的质量减轻了
B.一定条件下,SO2和O2生成SO3,反应前后分子总数不变
C.8g CH4完全燃烧生成8g CO2
D.某有机物在空气中燃烧只生成CO2和H2O,则该有机物一定含有碳、氢、氧元素
4、右图是某化学反应的微观示意图,下列说法正确的是( )
A、该反应属于分解反应
B、该反应共涉及四种原子
C、该反应前后,原子的种类没有发生变化
D、该反应前后所有元素的化合价都没有发生变化
5、建立一个适当的模型来反映和代替客观对象,可以帮助我们认识和理解观察不到的化学反应。
已知某两种物质在光照条件下能发生化学反应,其微观模型示意图如下,图中相同小球代表同种原子,原子间的短线代表原子的结合。
下列从图示获得的信息中错误的是()
A、图示中共有4种分子
B、图示符合质量守恒定律
C、该反应属于化合反应
D、说明化学反应中原子不可分
6、建立一个适当的模型来反映和代替客观对象,可以帮助我们认识和理解观察不到的化学反应。
已知某两种物质在光照条件下能发生化学反应,其微观模型示意图如下,图中相同小球代表同种原子,原子间的短线代表原子的结合。
下列从图示获得的信息中错误的是()
A、图示中共有4中分子
B、图示符合质量守恒定律
C、该反应属于化合反应
D、说明化学反应中原子不可分
A 、C
B 、N2 C、CO D、 O2
7、将一定量的苯(C6H6)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和一种未知物X。
测得反应前后物质的质量如下表:
物质苯氧气二氧
水X
化碳
反应前质量/g 3.9 9.6 0 0 0
反应后质量/g 0 0 6.6 2.7 m
A .表中m 的值为13.5
B .该反应属于分解反应
C .物质X 能在氧气中燃烧
D .物质X 中一定含有氢元素
8、将20克甲、5克乙、8克丙三种纯净物混合,在密闭容器中加热发生化学反应,经分析可知:反应后混合物中含有5克甲、16克丙,还含有一种新物质丁。
则丁物质的质量是( )
A.12g
B.9g
C. 4g
D.17g
9、将一定质量的A、B、C、D四种物质方一密闭容器中,在一定条件下反应一段时间后,测得各物质得质量如下:
物质
A B C D 反应前的质量
(g)
6.4 3.2 4.0 2.5 反应后的质量
(g) 3.8 待测数据 7.2 2.5
下列说法中错误的是( )
A.A和B时是反应物,D可能是催化剂
B.上表中的待测数据的数值为0.6
C.C物质中元素的种类,一定等于A、B二种物质中元素的种类之和
D.该反应一定属于化合反应
9、在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表所示。
关于此反应下列认识不正确的是( )
A. m 的值是1
B.甲可能是该反应的催化剂
C.该反应是分解反应
D.反应中乙、丁的质量比是29:8
10、下图为某反应的部分微观示意图,其中不同的球代表不同元素的原子。
下列说法正确的是( )
A.该反应属于置换反应
B.参加反应的两种分子个数比为1∶1
C.1个X 分子中含有3个原子
D.1个X 分子中含有3种不同的原子
11、下列实验能够直接用于验证质量守恒定律的是( )
¥12、某物质和二氧化碳反应后只生成碳酸钠和氧气,则该物质中( )
A.只含氧元素
B.一定含钠元素和氧元素
C.只含钠元素
D.一定含钠元素,可能含有氧元素
物质 甲 乙 丙 丁 反应前质量/g 1 20 15 2 反应后质量/g m 29 0 8 ++ 4X
13、一定条件下,在一个密闭容器中发生某反应.测得反应过程中各物质的质量如下表所示
物 质 X Y Z Q
第一次测得的质量/g
68 16 4.4 3.6 第二次测得的质
量/g 4 未测 48.4 39.6
下列判断错误的是( )
A 该反应一定是化合反应
B 若X 为氧气,则Y 一定发生氧化反应
C .第二次测量时,Y 已完全参加反应
D 该反应中z 与Q 质量变化之比为11:9
14、质量守恒定律是帮助我们认识化学反应实质的重要理论。
在化学反应aA+bB = cC+dD 中,
下列说法正确的是
A. 化学计量数a 与b 之和一定等于c 与d 之和
B. 若取xg A 和xg B 反应,生成C 和D 的质量总和不一定是2xg
C. 反应物A 和B 的质量比一定等于生成物C 和D 的质量比
D. 该反应一定是氧化反应
15、用和代表两种不同的单质分子,它们在一定条下
能发生化学反应,反应前后的模拟模型如下图所示,下列说法正确的是( )
A.参加反应的“ ”和“ ”分子的个数比是 2︰1
B.该反应是化合反应
C.该反应有2种生成物
D.每个生成物分子由3个原子构成
16、下图表示物质A()与B()在一定条件下
反应生成C ( )的微观示意图(和表示两种质
子数不同的原子)。
下列说法正确的是( )
A .该反应在反应前后其原子种类没有发生变化,
但原子数目减少
B .A 、B 、
C 三种物质在分类上均属于化合物
C .该反应的化学方程式中,A 、B 、C 的化学计量数之比为2:l :2
D .该反应属于复分解反应
17、根据化学方程式A +NaOH== B +H 2O 推断,B,A 的相对分子质量相差( )
A. 12
B. 18 C .22 D.40
18、现将10gA 和足量的B 混合加热,A 和B 发生化学反应,10gA 完全反应后生成8gC 和4gD ,则参加反应的A 与B 的质量比是( )
A .1:1
B .2:1
C .5:1
D .4:1
19、葡萄糖、乙酸(CH 3COOH )和尿素[CO(NH 2)2]组成的混合物240g ,在一定条件下完全燃烧,生成水的质量是( )
A .48g
B .72g
C .144g
D .无法计算
+反
应前 反应后。
