国内外生物制品审评指导原则及法律法规清单--
国家药品监督管理局关于发布《已上市生物制品变更事项及申报资料要求》的通告

国家药品监督管理局关于发布《已上市生物制品变更事项及申报资料要求》的通告文章属性•【制定机关】国家药品监督管理局•【公布日期】2021.06.17•【文号】国家药品监督管理局通告2021年第40号•【施行日期】2021.06.17•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药品监督管理局通告2021年第40号国家药监局关于发布《已上市生物制品变更事项及申报资料要求》的通告为配合药品注册管理办法实施,国家药品监督管理局组织制定了《已上市生物制品变更事项及申报资料要求》,现予发布。
本通告自发布之日起实施。
特此通告。
附件:已上市生物制品变更事项及申报资料要求国家药监局2021年6月17日附件已上市生物制品变更事项及申报资料要求一、国家药品监管部门审批的补充申请事项(一)国家药品监管部门发布的已上市生物制品药学变更相关技术指导原则中属于重大变更的事项。
(二)国家药品监管部门发布的已上市生物制品临床变更相关技术指导原则中属于重大变更的事项。
(三)药品上市许可持有人主体变更。
(四)使用药品商品名。
(五)国家药品监管部门规定需要审批的其他事项。
二、国家或省级药品监管部门备案事项(境内生产生物制品报持有人所在地省级药品监管部门备案,境外生产生物制品报国家药品监督管理局药品审评中心备案)(一)国家药品监管部门发布的已上市生物制品药学变更相关技术指导原则中属于中等变更的事项。
(二)国家药品监管部门发布的已上市生物制品临床变更相关技术指导原则中属于中等变更的事项。
(三)改变不涉及技术审评的药品注册证书载明事项。
(四)境外生产药品分包装及其变更。
(五)国家药品监管部门规定需要备案的其他事项。
三、年报事项(一)国家药品监管部门发布的已上市生物制品药学变更相关技术指导原则中属于微小变更的事项。
(二)国家药品监管部门发布的已上市生物制品临床变更相关技术指导原则中属于微小变更的事项。
(三)国家药品监管部门规定的需要年报的其他事项。
生物制品临床申报法规要求及注意事项

7. 杂质谱分析
对存在于药物制剂中的所有已鉴定和未鉴定的杂质的描述。 说清哪些是原材料、工艺带来的,杂质稳定后,再做动物试验
以表格形式列出已鉴定的杂质结构,说明其来源及相对保留时间,并结合工艺说明是否存在潜在 的遗传毒性杂质。
杂质名称或代号
杂质结构
杂质来源 相对保留时间
——ICH Q3
8. 稳定性
《药品注册管理办法》(国家市场监督管理总局令第27号) 2020年7月1日实施
分类及资料要求: • 生物制品注册分类及申报资料要求 (2020年第43号,国家药监局)2020年10月1日实施
《M4:人用药物注册申请通用技术文档(CTD)》
《M4模块一行政文件和药品信息》 (2020第6号,CDE)2020年7月1日实施
尽量选择同一家供应商;
不同风险等级的原材料质量控制要求
原材料风险等级,
5. 标准品/参比物质
标准物质:指检测、工艺、杂质等涉及到的参考品;
要说明来源,制造或纯化方法,质量特性分析、贮存条件等信息;
生产:新城疫病毒标准品 检测:蛋白质标准品、鲎试剂标准品
6. 质量研究
结构确证: 研发早期,应对样品进行初步结构确证,提交研究数据,包括一级结构、二级结构等; 申报新药上市,需完整的结构确证,包括高级结构; 不能完全参考文献,要仪器检测 结构鉴定和确定:氨基酸序列、氨基酸组成、肽图、糖结构、分子量及分子大小、异构体、消光 系数、电泳图谱等;
申报资料的关注点、痛点:法规要求是否清楚?各审评员的尺度?Biblioteka 中外法规、指南审评员
其他公司
申报注意事项
申报临床不需要生产许可证、生产上市需要生产许可证,申报临床:规范管理,亚GMP,GMP-like
国内外生物制品、审评指导原则及法律法规清单
体外诊断试剂说明书编写指导原则
2008-09-04
6
体外诊断试剂临床研究技术指导原则
2008-09-04
7
重组制品生产用哺乳动物细胞质量控制技术评价一般原则
2008-09-04
8
预防用疫苗临床试验不良反应分级标准指导原则
2008-09-04
9
预防用生物制品临床前安全性评价技术审评一般原则
2008-09-04
2008-09-04
15
结合疫苗质量控制和临床研究技术指导原则
2008-09-04
16
化学药物和生物制品临床试验的生物统计学技术指导原则
2008-09-04
17
多肽疫苗生产及质控技术指导原则
2008-09-04
18
疫苗临床试验技术指导原则
2008-09-04
19
化学药品、生物制品说明书指导原则(第二稿)
CFDA法律法规
1
中华人民共和国药品管理法
2
药物非临床研究质量管理规范
3
药品注册管理办法
4
生物制品注册分类及申报资料要求
5
预防用生物制品注册申办须知
6
新药注册特殊审批管理规定
7
药品补充申请注册事项及申报资料要求
8
药品包装用材料、容器管理办法(暂行)
9
药品说明书和标签管理规定
10
疫苗储存和运输管理规范
3
人用药物遗传毒性试验和结果分析指导原则
2011年11月
4
研发期间安全性更新报告
2010年8月
5
药物或生物技术产品开发相关的生物标记物:验证申请的背景资料、结构和格式
2010年8月
CDE生物制品审评

求,至少完成Ⅲ期;疫苗临床试验例数要求较 多,首次在中国上市疫苗需进行流行病学的保护 力试验。
16
8
技术指导原则(SFDA公布)
• 《人用重组DNA制品质量控制技术指导原则》 • 《人基因治疗研究和制剂质量控制技术指导原则》 • 《人体细胞治疗研究和制剂质量控制技术指导原则》 • 《人用单克隆抗体质量控制技术指导原则 》 • 《变态反应原(变应原)制品质量控制技术指导原则 》 • 《疫苗临床试验技术指导原则》 • 《预防用以病毒为载体的活疫苗制剂的技术指导原则 》 • 《预防用DNA疫苗临床前研究技术指导原则》 • 《艾滋病疫苗临床研究技术指导原则 》 • 《细胞培养用牛血清生产和质量控制技术指导原则》 • 《生物制品生产工艺过程变更管理技术指导原则 》
在技术审评层面落实药品注册法规
3
4
2
近年CDE承办生物制品审评任务
(包括申报临床、生产和补充申请)
年度 2005年
承办任务量 (按受理号计)
716
2006年
514
2007年
472
2008年
364
5
近年CDE完成生物制品审评任务
(至少完成一轮审评)
年度 2005年
完成任务量 (按受理号计)
586
2006年
19
药学方面
• 强调生产全过程的质量控制,包括原材料、 生产过程和终产品质量控制
• 关注活性、安全性、批间一致性 • 申报资料项目要求类似,审评重点不同
20
10
• 疫苗:
– 生产用菌毒种及细胞基质的来源和质控 – 工艺过程控制:工艺路线及主要技术参数
生物制品相关法规指南汇编

生物制品相关法规指南汇编English Answer:Guidelines for Regulatory Compliance of Biological Products.Introduction.Biological products are a complex and rapidly evolving field, with new products and technologies emerging all the time. This has led to a growing need for clear and comprehensive regulatory guidance to ensure the safety, efficacy, and quality of these products.Regulatory Framework.The regulatory framework for biological products varies from country to country, but there are some general principles that apply to most jurisdictions. These principles include:Pre-market approval: Biological products must be approved by a regulatory authority before they can be marketed. This approval process typically involves a review of the product's safety, efficacy, and quality.Manufacturing standards: Biological products must be manufactured in accordance with Good Manufacturing Practices (GMPs). GMPs are designed to ensure that products are produced in a consistent and controlled manner.Post-market surveillance: Regulatory authorities typically monitor the safety and efficacy of biological products after they have been marketed. This monitoring can include collecting data on adverse events, conducting clinical trials, and reviewing scientific literature.Specific Regulations.In addition to the general principles outlined above, there are a number of specific regulations that apply to biological products. These regulations vary from country tocountry, but some of the most common include:The US Food and Drug Administration (FDA) regulations for biological products: The FDA has a long history of regulating biological products, and its regulations are considered to be among the most stringent in the world. The FDA's regulations cover a wide range of topics, including pre-market approval, manufacturing standards, post-market surveillance, and product labeling.The European Medicines Agency (EMA) regulations for biological products: The EMA is the European Union's regulatory authority for medicinal products, including biological products. The EMA's regulations are based on the EU's pharmaceutical legislation, and they are similar to the FDA's regulations in many respects.The World Health Organization (WHO) guidelines for the regulation of biological products: The WHO provides guidance on the regulation of biological products to help countries develop their own regulatory frameworks. The WHO's guidelines are based on the latest scientificevidence and best practices.Conclusion.The regulatory landscape for biological products is complex and ever-changing. However, by understanding the general principles and specific regulations that apply to these products, manufacturers and regulators can ensure that they are safe, effective, and of high quality.Chinese Answer:生物制品的相关法规指南汇编。
预防用生物制品临床前安全性评价技术审评一般原则

指导原则编号:【S】G P T2-1预防用生物制品临床前安全性评价技术审评一般原则二零零五年十二月目录一、概述 (2)二、适用范围 (3)三、试验设计中的重点问题 (3)(一)相关动物 (3)(二)免疫毒性 (4)(三)具体问题具体分析 (4)四、研究内容 (5)(一)急性毒性试验 (5)(二)长期毒性试验 (5)(三)局部刺激性试验 (7)(四)过敏试验 (7)(五)生殖毒性试验 (8)(六)其它特殊考虑 (8)1.免疫原性试验和保护力试验 (8)2. 佐剂 (9)3.其它 (10)五、结语 (10)六、参考文献 (10)七、起草说明 (11)八、著者 (117)一、概述预防用生物制品(以下简称疫苗)系指含有抗原、能够诱导人体产生特异性主动免疫的制剂,它可以保护机体免受感染原、毒素,以及感染原引起的抗原性物质的损伤。
疫苗的安全性评价贯穿非临床试验、临床试验和上市后评价。
它包括对原辅材料、生产工艺和过程的控制、理化性质和生物学性质的检定、动物安全性评价、临床安全性评价以及上市后不良反应监测等一系列过程。
本文适用于疫苗的临床前动物安全性评价。
临床前动物安全性评价的主要目的系通过相关动物来考察疫苗的安全性,包括对免疫器官和其它毒性靶器官的影响、毒性的可逆性,以及与临床相关的参数,预测其在大规模人群中使用时可能出现的不良反应,降低临床试验受试者和临床使用者承担的风险,并为临床试验方案的制订提供依据。
疫苗可能导致的毒性反应主要包括:制品成分本身作为毒性物质对机体的直接损伤、诱导免疫系统引起的与免疫相关的毒性,以及污染物和残余杂质引起的毒性。
由于疫苗系通过诱导免疫系统产生抗体及/或效应T细胞发挥作用,因此其最主要的潜在毒性来自与免疫系统相关的毒性,常规药物安全性评价的方法并不完全适用于疫苗。
本文仅代表目前对疫苗安全性评价的基本认识,其中的内容并不完全是注册申请人进行开发时必须完成的内容,仅作为技术审评的一般原则。
国内外生物制品审评指导原则及法律法规清单

1
中华人民共和国药品管理法
2
药物非临床研究质量管理规范
3
药品注册管理办法
4
生物制品注册分类及申报资料要求
5
预防用生物制品注册申办须知
6
新药注册特殊审批管理规定
7
药品补充申请注册事项及申报资料要求
8
药品包装用材料、容器管理办法(暂行)
9
药品说明书和标签管理规定
10
疫苗储存和运输管理规范
2015年7月
2
妊娠、哺乳和生殖潜能:人用处方药和生物制品说明书—内容和格式—行业指南(小企业遵从指南)
2015年6月
3
申办方-研究者准备和提交的研究新药申请
2015年5月
4
风险评估和减低对策:修改和校正
2015年4月
5
抗非小细胞肺癌药物和生物制品批准的临床试验终点
2015年4月
6
在临床研究中使用电子知情同意书—问题和解答
2008-09-04
20
预防用以病毒为载体的活疫苗制剂的技术指导原则
2008-09-04
21
预防用DNA疫苗临床前研究技术指导原则
2008-09-04
22
人用重组DNA制品质量控制技术指导原则
2008-09-04
23
细胞培养用牛血清生产和质量控制技术指导原则
2008-09-04
24
人用单克隆抗体质量控制技术指导原则
36
临床试验中应用计算机系统的技术指导原则
2007年5月
37
抗肿瘤药物临床试验终点的技术指导原则
2007年5月
38
以临床为目标制定研发策略
2007年3月
美国、欧盟及中国生物制品注册分类探析

且 可 行 的 中 国生 物 制 品 注 册 分 类 管 理 法 规 复 杂 、难 控 制 和 风 险 大 的特 点 ,各 国药 品 理 分 类 的确 有 非 常 大 的 难 度 。 上 述分 类 虽
体 系 ,促 ห้องสมุดไป่ตู้ 实现 对 生 物 制 品 的 有 效 监 管 。
方 法 针 对 我 国 、 美 国及 欧 盟 对 生 物 制 品
素 )、病 毒类 疫 苗 、抗 毒 素及 抗 血 清 、血 类 、7 类和1 5 类 ;单纯 按 制 品 的性质 分 ,如 性 归 属 不 同 的监 管 部 门 ,而 且 不 同部 门 受
液 制 品 、细 胞 因 子 、生 长 因 子 、酶 、体 2~4 类 、5 类 、8 类 ;兼 顾 制 品 成 熟 程 度及 不 同 法 律 的 调 控 ,例 如 , 由C B E R 监 管 的
准 的 显著 变化 。
门,都具有非常大的难度和挑战性 】 。
价和研究 中心 ( C B E R )。 自从 2 0 0 3 年 以
关 键 词 :生 物 制 品; 注册 管 理 ; 分类 中图 分 类号 :R 9 5 文献 标 识 码 :A
文 章 编号 :1 0 0 5 — 8 2 5 7( 2 0 1 5 )0 3 - 0 0 0 5 - 0 1
同促 进生 物 制 品监 管 的 发展 。
生 物 制 品 作 为 药 品 的 一种 ,具 有 药 品 2 类 、4 类 ;兼 顾 制 品 成 熟 程 度 及 结构 、给 2 . 1归属 C B E R 监 管 的生 物 制 品
降 低 ,采 取 什 么样 的 技 术 标 准 显 得 更 加 重
此 ,制定 科 学 、合 理 而 且 可 行 的生 物 制 品
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
审评一般指导原则
1
治疗用生物制品非临床安全性技术审评一般原则
2010-05-06
2
预防用生物制品临床前安全性评价技术审评一般原则
2007-08-23?
3
疫苗生产用细胞基质研究审评一般原则
2007-08-23?
4
生物制品质量控制分析方法验证技术一般原则
2007-08-23?
5
生物组织提取制品和真核细胞表达制品的病毒安全性评价的技术审评一般原则
2007-08-23?
6
重组制品生产用哺乳动物细胞质量控制技术评价一般原则
2007-08-13?
二、非临床研究指导原则及CFDA法律法规清单
非临床研究指导原则
序号
名称
颁布时间
1
非临床安全性评价供试品检测要求的Q&A
2014-05-13
2
药物重复给药毒性研究技术指导原则
2014-05-13
3
药物非临床药代动力学研究技术指导原则
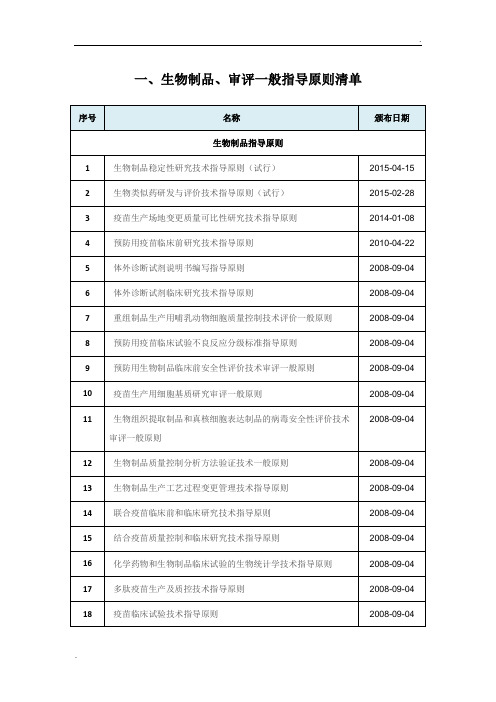
一、生物制品、审评一般指导原则清单
序号
名称
颁布日期
生物制品指导原则
1
生物制品稳定性研究技术指导原则(试行)
2015-04-15
2
生物类似药研发与评价技术指导原则(试行)
2015-02-28
3
疫苗生产场地变更质量可比性研究技术指导原则
2014-01-08
4
预防用疫苗临床前研究技术指导原则
2010-04-22
2015年3月
7
药物和生物制品儿科研究的一般临床药理学考虑
2014年12月
8
妊娠、哺乳和生殖潜能:人用处方药和生物制品说明书—内容和格式
2014年12月
9
人用处方药和生物制品说明书的患者咨询信息部分—内容和格式
2014年12月
10
以电子形式进行监管提交—标准化研究数据
2014年12月
11
生物制品领域的对照药品独占权
5
体外诊断试剂说明书编写指导原则
2008-09-04
6
体外诊断试剂临床研究技术指导原则
2008-09-04
7
重组制品生产用哺乳动物细胞质量控制技术评价一般原则
2008-09-04
8
预防用疫苗临床试验不良反应分级标准指导原则
2008-09-04
9
预防用生物制品临床前安全性评价技术审评一般原则
2008-09-04
2008-09-04
20
预防用以病毒为载体的活疫苗制剂的技术指导原则
2008-09-04
21
预防用DNA疫苗临床前研究技术指导原则
2008-09-04
22
人用重组DNA制品质量控制技术指导原则
2008-09-04
23
细胞培养用牛血清生产和质量控制技术指导原则
2008-09-04
24
人用单克隆抗体质量控制技术指导原则
3
人用药物遗传毒性试验和结果分析指导原则
2011年11月
4
研发期间安全性更新报告
2010年8月
5
药物或生物技术产品开发相关的生物标记物:验证申请的背景资料、结构和格式
2010年8月
6
上市后安全数据管理:快速报告的定义和标准
2003年11月
7
临床安全数据管理:已上市药品周期性安全数据更新报告
2003年6月
2015年7月
2
妊娠、哺乳和生殖潜能:人用处方药和生物制品说明书—内容和格式—行业指南(小企业遵从指南)
2015年6月
3
申办方-研究者准备和提交的研究新药申请
2015年5月
4
风险评估和减低对策:修改和校正
2015年4月
5
抗非小细胞肺癌药物和生物制品批准的临床试验终点
2015年4月
6
在临床研究中使用电子知情同意书—问题和解答
2009年1月?
31
工艺验证的一般原则和方法
2008年11月
32
Ⅱa期临床试验结束后沟通交流会的有关要求
2008年9月
33
Ⅰ期临床试验用样品的生产质量管理规范
2008年7月
34
改变制剂处方和变更药物给药途径的非临床安全性评价技术指导原则
2008年3月
35
抗菌药物采用非劣效性临床研究技术指导原则
2007年10月
2012年2月
26
药物相互作用研究--研究设计、数据分析、和对剂量及流感:研发治疗和/或预防药物
2011年4月
28
上市后研究和临床试验—联邦食品、药品和化妆品法案第505(O)(3)部分的实施
2011年3月
29
流感药物临床研究指导原则
2009年2月
30
动物模型-动物效应下考察药效的基本要素(第三批)
CFDA法律法规
1
中华人民共和国药品管理法
2
药物非临床研究质量管理规范
3
药品注册管理办法
4
生物制品注册分类及申报资料要求
5
预防用生物制品注册申办须知
6
新药注册特殊审批管理规定
7
药品补充申请注册事项及申报资料要求
8
药品包装用材料、容器管理办法(暂行)
9
药品说明书和标签管理规定
10
疫苗储存和运输管理规范
2014年8月
12
人用处方药和生物制品临床药理学部分说明书—考虑、内容和格式
2014年8月
13
药物研发工具的鉴定方法
2014年1月
14
临床研究中的电子源数据
2013年9月
15
以电子形式进行监管提交-上市后非加速的ICRS技术性问题与解答
2013年7月
15
使用电子医疗数据集开展和报告药物流行病学安全性研究的最佳规范
36
临床试验中应用计算机系统的技术指导原则
2007年5月
37
抗肿瘤药物临床试验终点的技术指导原则
2007年5月
38
以临床为目标制定研发策略
2007年3月
39
紧急临床研究免除知情同意的相关规定
2006年7月
40
临床试验数据监查委员会的建立与工作技术指导原则
2006年3月
41
儿科药品的非临床安全性评价一般原则
8
儿科人群中的医学产品临床研究
2000年7月
9
人用药物安全药理学研究指导原则
2000年11月
10
临床试验中对照组的选择
2000年7月
11
临床试验的统计学指导原则
1998年2月
12
接受国外临床资料的种族影响因素
1998年2月
13
临床研究的一般考虑
1997年7月
14
生物技术药物的临床前安全性评价
1997年7月
2005年2月
48
因临床研究者失职叫停临床试验的相关规定
2004年9月
49
无菌制剂生产质量管理规范
2004年9月
50
生物利用度和生物等效性试验生物样品的处理和保存要求
2004年5月
51
新药Ⅱ期和Ⅲ期临床试验药学申报资料的内容及格式要求
2003年5月
52
临床研究进程中沟通交流会的药学资料准备要求
2001年5月
2008-09-04
15
结合疫苗质量控制和临床研究技术指导原则
2008-09-04
16
化学药物和生物制品临床试验的生物统计学技术指导原则
2008-09-04
17
多肽疫苗生产及质控技术指导原则
2008-09-04
18
疫苗临床试验技术指导原则
2008-09-04
19
化学药品、生物制品说明书指导原则(第二稿)
53
群体药代动力学研究技术指导原则
1999年2月
54
药物代谢和药物相互作用的体外试验指导原则
1997年4月
55
药物体内代谢和药物相互作用研究指导原则
1997年4月
56
新药临床试验用样品制备技术指导原则
1997年2月
57
新药Ⅰ期临床试验申报资料的内容及格式要求
1995年11月
58
无菌工艺验证资料的申报要求
2013年12月
21
临床药物基因组学:早期临床研究的上市前评估和标签的建议
2013年1月
22
IND(研究新药申请)和BA/BE(生物利用度/生物等效性)研究的安全性报告要求
2012年12月
23
重要上市后药品安全性问题的分类
2012年3月
24
药物安全性信息—FDA与公众的交流
2012年3月
25
确定上市前末期和批准后临床研究所需的安全性数据收集范围
11
疫苗流通和预防接种管理条例(2016年修正)
12
药品注册现场核查管理规定
三、国外药品法规及指导原则清单
序号
名称
颁布时间
国际人用药品注册技术要求-国际协调会(ICH)
1
临床研究报告的结构和内容问与答
2012年6月
2
非抗心律失常药物致QT QTc间期延长及潜在致心律失常作用的临床评价问与答(R1)
2012年4月
2014-05-13
4
药物毒代动力学研究技术指导原则
2014-05-13
5
药物单次给药毒性研究技术指导原则
2014-05-13
6
药物刺激性、过敏性和溶血性研究技术指导原则
2014-05-13
7
药物安全药理学研究技术指导原则
2014-05-13
