(完整版)2018年器械分类目录(新)
解读2018新版《医疗器械分类目录》

解读2018新版《医疗器械分类目录》新版《医疗器械分类目录》是我国医疗器械管理领域的重要文件,对医疗器械的分类和管理起着关键作用。
本文将对该目录的主要内容和意义进行解读。
2018年新版《医疗器械分类目录》是国家药品监督管理局、国家卫生健康委员会联合发布的,自2019年1月1日起正式实施。
目录中包含了对医疗器械的分类、产品范围、管理要求等方面的规定,全面梳理了我国医疗器械市场现状,为医疗器械的生产、流通和使用提供了明确的指导。
一、目录的分类体系《医疗器械分类目录》按照医疗器械的功能和用途进行分类,分为17个大类,共计100个小类。
这种分类体系既考虑了医疗器械的技术特点,又体现了医疗器械的临床应用需求。
通过分类,可以更好地统一和规范不同类型医疗器械的管理,方便企业和医疗机构的运营和使用。
二、目录的主要内容《医疗器械分类目录》对医疗器械的定义、分类和管理要求进行了具体规定。
其中,针对高风险型医疗器械,目录明确规定了准入要求,按照产品的等级,从注册、审评到监管都有相应的要求和流程。
这对于提高我国医疗器械的质量和安全水平非常重要。
此外,在医疗器械分类和编码方面,《医疗器械分类目录》也进行了细化和完善。
新版目录对于有争议的医疗器械分类问题进行了解决,明确了分类标准,降低了因分类不明确而产生的交叉管理问题。
同时,目录还对医疗器械的命名和编码进行了规范,提高了信息交流和管理的效率。
此外,新版目录还增加了一些新的、符合临床需求的医疗器械,如微创手术器械、家庭医疗器械等。
这些器械的添加,使得新版《医疗器械分类目录》更贴合医疗实践,更加全面地覆盖了医疗器械市场的需求。
三、目录的意义与影响新版《医疗器械分类目录》的发布和实施,对于医疗器械行业具有重要意义。
首先,目录的出台进一步规范了医疗器械市场,促进了医疗器械的良性发展。
其次,目录的分类和命名规范,使得医疗器械的信息管理更加便捷高效,提高了监管部门的工作效率。
最后,通过修改完善目录,提高了医疗器械的准入门槛,加强了产品安全性和质量可控性的管理,保护了消费者的合法权益。
新医疗器械分类目录

新医疗器械分类目录新医疗器械分类目录是国家药品监督管理局根据《医疗器械监督管理条例》制定的医疗器械分类标准。
新分类目录于2024年1月1日起正式实施,与之前的旧分类相比,新分类目录系统更为细化和科学。
下面是旧分类对应新分类的完整版:1.未分类设备:无对应的新分类。
2.心电诊断设备:新分类为电生理和心电设备。
3.医用超声诊断设备:新分类为超声和电子医疗设备。
4.射线诊断设备:新分类为射线类、超声和电子医疗设备。
5.医用核素诊断体内摄取设备:新分类为核医学设备。
6.核医学设备:新分类为核医学设备。
7.内窥镜设备:新分类为内窥镜设备。
8.医用光学设备:新分类为光学设备。
9.医用电子设备:新分类为电子医疗设备。
10.医用手术设备:新分类为外科、眼科和牙科设备。
11.医用手术室、成像设备和治疗设备:新分类为外科、眼科和牙科设备。
12.医用麻醉和复苏设备:新分类为麻醉和体外循环设备。
13.附件:新分类为其他。
14.体外循环设备:新分类为麻醉和体外循环设备。
15.医用口腔科设备:新分类为外科、眼科和牙科设备。
16.耳鼻喉科设备:新分类为耳鼻喉科设备。
17.眼科设备:新分类为外科、眼科和牙科设备。
18.口腔科设备:新分类为外科、眼科和牙科设备。
19.物理治疗和康复设备:新分类为物理治疗、康复和护理设备。
20.电子治疗和诊断设备:新分类为电子医疗设备。
21.医用成像设备:新分类为超声和电子医疗设备。
22.医用实验室设备和试剂:新分类为实验室设备、试剂和监测设备。
23.眼科医用光学设备:新分类为光学设备。
24.医用口腔诊断设备:新分类为外科、眼科和牙科设备。
25.医用康复辅助设备:新分类为物理治疗、康复和护理设备。
26.检验设备、试剂和试剂盒:新分类为实验室设备、试剂和监测设备。
27.医用实验室设备:新分类为实验室设备、试剂和监测设备。
28.现场快速诊断设备和试剂:新分类为实验室设备、试剂和监测设备。
29.医用消毒和灭菌设备:新分类为消毒器械和灭菌器械。
(word完整版)医疗器械分类目录(分类)

医疗器械分类目录
关于指定《医疗器械分类目录》的说明
一、《医疗器械分类目录》制定的依据
《医疗器械监督管理条例》及《医疗器械分类规则》(第15号局长令)。
二、《医疗器械分类目录》与《医疗器械分类规则》的关系
《医疗器械分类规则》用于指导《医疗器械分类目录》的制定和确定新的产品注册类别。
我国实行的医疗器械分类方法是分类规则指导下的目录分类制,分类规则和分类目录并存。
一旦分类目录已实施,应执行分类目录。
三、制定分类目录的原则
执行分类规则指导下的目录分类制。
参照国际通行的分类,从严掌握。
使用风险是制定产品分类目录的基础。
分类目录尽可能适应管理的需要,有利于理顺监督管理,做到科学合理.
四、符合医疗器械定义的含药医疗器械为III类医疗器械.
五、由于各种手术包内组件不确定,所以本目录不包含该类产品。
凡手术包内含有III类医疗器械的,作为III类产品管理;只含有II类和I类医疗器械的,作为II类产品管理;只含有I类医疗器械的,作为I类产品管理。
六、依据《医疗器械分类目录》不能确定医疗器械分类时,由省级药品监督管理局根据分类规则进行预先分类,并报我局核定。
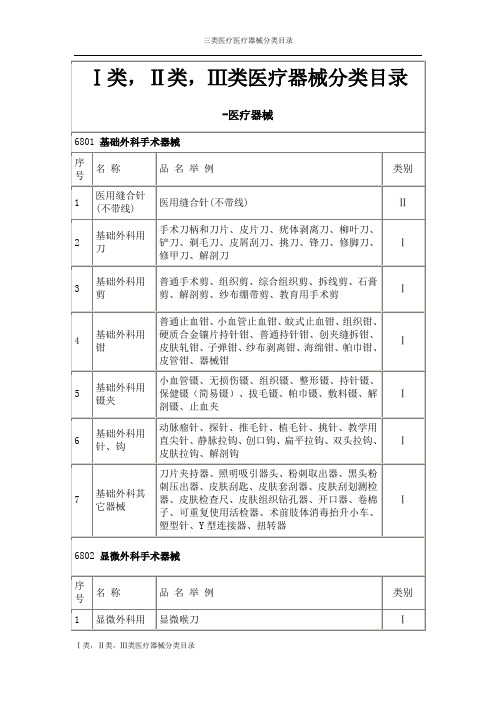
医疗器械分类目录6801基础外科手术器械。
2018医疗器械法律法规目录(最全)

医疗器械法律法规、部门规章制度汇总(2018版)医疗器械重点法律法规解读1.《医疗器械监督管理条例》已经2014年2月12日国务院第39次常务会议修订通过,现将修订后的《医疗器械监督管理条例》(以下简称“《条例》”)公布,自2014年6月1日起施行。
2.《医疗器械标准管理办法》已于2017年2月21日经国家食品药品监督管理总局局务会议审议通过,现予公布,自2017年7月1日起施行。
医疗器械标准,是指由国家食品药品监督管理总局依据职责组织制定、修订,依法定程序发布,在医疗器械研制、生产、经营、使用、监督管理等活动中遵循的统一的技术要求。
在中华人民共和国境内从事医疗器械标准的制定、修订、实施及监督管理,应当遵守法律、行政法规及本办法的规定。
医疗器械标准按照其效力分为强制性标准和推荐性标准。
3.《大型医用设备配置与使用管理办法》卫生部、国家发展和改革委员会、财政部联合制定并下发(卫规财发〔2004〕474号)。
大型医用设备是指列入国务院卫生行政部门管理品目的医用设备以及尚未列入管理品目、省级区域内首次配置的整套单价在500万元人民币以上的医用设备。
大型医用设备的管理实行配置规划和配置证制度。
甲类大型医用设备的配置许可证由国务院卫生行政部门颁发;乙类大型医用设备的配置许可证由省级卫生行政部门颁发。
医疗器械安全使用指南疗机构要加强大型医用设备使用管理,严格操作规范, 保证设备使用安全、有效。
4.《体外诊断试剂注册管理办法修正案》已于2017年1月5日经国家食品药品监督管理总局局务会议审议通过,现予公布,自公布之日起施行。
本办法所称的体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。
可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
按照药品管理的用于血源筛查的体外诊断试剂和采用放射性核素标记的体外诊断试剂,不属于本办法管理范围。
2018医疗器械法律法规目录(最全)

2018医疗器械法律法规目录(最全)【】2018医疗器械法律法规目录(最全)【目录】一、中华人民共和国法律1.《中华人民共和国医疗器械管理法》2.《中华人民共和国药品管理法》3.《中华人民共和国卫生法》4.《中华人民共和国广告法》5.《中华人民共和国产品质量法》二、配套规章1.《医疗器械注册与备案管理办法》2.《医疗器械监督管理办法》3.《医疗器械不良事件报告管理办法》4.《医疗器械广告审核标准》5.《医疗器械生产监督管理办法》三、行业标准1.《医疗器械质量管理体系要求》2.《医用电气设备安全》3.《医疗器械包装》4.《手术室净化空调系统》5.《医疗器械标签与说明》四、法院判例1.【案例1】医疗器械质量纠纷案2.【案例2】医疗器械广告虚假宣传案3.【案例3】医疗器械专利侵权案4.【案例4】医疗器械违规经营案5.【案例5】医疗器械不良事件案五、政策文件1.《医疗器械生产许可证管理办法》2.《医疗器械分销许可证管理办法》3.《医疗器械进口许可证管理办法》4.《医疗器械售后服务管理办法》5.《医疗器械网络销售管理办法》【附件】所涉及附件如下:1. 医疗器械注册申请表格2. 医疗器械不良事件报告表格3. 医疗器械广告审查申请表格4. 医疗器械生产企业许可证样本5. 医疗器械经营企业许可证样本【法律名词及注释】所涉及的法律名词及注释如下:1. 医疗器械管理法:指中华人民共和国颁布的管理医疗器械的法律法规。
2. 医疗器械注册与备案管理办法:指用于管理医疗器械注册和备案的相关规章。
3. 医疗器械质量管理体系要求:规定了医疗器械质量管理体系的基本要求。
4. 医用电气设备安全:指医疗器械中涉及到电气设备的安全管理规范。
5. 医疗器械不良事件报告管理办法:规定了医疗器械不良事件报告的要求和管理办法。
【困难及解决办法】在实际执行过程中,可能遇到的困难及解决办法如下:困难:1. 医疗器械注册和备案流程繁琐,需要大量的时间和精力。
(完整版)新医疗器械分类目录(旧分类对应新分类)

16眼科器械
6823-1超声诊断设备-眼科专用超声脉冲回波设;
6823-3超声治疗设备-超声手术设备
17口腔科器械
6823-3超声治疗设备中的超声洁牙设备(2012版)
18妇产科、辅助生殖和避孕器械
6823-2超声监护设备中的超声多普勒胎儿监护仪(2012版);
6821-8电声诊断仪器(2002版);
6821-3有创医用传感器(2002版);
6821-3无创医用传感器(2002版);
6821-18心电电极(2002版);
6821-19心电导联线(2002版)
08呼吸、麻醉和急救器械
6821-1用于心脏的治疗、急救装置中的心脏除颤器(2002版)
09物理治疗器械
6823-1超声诊断设备中的超声脉冲多普勒成像设备(2012版)
6824医用激光仪器设备
01有源手术器械
6824-1激光手术和治疗设备(除眼科激光光凝机、眼晶体激光乳化设备外)(2002版)(包含医用激光光纤)
06医用成像器械
6824-2激光诊断仪器(2002版);
6824-2激光诊断仪器(2002版)
6807-6胸腔心血管外科用其他器械中的双头剥离匙、内膜剥离器;
6807-6胸腔心血管外科用其他器械中的血管扩张器、血管牵开器;
6807-6胸腔心血管外科用其他器械中的血管打洞钳(器)、心房打洞器、胸骨手钻;
6807-7胸心血管外科用吸引器除静脉撑开器
6808腹部外科手术器械
02无源手术器械
6808-2腹部外科用剪;
6809-5泌尿肛肠科用针、钩;
6809-6泌尿肛肠科用其他器械中的尿道扩张器
Ⅰ类,Ⅱ类,Ⅲ类医疗器械分类目录
Ⅰ
3
泌尿肛肠科用钳
血管阻断钳、骼血管阻断钳、骼静脉侧壁钳
Ⅱ
肾蒂钳、肠钳、直肠活体取样钳、膀胱肿瘤匙钳、膀胱颈钳、痔核钳
Ⅰ
5
泌尿肛肠科用钩、针
膀胱拉钩、前列腺拉钩、肛门探针
Ⅰ
6
泌尿肛肠科用其他器械
尿道扩张器、肛门镜、阴茎夹、排便清肠器
Ⅰ
J型导尿管、肛肠手术用多功能小针刀、弯头负压吸力式套扎枪
Ⅱ
血管扩张器、血管牵开器、胸骨手钻、双头剥离匙、肋骨骨膜剥离子、内膜剥离器
Ⅰ
心血管吻合器
Ⅲ
7
胸腔心血管外科用吸引器
心内吸引器(头)、左房引流管、冠状动脉吸引器、冠状动脉灌注器、大隐静脉冲洗管、静脉撑开器、短柄吸引器(头)
Ⅱ
6808腹部外科手术器械
序号
名 称
品 名 举 例
类别
2
腹部外科用剪
胃内手术剪、直角剪
Ⅱ
6810矫形外科(骨科)手术器械
序号
名 称
品 名 举 例
类别
1
矫形(骨科)外科用刀、锥
椎管铲刀、椎管锉刀、手锥
Ⅱ
丝锥、髓腔铰刀、加压螺纹钉铰刀、截断刀、截骨刀、胫骨切刀、石膏刀、胫骨切割器、髋关节成型凹凸钻、钻头、铰孔钻、手枪式手摇骨钻
Ⅰ
2
矫形(骨科)外科用剪
双关节棘突骨剪、双关节咬骨剪、骨剪、膝关节韧带手术剪、石膏剪、钢丝剪
Ⅰ
6812妇产科用手术器械
序号
名 称
品 名 举 例
类别
1
妇产科用刀
碎胎刀
Ⅰ
2
妇产科用剪
一次性使用脐带剪
Ⅱ
子宫剪、剖腹产剪、脐带剪、会阴剪
2018医疗器械法律法规目录(最全)

2018医疗器械法律法规目录(最全) 2018医疗器械法律法规目录目录:一、医疗器械法律法规概述1.《医疗器械管理条例》2.《医疗器械分类目录》3.《医疗器械注册管理办法》4.《医疗器械生产企业许可管理办法》5.《医疗器械经营企业许可管理办法》6.《医疗器械广告审查管理办法》7.《医疗器械生产企业质量管理规范》8.《医疗器械经营企业质量管理规范》9.《医疗器械不良事件管理暂行规定》10.《医疗器械不良事件报告与处理管理规定》二、医疗器械注册与备案1.《医疗器械注册与备案办法》2.《医疗器械注册申请技术审评操作规范》3.《医疗器械注册证书管理规定》4.《医疗器械备案管理办法》5.《医疗器械备案结果发布管理办法》6.《医疗器械注册与备案信息发布管理办法》三、医疗器械生产许可1.《医疗器械生产许可申请与管理办法》2.《医疗器械生产许可证管理办法》3.《医疗器械生产许可信息发布管理办法》四、医疗器械经营许可1.《医疗器械经营许可申请与管理办法》2.《医疗器械经营许可证管理办法》3.《医疗器械经营许可信息发布管理办法》五、医疗器械广告审查1.《医疗器械广告审查申报技术指南》2.《医疗器械广告审查规范》3.《医疗器械广告审查费收费标准》六、医疗器械质量管理1.《医疗器械质量管理体系规范》2.《医疗器械不良事件管理规程》3.《医疗器械风险管理指南》4.《医疗器械临床试验技术指南》七、附件1.《医疗器械申报注册申请表格》2.《医疗器械备案申请表格》3.《医疗器械生产许可申请表格》4.《医疗器械经营许可申请表格》5.《医疗器械广告审查申请表格》6.《医疗器械质量监督抽查申请表格》法律名词及注释:1.医疗器械管理条例: 国家卫生健康委员会发布的对医疗器械监督管理的法规。
2.医疗器械分类目录: 医疗器械分门别类的目录,用于对不同类别医疗器械的管理。
3.医疗器械注册管理办法: 对医疗器械注册及相关管理流程的规定。
4.医疗器械生产企业许可管理办法: 对医疗器械生产企业许可及相关管理流程的规定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6804眼科手术器械
6807胸腔心血管外科手术器械
6808腹部外科手术器械
6809泌尿肛肠外科手术器械
6810矫形外科(骨科)手术器械
6812妇产科用手术器械
6813计划生育手术器械
6815注射穿刺器械
6816烧伤(整形)科手术器械
6820普通诊察器械
6821
6822 医用光学器具、仪器及内窥镜设备
6823医用超声仪器及有关设备
6824医用激光仪器设备
6825医用高频仪器设备
6826物理治疗设备
6827中医器械
6831医用X射线附属设备及部件
6832医用高能射线设备
6833医用核素设备
6834医用射线防护用品、装置
6840临床检验分析仪器
6841医用化验和基础设备器具
6845体外循环及血液处理设备
6846植入材料和人工器官
6854手术室、急救室、诊疗室设备及器具
6857消毒和灭菌设备及器具
6858医用冷疗、低温、冷藏设备及器具
6863口腔科材料
6864医用卫生材料及敷料。
