高中化学典型物质分子的空间构型
高中化学选择性必修二 第2章第2节 分子的空间结构 第一课时

A.CH3OH C.C2H4
B.C3H8 D.CH4
课堂练习
4.下列分子的空间结构模型正确的是( D )
A.CO2的空间结构模型: B.H2O的空间结构模型: C.NH3的空间结构模型: D.CH4的空间结构模型:
课堂练习
5. (1)硫化氢(H2S)分子中,两个H—S的夹角接近90°,说明H2S分子的空间结构为 ___V_形____。 (2)二硫化碳(CS2)分子中,两个C==S的夹角是180°,说明CS2分子的空间结构为 __直__线__形__。 (3)能说明CH4分子不是平面四边形,而是正四面体结构的是____a_d_____(填字母)。 a.两个键之间的夹角为109°28′ b.C—H为极性共价键 c.4个C—H的键能、键长都相等 d.二氯甲烷(CH2Cl2)只有一种(不存在同分异构体)
新课讲解 一、分子结构的测定
红外光谱仪原理示意图
测分子体结构:红外光谱仪→吸收峰→分析官能团、化学键。
新课讲解 一、分子结构的测定
例如,通过红外光谱仪测得某未知物的红外光谱图如上图所示,发现 有O—H、C—H、和C—O的振动吸收。因此,可以初步推测该未知 物中含有羟基(—OH)。
新课讲解 一、分子结构的测定
109°28′
四氯化碳 CCl4 正四面体形
109°28′
新课讲解 二、多样的分子空间结构
6.其他多原子分子
P4
椅式 C6H12
P4O6
P4O10
船式
C6H12
S8
C60 SF6
分子空间结构与其稳 定性有关。例如,上 图中S8像顶皇冠,如 果把其中一个向上的 硫原子倒转向下,尽 管也可以存在,却不 如皇冠式稳定;又如 ,椅式C6H12比船式 C6H12稳定。
〔人教课标版〕高中化学分子的空间构型教学PPT1

价层 电子 对数
价层
电子
对排 布
成键 电子 对数
孤对 电子 对数
分子 电子对的排 分子构型 类型 布方式
实例
5
0 AB5
三角双锥 PCl5
4 三角 5 双锥
3
1 AB4 2 AB3
变形四面 体
SF4
T形
ClF3
2
3 AB2
直线形
I
3
价层 价层电 成键 孤对 分子 电子对的排 分子构型 实 例
பைடு நூலகம்
电子 子对排 电子 电子 类型 布方式
利用价层电子对互斥理论,可以预测大多 数主族元素的原子所形成的共价化合物分子或 离子的空间构型。
中心原子的价层电子对的排布和 ABn 型共价分子的构型
价 价层 成 孤 分子 电子对的排 分子构型 实 例
层 电子 键 对 类型 布方式
电 对排 电 电
子 布 子子
对
对对
数
数数
直线 2 形 2 0 AB2
BeCl2分子形成
2p 2s
2p
2s 激发
杂化 直线形
Be基态
180
Cl Be
激发态
Cl
键合
sp杂化态 直线形
化合态
碳的sp杂化轨道
sp 杂 化 : 夹 角 为 180° 的 直 线 形 杂 化轨道。
NH3 的空间构型
H 2 O 的空间构型
几种常见的杂化轨道类型
杂化类型 sp sp2
sp3
20、赚钱之道很多,但是找不到赚钱 的种子 ,便成 不了事 业家。 21、追求让人充实,分享让人快乐。
22、世界上那些最容易的事情中,拖 延时间 最不费 力。 23、上帝助自助者。
新教材2023版高中化学专题4分子空间结构与物质性质第一单元分子的空间结构第1课时分子的空间结构模型

第1课时分子的空间结构模型课程目标1.能用杂化轨道理论判断分子的空间构型。
2.理解价层电子对互斥理论的含义。
3.知道一些常见简单分子的空间构型。
图说考点基础知识[新知预习]一、杂化轨道理论1.杂化轨道在形成多原子分子的过程中,中心原子的若干____________的原子轨道重新组合,形成的一组能量相等、成分相同的新轨道。
.用杂化轨道理论解释甲烷分子的空间构型碳原子2s轨道上的1个电子进入2p空轨道,________2s轨道和________2p轨道“混合”,形成________________的4个sp3杂化轨道碳原子的4个____________轨道分别与氢原子的________轨道重叠,形成4个相同的σ键CH分子为____________结构,分子中C—H键之间的夹角都是3.用杂化轨道理论分析C2H6、C2H4、C2H2的成键情况烷烃中C原子均采取sp3杂化;烯烃中碳碳双键两端的碳原子采取sp2杂化;炔烃中碳碳三键两端的碳原子采取sp杂化。
二、价层电子对互斥理论1.价层电子对互斥理论分子的____________是“价层电子对”相互________的结果。
2.价层电子对互斥模型与分子的立体结构(1)(2)中心原子有孤电子对的分子[即时性自测]1.下列关于杂化轨道的叙述中,不正确的是( )A.分子的中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构B.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对C.杂化前后的轨道数不变,但轨道的形状发生了改变D.sp3、sp2、sp杂化轨道的夹角分别为109° 28′、120°、180°2.下列分子的立体构型,可以用sp杂化方式解释的是( )A.HCl B.BeCl2C.BCl3 D.CCl43.下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是( )A.sp杂化轨道的夹角最大B.sp2杂化轨道的夹角最大C.sp3杂化轨道的夹角最大D.sp3、sp2、sp杂化轨道的夹角相等4.用价层电子对互斥理论预测下列粒子的立体结构是三角锥形的是( )A.PCl3 B.BeCl2C. N H4+ D.SO35.下列分子或离子中心原子形成4对σ键电子对的是( )A.CO2 B.SO2C. C O32− D.CH46.回答下列问题:(1)计算下列分子或离子中点“·”原子的价电子对数。
高中化学选修3分子的立体构型

第二章 分子结构与性质 第二节分子的立体结构 (第一课时)
复习回顾
σ键 共价键
成键方式 “头碰头”,呈轴对称
π键
键能 键参数
成键方式 “肩并肩”,呈镜像对称
键长
衡量化学键稳定性
键角 描述分子的立体结构的重要因素
一、形形色色的分子
1、双原子分子(直线型)
O2
2、三原子分子立体结构(有直线形和V形)
【选修3《物质结构与性质》】
第 二 章《分子结构与性质》
第二节 分子的立体结构
课时2
值得注意的是价层电子对互斥模型只能解释化合物分子的空 间构形,却无法解释许多深层次的问题,如无法解释甲烷中四个 C H的键长相同、键能相同及H—C —H的键角为109 28′。因 为按照我们已经学过的价键理论,甲烷的4个C — H单键都应该 是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨 道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠, 不可能得到四面体构型的甲烷分子。 碳原子:
课堂练习
• 美国著名化学家鲍林(L.Pauling, 1901— 1994)教授具有独特的化学想象力:只要 给他物质的分子式,他就能通过“毛估” 法,大体上想象出这种物质的分子结构模 型。请你根据价层电子对互斥理论,“毛 估”出下列分子的空间构型。 • PCl5 三角双锥形 • PCl3 三角锥形 • SO3 平面三角形 • SiCl4 正四面体
2s
BeCl2分子形成
2p
激发
2s
2p 杂化
直线形
Be基态
激发态
sp杂化态 直线形
180
Cl
Be
Cl
键合
高中化学有机物分子共面、同分异构体

考点一有机物分子中原子的共线与共面1.三种基本模型解读(1)甲烷分子中所有原子一定不共平面,最多有3个原子处在一个平面上,即分子中碳原子若以四条单键与其他原子相连,则所有原子一定不能共平面(如图①)。
(2)乙烯分子中所有原子一定共平面,若用其他原子代替其中的任何氢原子,所得有机物中所有原子仍然共平面(如图②)。
(3)苯分子中所有原子一定共平面,若用其他原子代替其中的任何氢原子,所得有机物中的所有原子也仍然共平面(如图③)。
2.解题方法突破(1)展开立体构型法其他有机物可看作以上三种典型分子中的氢原子被其他原子或原子团代替后的产物,但这三种分子的空间结构基本不变。
如CH2===CHCl,可看作Cl原子代替了乙烯分子中H原子的位置,故六个原子都在同一平面上。
(2)单键旋转法碳碳单键两端碳原子所连原子或原子团可以以“C—C”为轴旋转。
例如因①键可以旋转,故的平面可能和确定的平面重合,也可能不重合。
因而分子中的所有原子可能共面,也可能不共面。
(3)注意题目要求题目要求中常有“可能”、“一定”、“最多”、“最少”、“所有原子”、“碳原子”等限制条件。
如分子中所有原子可能共平面,分子中所有碳原子一定共平面而所有原子一定不能共平面。
[对点训练]1.下列有机物中所有原子一定共平面的是()A.B.C.D.2.下列有机物分子中,所有原子一定处于同一平面的是()3.下列有关CH3—CH===CH—C≡C—CF3分子结构的叙述中,正确的是()A.6个碳原子有可能都在一条直线上B.6个碳原子不可能都在一条直线上C.6个碳原子不可能都在同一平面上D.所有原子有可能在同一平面上4.下列有关分子结构的叙述中正确的是()①除苯环外的其余碳原子有可能都在一条直线上②除苯环外的其余碳原子不可能都在一条直线上③12个碳原子不可能都在同一平面上④12个碳原子有可能都在同一平面上A.①②B.②③C.①③D.②④5.下列分子中的碳原子可能处在同一平面内的是()6.有机化合物X是一种医药中间体,其结构简式如图所示。
三维化学-简单分子的空间结构
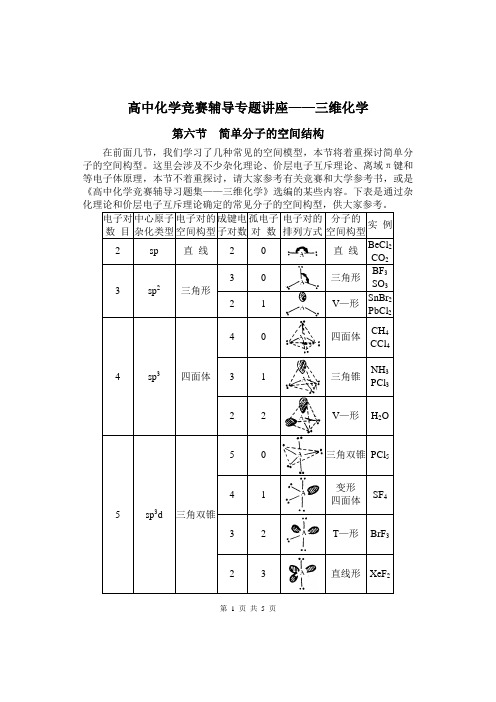
高中化学竞赛辅导专题讲座——三维化学第六节简单分子的空间结构在前面几节,我们学习了几种常见的空间模型,本节将着重探讨简单分子的空间构型。
这里会涉及不少杂化理论、价层电子互斥理论、离域π键和等电子体原理,本节不着重探讨,请大家参考有关竞赛和大学参考书,或是《高中化学竞赛辅导习题集——三维化学》选编的某些内容。
下表是通过杂第 1 页共 5 页【讨论】给出一个分子或离子,我们一般先找出中心原子,确定它的成键电子对数和孤电子对数,判断杂化类型和电子对构型,再判断分子或离子的构型。
由于等电子体具有类似的空间结构,我们也可以据此判断复杂的分子或离子的空间构型。
我们结合以下例题具体讨论。
【例题1】磷的氯化物有PCl3和PCl5,氮的氯化物只有NCl3,为什么没有NCl5?白磷在过量氯气(其分子有三种不同的相对分子质量)中燃烧时,其产物共有几种不同分子。
①【分析】PCl5中心原子P有3d轨道,能与3s、3p轨道一起参与杂化,杂化类型为sp3d,构型为三角双锥。
第二问是通过同位素来考察三角双锥的空间构型:“三角”是一个正三角形的三个顶点,等价的三个点;“双锥”是对称的两个锥顶。
P35Cl5的37Cl的一取代物可在角上和锥顶上2种情况;37Cl 的二取代物可在两个角上、两个锥顶上和一个角一个锥顶上3种情况;利用对称性,三取代物、四取代物与二取代物、一取代物是相同的。
共计有(1+2+3)×2=12种。
【解答】N原子最外层无d轨道,不能发生sp3d杂化,故无NCl5。
12种。
【练习1】PCl5是一种白色固体,加热到160℃不经过液态阶段就变成蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3g/L,极性为零,P-Cl键长为204pm和211pm两种。
继续加热到250℃时测得压力为计算值的两倍。
PCl5在加压下于148℃液化,形成一种能导电的熔体,测得P-Cl的键长为198pm和206pm两种。
(P、Cl相对原子质量为31.0、35.5)回答如下问题:①180℃下,PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。
高考化学一轮复习考点突破:杂化轨道与分子的空间构型(教与学课件)

空间成四面体分布。为了更好地说明这类问题,
Pauling等人以价键理论为基础,提出杂化轨道理
论
三.杂化轨道与分子的空间构型:
2.杂化轨道理论的要点:
其要点为:
1.在形成分子时,中心原子地能级相近地原 子轨道要打乱重组(杂化),形成能级相等的 杂化轨道。
2.n个原子轨道杂化,形成n个杂化轨道。
3.杂化轨道与其它原子成键时,共用电子对 间要采取排斥力最小的位置,以使分子系统的 能量最低,分子最稳定。
三.杂化轨道与分子的空间构型:
3.杂化轨道类型与分子的空间构型与分子的空间构型。 2)sp2杂化:如BF3,θ =1200 ∴ BF3为平面正方形,如下图所示:
三.杂化轨道与分子的空间构型:
3.杂化轨道类型与分子的空间构型与分子的空间构型。 3)sp3杂化: – CH4、CCl4:
cos
1
三.杂化轨道与分子的空间构型: 3.杂化轨道类型与分子的空间构型与分子的
空间构型。
1)sp杂化:
s轨道与p轨道形成sp杂化轨道后,“+”号部分 增大,“—”号减小。当它们与其它原子轨道 重叠成键时,重叠得更多,形成的键更稳定。
高中化学 专题4 分子空间结构与物质性质 第1单元 分子构型与物质的性质 第1课时 分子的空间构型

解析:C2H2 分子中,两个碳原子均采用 sp 杂化,每个 C 原子的 1 个 sp 轨道分别与 1 个 H 原子的 1s 轨道重叠形成 C—H σ 键,两个 C 原子各以 1 个 sp 轨道重叠形成 C—C σ 键,各以两个未杂化的 2p 轨道重叠形成 2 个 π 键,故 B 错。
答案:B
2.下列分子中,所有原子不可能处于同一平面的是
示为:
(2)共价键的形成:碳原子的 4 个____s_p_3____轨道分别与 4 个氢原子的____1_s_____轨道形成 4 个相同的___σ_键______。
(3)甲烷的分子构型:甲烷分子为_正__四__面__体___结构,4 个 C—H 键是等同的,键角__1_0_9_._5_°___。
4.分子的空间构型与物质的性质 具有相似分子空间构型的物质,在性质方面通常表现出 一定的__相__似__性____。
基础过关对点练
1.有关乙炔分子中的化学键描述不正确的是( ) A.两个碳原子采用 sp 杂化方式 B.两个碳原子采用 sp2 杂化方式 C.每个碳原子都有两个未杂化的 2p 轨道形成 π 键 D.两个碳原子形成两个 π 键
_1_个__s_轨_____ _道__与__2__个___ ___1_2__0_°___
_平__面__三__角__形_ BF3 、
p轨道 化 _________
CH2===CH2
sp _1_个__s_轨___道__ 杂 _与__1_个___p_轨__
道 化 _________
__1_8_0_°_ ___直__线__形___
价电子对数目与价电子对构型关系
价电子对数目 2
3
4
5
6
平面三 四面 三角双 八面 价电子对构型 直线形
