分析方法验证 - 专属性
分析方法验证与确认管理规程

分析方法验证与确认管理规程一、目的为了确保分析方法的准确性、可靠性和适用性,保证分析结果的质量,特制定本管理规程。
二、适用范围本规程适用于公司内所有分析方法的验证与确认工作,包括但不限于原材料、中间产品、成品的质量控制分析方法,以及清洁验证、工艺验证等过程中所使用的分析方法。
三、职责分工1、研发部门负责新分析方法的开发,并在方法转移前完成方法的验证工作。
2、质量控制部门负责接收转移的分析方法,并对其进行确认。
在日常工作中,负责按照经过验证或确认的分析方法进行检验,并对方法的适用性进行监控。
3、验证小组由质量控制、研发、生产等相关部门人员组成,负责对重大或复杂的分析方法验证与确认工作进行方案的制定、审核和结果的评价。
四、分析方法验证的类型1、鉴别试验用于确定样品中是否存在被分析物。
2、定量测定包括含量测定、杂质测定等。
3、限度试验用于检测样品中被分析物的含量是否低于或高于规定的限度。
五、分析方法验证的指标1、专属性指在其他成分(如杂质、辅料等)可能存在的情况下,能够准确地测定被分析物的能力。
2、准确性指测定结果与真实值或参考值接近的程度。
3、精密度包括重复性、中间精密度和重现性。
重复性是在相同条件下,由同一分析人员测定结果的精密度;中间精密度是在同一实验室,不同时间、不同分析人员、不同设备等条件下测定结果的精密度;重现性是在不同实验室,由不同分析人员使用不同设备测定结果的精密度。
4、检测限指样品中能够被检测出的被分析物的最低量。
5、定量限指样品中能够被定量测定的被分析物的最低量。
6、线性指在给定的范围内,测试结果与样品中被分析物浓度直接呈正比关系的程度。
7、范围指能够达到一定的准确性、精密度和线性的被分析物浓度的区间。
8、耐用性指在测定条件有小的变动时,分析方法仍然能够保持其有效性的能力。
六、分析方法验证的流程1、验证方案的制定由相关部门根据分析方法的特点和预期用途,制定详细的验证方案,明确验证的指标、方法、接受标准、样品制备、检验步骤等内容。
药品质量标准分析方法验证

以保证检出需控制的杂质。
➢两种方法:直观法、信噪比法。
编辑课件
方法验证的具体内容
直观法
直观评价可以用于非仪器分析方法,也可用于仪器分 析方法。检测限的测定是通过对一系列已知浓度被测物 的试样进行分析,并以能准确、可靠检测被测物的最小 量或最低浓度来建立。
杂质检查
➢为何要作专属性-作为纯度检查,所采用的分析方法应确保可检出被 分析物中杂质的含量。
➢试验方法
杂质可获得的情况下-向供试品中加入一定量的杂质
在杂质不能获得的情况下 -
采用另一种合理但分离或检测原理不同的 方法 将供试品破坏后与破坏前比较
编辑课件
方法验证的具体内容
专属性
含量测定
➢含量测定目的-得到供试品中被分析物的含量或效价的准确结果。
范围 ➢定义:系指能够达到一定的准确度、精密度和线性,测
试方法适用的试样中被分析物高低限浓度或量的区间。
➢特点:范围是规定值,在试验研究开始前应确定验证的
范围和试验方法。
➢试验方法:可采用符合要求的原料药配制成不同的浓度,
按照相应的测定方法进行试验。
编辑课件
方法验证的具体内容
➢不同项目范围的确定-原则上应根据分析方法的具体应用和
➢试验方法
杂质可获得的情况下-向供试品中加入一定量的杂质
在杂质不能获得的情况下 - 采用另一种合理但分离或检测原理不同 的方法
将供试品破坏后与破坏前比较,必要时 进行色谱纯度检查。
编辑课件
方法验证的具体内容
线性
➢定义:系指在设计的测量范围内,检品结果与供试品
中被分析物的浓度(量)直接呈线性关系的程度。
原则:根据改变的程度进行相应的再验证,从而保证
通用分析方法验证方案

xxxx含量分析方法验证方案起草签名日期审核签名日期批准签名日期变更历史1 验证目的 (3)2 验证范围 (3)3 验证时间 (3)4职责 (3)5 接受标准 (3)6 检测条件 (4)6.1 仪器、对照品、测试品 (4)6.2 检测方法 (4)7 验证内容 (5)7.1 专属性 (5)7.2 系统适应性 (6)7.3 线性及范围 (6)7.4 准确度 (8)7.5 精密度 (9)7.5.2 方法精密度 (10)7.5.3 中间精密度 (11)7.6 耐用性 (12)7.7 溶液稳定性 (14)7.8 三批样品含量测定 (15)7 偏差及异常处理 (16)8 验证结果结论与评价 (17)1 验证目的本分析方法验证方案的目的在于验证XXX含量分析方法,能有效的用于含量测定。
2 验证范围1)系统适应性2)专属性3)线性及范围4)精密度5)准确度6)耐用性7)溶液稳定性8)三批样品含量测定3 验证时间2013年1月4职责质量分析室分析员:起草验证方案并付诸实施,起草验证报告并做好相关的原始记录。
质量分析室副主任:审核验证方案及验证报告;准备相关仪器、试剂及人员安排,在验证实施过程中提供技术指导。
质量分析室主任:批准验证方案及验证报告。
6检测条件6.1仪器、对照品、测试品6.1.1 仪器6.1.2 对照6.1.3 测试品6.2检测方法6.2.1色谱条件色谱柱:Welch Ultimate RP 4.6*250mm 5um进样量:20ul柱温:25℃检测波长:298nm流动相A:20Mmol/L的磷酸二氢钾溶液(用氢氧化钾调节pH=5.70)流动相B:乙腈6.2.2溶液配制对照溶液: 称取约25.0mgXXXX对照品,置25ml容量瓶中,用流动相A溶解并稀释至刻度,作为对照品溶液。
供试液:称取约25.0mgXXXX供试品,置25ml容量瓶中,用流动相A溶解并稀释至刻度,作为供试品溶液。
7验证内容7.1专属性7.1.1 溶液配制B10:取25.0mgB10,精密称定,置25 ml容量瓶中,用流动相A并稀释至刻度,摇匀,即可。
检验分析方法的验证和确认培训课件

3
875
1764 95.59
7
881
1341 98.92
8
882
465
1340 98.49 97.7
9
883
1328
95.7
10
885
2240 97.13
11
884
1395
2254 98.21 97.51
12
881
2237
97.2
进行统计分析,结果平均回收率为98.15,RSD=2.65%。
检验分析方法的验证和确认
检验分析方法的验证和确认
8
二、分析方法验证
1、分析方法验证的定义:是根据检测项目的要求,预先设置一 定的验证内容,并通过设计合理的试验来验证所采用的分析方法 能否符合检测项目的要求。
2、分析方法验证的目的: 1)证明采用的分析方法是科学、合理,
2)证明分析方法能有效控制药品的内在质量。
♦ 验证过程和结果均应记载在标准起草或修订说明中。
成分相对于主摹被分析物的重量/重量首分比或峰面积百
分比。
检验分析方法的验证和确认
27
某成分含量测定-回收率1
编号 样品含 加入对 测得 回收率 平均回 RSD(%) 量(mg) 照品的 总量 (%) 收率(%) 量(mg)
1
881 930 1853 104.52 97.22 3.71
2
877
1785 97.63
回收试验: 加样回收试验:
检验分析方法的验证和确认
24
4)准确度 —原料药
➢ 用已知纯度的被分析物(如参比物质)进行测定 ➢ 用提出的分析方法的检测结果与第二种成熟的分析方法的
检测结果做比较,而后者的准确性是有规定的和(或)经确 定的。 ➢ 准确性可以在精密度、线性和专属性建立后,推论而得.
分析方法验证的目的与内容

谢 谢 / THANKS
制作人|刘清新
分析方法验证的目的与内容
分析方法验证的目的与内容
一、分析方法验证的目的 证明采用的方法是否适合相应检测要求。
起草药品质量标准 生产工艺变更 制剂组分改变 原分析方法修订
均需对分析方法进行验证
分析方法验证的目的与内容
二 、需进行验证的分析项目: 鉴别试验、限度或定量检查、含量测定、 制剂中其他成分(防腐剂等)的测定。 制剂的溶出度、释放度等的检查 三、分析方法验证的内容: 验证指标:准确度、精密度、专属性、检 测限、定量限、线性、范围和耐用性
4
分析方法验证的目的与内容
分析方法验证内容的选择原则: 1. 用于鉴别试验:只要求专属性、耐用性 2. 用于原料药中杂质测定和制剂中降解产物测定的方法:
①用于定量:除检测限不要求外,其余指标均要求。 ②限度检查:只要求检测限、专属性、耐用性 3. 原料、制剂的含量测定及溶出度测定:不要求检测限和 定量限,其余均要求。
分析方法验证的目的与内容
分析项目和验证指标
内容
鉴别
杂质测定 定量 限度
含量测定及 溶出量测定
校正因子
准确度
—
+
—
+
+
精密度 重复性
—
+
—
+
+
中间精密度 —
+①
—
①
+
+
专属性②
+
+
+
+
+
检测限
—
—③
+
—
+
定量限
—
&性
药品质量标准分析方法验证的内容有

体内药分作业J药剂0901 3091158012 钱晨药品质量标准分析方法验证的内容有:准确度,精密度(包括重复性,中间精密度和重现性),专属性,检测限,定量限,线性,范围和耐用性。
一、专属性1、体内:必须证明所测定的物质是原形药物或特定的活性代谢物,内源性物质和相应的代谢物不得干扰样品的测定。
对于色谱法至少要提供空白生物样品色谱图,空白生物样品外加对照色谱图记用药后的生物样品色谱图。
对于复方制剂应特别加强专属性研究,以排除可能的干扰。
2、体外:专属性系指在其他成分(如杂质,降解产物,辅料等)可能存在的情况下,采用的方法能正确测定出被测物的特性。
鉴别反应,杂质检查和含量测定方法,均应考察专属性。
如方法不够专属,应采用多个方法予以补充。
A、鉴别反应应能与可能共存的物质或结构相似的化合物区分。
不含被测物成分的供试品,以及结构相似或组分中的有关化合物,应均呈负反应。
B、含量测定和杂质测定色谱法和其他分离方法,应附代表性图谱,以说明方法的专属性,并标明诸成分在图谱中的位置,色谱中的分离应符合要求。
二、标准曲线和线性范围1、体内:根据所测定物质的浓度与响应的相关性,用回归分析方法获得标准曲线。
标准曲线高低浓度范围为线性范围,在线性范围内浓度测定结果应达到实验要求的精密度和准确度。
必须用至少6个浓度建立标准曲线,应使用与待测样品相同的生物介质,线性范围要能覆盖全部待测浓度,不允许将线性范围外推求算未知样品的浓度。
标准曲线不包括零点。
标准曲线上各浓度点的实测值与标示值的偏差(bias)在可接受范围内时,可判定标准曲线合格。
回归值系将各浓度点的响应值代人标准曲线计算所得的浓度值;标示值系指制备标准曲线时,各相应浓度点的配制浓度,标准曲线上各浓度点偏差的可接受范围一般规定为:最低浓度点的偏差在±20%以内,在其余各浓度点的偏差在±15%以内。
只有合格的标准曲线才能用于临床待测样品的浓度计算。
当线性范围较宽时,推荐采用加权最小二乘法(weighted least square method)进行同归计算2、体外:线性是只在设计范围内,测试结果与试样中被测物浓度直接呈正比关系的程度。
中国药典2020年版 9101 分析方法验证指导原则
9101分析方法验证指导原则分析方法验证(analytical method validation)的目的是证明建立的方法适合于相应检测要求。
在建立药品质量标准、变更药品生产工艺和制剂组分、修订原分析方法时,需对分析方法进行验证。
生物制品质量控制中采用的方法包括理化分析方法和生物学测定方法,其中理化分析方法的验证原则与化学药品基本相同,所以可参照本指导原则进行,但在进行具体验证时还需要结合生物制品的特点考虑;相对于理化分析方法而言,生物学测定方法存在更多的影响因素,因此本指导原则不涉及生物学测定方法验证的内容。
验证的分析项目:鉴别试验、杂质检查(限度或定量分析)、含量测定(包括特性参数和含量/效价测定,其中特性参数如:药物溶出度、释放度等)。
验证的指标有:专属性、准确度、精密度(包括重复性、中间精密度和重现性)、检测限、定量限、线性、范围、耐用性。
在分析方法中,须用标准物质进行试验。
由于分析方法具有各自的特点中,并随分析对象而变化,因此需要视具体情况拟订验证的指标。
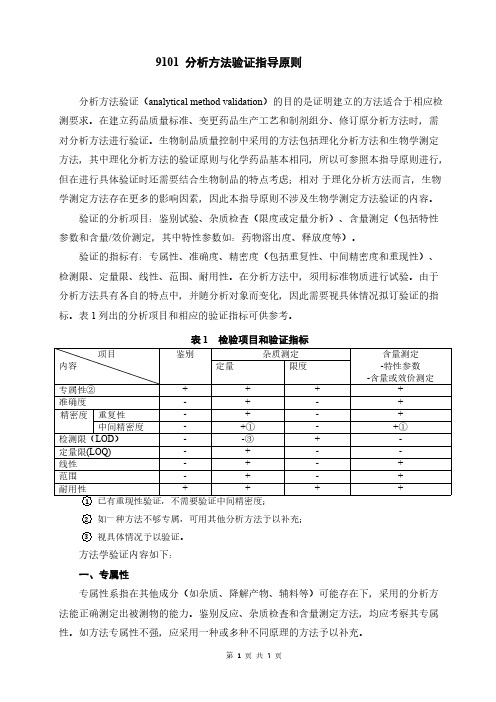
表1列出的分析项目和相应的验证指标可供参考。
表1检验项目和验证指标项目内容鉴别杂质测定含量测定-特性参数-含量或效价测定定量限度专属性②++++准确度-+-+精密度重复性-+-+中间精密度-+①-+①检测限(LOD)--③+-定量限(LOQ)-+--线性-+-+范围-+-+耐用性++++ 1已有重现性验证,不需要验证中间精密度;2如一种方法不够专属,可用其他分析方法予以补充;3视具体情况予以验证。
方法学验证内容如下:一、专属性专属性系指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的分析方法能正确测定出被测物的能力。
鉴别反应、杂质检査和含量测定方法,均应考察其专属性。
如方法专属性不强,应采用一种或多种不同原理的方法予以补充。
1.鉴别反应应能区分可能共存的物质或结构相似的化合物。
不含被测成分的供试品,以及结构相似或组分中的有关化合物,应均呈阴性反应。
化学药物分析方法验证的内容和评价

化学药物分析方法验证的内容和评价质量可控是活性化合物成药及进行药品安全有效性评价的前提。
对药品的质量进行控制应该是多方面的,其中包括生产环境的控制、原辅料来源和质量的控制、生产工艺过程的控制,以及按照质量标准进行成品检验控制等。
但是,在药品研发过程中,揭示药品的品质、控制药品的质量,通常是要针对研制药品的特性 (主药的理化性质及制剂的质量要求等 )确定相应的研究测试项目,再根据测试项目的需要,建立适宜的分析方法 (包括方法的选择和方法的验证 ),最后是根据药品质量的要求及安全性研究结果确定各测试项目的限度,起草制订检验药品质量的质量标准。
分析方法是揭示药品品质的工具和手段,方法验证是判断采用的分析方法是否科学、可行的过程。
实际上,方法验证就是根据确定的检测项目的要求,预先设置一定的验证内容,并通过设计合理的试验来验证所采用的分析方法能否符合检测项目的要求。
下面就根据《化学药物质量控制分析方法验证技术指导原则》解读分析方法验证的内容和评价要点,在对目前申报资料中分析方法验证工作中存在的问题进行分析的基础上,以高效液相色谱法为例,阐述方法验证的思路及验证要点,希望能对药物研发者有所帮助。
一、方法验证的内容首先应该明确的是:方法验证的内容应根据检测项目的要求,同时结合所采用的分析方法的特点确定。
相同的分析方法用于不同的检测项目时,其验证要求是不同的。
例如,采用高效液相色谱法用于制剂的鉴别和杂质定量检查时的验证要求是不同的;前者重点要验证方法的专属性,而后者重点要验证方法的专属性、准确度和定量限。
通常需要验证的检测项目:鉴别、杂质检查 (限度试验、定量试验 )、定量测定 (含量测定、溶出度、释放度等 ),还有其他特定的检测项目 (粒径分布、分子量分布)等。
方法验证的内容包括专属性、线性、范围、准确度、精密度、检测限、定量限、耐用性 (粗放度 )和系统适用性等。
1、专属性专属性系指在其他成分 (如杂质、降解物、辅料等 )存在下,采用的分析方法能够正确鉴定、检出被测物的特性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分析方法验证-专属性
2、含量测定和杂质测定
在能获得杂质的情况下,可加到试样中, 考察对结果的干扰。
在杂质和降解物不能获得的情况下,可 用已验证方法或药典方法进行对照;也可 用对试样加速破坏的方法。
谢 谢 / THANKS
制作人|刘清新
分析方法验证-专属性
分析方法验证-专属性
专属性指在其他成分(如杂质、降解 产物、辅料等)可能存在下,采用的方法 能准确测定出被测物的特性。
鉴别、杂质检查、含量测定方法, 均应考察其专属性
分析方法验证-专属性
1、鉴反应
应能与其它共存 的物质或相似化合物 区分,不含被测组分 的样品均应呈现负反 应。
1 23 4
清热醒脑灵片中黄连的TLC鉴别
1.黄连对照药材; 2.无黄连的阴性样品 3.小檗碱对照品; 4.供试品
分析方法验证-专属性
2、含量测定和杂质测定
色谱法和其他分离法,应附代表性的图 谱,以说明专属性。
图中应注明各组分的位置,色谱法中分 离度应符合要求。
分析方法验证-专属性
A B C
A:黄芩苷对照品溶液色谱图 B:供试品溶液色谱图 C:阴性对照溶液色谱图
