第11章 醚
第11章 醚

CH3CHOCH2CH3 + CH3CHOC2H5 . . OO
醚氧原子上的孤电子对能使α位上的自由基或正离子的稳定性增加, 它们的结构可用共振式表示:
. RCHOR1 RCHOR1
: :
. RHC OR1 RHC OR1
因此,醚容易在α-位氧化。
11.2.4 克莱森(L. Claisen)重排
如烯丙基的γ-碳原子上有一个氢原子被烷基取代,重排后烯丙基以γ-碳 原子与苯环的邻位相连。
OCH2CH CHCH3
OH CH3 CHCH CH2
如烯丙基迁移至对位,则烯丙基以α-碳原子与苯环的对位相连。
OCH2CH CHCH3 CH3 O CH3 CH3 CHCH CH2 CH3 OH CH3 CH3 CH3
醚,乙烯醚,烯丙醚等。
CH3CH2OCH2CH3 C6H5OC6H5 C6H5OCH3
(二)乙醚
CH2=CHOCH=CH2
二苯醚
C6H5OCH2CH=CH2
苯甲醚
n-C4H9OCH=CH2
二乙烯醚
苯烯丙醚
丁基乙烯基醚
如醚氧原子是环的一部分,则称为环醚。
O H2C CH2
环氧乙烷
H2 C CH2 H2C CH2
(CHOO)n CH3
过氧化物不稳定,加热时可能发生爆炸。此外,用醚类作溶剂,过氧 化物的存在还会引起一些不需要的副反应。因此醚类应尽量避免暴露在 空气中。使用前,特别是在蒸馏前,应检验过氧化物是否存在,并除去。 检验过氧化物的一种简便方法是将少量醚与KI水溶液一起摇动,如有 过氧化物存在,I− 氧化成I2可由其特殊的颜色观察到。醚与硫酸亚铁水溶 液一起摇动,可以除去过氧化物。 异丙醚特别容易生成过氧化物,乙醚和THF也容易生成过氧化物,甲 基叔丁基醚则不容易生成过氧化物。
Capter 11 醚

No pains, no gains.
本章讲授提要
第一节 醚的分类与命名
第二节 醚的物理性质
第三节 醚的制备
第四节 醚的化学性质
第五节 环醚
第六节 冠醚 第七节 硫醚(自学)
Eat to live, but not live to eat. No pains, no gains.
第一节 醚的分类和命名
No pains, no gains.
命名混醚时,即当氧原子连结的烃基不同时, 习惯上是:先小后大、先芳后脂。
甲乙醚
甲基叔丁基醚
苯乙醚(MTBE)
乙基乙烯基醚
甲基烯丙基醚
苯基烯丙基醚
Eat to live, but not live to eat.
No pains, no gains.
2、系统命名法
Eat to live, but not live to eat.
No pains, no gains.
二、醚键断裂的反应
醚与浓的HCl、HBr、HI作用,醚键可发生断裂。 HX的反应活性:HI > HBr > HCl 醚键断裂的顺序:3o烷基>2o烷基>1o烷基>芳烃基
1、 若两个是1o烷基则发生SN2,小烃基生成碘代烷, 大烃基生成醇。若氢碘酸过量则均生成碘代烷。
No pains, no gains.
O CH3 CH3 CH3
OH CH3
H
CH2CH α β
CH2 γ
CH2CH CH2
Eat to live, but not live to eat.
No pains, no gains.
第五节 环醚
碳链与氧原子形成环状结构的醚,也称作环氧化合物 一、命名 以“环氧”作词头或用杂环命名。
青岛科技大学有机化学课件—第11章(2)醚

CH3OCH3
(二)甲醚
(二)乙醚
2
O
二苯醚
结构复杂的醚用系统命名法命名:
CH 3CH 2CH CH 3 CHOCH 3 CH 3
3-甲基-2-甲氧基戊烷 烃氧基的命名可在烃基名称之间加上“氧”字。
CH 2=CHCH 2O
烯丙氧基
3
当氧原子是成环原子时,称为环氧化物。命名时 以“环氧”作词头,冠在母体烃名前面。
注:
格氏试剂与环氧化乙烷反应是制备增加两个碳的 伯醇的重要方法。
19
碱性开环是典型的SN2历程, 亲核试剂选择位阻较小 的碳原子进攻。开环方向发生在取代基较少的一端。
O CH3 CH CH2
CH3O-
OCH3CHCH2OCH3
CH3OH - CH3O-
OH CH3CHCH2OCH3
注意:不对称环氧化合物的开环方向取决于反应条件! 规律: 碱催化的开裂发生在取代基较少的一端。 (空间位阻)
酸催化的开裂发生在取代基较多的一端。( C+稳定性)
20
环氧化合物开环都是反式产物,具有典型的SN2特征。
H O
H2O
OH OH
H
从烯烃出发,用KMnO4氧化得到顺式邻二醇,
而经环氧化后再水解得到的是反式邻二醇。
21
11.8 醚的制备
1、威廉森合成法——卤烷与醇金属作用
RX + R`ONa ROR`
OH
OH2
+
H+
-H2O
+
+
H
-H+
26
作业: P255 11-5、 11-6、11-9、11-12 (4)、
胡宏纹《有机化学》章节题库(11-15章)【圣才出品】
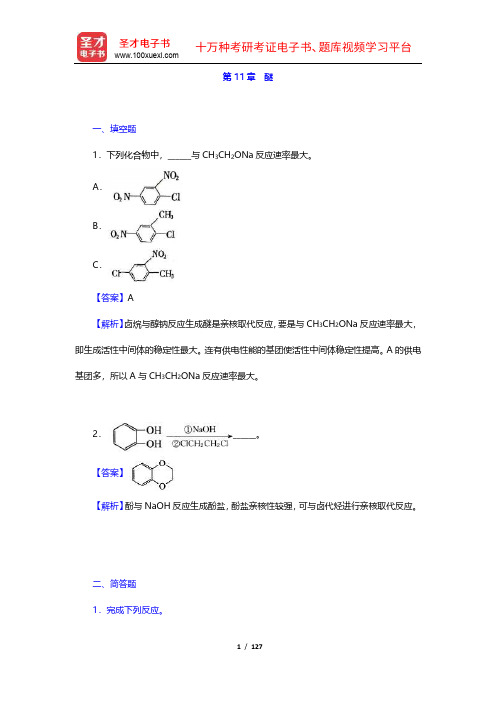
第11章醚一、填空题1.下列化合物中,______与CH3CH2ONa反应速率最大。
A.B.C.【答案】A【解析】卤烷与醇钠反应生成醚是亲核取代反应,要是与CH3CH2ONa反应速率最大,即生成活性中间体的稳定性最大。
连有供电性能的基团使活性中间体稳定性提高。
A的供电基团多,所以A与CH3CH2ONa反应速率最大。
2.______。
【答案】【解析】酚与NaOH反应生成酚盐,酚盐亲核性较强,可与卤代烃进行亲核取代反应。
二、简答题1.完成下列反应。
答:(5)ROH(4)、(5)反应很容易发生,(CH3)3COH及(CH3)3SiCl都可用作醇的保护剂。
2.下列化合物应如何合成?答:3.合成题。
(1)用乙炔为原料合成(无机试剂任选):(2)以乙烯和丙烯为原料(无机试剂任选)合成(CH3)2CHCH2CH2OH。
答:(1)乙炔为原料合成环氧烷烃,先用乙炔与NaNH2反应得到炔基钠,然后再与卤烷反应连上烷基,在生成烯烃。
烯烃与过氧化物反应即得到产物。
合成过程为:(2)要得到(CH3)2CHCH2CH2OH,使环氧乙烷与格氏试剂反应即可,环氧乙烷通过乙烯与氧气在银催化下加成得到;格式试剂通过卤烷与镁的醚溶液反应得到。
合成过程为:4.甲基数丁基醚在无水Et2O中与HI反应,生成的产物为碘甲烷和叔丁醇,而甲基叔丁基醚与浓HI反应则生成甲醇和叔丁基碘,为什么?答:在极性小的溶剂Et2O中,有利于S N2反应,亲核试剂I-进攻CH3的碳原子生成碘甲烷和叔丁醇。
在极性大的溶剂H2O中,有利于S N1反应,形成叔碳正离子,然后亲核试剂I-与叔碳正离子结合生成叔丁基碘。
表达方程式为:5.不对称醚一般不能用两个不同的醇与浓硫酸加热的方法制备,为什么?但叔丁醇在含有浓硫酸的甲醇中加热却高产率地得到了甲基叔丁基醚,试写出反应历程。
答:若用两个不同的醇直接制备不对称醚,除预期的混合醚外还会产生大量由同种醇反应生成的简单醚,一般不易分离或产率较低。
第十一章 醚

很少重排
OC(CH3)3
第四节 环醚
一、环氧化合物
H H
O
H
张力能114.1kJ/mol 张力能
H
反应: 反应:
碱催化下的 开环反应 反式产物 亲核基团 连接在 取代基较少 的碳上 酸催化下的 开环反应 反式产物 亲核基团 连接在 取代基较多 的碳上
制法: 制法:
OH Br
NaOH H2O
O
红外(IR): 1275~1020cm-1 C-O-C 红外 H 1H NMR): 核磁( 核磁 C O :3.3δ:3.3-3.7ppm 质谱: 峰较小, 质谱:M+峰较小, (M+1)+峰较大 R CH O R'' 基峰常为: 基峰常为: R CH O R''
R' - R'
第二节 醚的反应 一、碱性
OCH3
二、醇脱水
15%H2SO4 % (CH3)3COH+C2H5OH(过量) (CH3)3COC2H5 + 过 o 70 C
三、醇与烯烃的加成
SN 1
中间体为碳正离子, 中间体为碳正离子,有重排可能
(1)Hg(OAc)2,R'OH RCHCH3 RCH=CH2 (2)NaBH4,OHOR'
(1)Hg(OOCCF3)2,(CH3)3COH (2)NaBH4,OH-
[O]
四、克莱森重排(Claisen) 克莱森重排
协同反应
OCH2CH=CH2 CH=CH2
OH CH=CHCH2CH=CH2
OCH2CH=CHCH3 H3C CH3
H3C
O=CHCH2CH2CH=CH2
OH CH3
CH2CH=CHCH3
【有机化学】第十一章 醚【配套胡宏纹教材】

O + H2O
H+
HOCH2CH2OH O
HOCH2CH2OCH2CH2OH
H+
一缩二乙二醇 (二甘醇)
H+ O + CH3OH or OH-
CH2CH2OCH3 OH
O H+
HOCH2CH2OCH2CH2OCH3
乙二醇单烷基醚
二聚乙二醇单烷基醚
n-C12H25OH + n O
OHn-C12H25O(CH2CH2O)nH
O
O
O
O
O
O
18-冠-6环中氧原Fra bibliotek数环的总原子数目
冠醚中心是一个空穴,可对某些金属离子进行络合。用作相转移催化剂(加速 水-油两相体系的化学反应)。
4. 环氧乙烷的制备
a, 直接氧化法:
CH2 CH2
O2 / Ag
220-280 oC
O
b, 氯乙醇法
CH2 CH2 + Cl2 + H2O HOCl
CH2CH2 Ca(OH)2
OH Cl
O
5、冠醚
模型的形状与王冠相似,故得名。
大环多元醚(含≥3个-OCH2CH2-重复单元),是乙二醇的环状聚合物。
2. 环氧乙烷的开环反应
O H2C CH2
NaOH HO H2C CH2 OH H2O HX HO H2C CH2 Cl
B-:OH-,RO-,NH3
RMgX
H2O
RCH2CH2 O MgX H+
RCH2CH2OH
特点:1)能形成含有两个官能团的化合物; 2)和RMgX反应,制备比RMgX多2个碳的伯醇
H2C CH2 H2C CH2 H2C CH2
有机化学 11
氧与二个1 相连 发生S , 相连, 氧与二个 oC相连,发生 N2, 氧与2 、 相连, 氧与 oC、 3oC相连,发生 N1。 相连 发生S 。
烷基芳基混合醚: 烷基芳基混合醚: 一起加热生成碘代烷和酚 与HI一起加热生成碘代烷和酚,酚不与氢碘酸作用 。 一起加热生成碘代烷和酚,
O
CH3 + HI
O
-
Cl
-Cl-
O
Cl
Cl
+ HOCl
OH
NaOH
O-
分子内S 分子内 N2
O
Cl OH H
NaOH E2
HO
(4) 冠谜的合成
HO-CH2-CH2-OH + 2
O
苯甲醚 醚键: 醚键:C-O-C键 键
二苯醚
醚的结构、 第一节 醚的结构、命名和物理性质 1. 分类
开链醚:没有环的醚。 开链醚:没有环的醚。
CH 3 O
CH2=CHOCH=CH2
O O O
15 16 17 14 18 O 13 O1 2 12 O 11 O 10 9 O 8 7 6 O4 3 5
链增长: 链增长:
• (CH3)2COCH3 + O2
优先形成稳定 的自由基。 的自由基。
(CH3)2COCH3 OO •
(CH3)2COCH3 + (CH3)2CHOCH3 OO • • (CH3)2COCH3 + (CH3)2COCH3 OOH
关键中间体
3. 醚的碳氧键断裂反应
CH3OCH3 + HI (1mol)
RO
- ...
... CH2
X
取代
ROCH2CH2R' + X-
第10章 醚
1
醚
一、结构和命名
通式为R—O—R, R—O—R 两个烃基相同时称为简单醚, 不相同时称为混合醚。 烃基可以是芳香烃基,也可以是脂肪烃基, 两个烃基可以彼此相连形成环醚。 醚的命名,常用衍生物命名法:
一般的醚的名称以与氧相连的烃基名称加上“醚” 字, 这不是系统名称;
CH3CH2OCH2CH3 乙醚
H+
C4H9–O–C4H9 正丁醚 R–O–R′ + NaX CH3 CH3–C–O–CH2CH3 CH3
(2)威廉姆森合成制备混醚 混醚 (注意原料的选择)
CH3 CH3CH2–X + CH3–C–ONa CH3
原因:叔卤代烷, 碱性条件下, 易发生消除反应 CH3 CH3 CH3CH2–ONa + CH3–C–X CH3–C=CH2 CH3
CH3OCH2CH3
甲乙醚
2
CH2CH2OCH2CH2 Cl Cl
二(2 (2-氯乙基)醚
烃基结构复杂的醚使用系统命名,将烷氧基 作为取代基命名。
CH3CHCH2CHCH3 OCH3 CH3
CH2 CH2 O O CH2CH3 CH3
2-甲基-4-甲氧基戊烷
CH3CH CH2
1-甲氧基-2-乙氧基乙烷
-H2O
CH3–I + C5H11I
C5H11OH + AgI↓ C–C–C–COOH =CH2
7
一芳基醚生成酚和卤代烷,二芳基醚则不易断裂。
O CH3
HI
OH
+ CH3I
–O–
+ HI
×
醚键上连有易生成碳正离子的烷基, 按SN1历程进行了解
(CH3)3C O H
第十一章 醚PPT课件
❖环醚的命名,看作是烃的环氧衍生物,也常用习惯命名法。
含有三元环的环醚,英文名用epoxy(环氧)作词头,其他多采用杂环化合 物的命名法。
CH3CH CH2 O
环氧丙烷 epoxypropane
OO O
四氢呋喃 1,4-二氧六环(二噁烷)
tetrahydrofuran(THF) 1,4-dioxane
❖核磁共振谱:连在醚键碳上的H,δ值增大。 乙基苄基醚的核磁共振谱:
a. b. c. d.
a.
CH2OCH2CH3
d.
b.
c.
3 化学性质
❖醚的化学性质稳定,可用金属钠干燥醚类,醚在许多有机反应中可作溶剂。
❖官能团:醚键C—O—C,在一定条件下能发生反应。
Lewis碱与酸反应
强酸作用下醚键断裂
··
例:利用简单的化学方法除去正溴 丁烷中少量的正丁醇、正丁醚、1丁烯。
(2) 醚键的断裂 ❖钅羊盐的生成,使醚分子中的碳氧键变弱,因此在较高的温度下,强酸能使 醚键断裂。 氢卤酸最有效,其中氢碘酸作用最强,可在常温下作用。
C H 3 C H 2 O C H 3 +H I C H 3 C H 2 O H +C H 3 I
CH3CHCH2CH2CH3 OCH3
2-甲氧基戊烷 2-methoxypentane
CH3CHCH2CHCH3 CH3 OCH3
2-甲基-4-甲氧基戊烷 2-methoxy-4-methylpentane
CH2CH CH2
OCH3
3-甲氧基-1-丙烯 3-methoxyprop-1-ene
OCH(CH3)2
2 物理性质和光谱性质
❖物态:甲醚、甲乙醚为气体,大多数醚在室温下为液体,有香味,易燃。
第11章醚2016解析
O CC
H
O CC
H
+ ROH + R2NH
请推测上述反应合理的机理!
练习:完成下列反应,写出主要产物并指出反应类型 (1) CH3CH2OCH2CH=CH2 + HBr(48%) (2) CH3CH2OCH2CH2CH3 + HBr(48%过量) (3) (CH3CH2)3COCH2CH2CH3 + HBr(48%)
eg. CH2OCH3
CHOH CH2OH
系统命名:3-甲氧基-1,2-丙二醇 普通命名:丙三醇-1-甲醚(甘油-1-甲醚)
甘油-2-甲醚
CH2OH CHOCH3 CH2OH
3. 醚的物理性质
Hydrogen Bond !!
请解释以上化合物的水溶性的差异!!
醚中氧原子上具有孤电子对,是氢键受体 由于氢键的形成,醚也能溶于醇中:
保护酚羟基——形成苄基醚
4. 自动氧化
化学物质和空气中的氧在常温下温和地进行氧化,而 不发生燃烧和爆炸,这种反应称为自动氧化。自动氧化反 应通常在具有活泼氢的部位进行。
(CH3)2CH—O—CH3
O2 自动氧化
(CH3)2C—O—CH3
OOH
醚-位上的H
烯丙位、苯甲位、3oH、醚-位上的
H均易在C-H之间发生自动氧化。
反应机理:多数自动氧化是通过自由基机理进行的。
链引发: R• + O2
ROO•
ROO• + (CH3)2CHOCH3
ROOH + (CH3)2C•OCH3
优先形成稳 定的自由基
生成能力:ROR’ > ROAr > ArOAr
2. 醚键的断裂(与热的强酸HX作用 )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H CH3 O
H H + OCH3 1 开环 2 H+
-
H CH3 HO
OCH3 H H
环氧化合物与氢化锂铝的反应
H CH3 O H H
CH3
H
H H H O Al H H H
+ LiAlH4
3
H CH3 O
H H
[(CH3)2CHO]4Al +
Li+
H2O
4 (CH3)2CHOH + LiAlO2
CH2 CH2 + O2
CH2 CH2 Cl OH
Ag, 250~280℃
1~2MPa
O CH2 CH2
Ca(OH) 2
O + CaCl2 + H2O CH2 CH2
环氧乙烷的性质
• 环氧乙烷是一三元环,环张力很大,易开环, 性质非常活泼。可与水、醇、对苯二甲酸、氨、 格氏试剂等试剂反应。
氧与二个1oC相连,发生SN2, 氧与2oC、 3oC相连,发生SN1。
环醚的反应实例
+ HBr
O
BrCH2CH2CH2CH2OH
HBr
BrCH2CH2CH2CH2Br
O
+ HCl
ZnCl2
ClCH2CH2CH2CH2OH ClCH2CH2CH2CH2Cl
HCl, ZnCl2
R
O
HBr
RCHCH2CH2OH + RCHCH2CH2Br Br OH
[(CH3CH2)2OCH2CH3]BF-4 + AgI
+
ROH +
(CH CH ) OBF
+
3 2 3
4
ROCH2CH3 + CH3CH2OCH2CH3 + HBF4
三
醚的碳氧键断裂反应
CH3OCH3 + HI(1mol) CH3I + CH3OH
+
-I
+ CH3-O-CH3 H
SN2
CH3OH
OCH3 CH3CH CH CH3 CH3
6-甲基-5-乙基-3-甲氧基-3-庚烯
冠醚:含有多个氧的大环醚
15 16 17 14 18 O 1 13 O O 2 12 11 O 10 9 O 8 7 6 O4 3 5
命名一: 总原子数 + 冠 + 氧原子数 (对称)二苯并-18-冠-6 命名二: 按含杂环的系统命名法命名 2,3,11,12-二苯并-1,4,7,10,13,16-六氧杂环十八烷
H H
+
CH3 CH2CH3
H2O18
H
H
18 +
OH2
-H+
OH
18
CH3 CH2CH3
OH
OH
CH3 CH2CH3
环氧化合物与硼烷的反应
H CH3 O
H H
+ B2H6
CH3 H B H
H
H H O H
2
H CH3 O
H H
(CH3CH2CH2O)3B
H2O
CH3CH2CH2OH
2. 1,2环氧化合物的碱性开环反应
醚过氧化物的检验和除去
• 由于长期放置的醚可产生过氧化物,使用时, 需检测过氧化物的存在,方法是: • 淀粉- KI溶液(试纸)检验,若呈蓝色,则证 明有过氧化物存在(过氧化物有氧化性,可将 KI氧化成I2,碘遇淀粉即显蓝色)。 • 也可用 KSCN+Fe2+ 来检验,若变成血红色,则 有过氧化物( 过氧化物将Fe2+→ Fe3+ ,SCN-与 生成血红色的络离子)。 • 措 施 : ① 久 贮 的 醚 在 使 用 前 , 用 FeSO4 或 Na2SO3等还原剂处理后方可蒸馏。 • ② 贮存醚时,可在醚中加入少量的金属 钠或还原铁粉以防止过氧化物的生成。
3. 环氧化合物开环反应的应用
(1)乙二醇的生产
+ H2O
190-220oC, 2.2MPa O.5% H2SO4, 50-70oC 酸催化水合(后处理困难)
O
HOCH2CH2OH
(2)二甘醇、三甘醇的生产
+ HOCH2CH2OH HOCH2CH2OCH2CH2OH
一缩二乙二醇(二甘醇)
O
O
HOCH2CH2OCH2CH2OCH2CH2OH
反应规律 (1)卤化氢的反应性能:HI>HBr>HCl (浓)
(2)混合醚反应时,碳氧键断裂的顺序: 3o烷基> 2o烷基> 1o烷基>甲基>芳基。
四 1,2环氧化合物的开环反应
1. 环氧化合物在酸性条件下的开环反应
H H O CH3 CH2CH3
H+
H H O+ H
CH3 CH2CH3
H H O + H
4-乙基-2-甲氧基己烷 2-甲基-2-甲氧基丙烷
CH3 CH3 C O CH3 CH3
3. 环醚
• 环醚多用俗名,一般称环氧某烃或按杂环化合 物来命名。如:
O
环氧乙烷
O
1,2-环氧丙烷 环氧丙烷
如果分子中碳原子数较少,则叫“环氧X烃”,此中的 X不包括O原子数。 结构较大,碳数较多,多称“氧杂环X烃”,但此时, X包括O原子。 O 氧杂环丁烷
15 16 17 14 18 O 13 O1 2 12 O 11 O 10 9 O 8 7 6 O4 3 5
HOCH2CH2OCH2CH2OCH2CH2OH
KOH THF-H2O
+
ClCH2CH2OCH2CH2OCH2CH2Cl
18-冠-6
二 醇分子间失水
CH3CH2OH
H+
+
-H2O
SN2
CH3CH2OH + CH3CH2—OH2
醚的命名
• 1. 习惯法
• 结构简单的醚一般采用习惯法命名,方法是将 “烃基名”写在“醚”字前,单醚在烃基名前加“二” (但除芳醚和不饱和醚外,一般可省略)。如 • CH3CH2OCH2CH3 (二)乙醚 • 若是混醚,则按次序规则中,较大基团在后书写。 如:CH3OCH2CH3 甲乙醚 • CH3OCH2CH=CH2 甲基烯丙基醚 • 芳醚书写时,原则是先写芳基,后写烷基。如:
一 自动氧化
1 定义:
化学物质和空气中的氧在常温下温和地进行氧 化,而不发生燃烧和爆炸,这种反应称为自动氧化。
(CH3)2CH—O—CH3
醚-位上的H
O2 自动氧化
(CH3)2C—O—CH3 OOH
烯丙位、苯甲位、3oH、醚-位上的H均 易在C-H之间发生自动氧化。
2 反应机理:
多数自动氧化是通过自由基机理进行的。 引发:
R• + O2 ROO• • ROOH + (CH3)2COCH3
ROO• + (CH3)2CHOCH3
链增长:
• (CH3)2COCH3 + O2 OO • (CH3)2COCH3 + (CH3)2CHOCH3 OO • • (CH3)2COCH3 + (CH3)2COCH3 OOH
优先形成稳 定的自由基。
C2H5OH
浓H2SO4
135℃
C2H5OC2H5
重要的醚
• 2 环氧乙烷
• 最简单但也是最重要的环醚,沸点10.73 ℃,在 常温下为无色气体,有毒、易燃,与水混溶, 也可溶于乙醇、乙醚等有机溶剂。与空气混合 成爆炸性混合物,爆炸极限3.6~7.8%。 • 工业上采用乙烯的催化氧化法或用 氯乙醇脱卤 化氢的方法来制备。
-(CH3)3COH
+H+ (CH3)3COH -H+
(CH3)3COH2
+
-H2O +H2O
(CH3)3C+ -H+ (CH3)2C=CH2 蒸馏得烯
三
烯烃的烷氧汞化-去汞法
(CH3)3CCH=CH2 + Hg(OOCCF3)2 + C2H5OH -CF3COOH
(CH3)3CCHCH2HgOOCCF3 OC2H5
CH3CH2OCH2CH3
通 HCl气 或无水HCl溶液
CH3CH2OCH2CH3ClH
提供无水的HCl溶液
+
RNH2的乙醚溶液
+ RNH3Cl- + CH3CH2OCH2CH3
纯化胺
制法一 ROR + BF3 制法二
R O–BF
+
2
R’F
3
- 4 R2O-R' BF
+
CH3CH2I + AgBF4 + CH3CH2OCH2CH3
+
-H+
CH3CH2OCH2CH3 H
CH3CH2OCH2CH3
从原则上讲,醇在浓H2 2SO4 4作用下可以制得对称的醚。
实际上,1oROH制醚产率好, 2oROH制醚产率不好, 3oROH无法分离得到醚,如果蒸馏,最后得到烯。
+H+ (CH3)3COC (CH3)3 -H+
+
(CH3)3COC (CH3)3 H
第二节 醚的物理性质和光谱特征
水 溶 性 多数醚不溶于水。四氢呋喃和1,4-二氧六环因氧原 子裸露在外面,可以和水形成氢键,而能与水混溶。
光谱特征:(参见第八章)
第三节 醚的制备 一 威廉森合成法 二 醇分子间失水 三 烯烃的环氧汞化-去汞法
一 威廉森合成法
1 脂肪醚的合成
RO-Na+ + R’—X R’—OSO2OH
