人教版化学选修三第一章第一节-原子结构
化学选修三第一章笔记

化学选修三第一章笔记以下是一份化学选修三第一章的笔记,供您参考:化学选修三第一章:原子结构与元素周期律一、原子结构1. 原子的构成:原子由原子核和核外电子组成,原子核由质子和中子组成。
2. 电子排布:根据能量高低,电子分布在不同的能层上,能层序数即为电子层数。
同一能层中,电子的能量还不同,又可分为不同的能级。
3. 电子排布规律:(1)电子排布顺序:按照能层序数由低到高、能级符号由低到高的顺序。
(2)泡利原理:一个原子轨道上最多只能容纳自旋方向相反的两个电子。
(3)洪特规则:在等价能级上排布的电子将尽可能分占不同的能级,且自旋方向相同。
4. 元素性质与原子结构的关系:原子序数在数值上等于核电荷数,原子核电荷数等于质子数,质子数加中子数等于质量数。
二、元素周期律1. 元素周期表的结构:周期、族、区。
周期序数等于元素原子的电子层数,族序数等于最外层电子数,根据价电子构型将元素分为s区、p区、d区和ds区等区域。
2. 元素周期律:元素的性质随着原子序数的递增而呈现周期性的变化规律。
3. 元素周期表的意义:预测新元素及其性质,指导元素的发现、合成和开发,指导新材料的研发与应用等。
三、化学键与分子间作用力1. 离子键:由阳离子和阴离子通过静电作用形成的化学键。
离子键的强弱与离子半径和离子电荷有关。
2. 共价键:原子之间通过共用电子对形成的化学键。
根据共用电子对的偏移程度,可分为极性共价键和非极性共价键。
3. 金属键:金属原子之间通过自由电子形成的化学键。
金属键的强弱与金属原子的半径和价电子数有关。
4. 分子间作用力:分子之间的相互作用力,包括范德华力和氢键等。
范德华力主要与分子之间的距离和分子极性有关,氢键则与分子之间的特殊结构有关。
高中化学选修三-物质结构与性质-全套课件

b.电子云扩展程度
同类电子云能层序数n越大,电子能量越 大,活动范围越大电子云越向外扩张
2、原子轨道
①定义
电子在原子核外的一个空间运动状态
②原子轨道与能级
ns能级 ns轨道
npx轨道 简
np能级 npy轨道 npz轨道
并 轨 道
nd能级
ndz2轨道
ndx2—y2轨道
从K至Q ,能层离核越远,能层能量越大 每层最多容纳电子的数量:2n2
2、能级
同一个能层中电子的能量相同的电子亚层
能级名称:s、p、d、f、g、h…… 能级符号:ns、np、nd、nf…… n代表能层 最多容纳电子的数量 s:2 p:6 d:10 f:14
能层: 一 二
三
KL
M
四…… N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
全满规则 半满规则
四、电子云与原子轨道
1、电子云 以量子力学为基础
①电子云 处于一定空间运动状态的电子在原子核外空间 的概率密度分布的形象化描述
小黑点:概率密度 单位体积内出现的概率 小黑点越密概率密度越大
小黑点不是电子!
②电子云轮廓图 电子出现的概率约为90%的空间 即精简版电子云
③电子云轮廓图特点 a.形状 ns能级的电子云轮廓图:球形 np能级的电子云轮廓图:双纺锤形
2s
2p
F ↑↓ ↑ ↓ ↑ ↓ ↑
原子结构的表示方法 原子结构示意图
电子排布式 O原子:1s2 2s2 2p4
电子排布图
1s2 2s2
2p4
O原子
六、能量最低原理、基态与激发态、光谱
1、能量最低原理
人教版高二化学选修三1.1原子结构课件

思考与交流
1、铁易生锈,真金不怕火炼等事例说明了什么问 题?为什么?
2、O2和O3是同素异形体,空气中的O2是须臾不能 离开的,而空气中的O3多于1.2mg/L则有害;CO易燃, CO2却能灭火。这由说明了什么问题?为什么?
3、分子式为C2H6O的物质可能有图示两种结构, 前者与水互溶而后者不能。这也说明了什么问题?
4.卢瑟福原子模型(1911年)
原子中心有一个带正电荷的核,它的质量几乎 等于原子的全部质量,电子在它的周围沿着不同的 轨道运转,就象行星环绕太阳运转一样。
(“行星系式”原子模型) (核式模型)
5.玻尔原子模型(1913年)
电子在原子核外空间的一定轨道上绕核 做高速的圆周运动。
(电子分层排布模型)
思考与交流
• 电子排布式可以简化,如可以把钠 的电子排布式写成【Ne】3s1。试 问:上式方括号中的符号的意义是 什么?你能仿照钠原子的简化电子 排布式写出O、Si、Fe的简化电子 排布式吗?
s 1×2=2 p 3×2=6
d 5×2=10 f 7×2=14 g 9×2=18
课堂练习
1、以下能级符号正确的是( AD) A、6s B、2d C、3f D、7p
2、若n=3,以下能级符号错误的是( B ) A.n p B.n f C.n d D.n s
3、下列各电子能层中,不包含 d 能级的是 (CD )
3) 不同层不同能级可由下面的公式得出: ns < (n-2)f < (n-1)d < np (n为能层序数)
不同能层的能级上,能量有交错现象,如E(3d)>E(4s)、 E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、 E(4f)>E(6s)等。
人教高中化学选修三第一章第一节原子结构知识点(K12教育文档)

人教高中化学选修三第一章第一节原子结构知识点(word版可编辑修改) 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(人教高中化学选修三第一章第一节原子结构知识点(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为人教高中化学选修三第一章第一节原子结构知识点(word版可编辑修改)的全部内容。
随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化: ①、原子最外层电子数呈周期性变化 元素周期律 ②、原子半径呈周期性变化③、元素主要化合价呈周期性变化④、元素的金属性与非金属性呈周期性变化元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。
①、短周期(一、二、三周期) 周期(7个横行) ②、长周期(四、五、六周期)周期表结构 ③、不完全周期(第七周期) ①、主族(ⅠA~ⅦA 共7个) 元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个)③、Ⅷ族(8、9、10纵行)④、零族(稀有气体)①、核电荷数,电子层结构,最外层电子数②、原子半径性质递变 ③、主要化合价④、金属性与非金属性⑤、气态氢化物的稳定性电子层数: 相同条件下,电子层越多,半径越大.判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小.最外层电子数 相同条件下,最外层电子数越多,半径越大。
微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na 〉Mg>Al 〉Si>P>S 〉Cl.2、同主族元素的原子半径随核电荷数的增大而增大。
(完整版)人教版高中化学选修3知识点总结:第一章原子结构与性质
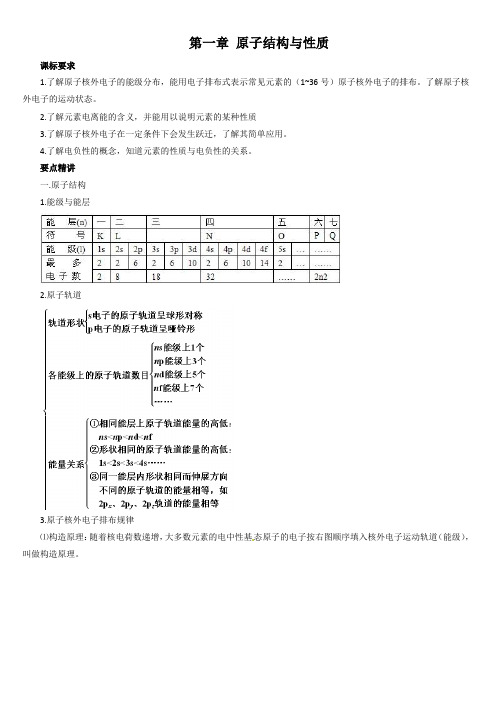
第一章原子结构与性质课标要求1.了解原子核外电子的能级分布,能用电子排布式表示常见元素的(1~36号)原子核外电子的排布。
了解原子核外电子的运动状态。
2.了解元素电离能的含义,并能用以说明元素的某种性质3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
4.了解电负性的概念,知道元素的性质与电负性的关系。
要点精讲一.原子结构1.能级与能层2.原子轨道3.原子核外电子排布规律⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。
能级交错:由构造原理可知,电子先进入4s 轨道,后进入3d 轨道,这种现象叫能级交错。
说明:构造原理并不是说4s 能级比3d 能级能量低(实际上4s 能级比3d 能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。
也就是说,整个原子的能量不能机械地看做是各电子所处轨道的能量之和。
(2)能量最低原理 现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。
(3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。
换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli )原理。
(4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund )规则。
比如,p3的轨道式为或,而不是洪特规则特例:当p 、d 、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。
即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。
前36号元素中,全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。
【课件】人教版高中化学选修三第一章原子结构与性质之一原子结构

选修三物质结构与性质引言世界万物本源冷热干湿水土气火古希腊吞食金石矿物,可以将金石的抗腐蚀性直接移植给人体。
——吞金可长生古中国物质的性质与变化决定了物质的组成与结构。
杜玛克(G. Domagk,1895.10.30~1964.4.24)德国病理学家,1933年将磺胺药应用于临床。
Chapter One本章内容结构洪特规则泡利原理原子光谱激发态基态能级泡利原理原子半径电离能电负性电子云和原子轨道能量最低原理构造原理原子核外电子排布元素周期律元素周期表元素周期系元素的性质原子结构原子结构与性质第一节原子结构(Section I Atomic Structure)一.开天辟地——原子的诞生1.大爆炸理论(The Big Bang Theory)比利时天文学家和宇宙学家勒梅特(Lemaitre Georges,1894.7.17~1966.6.20)1932年——宇宙大爆炸理论2.氢元素是宇宙中最丰富的元素——88.6%,氦约为氢原子数的1/8,两者约占宇宙原子总数的99.7%以上。
另外90多种天然元素——不足总数的1%。
【阅读教材】P4“科学史话”,你认为普鲁特的推理是符合逻辑的吗?【阅读教材】第一章彩图,了解人们认识原子模型的发展史。
一.开天辟地——原子的诞生3.不同时期的原子结构模型(1)古希腊原子论古希腊哲学家德谟克利特(Democritus,约公元前460 年~前370 年)原子是最小的、不可分割的物质粒子。
原子之间存在着虚空,无数原子从古以来就存在于虚空之中,既不能创生,也不能毁灭,它们在无限的虚空中运动着构成万物。
一.开天辟地——原子的诞生3.不同时期的原子结构模型(2)道尔顿原子模型(1803年)(实心球模型)道尔顿(John Dalton ,1766~1844)原子学说:①原子在一切化学变化中不可再分,并保持自己的独特性质。
②同一元素所有原子的质量、性质都完全相同。
③不同元素的原子质量和性质各不相同。
(新编)高中化学人教版选修3课件第1章第1节第1课时能层与能级构造原理与电子排布式

题组 2 电子排布式的书写 4.下列各原子或离子的电子排布式错误的是( ) A.K+ 1s22s22p63s23p6 B.F 1s22s22p5 C.S2- 1s22s22p63s23p4 D.Ar 1s22s22p63s23p6 【解析】 S2-的电子排布式应为 1s22s22p63s23p6。 【答案】 C
[题组·冲关]
题组 1 构造原理
1.下列各组多电子原子的能级能量高低比较中,错误的是( )
A.2s<2p
B.2p<3p
C.3s<3d
D.4s>3d
【解析】 同一能层中能级的能量 ns<np<nd<nf,符号相同的能级如
2p<3p<4p;由构造原理知能量 4s<3d,D 项错误。
【答案】 D
2.按能量由低到高的顺序排列,正确的一组是( )
(2)所有元素的原子核外电子排布都符合构造原理吗? 【提示】 1~36 号元素中,只有 Cr、Cu 两种元素基态原子的电子填充顺 序与构造原理不符合。 (3)元素周期表中钠的电子排布式写成[Ne]3s1,方括号里的符号是什么意 义?模仿写出 8 号、14 号、26 号元素简化的电子排布式。 【提示】 方括号里符号的意义是稀有气体元素原子的结构,表示该元素 前一周期的稀有气体元素原子的电子排布结构;O:[He]2s22p4;Si:[Ne]3s23p2; Fe:[Ar]3d64s2。
28
2 6 10 2 18
6
10
14
2
… …
…… ……
… …
32
…… …… …… 2n2
2.不同能层中同一能级,能层序数越大能量越高。如 1s<2s<3s…… 2p <3p<4p……
人教版高中化学选修三第一章《原子结构与性质》-构造原理电子排布式课件

原子结构示意图
电子排布式
Be: 1s22s2
B: 1s22s22p1 C: 1s22s22p2
Ne: 1s22s22p6
原子结构示意图
电子排布式
Na: 1s22s22p63s1
Al: 1s22s22p63s23p1
练一练
请写出1~18号元素原子的电子排布式。
想一想
为什么K原子的结构示意图是 而不是 试写出K原子的电子排布式
(3) 不同层不同能级可由下面的公式得出: ns<(n-2)f<(n-1)d<np (n为能层序数)
6
想一想
依据构造原理: 5f与6p 7p与6f 7s与6p 分别是哪个能级在前,哪个能级在 后
2.电子排布式
用数字在能级符号右上角表明该能级上的排布 的电子数。
原子结构示意图
电子排布式
H: 1s1 He: 1s2
问题探究 根据已有知识,试写出K原子
原子结构示意图? 答案一:
答案二:
1
三、构造原理
原子核外电子排布必须遵循 一定的能级顺序进行填充 —构造原理
构造原理: 1s;2s 2p;3s 3p;4s 3d 4p; 规律 5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d 核 外 电 子 填 充 顺 序 图
第 3层 第 4层 第 2层 第 1层
钾K
+19
2
8
8
1
钾K
1s2 2s22p6 3s23p6 4s1
12
电子排布式的简写
K: 1s2 2s22p6 3s23p6 4s1 K:
[Ar] 4s1
1.下列各原子的电子排布正确的是
A. Be 1s22s12p1 B. C 1s22s22p2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
纳电子
数
2
8
18
32
【学与问】2.不同的能层分别有多少个能级,与能层的
序数(n)间存在什么关系?能层序数=能级个数
【学与问】3.英文字母相同的不同能级中所容纳的 电子数是否相同?各级上所能容纳的电子数分别是
多少? 相同.如:1s2 2s2 3s2
分别是1、3、5、7的2 倍
课堂练习
1、以下能级符号正确的是( AD )
低
高
近
远
二、能层与能级
能层
一
二三
四 五六 七
符号n
n=1 n=2 n=3 n=4 n=5 n=6 n=7
最多容纳 电子数
2
8
18
32
50
… …
【学与问】1.原子核外电子的每一个能层最多可容纳 的电子数与能层的序数(n)间存在什么关系?
能层最多可容纳的电子数为2n2个。
二、能层与能级 (2)能级s,p,d,f
A、6s B、2d C、3f D、7p
2、若n=3,以下能级符号错误的是(B)
A.n p B.n f C.n d D.n s
3、下列各电子能层中,不包含 d 能级的是
( CD )
A、N能层 B、M能层 C、L能层 D、K能层
总结:
①能层的能级数等于该能层序数。 ②任一能层的能级总是从s能级开始。 ③在每一能层中,能级符号与能量大小的顺序是 :ns<np<nd<nf…
三、构造原理与电子排布式
问题解释:
1s22s22p63s23p63d1 正确书写方法: 1s22s22p63s23p64s1
想一想
第3层 第4层 第2层 第1层
钙Ca +20 2 8 8 2
钙Ca
K层 L层
1s22s22p63s23p64s2
M层 N层
三、构造原理与电子排布式
3、电子排布式:
用数字在能级符号右上角表明该能级上的
选修3《物质结构与性质》
.
第一章 原子结构与性质
第一节 原子结构
.
一、原子结构
质子 原子核
中子 原子
核外电子
原子核的体积很小,体积只占原子体积的几千亿分之一 ,电子在原子内有”广阔”的运动空间。核外电子由于原 子核的吸引力绕核做高速运转(光速),那么多电子的 原子核外,电子又是怎样运动的呢?彼此间会不会为了 占领空间而“打架”呢?
二、能层与能级
(1)能层(电子层1,2,3,4,5,6,7 )在多电子的原子核外电子的能量是不同的,按电子
的能量差异,可以将核外电子分在不同的能层里,
电子能量高在离核远的区域内运动,电子能量低在离核近的
区域内运动 。
电子层(n) 1 2 3 4 5 6 7
字母表示 能量 离核距离
KL M N O P Q
三、构造原理与电子排布式
练习 : 1.电子排布式为1s22s22p63s23p6 某原子, 则该元素的核电荷数是____1_8_______
2.某元素原子的价电子构型为3s23p4, 则此元 素在周期表的位置是__第__3_周_期__,_第__V_IA族
在多电子原子中,同一能层的电子,能量可 以不同,还可以把它们进一步分成能级 ,就 好比能层是楼层,能级是楼梯的阶级。
能级表示方法及各能级所容纳的最多电子数:
能层 K n=1 L n=2
M n=3
N n=4
能级
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
最多容
2
2 6 2 6 10 2 6 10 14
能量相近的能 级划为一组,称
为能级组
第三能级组 3s 3p
第四能级组 4s 3d 4p
第五能级组 5s 4d 5p
第六能级组 6s 4f 5d 6p
第七能级组 7s 5f 6d 7p
通式:ns······(n-2)f、(n-1)d、
三、构造原理与电子排布式
2.构造原理中排布顺序的实质 -----各能级的能量高低顺序
(1)相同能层的不同能级的能量高低顺序 : ns<np<nd<nf
(2)英文字母相同的不同能级的能量高低顺序: (3) 不1s同<层2s不<同3s能<级4s可;由2p下<面3p的<公4p式; 得3d出<:4d
ns < (n-2)f < (n-1)d < np (n为能层序数)
三、构造原理与电子排布式
半充满(p3,d5,f7)
三、构造原理与电子排布式
4.原子的简化电子排布:原子实 Na的简化电子排布:[Ne]3s1
上式方括号里的符号的意义是:
该元素前一个周期的惰性气体电子排布结构
练习:写出第8号元素氧、第14号元素硅和第 26号元素铁的简化电子排布式吗?
O: [He]2s22p4 Si: [Ne]3s23p2 Fe: [Ar]3d64s2
排布的电子数。 能层序数 能级符号
该能级上排布 的电子数
钠 Na 1s22s22p63s1 铝 Al 1s22s22p63s23p1
三、构造原理与电子排布式
【练习】试书写 Cl、26Fe原子的核外电子排 布式。
Cl: 1s2 2s22p6 3s23p5
26Fe: 1s2 2s22p6 3s23p63d6 4s2
练习:
1.按能量由低到高的顺序排列,正确的一组是:
(C )
A.1s、2p、3d、4s
B.1s、2s、3s、2p
C.2s、2p、3s、3p D.4p、3d、4s、3p
2.比较多电子原子能级的能量大小关系
(1)2s ﹤ 4s; (2)3p﹤ 3d; (3)3d﹥4s;
(4)4d﹤ 5d; (5)2p ﹤ 3s; (6)4d﹤5f。
问题探究
知道了原子核外电子的能层和能级可容纳的 最多电子数,是否就可以得出各种原子的 电子排布规律呢?
1s22s22p63s23p63d1
三、构造原理与电子排布式
1.构造原理:
随原子核电荷 数递增,绝大 多数原子核外 电子的排布遵 循如右图的排 布顺序,这个 排布顺序被称 为构造原理。
7S
7P
6S
6P
6d
5S
5P
5d
5f
构
4S
4P
4d
4f
造
3S
3P
3d
原
理
2S
2P
1S
注意:从图中可以看出 ,不同能层的能级有交 错现象,如E(4s) ﹤E(3d)
能级交错
有兴趣的同学可以阅读 有关屏蔽效应和钻穿效 应的内容了解产生“能 级交错”的原因。
电子填入轨道次序图
第一能级组 1s 第二能级组 2s 2p
注意:在书写电子排布式时,能层低的能级要写在左边, 不能按照填充顺序写。 注意:最高能级组电子数为价电子数
三、构造原理与电子排布式
电子排布式特例: 24号铬: 1s22s22p63s23p63d54s1 29号铜: 1s22s22p63s23p63d104s1
全充满(p6,d10,f14) 相对稳定的状态 全空时(p0,d0,f0)
