高一化学必修一一复习课件
合集下载
高一化学必修一总复习ppt课件
√
(3)标准状况下,1摩尔O2和N2的混合气体(任意比)
×的体积为22.4L。
(4)22.4L气体所含分子数一定大于11.2L气体所含分 子数。
×
(5)当温度高于0℃时,1摩尔任何气体体积都大于 22.4L。
×(6)1摩尔CO和1摩尔CO2所含分子数相同,体积也
相同。
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
③、删:删去两边形式相同的离子:
2Ag++2Cl- == 2AgCl↓
④、查:整理方程式并检查两边各元素的原子个数和电 荷总数是否相等,系数约成最简整数比。
Ag+ + Cl- == AgCl↓
1
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
2、溶解溶质的能力大于原溶剂 如, CCl4(I2)>H2O (I2)
3、不与被萃取的物质反应 如, CCl4不与I2反应
萃取碘水中的碘(酒精)?
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
第一章
第二节 化学计量在实验中的应用
一、物质的量(n):表示含有一定数目粒子的集合体
是国际单位制七个基本物理量之一
物质的量的单位是 摩尔、简称摩,符号:mol 二、阿伏加德罗常数:1 mol 任何粒子的粒子数。
科学上规定为: 0.012 Kg 12C 中所含的碳原子数 符号: NA 单位: mol-1,数值:约为6.02×1023 三、摩尔质量:单位物质的量的物质所具有的质量
(3)标准状况下,1摩尔O2和N2的混合气体(任意比)
×的体积为22.4L。
(4)22.4L气体所含分子数一定大于11.2L气体所含分 子数。
×
(5)当温度高于0℃时,1摩尔任何气体体积都大于 22.4L。
×(6)1摩尔CO和1摩尔CO2所含分子数相同,体积也
相同。
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
③、删:删去两边形式相同的离子:
2Ag++2Cl- == 2AgCl↓
④、查:整理方程式并检查两边各元素的原子个数和电 荷总数是否相等,系数约成最简整数比。
Ag+ + Cl- == AgCl↓
1
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
2、溶解溶质的能力大于原溶剂 如, CCl4(I2)>H2O (I2)
3、不与被萃取的物质反应 如, CCl4不与I2反应
萃取碘水中的碘(酒精)?
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
第一章
第二节 化学计量在实验中的应用
一、物质的量(n):表示含有一定数目粒子的集合体
是国际单位制七个基本物理量之一
物质的量的单位是 摩尔、简称摩,符号:mol 二、阿伏加德罗常数:1 mol 任何粒子的粒子数。
科学上规定为: 0.012 Kg 12C 中所含的碳原子数 符号: NA 单位: mol-1,数值:约为6.02×1023 三、摩尔质量:单位物质的量的物质所具有的质量
高一化学必修1第一章复习

定容没有平视读数
离子检验
定容摇匀后又加水
气体体积(V)
微粒数(N)
÷ NA NA×
Vm× ÷Vm
×M(g/mol)
物质的量(n)
质量(m)
M(g/mol) ÷
V溶液× ÷V溶液
物质的量浓度 (c)
1、NA≈6.02×1023· mol-1 2、标况时Vm=22.4L· mol-1
3、摩尔质量在数值上等于相对原子质量等 4、浓度计算时溶液体积以“升(L)”为单位
辩认安全标识
试管预热、固体加热的大试管、液体加热时的容量
实
烧瓶加热时的容量、沸石、石棉网
验
气体实验防倒吸的方法
安
Cl2、SO2、NO2的尾气吸收
全 规范实验操作 浓硫酸的稀释方法
可燃气体的验纯
基
H2还原氧化铜、气体制备中的操作顺序
钠的取用
础
热的蒸发皿、坩埚的取用
实
验
常见事故处理
物质分离
溶液配制 离子检验
酒精着火、活泼金属着火 浓硫酸、强碱溶液溅到皮肤上 酸、碱溶液溅到眼睛里 误食重金属盐
实验安全 实验仪器
过滤 二低三接触
基物 础质 实分 验离
实验仪器 蒸发
搅拌、余热蒸干、液体体积不能超过2/3 实验仪器 蒸馏 石棉网、沸石、温度计、冷凝管中水的流向 烧瓶中的液体不起过2/3
实验仪器 萃取 分液 萃取剂的选择、振荡及静置、玻璃塞和旋塞的开启 溶液配制 上下层液体的处理、分液后的处理、检查漏水 离子检验
P、T相同时: V1
n1
V2
n2
阿伏加德罗定律
P、T相同时: ρ1 ρ2
M1 M2
T、V相同时: P1
人教版高一化学必修一复习完整第一章从实验中学化学共62张ppt课件

胶头滴管吸取
直接倾注法(标签、玻璃棒引流)
完整最新ppt
30
完整最新ppt
31
二、基本实验操作
2. 试纸的使用
(1)试纸的种类
完整最新ppt
32
二、基本实验操作
2. 试纸的使用
(1)试纸的种类 (2)使用方法
①检验液体: 表面皿或玻璃片 ②检验气体: 润湿 --- 玻璃棒一端(注意不要接触其它仪器)
完整最新ppt
19
一、常见仪器
9. 仪器的洗涤 一般洗涤方法: 用洗涤剂和毛刷反复洗涤,然后用水冲洗几次
特殊污垢的洗涤:
MnO2、Fe(OH)3、KMnO4 银镜
浓盐酸(可加热)
硫
碘、酚醛树脂
苯酚
油脂
完整最新ppt
20
一、常见仪器
9. 仪器的洗涤 一般洗涤方法: 用洗涤剂和毛刷反复洗涤,然后用水冲洗几次
强氧化性和酸性物质、有机物---毛玻璃塞。
完整最新ppt
40
常见危险化学品的标志
易燃固体
易燃气体
完整最新ppt
易燃液体
41
常见危险化学品的标志
爆炸品
有毒气体 放射性物品
完整最新ppt
42
常见危险化学品的标志
腐蚀品
自然物品
完整最新ppt
氧化剂
43
常见危险化学品的标志
遇湿易燃物品
完整最新ppt
44
①固体药品的取用
②液体药品的取用
完整最新ppt
28
二、基本实验操作 1. 药品的取用
(1)取用原则 (2)基本方法
①固体药品的取用 药匙 、小纸条、镊子
②液体药品的取用
完整最新ppt
直接倾注法(标签、玻璃棒引流)
完整最新ppt
30
完整最新ppt
31
二、基本实验操作
2. 试纸的使用
(1)试纸的种类
完整最新ppt
32
二、基本实验操作
2. 试纸的使用
(1)试纸的种类 (2)使用方法
①检验液体: 表面皿或玻璃片 ②检验气体: 润湿 --- 玻璃棒一端(注意不要接触其它仪器)
完整最新ppt
19
一、常见仪器
9. 仪器的洗涤 一般洗涤方法: 用洗涤剂和毛刷反复洗涤,然后用水冲洗几次
特殊污垢的洗涤:
MnO2、Fe(OH)3、KMnO4 银镜
浓盐酸(可加热)
硫
碘、酚醛树脂
苯酚
油脂
完整最新ppt
20
一、常见仪器
9. 仪器的洗涤 一般洗涤方法: 用洗涤剂和毛刷反复洗涤,然后用水冲洗几次
强氧化性和酸性物质、有机物---毛玻璃塞。
完整最新ppt
40
常见危险化学品的标志
易燃固体
易燃气体
完整最新ppt
易燃液体
41
常见危险化学品的标志
爆炸品
有毒气体 放射性物品
完整最新ppt
42
常见危险化学品的标志
腐蚀品
自然物品
完整最新ppt
氧化剂
43
常见危险化学品的标志
遇湿易燃物品
完整最新ppt
44
①固体药品的取用
②液体药品的取用
完整最新ppt
28
二、基本实验操作 1. 药品的取用
(1)取用原则 (2)基本方法
①固体药品的取用 药匙 、小纸条、镊子
②液体药品的取用
完整最新ppt
高中化学必修一课件(全套)pptx

溶度积常数(Ksp)
沉淀溶解平衡的应用
判断沉淀的生成与溶解、分离与提纯 等
在一定温度下,难溶电解质的饱和溶 液中各离子浓度幂之积为一常数
03
物质结构与性质
元素周期律及其应用
元素周期表的结构与特点 元素周期表与元素周期律的应用
元素周期律的内容与实质 原子结构与元素性质的关系
金属元素及其化合物性质
醛酮羧酸
醛和酮是含有羰基的化合物;羧酸是含有羧基的化合物。它们具有不同的物理性质和化学 性质,可发生氧化、还原、酯化等反应。
有机合成与推断方法
有机合成路线设计
逆推法、正推法或综合法确定合 成路线;根据原料、目标化合物 的结构特点和官能团的转化规律
设计合成路线。
官能团转化方法
通过加成、取代、消去等反应实现 官能团的转化;通过氧化还原反应 实现官能团的升降。
探究性实验设计思路与实践
探究性实验设计思路
了解探究性实验的设计思路,包括问题提出、假设建立、实验设 计、实验操作、数据分析与解释等步骤。
探究性实验实践
通过具体案例,学习如何设计并实施探究性实验,培养创新思维和 实践能力。
实验结果分析与讨论
学习如何对实验结果进行分析和讨论,包括数据解读、结果比较、 原因探讨等,提高分析问题和解决问题的能力。
握相应的应对措施。
事故处理措施
掌握实验室常见事故的应急处理 方法,如火灾、触电、化学灼伤 等,确保在紧急情况下能够迅速
采取正确措施。
常见仪器使用方法及注意事项
常见仪器介绍
了解高中化学实验中常用的仪器,如试管、烧杯、量筒、滴定管 等。
使用方法及注意事项
学习各种仪器的正确使用方法,包括使用前准备、使用过程中注 意事项以及使用后清洗和保养等。
新课标高中化学必修一复习PPT课件PPT课件
SO2 + H2O = H2SO3(亚硫酸)
(2)与碱反应生成盐和水
SO2 + 2 NaOH = Na2SO3 + H2O SO2 + Ca(OH)2 = CaSO3↓ + H2O
第18页/共35页
0
+4
S
SO2
+6
SO3
(3)既有氧化性,又有还原性
2SO2 + O2 催化剂 2SO3
SO2 + 2 H2S = 3 S ↓ + 2 H2O
3、 NO 易溶于水: 第22页/共35页
二氧化硫和二氧化氮对大气的污染
1、空气中 SO2和NO2的来源: (1)煤、石油等含硫燃料的燃烧; (2)火山爆发、工厂尾气; (3)汽车尾气。 2、SO2和NO2的危害性:
形成酸雨
第23页/共35页
酸雨的形成: 雨水. 霜. 雹. 露 等
SO2 NOx
(3)与碱反应:
名“水玻璃”,具有
比比SS较较iiOO::22++CC2COONa22++(aCONOaaH(HO=H)NO=Ha2N=2)SCai22aO=C粘制防S3OC+i性备火O3Ha+3C2,硅剂H+O其OH23胶等O2用↓O和+途H木很2O材广,
思考:实验室盛装NaOH溶液的试剂瓶而橡
皮塞而不用玻璃塞?
△ C + 2H2SO4 (浓) = CO2 + 2SO2 + 2H2O
第32页/共35页
硝酸
物理性质:
纯HNO无3是 色、易挥发 ,有 的液体,能与水任意比互溶.
化学性质:
刺激气性味
强氧化性 稀硝酸和浓硝酸都有强氧化性
(2)与碱反应生成盐和水
SO2 + 2 NaOH = Na2SO3 + H2O SO2 + Ca(OH)2 = CaSO3↓ + H2O
第18页/共35页
0
+4
S
SO2
+6
SO3
(3)既有氧化性,又有还原性
2SO2 + O2 催化剂 2SO3
SO2 + 2 H2S = 3 S ↓ + 2 H2O
3、 NO 易溶于水: 第22页/共35页
二氧化硫和二氧化氮对大气的污染
1、空气中 SO2和NO2的来源: (1)煤、石油等含硫燃料的燃烧; (2)火山爆发、工厂尾气; (3)汽车尾气。 2、SO2和NO2的危害性:
形成酸雨
第23页/共35页
酸雨的形成: 雨水. 霜. 雹. 露 等
SO2 NOx
(3)与碱反应:
名“水玻璃”,具有
比比SS较较iiOO::22++CC2COONa22++(aCONOaaH(HO=H)NO=Ha2N=2)SCai22aO=C粘制防S3OC+i性备火O3Ha+3C2,硅剂H+O其OH23胶等O2用↓O和+途H木很2O材广,
思考:实验室盛装NaOH溶液的试剂瓶而橡
皮塞而不用玻璃塞?
△ C + 2H2SO4 (浓) = CO2 + 2SO2 + 2H2O
第32页/共35页
硝酸
物理性质:
纯HNO无3是 色、易挥发 ,有 的液体,能与水任意比互溶.
化学性质:
刺激气性味
强氧化性 稀硝酸和浓硝酸都有强氧化性
高一化学必修一专题一复习 PPT课件 图文

) A.等体积、等压强的CO和C2H4 B.等温、等体积的O2和N2 C.等压、等体积的N2和CO2 D.质量相等、密度不等的N2和C2H4
29
5、按照分散质粒子的大小来分
•分散系
•溶液 •胶体 •浊液
溶液
胶体 悬、乳浊液
分散质粒 子大小/n
m 外观特征
能否通过 滤纸
是否有丁 达尔效应
实例
<1
稳定,均 一
沸点的差异 互不相溶
分液 萃取
从含有少量氯化钠的硝 酸钾溶液中提取硝酸钾
在水中溶 解度的差异
结晶
16、4、8、9、15
4.准确配制一定物质的量浓度溶液
特点:①容量瓶上标有温度和容积 ②容量瓶上有刻度线而无刻度
1.容量瓶的常用规格
50mL. 100mL. 250mL. 500ml. 1000mL
2、步骤及所用仪器
能
否
饱和NaC l溶液
1~100
较稳定, 均一
能 是
豆浆
>100
不稳定,不 均一 不能 否
泥浆水
胶体的性质
① 能通过滤纸而不能透过半透膜——用于分离悬浊液、胶体、溶液 ② 对光的散射作用——一束光通过胶体时产生一条光亮的“通路”——
丁达尔效应(辨别溶液和胶体) ③ 受水分子从各个方向大小不同的撞击作用——胶粒在胶体中做不停息
长进短出 常用冰水
蛋白质溶液、硬脂酸钠 和甘油
CO2(HCl) NO2(N2O4)
1、萃取
利用溶质在互不相溶的溶剂里溶解度的不同, 用一种溶剂把溶质从原来溶液中提取出来
碘在CCl4中的溶解度比H2O中大,所以CCl4 可以把碘从碘水中萃取出来(苯如何?) 萃取剂满足的条件:
29
5、按照分散质粒子的大小来分
•分散系
•溶液 •胶体 •浊液
溶液
胶体 悬、乳浊液
分散质粒 子大小/n
m 外观特征
能否通过 滤纸
是否有丁 达尔效应
实例
<1
稳定,均 一
沸点的差异 互不相溶
分液 萃取
从含有少量氯化钠的硝 酸钾溶液中提取硝酸钾
在水中溶 解度的差异
结晶
16、4、8、9、15
4.准确配制一定物质的量浓度溶液
特点:①容量瓶上标有温度和容积 ②容量瓶上有刻度线而无刻度
1.容量瓶的常用规格
50mL. 100mL. 250mL. 500ml. 1000mL
2、步骤及所用仪器
能
否
饱和NaC l溶液
1~100
较稳定, 均一
能 是
豆浆
>100
不稳定,不 均一 不能 否
泥浆水
胶体的性质
① 能通过滤纸而不能透过半透膜——用于分离悬浊液、胶体、溶液 ② 对光的散射作用——一束光通过胶体时产生一条光亮的“通路”——
丁达尔效应(辨别溶液和胶体) ③ 受水分子从各个方向大小不同的撞击作用——胶粒在胶体中做不停息
长进短出 常用冰水
蛋白质溶液、硬脂酸钠 和甘油
CO2(HCl) NO2(N2O4)
1、萃取
利用溶质在互不相溶的溶剂里溶解度的不同, 用一种溶剂把溶质从原来溶液中提取出来
碘在CCl4中的溶解度比H2O中大,所以CCl4 可以把碘从碘水中萃取出来(苯如何?) 萃取剂满足的条件:
高一化学必修一第一章复习课.ppt课件(1).ppt
阿伏伽德罗常数(NA)的计算
练习题4 (周3练习卷 选择题第4题)
4、1gN2中含有N个分子,则阿伏加德罗常数是 C
A.14N
B.N/14
C.28N
D.N/28
NA=N/n=N/(m/M)=N/(1g/28g/mol)
测试题12 (试卷2 双选题第12题)
BC
12、用NA表示阿伏加德罗常数,下列叙述正确的是: A.标准状况下,22.4 L H2O含有的分子数为 NA B.常温常压下,1.06 g Na2CO3含有的Na+数为0.02 NA C.标准状况下,11.2L的O2含有 NA个氧原子 D.通常状况下,NA个CO2分子占有的体积为22.4 L
常见的萃取剂: 四氯化碳、汽油、苯、甲苯
(注意与水的密度比较)
测试题3
从碘水中萃取碘的实验中,不能用作萃取剂的是B:
A.四氯化碳(CCl4) B.乙醇(酒精)
C.苯
D.汽油
课内习题6用汽油萃取碘水中的碘后,显紫红色 的是(A ) A.上层 B.下层 C.中间 D.无法确定
注意区分萃取剂与水的密度大小,确定谁上谁下
A
A.1g H2 B.10g O2 C.11g CO2 D.16g CH4
在相同条件下,只要确定其物质的量,就能确定其体积,
与气体组成无关。既可以是单一气体,也可以是混合气体。
练习题14 (周3试卷选择题第9题)
14、下列有关气体的体积叙述正确的是
B
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度和压强下,气体体积由气体的物质的量的多
M=m/n=m/(N/NA) =3.2g/(3.01 ×1022/ 6.02 ×1023mol-1) =64g/mol
高一化学必修一一ppt课件
化学实验常用仪器及使用
烧瓶
用于较多量液体的反应或 蒸馏,需配合冷凝管使用 。
滴定管
用于准确量取一定体积的 液体,有酸式滴定管和碱 式滴定管之分。
容量瓶
用于配制一定物质的量浓 度的溶液,不能加热。
化学实验常用仪器及使用
漏斗
用于过滤或向小口容器中转移液 体。
分液漏斗
用于分离互不相溶的两种液体, 也可用于向反应器中滴加液体。
晶体的性质
晶体的性质包括熔点、沸点、硬度 、导电性、导热性等。这些性质与 晶体的内部结构密切相关,是晶体 应用的基础。
03
化学反应与能量
化学反应的热效应
1 2
热化学方程式
表示化学反应所放出或吸收的热量的化学方程式 。
热化学方程式的书写
注意标明各物质的状态、反应热的数值和单位、 正负号等。
3
反应热的计算
分子式相同但结构不同的有机化合物互称为同分异构体。
有机化合物的性质
物理性质(熔沸点、溶解性等)、化学性质(可燃性、取代反应、 加成反应等)。
有机合成与推断
有机合成的基本方法
加成反应、取代反应、消去反应等。
有机推断的基本方法
根据反应条件推断官能团、根据数据推断官能团数目、根据性质推 断官能团位置等。
02
取用液体药品时,瓶塞要倒放在 桌上,标签要向着手心,瓶口要 紧挨着试管口。
化学实验基本操作
物质的加热
给试管里的液体加热时,要先预热,方法是:在火焰上来回移动试管。 对已固定的试管,可移动酒精灯。待试管均匀受热后,再把灯焰固定在 放液体的部位加热。
给试管里的固体加热时,试管口应略向下倾斜,以防止冷凝水流入试管 底部,引起试管炸裂。
现代化学
化学必修一ppt课件
强。
盐的性质与分类
盐的性质
盐具有广泛的化学性质,能与许多物质发生化学反应,如与酸反应生成新盐和新酸,与碱反应生成新 盐和新碱,与某些金属氧化物反应生成盐和金属,与某些非金属氧化物反应生成盐和非金属等。
盐的分类
根据盐中所含阳离子和阴离子的不同,可将盐分为正盐、酸式盐、碱式盐和复盐四类。
氧化还原反应的概念与判断方法
化学必修一ppt课件
contents
目录
• 第一章 化学基础知识 • 第二章 原子结构与元素周期表 • 第三章 化学键与分子结构 • 第四章 化学反应速率与化学平衡 • 第五章 酸碱盐与氧化还原反应 • 第六章 有机化合物与材料
01
第一章 化学基础知识
化学的发展与意义
化学的发展
从最早的炼金术到近代的分子科学,化学一直在不断发展。
05
第五章 酸碱盐与氧化还原 反应
酸碱的性质与强弱判断
酸的性质
能与碱反应生成盐和水;能与活 泼金属反应生成氢气;能与金属 氧化物反应生成盐和水;能与某
些盐反应生成新酸和新盐。
碱的性质
能与酸反应生成盐和水;能与某 些非金属氧化物反应生成盐和水 ;能与某些盐反应生成新碱和新
盐。
强弱判断
根据酸或碱的电离程度来判断, 电离程度越大,则酸性或碱性越
• 实例:如NaCl、KCl等。
离子键与共价键
01
共价键
02
03
04
定义:通过共用电子对形成的 化学键。
形成条件:一般是由非金属元 素之间形成的化学键。
实例:如HCl、CO2等。
分子间作用力与氢键
分子间作用力 定义:分子之间存在的吸引和排斥作用。
影响因素:分子的大小、形状、极性等。
盐的性质与分类
盐的性质
盐具有广泛的化学性质,能与许多物质发生化学反应,如与酸反应生成新盐和新酸,与碱反应生成新 盐和新碱,与某些金属氧化物反应生成盐和金属,与某些非金属氧化物反应生成盐和非金属等。
盐的分类
根据盐中所含阳离子和阴离子的不同,可将盐分为正盐、酸式盐、碱式盐和复盐四类。
氧化还原反应的概念与判断方法
化学必修一ppt课件
contents
目录
• 第一章 化学基础知识 • 第二章 原子结构与元素周期表 • 第三章 化学键与分子结构 • 第四章 化学反应速率与化学平衡 • 第五章 酸碱盐与氧化还原反应 • 第六章 有机化合物与材料
01
第一章 化学基础知识
化学的发展与意义
化学的发展
从最早的炼金术到近代的分子科学,化学一直在不断发展。
05
第五章 酸碱盐与氧化还原 反应
酸碱的性质与强弱判断
酸的性质
能与碱反应生成盐和水;能与活 泼金属反应生成氢气;能与金属 氧化物反应生成盐和水;能与某
些盐反应生成新酸和新盐。
碱的性质
能与酸反应生成盐和水;能与某 些非金属氧化物反应生成盐和水 ;能与某些盐反应生成新碱和新
盐。
强弱判断
根据酸或碱的电离程度来判断, 电离程度越大,则酸性或碱性越
• 实例:如NaCl、KCl等。
离子键与共价键
01
共价键
02
03
04
定义:通过共用电子对形成的 化学键。
形成条件:一般是由非金属元 素之间形成的化学键。
实例:如HCl、CO2等。
分子间作用力与氢键
分子间作用力 定义:分子之间存在的吸引和排斥作用。
影响因素:分子的大小、形状、极性等。
化学必修一全册课件
06 有机化合物
有机化合物的分类与特点
烃类化合物
由碳和氢元素组成, 包括烷烃、烯烃、炔 烃和芳香烃等。
烃的衍生物
烃分子中的氢原子被 其他原子或基团取代 后形成的化合物。
醇、酚、醚
含有羟基、酚羟基或 醚键的有机化合物。
醛、酮、酯
含有醛基、酮羰基或 酯键的有机化合物。
羧酸及其衍生物
含有羧基的有机化合 物,如酸酐、酰卤等。
化合反应
两种或两种以上的物质反应生成一种产物 的反应,如$H_2 + Cl_2 rightarrow 2HCl$。
置换反应
一种单质与另一种化合物反应生成另一种 单质和化合物的反应,如$Zn + 2HCl rightarrow ZnCl2 + H2$。
分解反应
一种物质分解成两种或两种以上的物质, 如$2H2O2 rightarrow 2H2O + O2$。
化学必修一全册课件
目录
• 引言 • 化学基本概念 • 原子结构与元素周期表 • 分子结构与化学键 • 化学反应与能量转化 • 有机化合物 • 实验基础与安全
01 引言
课程简介
课程名称
化学必修一全册
适用对象
高中一年级学生
课程目标
掌握化学基础知识,培养实验技能,为后续学习 打下基础
学习目标
01
02
和共价化合物(如水、二氧化 碳)。
离子分子
原子之间通过电子的得失来形成 化学键,常见的离子分子包括金
属氧化物、强酸强碱盐等。
配位分子
一种特殊的共价分子,其中某一 个原子提供孤对电子,另一个原
子提供空轨道,形成配位键。
化学键的类型与性质
共价键
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
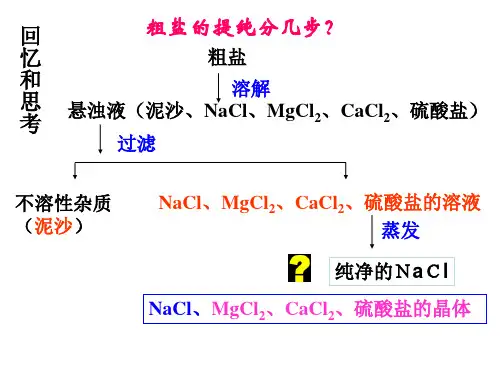
萃取是用萃取剂把一种溶液中的溶质提取出来 的方法; 分液是分离两种互不相溶的液体的操作。 (一般萃取后要进行分液,再蒸馏进行提纯。)
二、物质的分离和提纯
? 分离和提纯物质就是要除掉杂质。 ? 不能引入新杂质,若引入,必须进一
步除去 ? 提纯后物质成分不变(该成分的量若
能增多则更好) ? 实验过程和操作方法简单易行
归纳为“不增、不 减、易分、复原”
测试题11
11、为了除去硝酸钾晶体中所含的硝酸钙和硫酸镁,先
将它配成溶液,然后加入 KOH、K2CO3、Ba(NO3)2等试剂 ,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,
2、常见意外事故的处理方法:
?沾到酸液: 水+ 3%~5%NaHCO 3溶液
沾到碱液:
水+
硼酸溶液
(这里的酸或碱液的浓度不高, 所以可以直接水洗后中和)
?酸(或碱)流到实验桌上:
NaHCO3溶液(或醋酸)中和 +水洗稀释 ?眼睛的化学灼伤: 水(边洗边眨眼睛)
?酒精等有机溶剂泼洒在桌面上着火燃烧,用
方法二 蒸发和结晶
固体-液体分离
例:食盐溶液的 蒸发结晶。 固体-固体(均 溶)分离 例:KNO 3、 NaCl 的结晶分 离。
操作要点:
①加热时用玻璃棒不 断地搅动防止热液溅 出;
②发现溶液出现较多 固体快干时撤火,利 用余热将溶液蒸干。
方法三 蒸馏
(1)蒸馏烧瓶加热要垫石
棉网,温度计水银球与蒸馏
其加入试剂的顺序: A C
A.KOH—— Ba(NO 3)2—— K2CO3—— HNO 3 B.Ba(NO3)2——KOH——HNO3 —— K2CO3
C.Ba(NO3)2——KOH—— K2CO3——HNO3
D.KOH—— K2CO3——Ba(NO3)2——HNO3
①解题思路:要除去的离子
② Ba(NO3)2在K2CO 3前加入,
萃取
溶质在两种互不相溶的溶 从碘水中获取碘 剂中溶解度不同
分液
分离互不相溶、密度不 分离油和水 同的液体混合物
测试题2 (Leabharlann 卷选择题第2题) 2、下列实验装置一般不用于分离物质的是:
D
蒸馏
分液 过滤
方法一 过滤(沉淀洗涤)
固体(不溶) 一液体分离 例:除去粗 盐中的泥沙
操作要点: (1) 一贴两低三靠 (2)沉淀洗涤: 加水,水面高于沉淀, 浸洗三次。
“六防”: 防爆炸、防爆沸、防失火、防中毒、防倒吸、防污染
课外习题1 下列试剂保存方法中正确的是(C ) A.浓硫酸难挥发,可以敞口放置 B.浓硝酸见光易分解,可以放在棕色广口瓶中 C.酒精应密封存放,并远离火源 D.白磷不易挥发,不需密封存放
A.浓硫酸易吸水,应密封存放
D.白磷易氧化且着火点低( 40℃)
↓ 加入的试剂(过量)
可确保将多余的Ba2+除去。
↓
③最后加入HNO3,以完全除
新引入的试剂 ……
去KOH和过量的K2CO 3。
物质分离和提纯的方法
分离、提 纯方法
适用范围
举例
过滤 蒸发 蒸馏
不溶固体和液体的分离 食盐提纯(除去其中泥沙)
可溶性固体和液体的分离 用海水制盐
沸点不同的互溶液体混 用海水制淡水 合物的分离
?间接加热:使用石棉网 ?气体收集:向上排气法、向下排气法、排水集气法
课内习题 6、下列实验操作中错误的是(D ) A.用规格为10mL的量筒量取 6mL的液体 B.用药匙或者纸槽把粉末状药品送入试管的底部 C.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 D.如果没有试管夹,可以临时手持试管给固体或液体加热
课内习题 3、某同学用托盘天平称量锌粒 24.4g(1g以下用游码), 他把锌粒放在右盘,砝码放在左盘,当天平平衡时,所称 锌粒的实际质量为( C ) A.24.4g B.25.5g C.23.6g D.24g
所以:物品质量 =砝码质量-游码质量=24-0.4=23.6 直接用整数部分(砝码质量) - 小数部分(游码质量)
互溶混合液体(沸点 相差30℃以上) 例: 分离沸点不同的液体
烧瓶的支管口处相平。 (2)冷凝管横放时头高尾 低保证冷凝液自然下流,冷 却水与被冷凝蒸气流方向相 反。(下进上出)
(3)烧瓶中放入沸石或碎
瓷片,以防暴沸。
蒸
温度计
冷
馏
凝
尾
烧
管
接
瓶
管
热水 冷水
区别一
蒸发与蒸馏的区别
蒸发是溶液加热后获得固体物质; 蒸馏是加热后收集蒸气冷凝形成的液体。
课内习题4、下列物质中可以较大量地随身携带
乘车、船或飞机的是(D )
A.硝酸钾
B.高锰酸钾
C.硫黄
D.硫酸钾
4、实验操作
?固体称量:托盘天平 调零防腐;左物右码;先大后小;镊子夹取与拨动游码
?液体称量:量筒 ?加热前:预热 ?直接加热:使用酒精灯外焰加热
酒精灯内酒精不超过体积的 1/3;“三不” 液体加热:体积不超过试管的 1/3 固体加热:试管口略向下倾斜
必修 一 第一章 复习课件
§1-1化学实验基本方法
§1-2 化学计量在实验中的应用
巴东三中高一化学备课组
一、实验安全与操作
1、实验安全措施 ?易吸水、易潮解、易被氧化的物质:密封存放
?受热或见光易分解的物质:棕色瓶存放在冷暗处
?金属钾、钠(易与O2、H2O反应):封存在煤油 ?氧化剂和还原剂不能一起存放
方法四 萃取分液
萃取:溶质在两种互
不相溶的溶剂中溶解 (1)分液漏斗使用前要
度不同
进行检漏。
分液:互不相溶、密 (2)下层液体下口放出,
度不同的液体混合物 上层液体上口倒出。
例:
(下下上上)
用CCl4将碘从碘水中 (3)放下口液体时,切 萃取出来后,再分液 记拔下上口塞;
分离
区别二
萃取与分液的区别
湿布、石棉或沙子 盖灭以隔绝空气
?与水发生剧烈反应的化学药品不能用水扑救,
如钾、钠(用沙子盖灭)等
课内习题1 浓硫酸不慎沾到了皮肤上或衣服上 先用 布擦干, 再用水冲洗 ,最后涂抹 3%~5%NaHCO3溶液。
课内习题2 水银滴落在桌上或地上应立即撒 上 硫磺 。
3、辨认安全标识
易燃品
易燃气体: H2、CH 4等 易燃液体: 有机溶剂(酒精、汽油等)
自燃物品: 白磷、镁粉
腐蚀品
遇湿易燃物品:Na 、K、电石( CaC 2)等 浓硫酸、浓硝酸、浓盐酸、 NaOH 固体等
有毒品 氧化剂
CO、氰化物( KCN )、钡盐、汞( Hg)、 铅(Pb )等
KMnO 4、过氧化物( H2O2、Na 2O2)等
测试题11、在盛放浓硫酸的试剂瓶的标签上应 印有下列警示标记中的是(A )
二、物质的分离和提纯
? 分离和提纯物质就是要除掉杂质。 ? 不能引入新杂质,若引入,必须进一
步除去 ? 提纯后物质成分不变(该成分的量若
能增多则更好) ? 实验过程和操作方法简单易行
归纳为“不增、不 减、易分、复原”
测试题11
11、为了除去硝酸钾晶体中所含的硝酸钙和硫酸镁,先
将它配成溶液,然后加入 KOH、K2CO3、Ba(NO3)2等试剂 ,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,
2、常见意外事故的处理方法:
?沾到酸液: 水+ 3%~5%NaHCO 3溶液
沾到碱液:
水+
硼酸溶液
(这里的酸或碱液的浓度不高, 所以可以直接水洗后中和)
?酸(或碱)流到实验桌上:
NaHCO3溶液(或醋酸)中和 +水洗稀释 ?眼睛的化学灼伤: 水(边洗边眨眼睛)
?酒精等有机溶剂泼洒在桌面上着火燃烧,用
方法二 蒸发和结晶
固体-液体分离
例:食盐溶液的 蒸发结晶。 固体-固体(均 溶)分离 例:KNO 3、 NaCl 的结晶分 离。
操作要点:
①加热时用玻璃棒不 断地搅动防止热液溅 出;
②发现溶液出现较多 固体快干时撤火,利 用余热将溶液蒸干。
方法三 蒸馏
(1)蒸馏烧瓶加热要垫石
棉网,温度计水银球与蒸馏
其加入试剂的顺序: A C
A.KOH—— Ba(NO 3)2—— K2CO3—— HNO 3 B.Ba(NO3)2——KOH——HNO3 —— K2CO3
C.Ba(NO3)2——KOH—— K2CO3——HNO3
D.KOH—— K2CO3——Ba(NO3)2——HNO3
①解题思路:要除去的离子
② Ba(NO3)2在K2CO 3前加入,
萃取
溶质在两种互不相溶的溶 从碘水中获取碘 剂中溶解度不同
分液
分离互不相溶、密度不 分离油和水 同的液体混合物
测试题2 (Leabharlann 卷选择题第2题) 2、下列实验装置一般不用于分离物质的是:
D
蒸馏
分液 过滤
方法一 过滤(沉淀洗涤)
固体(不溶) 一液体分离 例:除去粗 盐中的泥沙
操作要点: (1) 一贴两低三靠 (2)沉淀洗涤: 加水,水面高于沉淀, 浸洗三次。
“六防”: 防爆炸、防爆沸、防失火、防中毒、防倒吸、防污染
课外习题1 下列试剂保存方法中正确的是(C ) A.浓硫酸难挥发,可以敞口放置 B.浓硝酸见光易分解,可以放在棕色广口瓶中 C.酒精应密封存放,并远离火源 D.白磷不易挥发,不需密封存放
A.浓硫酸易吸水,应密封存放
D.白磷易氧化且着火点低( 40℃)
↓ 加入的试剂(过量)
可确保将多余的Ba2+除去。
↓
③最后加入HNO3,以完全除
新引入的试剂 ……
去KOH和过量的K2CO 3。
物质分离和提纯的方法
分离、提 纯方法
适用范围
举例
过滤 蒸发 蒸馏
不溶固体和液体的分离 食盐提纯(除去其中泥沙)
可溶性固体和液体的分离 用海水制盐
沸点不同的互溶液体混 用海水制淡水 合物的分离
?间接加热:使用石棉网 ?气体收集:向上排气法、向下排气法、排水集气法
课内习题 6、下列实验操作中错误的是(D ) A.用规格为10mL的量筒量取 6mL的液体 B.用药匙或者纸槽把粉末状药品送入试管的底部 C.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 D.如果没有试管夹,可以临时手持试管给固体或液体加热
课内习题 3、某同学用托盘天平称量锌粒 24.4g(1g以下用游码), 他把锌粒放在右盘,砝码放在左盘,当天平平衡时,所称 锌粒的实际质量为( C ) A.24.4g B.25.5g C.23.6g D.24g
所以:物品质量 =砝码质量-游码质量=24-0.4=23.6 直接用整数部分(砝码质量) - 小数部分(游码质量)
互溶混合液体(沸点 相差30℃以上) 例: 分离沸点不同的液体
烧瓶的支管口处相平。 (2)冷凝管横放时头高尾 低保证冷凝液自然下流,冷 却水与被冷凝蒸气流方向相 反。(下进上出)
(3)烧瓶中放入沸石或碎
瓷片,以防暴沸。
蒸
温度计
冷
馏
凝
尾
烧
管
接
瓶
管
热水 冷水
区别一
蒸发与蒸馏的区别
蒸发是溶液加热后获得固体物质; 蒸馏是加热后收集蒸气冷凝形成的液体。
课内习题4、下列物质中可以较大量地随身携带
乘车、船或飞机的是(D )
A.硝酸钾
B.高锰酸钾
C.硫黄
D.硫酸钾
4、实验操作
?固体称量:托盘天平 调零防腐;左物右码;先大后小;镊子夹取与拨动游码
?液体称量:量筒 ?加热前:预热 ?直接加热:使用酒精灯外焰加热
酒精灯内酒精不超过体积的 1/3;“三不” 液体加热:体积不超过试管的 1/3 固体加热:试管口略向下倾斜
必修 一 第一章 复习课件
§1-1化学实验基本方法
§1-2 化学计量在实验中的应用
巴东三中高一化学备课组
一、实验安全与操作
1、实验安全措施 ?易吸水、易潮解、易被氧化的物质:密封存放
?受热或见光易分解的物质:棕色瓶存放在冷暗处
?金属钾、钠(易与O2、H2O反应):封存在煤油 ?氧化剂和还原剂不能一起存放
方法四 萃取分液
萃取:溶质在两种互
不相溶的溶剂中溶解 (1)分液漏斗使用前要
度不同
进行检漏。
分液:互不相溶、密 (2)下层液体下口放出,
度不同的液体混合物 上层液体上口倒出。
例:
(下下上上)
用CCl4将碘从碘水中 (3)放下口液体时,切 萃取出来后,再分液 记拔下上口塞;
分离
区别二
萃取与分液的区别
湿布、石棉或沙子 盖灭以隔绝空气
?与水发生剧烈反应的化学药品不能用水扑救,
如钾、钠(用沙子盖灭)等
课内习题1 浓硫酸不慎沾到了皮肤上或衣服上 先用 布擦干, 再用水冲洗 ,最后涂抹 3%~5%NaHCO3溶液。
课内习题2 水银滴落在桌上或地上应立即撒 上 硫磺 。
3、辨认安全标识
易燃品
易燃气体: H2、CH 4等 易燃液体: 有机溶剂(酒精、汽油等)
自燃物品: 白磷、镁粉
腐蚀品
遇湿易燃物品:Na 、K、电石( CaC 2)等 浓硫酸、浓硝酸、浓盐酸、 NaOH 固体等
有毒品 氧化剂
CO、氰化物( KCN )、钡盐、汞( Hg)、 铅(Pb )等
KMnO 4、过氧化物( H2O2、Na 2O2)等
测试题11、在盛放浓硫酸的试剂瓶的标签上应 印有下列警示标记中的是(A )
