乙苯脱氢制苯乙烯实验
乙苯脱氢制苯乙烯

实验13 乙苯脱氢制苯乙烯一.实验目的1.熟悉乙苯气相催化脱氢制备苯乙烯的过程,明确乙苯脱氢操作条件对产物收率的影响。
2.掌握反应温度控制和测量方法以及加料的控制与计量方法。
3.掌握反应产物的分析测试方法。
二.实验原理乙苯脱氢为可逆吸热反应:主反应: C 8H 10 C 8H 8 + H 2 △H 873K = 125 kJ/mol (2-13-1)除脱氢反应外,还发生一系列副反应,生成苯、甲苯、甲烷、乙烷、烯烃、焦油等,如:C 8H 10 C 6H 6+ C 2H 4 △H 873K = 102 kJ/mol (2-13-2)C 8H 10 + H 2 C 7H 8 + CH 4 △H 873K = - 64.4 kJ/mol (2-13-3) C 8H 10 + H 2 C 6H 6 + C 2H 6 △H 873K = - 41.8 kJ/mol (2-13-4) C 8H 10 8C + 5H 2 △H 873K = - 1.72kJ/mol (2-13-5) 乙苯脱氢反应是一个吸热、摩尔数增多并需要催化剂的复杂过程。
由于反应是吸热反应,随着温度的升高,脱氢反应加快,苯乙烯收率也迅速增加。
反应温度过高,脱氢反应加快,但苯乙烯收率增加变慢,即副反应大大加快,所以反应温度一般控制在550-610℃范围内。
反应(2-13-2)、(2-13-3)是两个主要的平行副反应,这两个副反应的平衡常数大于乙苯脱氢生成苯乙烯的平衡常数,因此,如果从热力学分析看,乙苯脱氢生产苯乙烯的可能性确实不大,所以要采用高选择性的催化剂,增加主反应的反应速率。
常用的乙苯气相催化脱氢制取苯乙烯的催化剂种类很多,通常是以铁(Fe 2O 3)为基础的多组分催化剂,助催化剂有钾(K 2O ),铬(Cr 2O 3)等。
本试验采用铁系催化剂作为乙苯气相脱氢制苯乙烯反应的催化剂。
乙苯气相脱氢制苯乙烯是一个摩尔数增多、体积增大的过程,因而在减压条件下进行对生成苯乙烯有利。
乙苯脱氢制苯乙烯
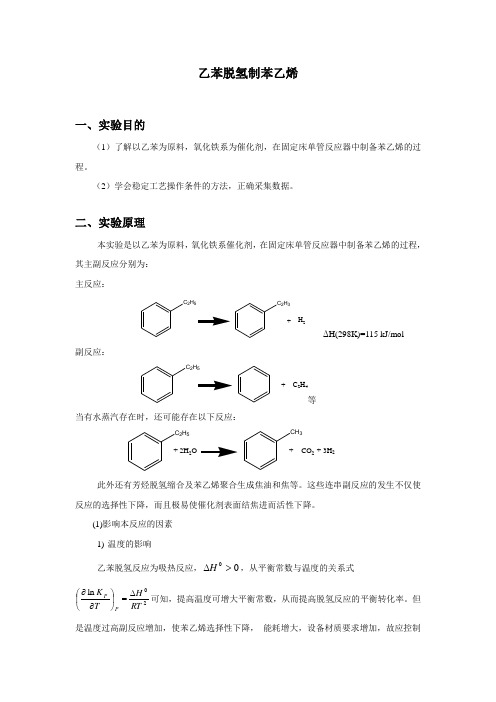
乙苯脱氢制苯乙烯一、实验目的(1)了解以乙苯为原料,氧化铁系为催化剂,在固定床单管反应器中制备苯乙烯的过程。
(2)学会稳定工艺操作条件的方法,正确采集数据。
二、实验原理本实验是以乙苯为原料,氧化铁系催化剂,在固定床单管反应器中制备苯乙烯的过程,其主副反应分别为: 主反应:C 2H5C 2H 3+H 2ΔH(298K)=115 kJ/mol副反应:C 2H5+C 2H 4等当有水蒸汽存在时,还可能存在以下反应:C 2H 5+CO 2+ 2H 2OCH 3+ 3H 2此外还有芳烃脱氢缩合及苯乙烯聚合生成焦油和焦等。
这些连串副反应的发生不仅使反应的选择性下降,而且极易使催化剂表面结焦进而活性下降。
(1)影响本反应的因素 1) 温度的影响乙苯脱氢反应为吸热反应,00>∆H ,从平衡常数与温度的关系式20ln RTH T K P P ∆=⎪⎭⎫⎝⎛∂∂可知,提高温度可增大平衡常数,从而提高脱氢反应的平衡转化率。
但是温度过高副反应增加,使苯乙烯选择性下降, 能耗增大,设备材质要求增加,故应控制适宜的反应温度。
本实验的反应温度为:540~600℃。
2) 压力的影响乙苯脱氢为体积增加的反应,从平衡常数与压力的关系式γ∆⎪⎪⎭⎫ ⎝⎛=∑i n P nP K K 总可知,当0>∆γ时,降低总压总P 可使n K 增大,从而增加了反应的平衡转化率,故降低压力有利于平衡向脱氢方向移动。
本实验加水蒸汽的目的是降低乙苯的分压,以提高平衡转化率。
较适宜的水蒸汽用量为:水:乙苯=1.5:1(体积比)=8:1 (摩尔比)。
3) 空速的影响乙苯脱氢反应系统中有平衡副反应和连串副反应,随着接触时间的增加,副反应也增加,苯乙烯的选择性可能下降,适宜的空速与催化剂的活性及反应温度有关,本实验乙苯的液空速以0.6h -1为宜。
(2)催化剂本实验采用氧化铁系催化剂其组成为:23232CeO O K CuO O Fe ---三、实验流程在汽化温度300℃,脱氢反应温度540~600℃,水:乙苯=1.5:1(体积比),相当于乙苯加料0.5毫升/分,蒸馏水0.75毫升/分(50毫升催化剂)的条件下,考察不同温度对乙苯的转化率、苯乙烯的选择性、收率的影响。
实验一 乙苯脱氢制苯乙烯

4.2 实验一 乙苯脱氢制苯乙烯一 实验目的(1)了解以乙苯为原料,氧化铁系为催化剂,在固定床单管反应器中制备苯乙烯的过程。
(2)学会稳定工艺操作条件的方法。
二 实验原理1.本实验的主副反应 主反应:副反应:在水蒸气存在的条件下,还可能发生下列反应:此外还有芳烃脱氢缩合苯乙烯聚合生成焦油和焦等。
这些连串副反应的发生不仅使反应的选择性下降,而且极易使催化剂表面结焦进而活性下降。
(1)影响本反应的因素 1)温度的影响乙苯脱氢反应为吸热反应,00>∆H,从平衡常数与温度的关系式20ln RT H T K pp ∆=⎪⎪⎭⎫ ⎝⎛∂∂可知,提高温度可增大平衡常数,从而提高脱氢反应的平衡转化率。
但是温度过高副反应增加,使苯乙烯选择性下降,能耗增大,设备材质要求增加,故应控制适宜的反应温度。
本实验的反应温度为:540~600℃。
2)压力的影响乙苯脱氢为体积增加的反应,从平衡常数与压力的关系式n p K K =γ∆⎪⎪⎭⎫⎝⎛∑i nP 总可知,当γ∆>时,降低总压总P 可使n K 增大,从而增加了反应的平衡转化率,故降低压力有利于平衡向脱氢方向移动。
本实验加水蒸气的目的是降低乙苯的分压,以提高平衡转化率。
较适宜的水蒸气用量为:水∶乙苯=1.5∶1(体积比)或8∶1(摩尔比)。
3)空速的影响乙苯脱氢反应系统中有平衡副反应和连串副反应,随着接触时间的增加,副反应也增加,苯乙烯的选择性可能下降,适宜的空速与催化剂的活性及反应温度有关,本实验乙苯的液空速以0.6h-1为宜。
(2)催化剂本实验采用氧化铁系催化剂其组成为:Fe2O3—CuO—K2O3—CeO2。
三预习与思考(1)乙苯脱氢生成苯乙烯反应是吸热还是放热反应?如何判断?如果是吸热反应,则反应温度为多少?实验室是如何来实现的?工业上又是如何实现的?(2)对本反应而言是体积增大还是减小?加压有利还是减压有利?工业上是如何来实现加减压操作的?本实验采用什么方法?为什么加入水蒸气可以降低烃分压?(3)在本实验中你认为有哪几种液体产物生成?哪几种气体产物生成?如何分析?四实验装置及流程见图4.2-1。
乙苯脱氢制苯乙烯实验报告

乙苯脱氢制苯乙烯实验报告一实验目的(1)了解以乙苯为原料在铁系催化剂上进行固定床制备苯乙烯的过程,学会设计实验流程和操作;(2)掌握乙苯脱氢操作条件对产物收率的影响,学会获取稳定的工艺条件之方法。
(3)掌握催化剂的填装、活化、反应使用方法。
(4)掌握色谱分析方法。
二实验原理2.1 主副反应乙苯脱氢生成苯乙烯和氢气是一个可逆的强烈吸热反应,只有在催化剂存在的高温条件下才能提高产品收率,其反应如下:主反应C6H5C2H5C6H5C2H3+H2副反应C6H5C2H5C6H6+C2H4C2H4+H2C2H6C6H5C2H5+H2C6H6+C2H6C6H5C2H5C6H5-CH3+CH4此外,还有部分芳烃脱氢缩合、聚合物以及焦油和碳生成。
2.2影响因素乙苯脱氢反应为吸热反应,△H0>0,从平衡常数与温度的关系式ln K P H0可知,提高温度可增大平衡常数,从而提高脱氢反应的平衡转T P RT2化率。
但是温度过高副反应增加,使苯乙烯选择性下降,能耗增大,设备材质要求增加,故应控制适应的反应温度。
2.2.2 压力的影响乙苯脱氢为体积增加的反应,从平衡常数与压力的关系式K P K n P总可ni知,当△γ >0 时,降低总压 P 总可使 K n增大 ,从而增加了反应的平衡转化率 ,故降低压力有利于平衡向脱氢方向移动。
实验中加入惰性气体或减压条件下进行,通常均使用水蒸气作稀释剂,它可降低乙苯的分压,以提高平衡转化率。
水蒸气的加入还可向脱氢反应提供部分热量 ,使反应温度比较稳定 ,能使反应产物迅速脱离催化剂表面 ,有利于反应向苯乙烯方向进行 ;同时还可以有利于烧掉催化剂表面的积碳。
但水蒸汽增大到一定程度后,转化率提高并不显着,因此适宜的用量为:水:乙苯= 1.2~ 2.6: 1(质量比)。
2.2.3 空速的影响乙苯脱氢反应中的副反应和连串副反应,随着接触时间的增大而增大,产物苯乙烯的选择性会下降,催化剂的最佳活性与适宜的空速及反应温度有关,本实验乙苯的液空速以 0.6~1h-1为宜。
乙苯脱氢制苯乙烯

620℃
W% 1.83 1.60 45.63 50.95 质量/g 0.15 0.13 3.79 4.23
产品 苯 甲苯 乙苯 苯乙烯
乙苯脱氢制苯乙烯各结果表
反应温度/℃ 乙苯转化率 苯乙烯选择性 苯乙烯收率
560.7
61.7%
12.7%
7.8%
591.9
70%
21.8%
15.26%
621.3
78.1%
高温、低压有助于脱氢反应的进行
减压:高温下进行负压操作不安全,加入惰性气体(稀释剂,一般用 水蒸气)实现降低原料气分压的目的。
副反应
C2H5
+ C2H4
CH3
C2H5
+ 2H2
+ CH4
乙苯脱氢反应产 物称为脱氢液, 也称炉油,其组 成为:苯、甲苯、 乙苯、苯乙烯。
C2H5
+ 2H2
+ C2H6
C2H5
8C + 5H2
C2H5
+ 16H2O
8CO2 + 21H2
在700 ℃下,加氢裂解的 平衡常数Kp仍很大,故裂 解和加氢裂解反应比脱氢 反应有利,需高活性、高 选择性催化剂。
t/℃
乙苯脱氢主副反应平衡常数比较
4.实验方案
乙苯脱氢工艺条件
温度的影响 主反应:吸热反应 ,T↑ , KP ↑ 副反应:裂解、 结焦,T ↑ ,有利于副反应,反应选择性变差
31.2%
24.37%
乙苯转化率、苯乙烯选择性、苯乙烯收率关系图
实验结论
通过实验,在压力一定的条件下随着温度的升高,乙 苯的转化率增大,苯乙烯的选择性不断提高
谢谢各位老师的指导和建议!
乙苯脱氢制备苯乙烯的实验指导书

乙苯脱氢制苯乙烯实验装置实验指导书乙苯脱氢制备苯乙烯实验指导书一、实验目的1、了解以乙苯为原料,氧化铁系为催化剂,在固定床单管反应器中制备苯乙烯的过程。
2、学会稳定工艺操作条件的方法。
3、掌握乙苯脱氢制苯乙烯的转化率、选择性、收率与反应温度的关系;找出最适宜的反应温度区域。
4、学会使用温度控制和流量控制的一般仪表、仪器。
5、了解气相色谱分析及使用方法。
二、实验原理1、本实验的主副反应主反应:副反应:在水蒸气存在的条件下,还可能发生下列反应:此外还有芳烃脱氢缩合及苯乙烯聚合生成焦油等。
这些连串副反应的发生不仅使反应的选择性下降,而且极易使催化剂表面结焦进而活性下降。
2、影响本反应的因素(1)温度的影响乙苯脱氢反应为吸热反应,∆H o >0,从平衡常数与温度的关系式20ln RTH TK pp ∆=⎪⎪⎭⎫ ⎝⎛∂∂可知,提高温度可增大平衡常数,从而提高脱氢反应的平衡转化率。
但是温度过高副反应增加,使苯乙烯选择性下降,能耗增大,设备材质要求增加,故应控制适宜的反应温度。
本实验的反应温度为:540~600℃。
(2)压力的影响乙苯脱氢为体积增加的反应,从平衡常数与压力的关系式Kp =Kn=γ∆⎪⎪⎭⎫ ⎝⎛∑i n P 总可知,当∆γ>0时,降低总压P 总可使Kn 增大,从而增加了反应的平衡转化率,故降低压力有利于平衡向脱氢方向移动。
本实验加水蒸气的目的是降低乙苯的分压,以提高乙苯的平衡转化率。
较适宜的水蒸气用量为:水﹕乙苯=1.5﹕1(体积比)或8﹕1(摩尔比)。
(3)空速的影响乙苯脱氢反应系统中有平行副反应和连串副反应,随着接触时间的增加,副反应也增加,苯乙烯的选择性可能下降,故需采用较高的空速,以提高选择性。
适宜的空速与催化剂的活性及反应温度有关,本实验乙苯的液空速以0.6h -1为宜。
3、催化剂本实验采用GS-08催化剂,以Fe ,K 为主要活性组分,添加少量的IA ,ⅡA ,IB 族以稀土氧化物为助剂。
乙苯脱氢制苯乙烯实验注意事项
乙苯脱氢制苯乙烯实验注意事项
一、实验原理
乙苯脱氢是利用催化剂将乙苯加热至高温,使其分解成苯和乙烯的过程。
该反应是工业上制取苯乙烯的重要方法。
二、实验步骤
1.将催化剂(如氧化钒或氧化铁)加入反应釜中。
2.加入适量的乙苯,并通入氢气。
3.升温至500℃左右,持续反应2-3小时。
4.冷却后,收集产物并进行分析。
三、注意事项
1.实验操作时需佩戴防护手套、护目镜等个人防护装备,以免受到反应物或产物的伤害。
2.反应釜应选择耐高温、耐腐蚀的材料制成,如不锈钢或玻璃等,并保持清洁干燥。
3.催化剂的选择要根据实验需要进行调整,以保证反应效果和产物纯度。
4.通入氢气时需注意控制流量和压力,避免因过高压力导致爆炸事故发生。
5.加热时要慢慢升温,避免温度过高引起反应釜爆炸。
6.收集产物时要使用合适的容器,并进行标记和储存,以免产生混淆或误用。
7.实验结束后,要及时清洗反应釜和设备,并进行妥善保管。
四、实验安全提示
1.实验室内禁止吸烟、饮食等行为,以免引起火灾或中毒事故。
2.实验前要对设备进行检查和试运行,确保其正常工作。
3.实验操作时要严格按照操作规程进行,不得随意更改或省略步骤。
4.如遇到异常情况(如气味异常、产物颜色变化等),应立即停止操作并向有关人员报告。
乙苯脱氢实验报告
乙苯脱氢实验报告乙苯脱氢实验报告引言:乙苯脱氢是一种重要的有机合成反应,可以将乙苯转化为苯乙烯。
本实验旨在通过观察乙苯脱氢反应过程,探究其反应机理和反应条件对反应效果的影响。
实验材料和方法:实验材料包括乙苯、催化剂、反应釜和气体收集装置等。
实验步骤如下:首先,将乙苯加入反应釜中,然后加入适量的催化剂。
接下来,将反应釜密封,连接气体收集装置,并通过加热使反应开始。
在反应过程中,收集产生的气体,并记录反应时间和温度。
实验结果和讨论:通过实验,我们观察到了乙苯脱氢反应的一系列现象。
首先,反应开始后,我们可以看到反应釜内的乙苯逐渐变为无色,同时产生大量的气体。
这表明乙苯脱氢反应是一个放热反应,生成的苯乙烯是气态的。
随着反应的进行,我们观察到收集装置中逐渐积累的气体体积增加,同时反应釜内的温度也逐渐升高。
这说明乙苯脱氢反应是一个放热反应,反应速率随着温度的升高而增加。
进一步观察实验结果,我们发现催化剂对乙苯脱氢反应具有重要影响。
在实验中,我们使用了不同种类和不同量的催化剂,并观察到了不同的反应效果。
催化剂的选择和添加量会影响反应速率和产物选择性。
例如,当我们使用铜作为催化剂时,反应速率较快,但产物选择性较低。
而当我们使用铬作为催化剂时,反应速率较慢,但产物选择性较高。
这说明催化剂的种类和添加量对乙苯脱氢反应的结果有重要影响。
此外,我们还观察到反应时间对乙苯脱氢反应的影响。
在实验中,我们分别记录了不同反应时间下的反应结果。
结果显示,随着反应时间的延长,反应釜内的乙苯逐渐消失,生成的苯乙烯逐渐增加。
这表明乙苯脱氢反应是一个随时间进行的反应,反应速率随着反应时间的延长而增加。
结论:通过本实验,我们深入了解了乙苯脱氢反应的反应机理和反应条件对反应效果的影响。
我们发现乙苯脱氢反应是一个放热反应,反应速率随着温度的升高而增加。
催化剂的种类和添加量会影响反应速率和产物选择性。
此外,反应时间的延长也会增加反应的产物产量。
乙苯脱氢反应实验报告
乙苯脱氢反应实验报告乙苯脱氢制苯乙烯实验报告乙苯脱氢制苯乙烯实验报告一实验目的(1)了解以乙苯为原料在铁系催化剂上进行固定床制备苯乙烯的过程,学会设计实验流程和操作;(2)掌握乙苯脱氢操作条件对产物收率的影响,学会获取稳定的工艺条件之方法。
(3)掌握催化剂的填装、活化、反应使用方法。
(4)掌握色谱分析方法。
二实验原理2.1主副反应乙苯脱氢生成苯乙烯和氢气是一个可逆的强烈吸热反应,只有在催化剂存在的高温条件下才能提高产品收率,其反应如下:主反应C6H5C2H56H5C2H3 + H2副反应C6H5C2H56 + C2H4C2H4 + H2H6C6H5C2H5 + H2H6+ C2H6C6H5C2H56H5,CH3+ CH4此外,还有部分芳烃脱氢缩合、聚合物以及焦油和碳生成。
2.2 影响因素2.2.1温度的影响乙苯脱氢反应为吸热反应,?H00,从平衡常数与温度的关系式?H0??lnKP?可知,提高温度可增大平衡常数,从而提高脱氢反应的平衡???2?TRT??P转化率。
但是温度过高副反应增加,使苯乙烯选择性下降,能耗增大,设备材质要求增加,故应控制适应的反应温度。
2.2.2 压力的影响?P?乙苯脱氢为体积增加的反应,从平衡常数与压力的关系式KP?Kn?总?可??ni???知,当?γ0时,降低总压P总可使Kn增大,从而增加了反应的平衡转化率,故降低压力有利于平衡向脱氢方向移动。
实验中加入惰性气体或减压条件下进行,通常均使用水蒸气作稀释剂,它可降低乙苯的分压,以提高平衡转化率。
水蒸气的加入还可向脱氢反应提供部分热量,使反应温度比较稳定,能使反应产物迅速脱离催化剂表面,有利于反应向苯乙烯方向进行;同时还可以有利于烧掉催化剂表面的积碳。
但水蒸汽增大到一定程度后,转化率提高并不显著,因此适宜的用量为:水:乙苯,1.2,2.6:1(质量比)。
2.2.3 空速的影响乙苯脱氢反应中的副反应和连串副反应,随着接触时间的增大而增大,产物苯乙烯的选择性会下降,催化剂的最佳活性与适宜的空速及反应温度有关,本-1实验乙苯的液空速以0.6,1h为宜。
乙苯脱氢制苯乙烯的实验反思
乙苯脱氢制苯乙烯的实验反思1. 实验目的本次实验的目的是通过乙苯脱氢反应制备苯乙烯,通过实验验证催化剂对反应速率和产物选择性的影响。
2. 实验步骤及观察结果2.1 实验步骤1.实验前准备:将所需仪器、试剂准备齐全,清洗干净。
2.综合反应装置:按照实验要求组装综合反应装置,包括催化剂放置器、反应釜和冷凝器。
3.加入催化剂:在催化剂放置器中加入适量的磷酸硅凝胶催化剂。
4.开始反应:将乙苯缓慢滴入反应釜中,并同时通入反应气体。
5.反应结束:停止滴加乙苯后,继续通入反应气体一段时间,以确保反应充分。
6.收集产物:将产生的气体通过冷凝器冷却并收集。
2.2 观察结果•反应开始时,乙苯溶液呈现透明状。
•随着反应的进行,乙苯溶液逐渐变浑浊,产生溶液中的气泡。
•反应结束后,收集到的气体呈黄色。
3. 实验结果与讨论3.1 异常观察及可能原因在实验过程中,没有观察到异常情况。
3.2 反应速率与催化剂的关系本实验对比了使用不同催化剂的乙苯脱氢反应速率,通过比较反应结束时收集到的气体颜色的深浅,可以初步判断反应速率的差异。
然而,由于实验过程中所使用的催化剂种类有限,并且没有设置对照组,无法准确评估不同催化剂对反应速率的影响。
因此,在未来的实验中,应该选择更多的催化剂进行比较,并设计对照组来准确评估反应速率的差异。
3.3 反应产物的选择性与催化剂的关系乙苯脱氢反应的主要产物是苯乙烯,然而,实验结果表明,反应产物中还有一些副产物。
通过进一步的分析,发现了苯环的裂解现象,导致了副产物的形成。
这可能与催化剂的选择有关。
在本次实验中,磷酸硅凝胶催化剂被选中,其与反应物表面形成的活性位点对于苯环的裂解具有一定的促进作用,导致副产物的生成。
为了提高产物的选择性,在未来的实验中可以尝试使用其他催化剂,并探索不同催化剂对产物选择性的影响。
3.4 实验条件与结果的关系本次实验中,反应的温度、催化剂用量和反应时间等实验条件对实验结果产生了重要影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一 、实验目的
1、了解以乙苯为原料在铁系催化剂上进行固定床制备苯乙烯的过程,学会
设计实验流程和操作;
2、掌握乙苯脱氢操作条件对产物收率的影响,学会获取稳定的工艺条件之
方法;
3、掌握催化剂的填装、活化、反应使用方法;
4、掌握色谱分析方法。
二 、实验原理
1、主副反应
乙苯脱氢生成苯乙烯和氢气是一个可逆的强烈吸热反应,只有在催化剂存在的高温条件下才能提高产品收率,其反应如下:
主反应
副反应
此外,还有部分芳烃脱氢缩合、聚合物以及焦油和碳生成。
2、影响因素 (1)温度的影响
乙苯脱氢反应为吸热反应,△H 0>0,从平衡常数与温度的关系式
2
0ln RT H T K P P ∆=⎪⎭⎫
⎝⎛∂∂可知,提高温度可增大平衡常数,从而提高脱 氢 反应的平衡转化率。
但是温度过高副 反应增加,使苯乙烯选择性下降,能耗增大,设备材质要求增加,故应控制适应的反应温度。
(2)压力的影响
乙苯脱氢为体积增加的反应,从平衡常数与压力的关系式γ
∆⎥
⎦
⎤⎢⎣⎡∑=ni 总P K K n P 可知,当△γ>0时,降低总压P 总可使K n 增大,从而增加了反应的平衡转化率,故降
低压力有利于平衡向脱氢方向移动。
实验中加入惰性气体或减压条件下进行,通常均使用水蒸气作稀释剂,它可降低乙苯的分压,以提高平衡转化率。
水蒸气的加入还可向脱氢反应提供部分热量,使反应温度比较稳定,能使反应产物迅速脱离催化剂表面,有利于反应向苯乙烯方向进行;同时还可以有利于烧掉催化剂表面的积碳。
但水蒸汽增大到一定程度后,转化率提高并不显著,因此适宜的用量为:水:乙苯=1.2~2.6:1(质量比)。
(3)空速的影响
乙苯脱氢反应中的副反应和连串副反应,随着接触时间的增大而增大,产物苯乙烯的选择性会下降,催化剂的最佳活性与适宜的空速及反应温度有关,本实验乙苯的液空速以0.6~1h-1为宜。
(4)催化剂
乙苯脱氢技术的关键是选择催化剂。
此反应的催化剂种类颇多,其中铁系催化剂是应用最广的一种。
以氧化铁为主,添加铬、钾助催化剂,可使乙苯的转化率达到40%,选择性90%。
在应用中,催化剂的形状对反应收率有很大影响。
小粒径、低表面积、星形、十字形截面等异形催化剂有利于提高选择性。
为提高转化率和收率,对工业规模的反应器的结构要进行精心设计。
实用效果较好的有等温和绝热反应器。
实验室常用等温反应器,它以外部供热方式控制反应温度,催化剂床层高度不宜过长。
三、实验装置及仪器
实验流程见图1
图1 实验装置流程图
反应器有石英玻璃管和不锈钢管式反应器两种,内部中心轴向有测温热电偶插入管,结构如图2、图3。
所用仪器如下:
(1)柱塞式液体加料泵2台;
(2)氮气钢瓶1个;
(3)注射器(10μL)1支;
(4)色谱仪1台;
(5)取样瓶5只;
(6)分液漏斗1个;
(7)反应器及温度控制仪1套;
(8)冷却器1个;
(9)气液分离器1个;
(10)储液瓶2支;
(11)催化剂40mL。
四、实验步骤
(1)组装流程(将催化剂按图2、3所示装入反应器内),检查各接口,试漏(空气或氮气)。
(2)检查电路是否连接妥当。
(3)上述准备工作完成后,开始升温,预热器温度控制在200~300℃。
待反应器温度达到200℃后,开始启动注水加料泵,同时调整流量(控制在0.6ml/min 以内)持续升温,温度升至500℃时,恒温活化催化剂1个小时,此后逐渐升温至550℃,启动乙苯加料泵。
调节流量在水:乙苯=2:1(体积比)范围内,并严格控制进料速度使之稳定。
反应温度控制在550℃、575℃、600℃、625℃、650℃。
考查不同温度下反应物的转化率与产品的收率。
(4)在每个反应条件下稳定30分钟后,取20分钟样品二次,取样时用分液漏斗分离水相,用注射器进样至色谱仪中测定其产物组成。
分别称量油相及水相重量,以便进行物料恒算。
(5)反应完毕后停止加乙苯原料,继续通水维持30~60分钟,以清除催化剂上的焦状物,使之再生后待用。
(6)实验结束后关闭水、电。
五、数据记录与处理
根据实验内容自行设计记录表格,记录实验数据:
原始记录室温:大气压:
分析结果
按下式处理数据
00100 原料中乙苯量乙苯量
原料中乙苯量-产物中乙苯转化率=
00100mol)
mol)
反应的乙苯量(生成苯乙烯量(苯乙烯选择性=
苯乙烯收率=转化率x 选择性
通过计算得出在各个反应温度下乙苯的转化率和苯乙烯收率如下表所示:
乙苯的转化率和苯乙烯收率表
反应温度/℃ 乙苯转化率/% 苯乙烯选择性/% 苯乙烯收率/% 备注
570.2 1.00 28.26 0.28 597.1 5.04 71.95 3.63 621.9 11.66 33.89 3.95 648.7 51.48 91.24 46.97 673.2
71.95
81.84
58.57
乙苯转化率和苯乙烯收率-温度曲线图
六、结果与讨论
结果分析:
1.随着温度的升高,转化率增大,选择性波动,收率增大;
2.由于乙苯脱氢反应是吸热反应,温度升高有利于主副反应的进行,所以
转化率升高,选择性波动;
3.有图可知收率增大,故升高温度有利于乙苯脱氢反应。
误差分析:
1、仪器存在系统误差;
2、由于第一组数据催化剂活化时间由原来的三小时改为一小时,催化剂活
性低,使得转化率低;
3、由于产物隔周测量,产物氧化变质影响实验结果。
