全国艾滋病检测技术规范(2015年修订版)印刷版(终版)
HIV检测规范

1 范围本章规定了HIV抗体的检测方法、结果报告及质量控制。
适用于各级各类医疗、疾病预防控制、检验检疫、采供血及卫生保健机构。
可作为对HIV感染者诊断和监测的实验室依据。
2 规范性文件引用《艾滋病和艾滋病病毒感染诊断标准》(中华人民共和国卫生行业标准,WS293-有效版本)。
Consolidated Guidelines on HIV Testing Services. WHO July 2015Statement from the Surveillance and Survey Working Group and the Laboratory Working Group to the Office of the Global AIDS Coordinator.26 Nov.2006.Guidelines for using HIV testing technologies in surveillance. UNAIDS/WHO.2009.《艾滋病病毒抗体快速检测技术手册》(中国疾病预防控制中心,2011年版)3 HIV抗体检测实验室要求应符合国家对实验室生物安全的有关要求。
实验室的质量控制按本规范相关章节规定执行。
4 HIV抗体检测的目的和要点4.1 HIV抗体检测的目的4.1.1 HIV抗体检测可用于诊断、血液筛查、监测等。
4.1.2 以诊断为目的的检测是为了确定个体HIV感染状况,包括临床检测、自愿咨询检测、根据特殊需要进行的体检等。
4.1.3 以血液筛查为目的的检测是为了防止输血传播HIV,包括献血员筛查和原料血浆筛查。
4.1.4 以监测为目的的检测是为了解不同人群HIV感染率及其变化趋势,包括各类高危人群、重点人群和一般人群。
4.2 HIV抗体检测的要点4.2.1 根据目的选择检测方法及检测策略。
4.2.2 严格遵守实验室标准操作程序(SOP)。
4.2.3 结果判定以试剂盒说明书为标准。
全国艾滋病检测技术规范

全国艾滋病检测技术规范National Guideline for Detection of HIV/AIDS(2009年修订版)中国疾病预防控制中心二○○九年九月全国艾滋病检测技术规范National Guideline for Detection of HIV/AIDS (2009年修订版)中国疾病预防控制中心二○○九年九月II前言艾滋病在我国的流行已有二十余年,随着感染者不断增加、感染人群的变化和临床病人的日益增多,艾滋病检测工作量逐渐加大,新的监测和检测需求也不断增加,艾滋病检测实验室已遍及全国各级医疗、疾病预防控制、采供血、妇幼保健机构,出入境检验检疫、军队等各个系统。
近几年,为了适应基层艾滋病检测的需要,一些没有条件建立规范的艾滋病检测实验室的乡镇卫生院,也陆续建起了艾滋病检测点。
遍布全国的实验室网络为艾滋病防治工作提供了重要而坚实的基础。
在新的形势下,为了更加有效地支持艾滋病监测、咨询检测(包括VCT和PITC)、新生儿感染早期诊断和抗病毒治疗工作,根据《关于艾滋病抗病毒治疗管理工作的意见》、《中国预防与控制艾滋病中长期规划(1998—2010年)》和“四免一关怀”等重要方针政策,在向各省、市征求意见基础上,在“全国艾滋病检测实验室审评和技术指导专家组”的参与下,中国疾病预防控制中心性艾滋病预防控制中心对《全国艾滋病检测技术规范(2004年版)》进行修改、增补和完善后,制定出《全国艾滋病检测技术规范(2009年版)》,使其既能满足目前艾滋病检测工作的实际需要,又能体现检测技术的发展。
本次主要对以下几个方面内容进行了修改、增补和完善:(1)在样品的采集和处理中,增加了滤纸干血斑样品、快速检测样品的采集和处理,用于CD4+/CD8+T淋巴细胞测定样品、尿液和唾液样品的采集和处理;(2)在HIV抗体检测中,增加了免疫荧光法和化学发光法,进一步明确了不同情况下的检测策略;(3)在HIV核酸检测中,增加了HIV感染产妇所生婴儿HIV感染早期诊断检测流程和适用于窗口期的集合核酸检测方法;(4)根据临床治疗需求,增加了HIV-1的耐药检测;(5)进一步完善了艾滋病检测实验室安全防护和艾滋病检测实验室的质量管理,使其更加符合目前艾滋病防治工作的需求,更加具有可操作性;(6)考虑到技术发展和新的需求,增加了HIV-1新近感染检测和HIV-1的分离培养技术。
全国人类免疫缺陷病毒检测技术规范(2023年修订版)

全国人类免疫缺陷病毒检测技术规范(2023年修订版)引言本文档是全国人类免疫缺陷病毒(HIV)检测技术规范的修订版,旨在规范全国范围内HIV检测的质量和准确性,以提高HIV 感染者的早期发现和治疗。
1. 范围本技术规范适用于全国范围内所有医疗机构、疾病预防控制中心、实验室等单位进行HIV检测。
2. 术语定义- HIV:Human Immunodeficiency Virus,人类免疫缺陷病毒。
- HIV抗体:人体对HIV感染产生的免疫反应所产生的抗体。
- HIV抗原:HIV感染人体内HIV病毒产生的抗原。
- HIV核酸:HIV病毒的遗传物质(RNA)。
3. 检测方法3.1 HIV抗体检测- 检测方法应使用经国家药品监督管理部门批准的HIV抗体检测试剂盒。
- 检测过程应严格按照检测试剂盒说明书进行操作。
- 检测结果应根据检测试剂盒说明书的判断标准进行解读。
3.2 HIV抗原检测- HIV抗原检测可作为HIV感染早期诊断的辅助方法。
- 检测方法应使用经国家药品监督管理部门批准的HIV抗原检测试剂盒。
- 检测过程应严格按照检测试剂盒说明书进行操作。
- 检测结果应根据检测试剂盒说明书的判断标准进行解读。
3.3 HIV核酸检测- HIV核酸检测可作为HIV感染确认和病毒负载监测的方法。
- 检测方法应使用经国家药品监督管理部门批准的HIV核酸检测试剂盒。
- 检测过程应严格按照检测试剂盒说明书进行操作。
- 检测结果应根据检测试剂盒说明书的判断标准进行解读。
4. 质量控制4.1 检测设备- 检测设备应符合国家标准和相关法规的要求。
- 设备应定期进行校准和维护,确保其准确性和稳定性。
4.2 检测人员- 检测人员应具备相关专业知识和技能,经过专业培训并持有相关资质证书。
- 检测人员应定期参加质量控制和技术培训,保持技术能力和水平。
4.3 质量控制物质- 检测过程中应使用经国家质量控制中心认证的质控物质,以保证检测结果的准确性和可靠性。
艾滋病检测技术规范(2015版)勘误表
全国艾滋病检测技术规范(2015年修订版)勘误表
1. 第4页,4.3.5中,“时间不超过24小时”改为“时间不超过48小时”。
2. 第16页,5.4.1.1中,第二行“下表”改为“试剂盒规定的”。
3. 第29页,5.2.
4.2中,第二行“报告检测值,”改为“报告检测值;”。
4. 第30页,
5.3.1.6中,第二行“RNA1033CPs/ml”改为“RNA103CPs/ml”。
5. 第31页,
6.3中,第五行“150003CPs/ml”改为“15000CPs/ml”。
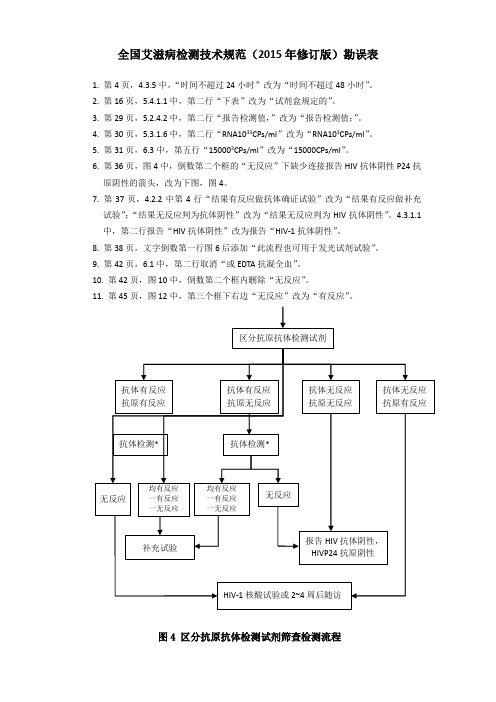
6. 第36页,图4中,倒数第二个框的“无反应”下缺少连接报告HIV抗体阴性P24抗
原阴性的箭头,改为下图,图4。
7. 第37页,4.2.2中第4行“结果有反应做抗体确证试验”改为“结果有反应做补充
试验”;“结果无反应判为抗体阴性”改为“结果无反应判为HIV抗体阴性”。
4.3.1.1中,第二行报告“HIV抗体阴性”改为报告“HIV-1抗体阴性”。
8. 第38页,文字倒数第一行图6后添加“此流程也可用于发光试剂试验”。
9. 第42页,6.1中,第二行取消“或EDTA抗凝全血”。
10. 第42页,图10中,倒数第二个框内删除“无反应”。
11. 第45页,图12中,第三个框下右边“无反应”改为“有反应”。
全国艾滋病检测技术规范修订说明

附件2全国艾滋病检测技术规范修订说明本次《全国艾滋病检测技术规范》简称规范修订根据我国目前HIV检测的检测需求,结合发达国家使用的指南,主要对以下几个方面内容进行了修改、增补和完善:(1)完善了不同的检测策略,并将其整合为独立的新的一章(艾滋病病毒实验室检测策略)。
将09版HIV抗体检测一章中检测流程全部放进本章,规范了流程图;增加了疫情监测的HIV匿名无关联试验流程;将09版阴性反应和阳性反应改为无反应和有反应(更科学);修改09版HIV抗体筛查流程,增加了一种试剂检测有反应时,可以用原有试剂双孔双份复检程序(简化流程),对复检结果有反应或者一有反应一无反应的情况,增加了可以选择核酸诊断的策略(满足医院的和血站需求),既可以选择抗体确证,也可选择核酸诊断;修改09版核酸检测流程,将WB不确定结果随访由4周改到2-4周(试剂敏感性提高),并可以进行核酸检测;新增加抗原检测流程图(发现可能的早期感染者);新增核酸检测流程图;修改09版高危人群VCT检测流程,将S/CO 值定义值6取消,(目前试剂比较多,S/CO比值不同,无法硬性规定),新增高危人群快速试剂检测策略和快速+酶联试剂的检测策略(云南和我科室的研究资料支持不用WB在高危人群中确证HIV感染);增加了血液筛查两个流程,血液HIV血清学筛查试验流程和血液核酸HIV试验流程(血站在用的,可以了解血站的检测流程);修改了09版艾滋病感染产妇所生儿童HIV感染早期感染检测流程,出生后6周采集血,制备干血斑,而不用EDTA 抗凝的全血(简化运输危险性和费用)。
(2)增加了HIV-1新发感染检测一章(原来规范里的内容简单,本次充实内容,增加了新的亲和力检测新发感染的方法)。
(3)新增补充试验概念,其内容包括抗体确证试验(WB,RIBA/LIA)和核酸试验(定性和定量试验)。
(4)完善HIV-1抗原检测一章,细化了定性试验的种类,完善了相应检测方法的质控。
全国艾滋病检测技术规范(试行)

样品的采集和处理—样品的接受
样品由经过培训的工作人员接受。 核对样品与送检单,检查有无破损和溢漏,
记录有无严重溶血、污染等情况。 自发荧光的样品不可用荧光测试。 消毒处理被污染的盛器和物品。
HIV抗体检测—试剂
1、筛查试剂要求 国家食品药品监督管理局注册批准 批批检合格 临床评估质量优良 在有效期内 2、确认试剂要求 国家食品药品监督管理局注册批准 种类:免疫印迹、条带免疫、免疫荧光 常用试剂:免疫印迹
HIV抗体检测确认试验流程图
免疫印迹法(HIV1/2混合型)
阴性反应 HIV-1阳性反应 不确定反应
出现HIV-2指示条带
阴性报告 HIV-1阳性报告
免疫印迹法(HIV-2)
阳性反应
阴性反应
报告HIV-2血清学阳性 不确定反应 必要时测核酸
阴性反应
每3个月随访一次,共2次,仍属可疑,则作阴性报告;如随访期间出现阳性反应则报告阳性
《全国艾滋病检测工作规范》 卫生部1997年9月颁布
《全国艾滋病检测工作管理规范》 卫生部待颁布
《全国艾滋病检测技术规范》(试行) 中国CDC2003年5月颁布
全国艾滋病检测技术规范(试行)
包括: 1、样品的采集和处理 2、HIV抗体、抗原检测 3、HIV核酸检测 4、艾滋病检测实验室安全防护 5、艾滋病实验室质量管理 6、艾滋病确认实验室质量考评办法 7、HIV诊断试剂临床评估方案
3、操作:严格按照试剂盒说明书 4、结果报告和解释:
*P24抗原阳性必须经过中和试验确认 *P24抗原阳性仅作HIV感染的辅助诊
断依据,不能确诊 *P24抗原阴性只表示本试验无反应,不能
艾滋病技术规范
全国艾滋病检测技术规范(试行)中国疾病预防控制中心二○○三年五月第二版《全国艾滋病检测工作规范》修改说明艾滋病检测工作具有严格的科学性和政策性。
为了加强全国艾滋病检测工作的规范化管理和质量控制,确保每一例检测的准确性和可靠性,及时有效地发现感染者和上报疫情,1997年9月卫生部对1990年发布的《全国HIV检测管理规范(试行)》修改补充后,颁布了第一版《全国艾滋病检测工作规范》。
《全国艾滋病检测工作规范》实施五年多来,在全国艾滋病检测实验室的设臵、申报、验收和审批,HIV抗体检测工作的规范化和质量管理,检测结果的判定、报告和反馈,实验室安全以及HIV感染者和艾滋病患者的保密等方面均发挥了重要的作用。
艾滋病在我国的流行已经近20年,流行形势日趋严峻,据估计截至2002年底HIV 感染者已逾百万,随着感染者数量的不断增加和临床病人的日益增多,检测工作的量也在不断加大,各级艾滋病检测实验室也由疾病预防控制系统逐渐遍及医院、血站、出入境检验检疫局、妇幼、军队等各个系统。
因此,早期制定的“全国艾滋病检测工作规范”已经不能满足目前各个系统对艾滋病检测工作的需求。
此外,近年来,检测技术和方法有了很大的发展和提高,对于保障血液安全和缩短窗口期等也提出了更高的要求,因此,仅靠单纯的血清学检测方法已经不能满足需求。
为了更好的指导全国的艾滋病检测工作,不断提高检测工作质量,需要进一步丰富有关的检测技术内容,制定更加完善的可满足各个系统需求的检测工作规范。
2001年由艾滋病确认实验室审评专家委员会组织对第一版《全国艾滋病检测工作规范》进行修改、补充工作。
经初步修改后,于2001年11月召开的“全国艾滋病检测工作年会”上各确认实验室的专家及技术人员对修改稿进行了讨论,与会者提议,考虑到检测技术和方法的快速发展和卫生部的职能下放等因素,为便于检测工作的管理、及时增加和补充新的技术内容,建议将原“全国艾滋病检测工作规范”修订为“艾滋病检测工作管理办法”(下称“办法”)和“艾滋病检测技术规范”(下称“规范”),使艾滋病检测工作的管理和技术文件能够更加准确地为全国艾滋病检测实验室提供服务。
05张佳峰_全国艾滋病检测技术规范(2020修订版)解读 20200923
全国艾滋病检测技术规范(2020修订版)解读张佳峰浙江省疾病预防控制中心2020年9月23日《全国艾滋病检测技术规范》第一版(1997)第二版(2004)第三版(2009)第四版(2015)第五版(2020)新规范修订的背景☐我国艾滋病防治对扩大检测的需求不断增加《中国遏制与防治艾滋病“十三五”行动计划》、《遏制艾滋病传播实施方案(2019—2022年)》要求我国艾滋病防治实现“三个90%”的防治目标,其中第一个90%,即诊断发现并知晓自身感染状况的感染者和病人的比例达90%以上。
检测是艾滋病防治不可或缺的科学工具和技术支撑,近年来艾滋病检测需求不断增加。
新规范修订的背景☐防治工作的发展对艾滋病检测提出新挑战国内外艾滋病检测技术不断发展,新的检测方法和检测策略不断出现并逐步推广应用防治工作的发展也给检测提出了新的挑战:如何提高对急性期感染者的诊断能力如何在暴露前后预防、急性期治疗等新型防治策略下准确诊断如何对输入性抗体等新情况进行检测新版检测技术规范的起草和编写单位起草单位:中国疾病预防控制中心性病艾滋病预防控制中心参加编写单位:中国人民解放军军事科学院军事医学研究院、上海市疾病预防控制中心、中国医科大学、云南省疾病预防控制中心、四川省疾病预防控制中心、河南省疾病预防控制中心、北京市红十字血液中心、国家卫生健康委临床检验中心、江苏省疾病预防控制中心、安徽省疾病预防控制中心、首都医科大学附属北京地坛医院、首都医科大学附属北京佑安医院、北京市疾病预防控制中心、中华人民共和国北京海关、浙江省疾病预防控制中心。
本《规范》适用于全国艾滋病检测实验室本《规范》解释权属于中国疾病预防控制中心《全国艾滋病检测技术规范(2020年修订版)》发布《全国艾滋病检测技术规范(2020年修订版)》于2020年4月27日由中国疾病预防控制中心批准,下发至全国艾滋病检测实验室及有关单位,《全国艾滋病检测技术规范(2015年修订版)》同时废止。
全国艾滋病检测技术规范(2020年修订版)及
全国艾滋病检测技术规范(2020年修订版)及全国艾滋病检测技术规范修订说明
2020年4月27日,《全国艾滋病检测技术规范(2020年修订版)》(以下简称《规范》)由中国疾病预防控制中心批准发布实施,《全国艾滋病检测技术规范(2015年修订版)》同时废止。
《艾滋病和艾滋病病毒感染诊断标准》(中华人民共和国卫生行业标准,WS293-2019)和《全国艾滋病检测技术规范》(2020年版)明确规定:除了传统常用的艾滋病抗体筛查试验有反应后经艾滋病抗体确证试验阳性的检测策略外,增加了三个核酸检测相关标准:
1、艾滋病抗体筛查试验有反应和核酸定性试验阳性;
2、艾滋病抗体筛查试验有反应和核酸定量试验>5000CPs/ml;
3、有流行病学史或艾滋病相关临床表现,两次HIV核酸检测均为阳性。
2全国艾滋病检测技术规范修订版共123页文档
样品的保存(四)
• 艾滋病检测确证实验室收到的筛查阳性样 品,无论确证结果如何,均应将剩余的样 品保存至少10年,特殊用途或专项项目的 样品根据具体要求确定保存时间。
样品的运送
• 应符合生物安全要求; • 要获得相应部门批准并由具有资质的人员
专程护送; • 应采用三层容器对样品进行包装,随样品
应附有与样品唯一性编码相对应的送检单。 送检单应标明受检者姓名、样品种类等信 息,并应放置在第二层和第三层容器之间。
文 家 。汉 族 ,东 晋 浔阳 柴桑 人 (今 江西 九江 ) 。曾 做过 几 年小 官, 后辞 官 回家 ,从 此 隐居 ,田 园生 活 是陶 渊明 诗 的主 要题 材, 相 关作 品有 《饮 酒 》 、 《 归 园 田 居 》 、 《 桃花 源 记 》 、 《 五 柳先 生 传 》 、 《 归 去来 兮 辞 》 等 。
样品的保存(二)
• 用于核酸检测的血浆和血细胞样品4天内进 行检测的可存放于4℃,3个月以内应存放 于-20℃以下。3个月以上应置于-70℃以下。
样品的保存(三)
• 艾滋病检测筛查实验室检测的筛查阳性样 品应及时送确证实验室,筛查阴性样品, 可根据具体需要决定保存时间,建议至少 保存1~2个月。特殊用途或专项项目的样 品根据具体要求确定保存时间。
② 在HIV抗体检测中,增加了免疫荧光法和 化学发光法,进一步明确了不同情况下的 检测策略;
修订版(二)
③ 在HIV核酸检测中,增加了HIV感染产妇 所生婴儿HIV感染早期诊断检测流程和适 用于窗口期的集合核酸检测方法;
④ 根据临床治疗需求,增加了HIV-1的耐药 检测;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
全国艾滋病检测技术规范 National Guideline for Detection of HIV/AIDS (2015年修订版)
中国疾病预防控制中心 二○一五年十二月 全国艾滋病检测技术规范 National Guideline for Detection of HIV/AIDS (2015年修订版)
中国疾病预防控制中心 二○一五年十二月I
前 言 艾滋病在我国的流行已数十年,随着感染者和临床病人的不断增加、感染人群的变化,艾滋病检测工作量逐渐加大,对监测和检测的需求也不断增加,承担艾滋病检测的实验室已遍及全国各级医疗、疾病预防控制、采供血、妇幼保健机构,出入境检验检疫、军队等各个系统。为了尽早发现HIV感染者和艾滋病病人,及早提供咨询、治疗,同时为适应基层艾滋病检测工作需求,在新的形势下,根据《关于艾滋病抗病毒治疗管理工作的意见》、《中国预防与控制艾滋病中长期规划(1998—2010年)》、《中国遏制与防治艾滋病十二五行动计划的通知(国办发[2012]4号)》、“四免一关怀”等国家艾滋病防治重要方针政策和十三五防治工作重点,在广泛征求各省、市疾病预防控制机构和医疗机构意见的基础上,在中华人民共和国卫生和计划生育委员会艾滋病专家及省级专家的参与下,中国疾病预防控制中心性病艾滋病预防控制中心对《全国艾滋病检测技术规范(2009年版)》进行修改、增补和完善,制定出《全国艾滋病检测技术规范(2015年版)》(以下简称《规范》),使其既能满足目前艾滋病检测工作的实际需求,又能体现检测技术的发展。
本次《规范》修订工作立足于我国目前检测状况,结合发达国家使用的指南,主要对以下几个方面内容进行了修改、增补和完善:(1)完善了不同的检测策略,并将其整合为独立的一章;(2)增加了HIV-1新发感染检测一章;(3)新增了补充试验概念,其内容包括抗体确证试验(WB,RIBA/LIA等)和核酸试验(定性和定量试验);(4)增加了第4代试剂(抗原抗体联合检测试剂)的检测流程 ;(5)增加了核酸检测流程;(6)完善了检测报告。将抗体筛查和复检报告整合为 HIV抗体筛查检测报告,增加了HIV-1核酸检测报告和婴儿艾滋病病毒感染早期诊断检测报告,取消了流行病检测HIV抗体检测报告单、艾滋病病毒抗体检测数和阳性人数统计报表、艾滋病职业暴露个案登记表和艾滋病防治工作人员职业暴露事故汇总表;(7) 取消了实验室生物安全一章和艾滋病检测实验室质量管理一章。
所有附表的检测报告仅供使用实验室参考。 本《规范》由中国疾病预防控制中心批准,下发至全国艾滋病检测实验室及有关单位。本《规范》将为国家、相关部委下发的艾滋病防治工作各项政策法规的有效实II
施提供强有力的技术支持,并具体指导艾滋病实验室技术人员开展日常工作。 本《规范》起草单位:中国疾病预防控制中心性病艾滋病预防控制中心。 本《规范》参加编写单位:中国人民解放军军事医学科学院、上海市疾病预防控制中心、中国医科大学、北京出入境检验检疫局、云南省疾病预防控制中心、四川省疾病预防控制中心、浙江省疾病预防控制中心、河南省疾病预防控制中心、北京市红十字血液中心、卫生部临床检验中心、江苏省疾病预防控制中心、陕西省疾病预防控制中心、安徽省疾病预防控制中心、首都医科大学附属北京佑安医院、北京市疾病预防控制中心。 本《规范》编写组人员:蒋岩、汪宁、李敬云、钟平、尚红、邵一鸣、肖瑶、朱红、邢文革、姚均、潘品良、邱茂锋、马艳玲、梁姝、郭志宏、王哲、葛红卫、王盈、李金明、徐晓琴、常文辉、吴建军、张福杰、吴昊、苏雪丽、廖玲洁。 本《规范》参加编写主要国际机构:世界卫生组织(Po-lin CHAN、张岚)。美国疾病预防控制中心GAP项目( Colin Shepard、郝玲、齐明山)。 本《规范》编写工作联系人:肖瑶。 本《规范》自发布之日起实施,同时终止《全国艾滋病检测技术规范(2009年版)》。 本《规范》适用于全国艾滋病检测实验室。 本《规范》解释权属于中国疾病预防控制中心。 致谢:感谢盖茨基金会在《规范》修订过程中给予技术和人力等方面的支持。 全国艾滋病检测技术规范
1 目 录
第一章 样品的采集和处理 .......................................................................................... 6 1 范围 ............................................................................................................................... 6 2 规范性文件引用 ........................................................................................................... 6 3 样品种类及相应的用途 ............................................................................................... 6 4 操作步骤 ....................................................................................................................... 7 4.1 采样前准备........................................................................................................... 7 4.2 样品的采集和处理............................................................................................... 7 4.3 样品的保存........................................................................................................... 9 4.4 样品的运送........................................................................................................... 9 4.5 样品的接收......................................................................................................... 10
第二章 HIV抗体检测 .............................................................................................. 11 1 范围 ............................................................................................................................. 11 2 规范性文件引用 ......................................................................................................... 11 3 HIV抗体检测实验室要求 .......................................................................................... 11 4 HIV抗体检测的目的和要点 ...................................................................................... 11 4.1 HIV抗体检测的目的.......................................................................................... 11 4.2 HIV抗体检测的要点.......................................................................................... 12 5 常规HIV抗体检测方法 ............................................................................................. 12 5.1 试剂和样品........................................................................................................... 12 5.2 方法....................................................................................................................... 12 6 结果报告 ..................................................................................................................... 14 6.1 筛查报告............................................................................................................. 14 6.2 确证报告............................................................................................................. 14 7 质量控制 ..................................................................................................................... 15 7.1 酶免或发光法抗体检测的室内质量控制......................................................... 15 7.2 快速法抗体检测质控......................................................................................... 17
