热力学讲义——第七章
合集下载
热力学第七章2.

锅炉 调节阀
冷却水 冷凝器
抽汽式热电联 供循环, 可以自动 调节热、电供应比 例,以满足不同用 户的需要。
水泵 2 加热器 水泵 1
热电联产(供)循环的经济性评价
只采用热效率
t
wnet q1
显然不够全面
能量利用系数,但未考虑热和电的品位不同
Utilization factor
K
已被利用的能量 工质从热源得到的能量
q供热+wnet q1
Ex经济学评价
热电联产、集中供热是发展方向,经济环保
第七章 小 结 Summary
1、熟悉郎肯循环图示与计算 2、郎肯循环与卡诺循环
3、蒸汽参数对朗肯循环热效率的影响 4、再热、回热原理及计算
第七章 完
End of Chapter Seven
1 1kg
抽汽 冷凝水
a2
α kg
6
3
5
4
(1-α )kg
抽汽式回热
Feedwater heater
Closed Feedwater heater 去凝汽器
表面式回热器
抽汽 给O水pen Feed冷wa凝te水r
heater
混合式回热器
蒸汽抽汽回热循环
T
1
1kg 6 kg
a
4 5 (1- )kg
放热量:
q2 h2 h3
净功(忽略泵功):
3
2 wnet h1 hb ha h2
热效率: t,RH
wqns1et
(h1 hb ) (ha h2 ) (h1 h4 ) (ha hb )
§7-4 蒸汽回热循环(regenerative)
《化工热力学》第七章

汽-液平衡计算可分为两大类: * 泡点/露点计算:流体混合物所处单相饱和点。若已知温度,可求出相 应的泡/露点压力;若已知压力,可求出相应的泡/露 点温度,同时计算得到平衡相的组成。 * 平衡闪蒸计算:流体混合物处于汽-液两相区。通常已知混合物总组成 zi,体系温度、压力,求解平衡汽、液相的量及两相 的组成。
中的溶解平衡;气体在固体表面的吸附平衡,如:用分子筛从天然气
中脱除二氧化碳和硫化氢 。
7.1.2 相平衡的基本类型及其工业背景(续)
(五)液-固平衡
液-固平衡包括两种平衡:
溶解平衡:是发生在不同的化学物种的液相和固相间。 熔化平衡:是发生在同一化学物种的熔融态和固态间。 结晶过程是典型的化工单元操作之一。沥青质、石蜡的沉淀是石油 生产和运输中常见的液-固平衡问题。
定义i组分的相平衡常数Ki为: K i
ˆL yi Ki iV ˆ xi i
yi xi
p ˆ RT ln i n i
V
RT dV RT ln Z T ,V ,n j i V
7.2.1 状态方程法(续)
回归得到。不同状态方程对应的kij值是不同的。使用一个交互作用参数 kij,大多数立方型状态方程就可较好地描述非极性、弱极性和对称性体 系(如烃类混合物)的相平衡行为。但不能很好描述强极性和非对称体 系,有时可再加入一个可调参数lij,即
bij bi b j 2
1 l
ij
(3)交互作用参数与组成有关的混合规则 Kabadi和Danner混合规则(烃-水体系 )
(1)已知α相摩尔分数 x1 ,x2 , x3 … xm 和温度T(或压力P),求解β
相摩尔分数 x1, ,x3 … xm 和压力P(或温度T)。 x2
中的溶解平衡;气体在固体表面的吸附平衡,如:用分子筛从天然气
中脱除二氧化碳和硫化氢 。
7.1.2 相平衡的基本类型及其工业背景(续)
(五)液-固平衡
液-固平衡包括两种平衡:
溶解平衡:是发生在不同的化学物种的液相和固相间。 熔化平衡:是发生在同一化学物种的熔融态和固态间。 结晶过程是典型的化工单元操作之一。沥青质、石蜡的沉淀是石油 生产和运输中常见的液-固平衡问题。
定义i组分的相平衡常数Ki为: K i
ˆL yi Ki iV ˆ xi i
yi xi
p ˆ RT ln i n i
V
RT dV RT ln Z T ,V ,n j i V
7.2.1 状态方程法(续)
回归得到。不同状态方程对应的kij值是不同的。使用一个交互作用参数 kij,大多数立方型状态方程就可较好地描述非极性、弱极性和对称性体 系(如烃类混合物)的相平衡行为。但不能很好描述强极性和非对称体 系,有时可再加入一个可调参数lij,即
bij bi b j 2
1 l
ij
(3)交互作用参数与组成有关的混合规则 Kabadi和Danner混合规则(烃-水体系 )
(1)已知α相摩尔分数 x1 ,x2 , x3 … xm 和温度T(或压力P),求解β
相摩尔分数 x1, ,x3 … xm 和压力P(或温度T)。 x2
热学第七章

胡克定律的微观理解
F
F=-a(r-r0)
r0
r
第19页,本讲稿共23页
§3. 晶体中粒子的热运动(1)
决定物质热学性质的内因是分子力和分子的热运动。
对于气体,热运动的能量占主要地位;对于晶体分子间的势能占 主要地位。
晶体中粒子的热运动并不能破坏粒子之间的结合,只是 使粒子在平衡位置附近做微小的振动,即热振动。
§2. 晶体中粒子的结合力和结合能(5)
3. 范德瓦耳斯键: 分子间的微弱吸引力
由范德瓦耳斯键的作用所组成的晶体 称为分子晶体
分子晶体的特点是:硬度小、熔点低、
易挥发
低静电势能
+-
+-
范德瓦耳斯 (1837~1923)
瞬时偶极矩
高静电势能
+ -- +
第13页,本讲稿共23页
§2. 晶体中粒子的结合力和结合能(6)
c3r杜隆珀蒂定律二热缺陷的产生和运动扩散晶体中粒子的热运动能量和气体中一样也有一定的统计分布在一定温度下总有一些粒子具有足够的能量脱离平衡位置而形成缺陷这种由于粒子热运动而产生的缺陷称为热缺陷热缺陷可分为填充粒子和空位两种
热学第七章
第1页,本讲稿共23页
目录
§1. 晶体 §2. 晶体中粒子的结合力和结合能 §3. 晶体中粒子的热运动
晶格整体平移一定距离后与 自身重合,此距离称为晶格
的平移周期,在不同方向上
有不同的平移周期。最小的
几何单位称为原胞,原胞各 边的尺寸称为点阵常数。
具有平移对称性的晶格,只能
有2、3,4、6重旋转对称性
3重旋转对称性
第7页,本讲稿共23页
§1. 晶体(5)
准晶:不具有严格平移对称性,
F
F=-a(r-r0)
r0
r
第19页,本讲稿共23页
§3. 晶体中粒子的热运动(1)
决定物质热学性质的内因是分子力和分子的热运动。
对于气体,热运动的能量占主要地位;对于晶体分子间的势能占 主要地位。
晶体中粒子的热运动并不能破坏粒子之间的结合,只是 使粒子在平衡位置附近做微小的振动,即热振动。
§2. 晶体中粒子的结合力和结合能(5)
3. 范德瓦耳斯键: 分子间的微弱吸引力
由范德瓦耳斯键的作用所组成的晶体 称为分子晶体
分子晶体的特点是:硬度小、熔点低、
易挥发
低静电势能
+-
+-
范德瓦耳斯 (1837~1923)
瞬时偶极矩
高静电势能
+ -- +
第13页,本讲稿共23页
§2. 晶体中粒子的结合力和结合能(6)
c3r杜隆珀蒂定律二热缺陷的产生和运动扩散晶体中粒子的热运动能量和气体中一样也有一定的统计分布在一定温度下总有一些粒子具有足够的能量脱离平衡位置而形成缺陷这种由于粒子热运动而产生的缺陷称为热缺陷热缺陷可分为填充粒子和空位两种
热学第七章
第1页,本讲稿共23页
目录
§1. 晶体 §2. 晶体中粒子的结合力和结合能 §3. 晶体中粒子的热运动
晶格整体平移一定距离后与 自身重合,此距离称为晶格
的平移周期,在不同方向上
有不同的平移周期。最小的
几何单位称为原胞,原胞各 边的尺寸称为点阵常数。
具有平移对称性的晶格,只能
有2、3,4、6重旋转对称性
3重旋转对称性
第7页,本讲稿共23页
§1. 晶体(5)
准晶:不具有严格平移对称性,
第7章热力学
(3)对微小过程,热力学第一定律可以表示成:
dQ dE dA
(4)过程量与状态量
二、准静态过程中的体积功
气体在某准静态过程中对外做功,实 际上是通过体积变化达到的。
dx
F
dA Fdx pSdx pdV
第二篇 热学
A dA PdV
V1 V2
P
P1
A II I B
A Q E R(T2 T1 )
第二篇 热学
本题还有另外一种计算方法:通过过程曲线先计算做功和内能增量 ,即:
A ( P 1P 2 )(V2 V 1) / 2
P kV , PV RT 1 A ( PV 1 1 PV 2 1 PV 1 2 PV 2 2) 2 1 ( RT2 RT1 ) R(T2 T1 ) 2
a
V V
•内能改变:
i E R T 2
•体积功:
V 0 A 0
i Q E RT 2 CV ,m Q i R T 2
•热量
Q : E : A 1 : 1 : 0
这里,CV,m叫定容摩尔热容量。
•摩尔热容量
第二篇 热学
2.等压过程 •特点: p1 理想气体的压强保持不变,p = const. •过程曲线: 在 p-V 图上是一条垂直p轴的直线(等压线)。 过程方程:V/T = const.
•在p-V图中的一个点表示一个平衡态. •在p-V图中的一条曲线表示一个准静态过程. •准静态过程方程为:p = p(V)
P
A P B
o
4) V-T图和p-T图需要自己从p-V图翻译
V
V
第二篇 热学
3、常见准静态过程的曲线及其方程 (1)等容过程:
(大学物理)第七章热力学基础2-3

PCPV0
1
VCPV
n=0 n=
多方过程 PVn C (n为多方指数)
气体内进行的实际过程 一般情况可以多方指数为 1 n 多方过程近似代表。
例1:0.02kg的氦气(视为理想气体),温度由17℃升
为27℃,若在升温过程中,(1)体积不变;(2)压强
不变;(3)不与外界交换热量。
试分别求出气体内能的改变、吸收的热量、外界对气体
2) QcaAcaEc a
C ቤተ መጻሕፍቲ ባይዱQ dT
1)物质有关 2)过程有关
等体(等容)摩尔热容:(1mol物质)
dV 0 dA 0 p b.T2
dQ = dA + dE
dQdEi RdT 2
o
a.T1
V
CV
dQi R dT 2
等压摩尔热容:(1mol物质)
p
1.
.2
dQ dE dA
i RdTPdV 2
o V1
V2 V
等压摩尔热容:(1mol物质)
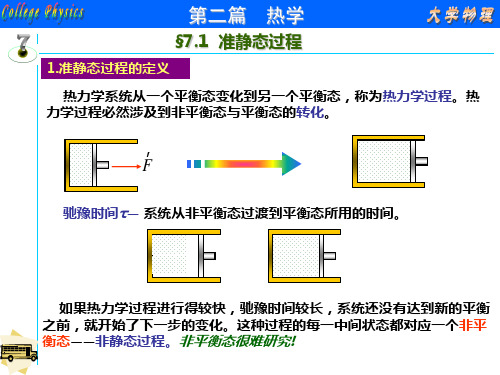
准静态过程 (quasi-static process)
一个过程,如果任意
时刻的中间态都无限接近
于一个平衡态,则此过程
为准静态过程。
R 电源
第七章 热力学基础 研究对象: 热力学第零定律 理想气体 热力学第一定律 平衡态 热力学第二定律 准静态过程
宏观运动能量
热运动能量
机械能引起系统热运动状态的变化 .
程 p1T c''
AV V 12PdV P1V1V V 12dVVpp1
1(p1,V1,T1)
Q0
P1V1 P2V2 1
p2
o V1
(p2,V2,T2) 2
化工热力学第七章7

2.正规溶液的特征:
SE=0, VE=0, HE≠0,
RT ln i 常数
GE=HE=UE
化工热力学
第七章
溶液热力学基础
第七节
3.以正规溶液为基础的活度系数模型 (1)范拉尔(van Laar)方程
x1 x2V1V2 a11 a22 a12 2 2 2 G V x1V1 x2V2 1 V2 V1V2
ij jj Vi ij是Wilson模型参数, ij exp Vj RT Vi , V j 是系统温度下纯液体的 摩尔体积,
(ij jj )是能量参数。 计算等温条件下的活度 系数时,直接用 ij作为模型参数, 不需要液体摩尔体积数 据。
化工热力学
第七章
溶液热力学基础
第七节
(4)局部组成型方程 用Xij 表示局部摩尔分数,表示i分子紧邻在中心分子j周围 的几率。为联系局部组成Xij与体相组成xi之间的关系,引入权 重因子(称Boltzmann因子)exp[-(gij-gjj)/RT]。
X 21 x2 g 21 g11 则: exp X 11 x1 RT X 12 x1 g12 g 22 exp X 22 x2 RT g ij是分子i与分子j之间的相互作用能 .
R i k
化工热力学
第七章
溶液热力学基础
第七节
NRTL和UNIQUAC方程要比wilson方程更新一些。 它们和wilson方程一样,能用二组分参数去直接推算多组分 气液平衡,而且都能用于不互溶的浓度区间,故可用来关 联计算液液平衡。UNIQUAC方程中的二组分参数和温度关 系至少在不太大的温度范围内可以适用,该方程对分子大 小相差悬殊的系统有较好的效果。
SE=0, VE=0, HE≠0,
RT ln i 常数
GE=HE=UE
化工热力学
第七章
溶液热力学基础
第七节
3.以正规溶液为基础的活度系数模型 (1)范拉尔(van Laar)方程
x1 x2V1V2 a11 a22 a12 2 2 2 G V x1V1 x2V2 1 V2 V1V2
ij jj Vi ij是Wilson模型参数, ij exp Vj RT Vi , V j 是系统温度下纯液体的 摩尔体积,
(ij jj )是能量参数。 计算等温条件下的活度 系数时,直接用 ij作为模型参数, 不需要液体摩尔体积数 据。
化工热力学
第七章
溶液热力学基础
第七节
(4)局部组成型方程 用Xij 表示局部摩尔分数,表示i分子紧邻在中心分子j周围 的几率。为联系局部组成Xij与体相组成xi之间的关系,引入权 重因子(称Boltzmann因子)exp[-(gij-gjj)/RT]。
X 21 x2 g 21 g11 则: exp X 11 x1 RT X 12 x1 g12 g 22 exp X 22 x2 RT g ij是分子i与分子j之间的相互作用能 .
R i k
化工热力学
第七章
溶液热力学基础
第七节
NRTL和UNIQUAC方程要比wilson方程更新一些。 它们和wilson方程一样,能用二组分参数去直接推算多组分 气液平衡,而且都能用于不互溶的浓度区间,故可用来关 联计算液液平衡。UNIQUAC方程中的二组分参数和温度关 系至少在不太大的温度范围内可以适用,该方程对分子大 小相差悬殊的系统有较好的效果。
(大学物理)第七章热力学基础2-3

Vc 3V0
Ⅰ III
PT 0V 00 9P0 T3cV0 Tc 2T 70
a(P0V0T0)
V
Q IC vT b-T a23R9T0-T012R0T
PV m RT M
Q Q IIII IC A PT cΔ-T Eb V aP52R dV 2C T 70v-T9aT-0Tc4R 5 0T
PV T
mR M
期末通知
一、考试时间: 6月29日 (周四)下午 1:30~3:30
二、答疑时间: 6月28日 (周三)下午 1:30 ~ 4:30 晚上 6:30 ~ 9:00 6月29日 (周四)上午 8:30~10:00
地点 实验二楼105室
三、一页开卷的说明: (1)只能用本纸 (2)只能手写,不能打印和复印。
M
V1
(P1V1P2V2)
RT ln P1 P2
p
p1 .I
过程方程:PV=RT=常量 P-V图一条双曲线,称为等温线
p 2
.II
o V1
V2 V
4、绝热过程(adiabatic process) 特点:dQ=0
绝热套
A E0
A-E-M mCVT2-T1
PdV-M mCVdT
PdVVdPmRdT
V2 V
第二节 热力学第一定律对理想气体的应用
绝热线和等温线:
绝热过程曲线的斜率
p
T 常量
Q0
p A papT A C
B
pV 常量
pV - 1dVVdp0
(ddVp)a
-
pA VA
等温过程曲线的斜率
o V A V V B V
绝热线的斜率大于等温 线的斜率.
pV常量
化工热力学第七章4

i
Gi E Gi E Gi Giid Gi RT ln xi
G E 是非常有用的热力学量,它将会和组分的活度系数相
联系。在相平衡中常用到。
化工热力学
第七章
溶液热力学基础
第四节
例 7-10 在定温和定压下,二元系的焓值可用
H 200x1 300x2 H E E 表示,式中的 H x1 x2 20x1 10x2 , 和 H 的因次为 H
H 1意味着用 x1 0 代入(B)式,得 H1 210J mol1
H2 300J mol1
H
意味着用 2
x1 1 代入(C)式,得 H2 320J mol1
(D)
dH E H1E H E x2 dx1
化工热力学
第七章
溶液热力学基础
第四节
(E)
E
J mol1。
试求(1) 1 和 H 2 的表达式; H (2)纯物质的焓 H1和 H 2 ; H 1 和 H 2 (3)在无限稀释条件下的偏摩尔焓
E (4)H 1E 和 H 2的表达式。
(5) (6)
H H
E 1
E 2
H的表达式
化工热力学 [解]
第七章
溶液热力学基础
i
SiE SiE Si Siid Si R ln xi
AE AE A Aid A RT xi ln xi
i
化工热力学
E E
第七章
溶液热力学基础
id i
第四节
Ai Ai Ai A Ai RT ln xi
G E G E G Gid G RT xi ln xi
dH E H 2E H E x1 dx1
Gi E Gi E Gi Giid Gi RT ln xi
G E 是非常有用的热力学量,它将会和组分的活度系数相
联系。在相平衡中常用到。
化工热力学
第七章
溶液热力学基础
第四节
例 7-10 在定温和定压下,二元系的焓值可用
H 200x1 300x2 H E E 表示,式中的 H x1 x2 20x1 10x2 , 和 H 的因次为 H
H 1意味着用 x1 0 代入(B)式,得 H1 210J mol1
H2 300J mol1
H
意味着用 2
x1 1 代入(C)式,得 H2 320J mol1
(D)
dH E H1E H E x2 dx1
化工热力学
第七章
溶液热力学基础
第四节
(E)
E
J mol1。
试求(1) 1 和 H 2 的表达式; H (2)纯物质的焓 H1和 H 2 ; H 1 和 H 2 (3)在无限稀释条件下的偏摩尔焓
E (4)H 1E 和 H 2的表达式。
(5) (6)
H H
E 1
E 2
H的表达式
化工热力学 [解]
第七章
溶液热力学基础
i
SiE SiE Si Siid Si R ln xi
AE AE A Aid A RT xi ln xi
i
化工热力学
E E
第七章
溶液热力学基础
id i
第四节
Ai Ai Ai A Ai RT ln xi
G E G E G Gid G RT xi ln xi
dH E H 2E H E x1 dx1
