特殊氧化物的定义高中
衔接点01 酸性氧化物和碱性氧化物-2022年高一化学预科班《衔接教材》

衔接点 01 酸性氧化物和碱性氧化物
一、酸性氧化物 1.定义: 能与水作用生成相应价态的酸,或与碱作用只生成一种相应价态盐和水的氧化物。 2.概述: 非金属氧化物多数是酸性氧化物,某些过渡元素的高价氧化物(如 CrO3、Mn2O7 等)也是酸性氧化物。
酸性氧化物属于酸酐,例如 SO2 叫亚硫酐,SO3 叫硫酐,CO2 叫碳酐,醋酸酐是酸酐但不是酸性氧化物。 注意: ①硝酸的酸酐是 N2O5,磷酸的酸酐是 P2O5. ②非金属氧化物不一定是酸性氧化物;如:NO、CO(不成盐氧化物),NO2、N2O4、H2O 。 酸性氧化物对应的水化物是含氧酸,如 SO3 对应的水化物是 H2SO4,CO2 对应的水化物是 H2CO3,SiO2
C.有机物
D.单质
3.物质的分类法是化学研究的重要方法之一。化学工作者经常根据物质的组成对物质进行分类研究。近年
来发现在金星大气层中存在三氧化二碳。下列物质与它属于同类的是
()
A.H2、O3
B.H2SO4、H2CO3 C.SO2、NO
D.Na2SO3、KClO3
4.小美在奥运五连环中填入了 5 种物质(如图所示),相连环的物质间所发生的反应中,没有涉及的基本反
敏捷性训练
1.【答案】B 【解析】HNO3 应属于酸、含氧酸、一元酸、化合物,所以 B 选项正确 2.【答案】B 【解析】①中此盐既属于钠盐又属于硫酸盐。则可排除 A、C 两选项,④中此盐既属于铵盐又属于盐酸盐, 则 B 项中的 NH4Cl 正确,排除了 D 项。 3.【答案】B 【解析】非金属氧化物不都是酸性氧化物,如水、一氧化碳、一氧化氮等氧化物就属于不成盐氧化物,所 以 A 不正确。SiO2 是酸性氧化物但不与水反应;所以 C 不正确。酸性氧化物一般不能和酸反应,但二氧化 硅能与氢氟酸反应,生成四氟化硅气体和水:SiO2+4HF=SiF4↑+2H2O。D 选项也不正确。只有碱性氧化物都 是金属氧化物的说法是正确的。 4.【答案】C 【解析】根据初中化学中对化学反应的分类方法,物质得到氧的反应称为氧化反应;由两种或两种以上的 物质生成一种物质的反应叫化合反应。在题目所给出的四个反应中,既属于化合反应又属于氧化反应的应 当是 C。 5.【答案】D 【解析】四个选项中属于无机物的是碳酸钠和氢氧化铜;其中碳酸钠是盐,氢氧化铜是碱。
高一化学必背知识点必修一

高一化学必背知识点必修一本店铺为大家整理的,整理化学繁琐知识点是重要的学习任务之一,高中时期化学是非常重要的一门课程。
1.高一化学必背知识点必修一篇一钠及其化合物的性质:1.钠在空气中缓慢氧化:4Na+O2==2Na2O2.钠在空气中燃烧:2Na+O2点燃====Na2O23.钠与水反应:2Na+2H2O=2NaOH+H2↑现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。
4.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑5.过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O26.碳酸氢钠受热分解:2NaHCO3△==Na2CO3+H2O+CO2↑7.氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O8.在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaHCO32.高一化学必背知识点必修一篇二1、化学变化:生成了其它物质的变化2、物理变化:没有生成其它物质的变化3、物理性质:不需要发生化学变化就表现出来的性质(如:颜色、状态、密度、气味、熔点、沸点、硬度、水溶性等)4、化学性质:物质在化学变化中表现出来的性质(如:可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等)5、纯净物:由一种物质组成6、混合物:由两种或两种以上纯净物组成,各物质都保持原来的性质7、元素:具有相同核电荷数(即质子数)的一类原子的总称8、原子:是在化学变化中的小粒子,在化学变化中不可再分9、分子:是保持物质化学性质的小粒子,在化学变化中可以再分10、单质:由同种元素组成的纯净物11、化合物:由不同种元素组成的纯净物12、氧化物:由两种元素组成的化合物中,其中有一种元素是氧元素13、化学式:用元素符号来表示物质组成的式子14、相对原子质量:以一种碳原子的质量的1/12作为标准,其它原子的质量跟它比较所得的值某原子的相对原子质量=相对原子质量≈质子数+中子数(因为原子的质量主要集中在原子核)15、相对分子质量:化学式中各原子的相对原子质量的总和16、离子:带有电荷的原子或原子团注:在离子里,核电荷数=质子数≠核外电子数17、四种化学反应基本类型:①化合反应:由两种或两种以上物质生成一种物质的反应如:A+B=AB②分解反应:由一种物质生成两种或两种以上其它物质的反应如:AB=A+B③置换反应:由一种单质和一种化合物起反应,生成另一种单质和另一种化合物的反应如:A+BC=AC+B④复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应如:AB+CD=AD+CB3.高一化学必背知识点必修一篇三1.区分元素、同位素、原子、分子、离子、原子团、取代基的概念。
高中氧化物分类

高中氧化物分类一、氧化物的概念和特点氧化物是由氧元素和其他元素形成的化合物,其中氧元素以氧离子形式存在。
氧化物在化学中具有重要的地位,广泛存在于自然界和人工合成物中。
氧化物的化学性质多样,可以是酸性、碱性或中性的。
二、金属氧化物金属氧化物是由金属元素和氧元素形成的化合物。
金属氧化物具有一定的导电性和热导性,常见的金属氧化物有氧化铁(Fe2O3)、氧化铜(CuO)、氧化锌(ZnO)等。
金属氧化物通常呈现出金属的典型性质,如导电、延展性、可塑性等。
三、非金属氧化物非金属氧化物是由非金属元素和氧元素形成的化合物。
非金属氧化物多为电负性较高的元素氧化而成,具有酸性或中性。
常见的非金属氧化物有二氧化碳(CO2)、三氧化硫(SO3)、二氧化硫(SO2)等。
非金属氧化物的特点是通常呈现出非金属的性质,如脆性、不导电等。
四、碱性氧化物碱性氧化物是指能与水反应生成碱的氧化物,通常呈碱性溶液。
常见的碱性氧化物有氧化钠(Na2O)、氧化钾(K2O)等。
碱性氧化物与水反应生成碱,具有碱性溶液的性质,能与酸反应产生盐和水。
五、酸性氧化物酸性氧化物是指能与水反应生成酸的氧化物,通常呈酸性溶液。
常见的酸性氧化物有二氧化硫(SO2)、二氧化硫(SO3)等。
酸性氧化物与水反应产生酸,具有酸性溶液的性质,能与碱反应产生盐和水。
六、中性氧化物中性氧化物是指不与水反应形成酸或碱的氧化物,通常呈中性溶液。
常见的中性氧化物有二氧化氮(NO2)、二氧化硅(SiO2)等。
中性氧化物不具有酸性或碱性溶液的性质,与水反应不产生酸碱中和反应。
七、氧化物的应用氧化物在生活和工业中有广泛的应用。
金属氧化物常用于陶瓷、涂料、颜料等领域;非金属氧化物常用于制造肥料、制酸等化学反应中;碱性氧化物常用于制造碱、玻璃等;酸性氧化物常用于制造酸、电池等;中性氧化物常用于制造光学玻璃、硅胶等。
八、氧化物的环境影响一些氧化物对环境具有一定的影响。
例如,二氧化碳是温室气体,过多的排放会导致全球气候变暖;二氧化硫和二氧化氮是大气污染物,会对空气质量和人体健康造成危害。
谈谈高中化学中的氧化物

谈谈高中化学中的氧化物氧化物含义:氧化物是指氧与另一种元素形成的化合物。
二、氧化物的分类:1、氧化物依组成元素,可以分成两类,金属氧化物和非金属氧化物。
2、氧化物依性质可分为四类:(1)酸性氧化物(又称为酸酐)(如二氧化硫、三氧化硫、二氧化碳、二氧化硅、七氧化二锰、三氧化铬、五氧化二氮、三氧化二氮、五氧化二磷等)。
(2)碱性氧化物(氧化钠、氧化镁、氧化钙、氧化铁、氧化铜等)。
(3)两性氧化物(氧化铝即三氧化二铝)。
(4)其他:不成盐氧化物(一氧化碳、一氧化氮、二氧化氮)。
磁性氧化物(四氧化三铁)。
3、氧化物依氧元素的化合价又可分为普通氧化物和特殊氧化物(过氧化物、超氧化物、臭氧化物等)。
三、酸性氧化物:1、定义:指能与碱反应生成盐(只一种盐)和水的氧化物;2、判断方法:依定义来判断。
记住常见的与特殊的。
与含氧酸中中心原子化合价相同的氧化物。
3、酸性氧化物不一定是非金属氧化物(七氧化二锰),非金属氧化物也不一定是酸性氧化物(CO)。
4、酸性氧化物又叫酸酐。
酸分解就来酐了,酐加水就酸了,这是从组成上看,酸不一定能分解,酐也不一定能与水反应。
如硅酸能分解成二氧化硅,但二氧化硅不能与水反应。
另有机酸的酸酐是羧酸分子间脱水形成的物质不是氧化物,所以酸酐不一定是氧化物。
5、酸性氧化物的性质(4条):(1)都能与碱反应生成对应的盐和水。
(2)有的能与水反应生成对应的酸。
(3)有的能与碱性氧化物反应生成盐。
(4)有的能与某些盐反应生成盐和新的酸性氧化物。
四、碱性氧化物1、定义:指能与酸反应生成盐和水的氧化物。
2、判断方法:依定义判断。
记住常见的。
与碱中金属元素化合价相同的氧化物。
3、碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物。
(如氧化铝、七氧化二锰、三氧化铬)。
4、碱性氧化物的性质(3条):(1)都能与酸反应生成对应的盐和水。
(2)有的能与水反应生成对应的碱。
(3)有的能与酸性氧化物反应生成盐。
2023年高中化学学业水平考试知识点总结
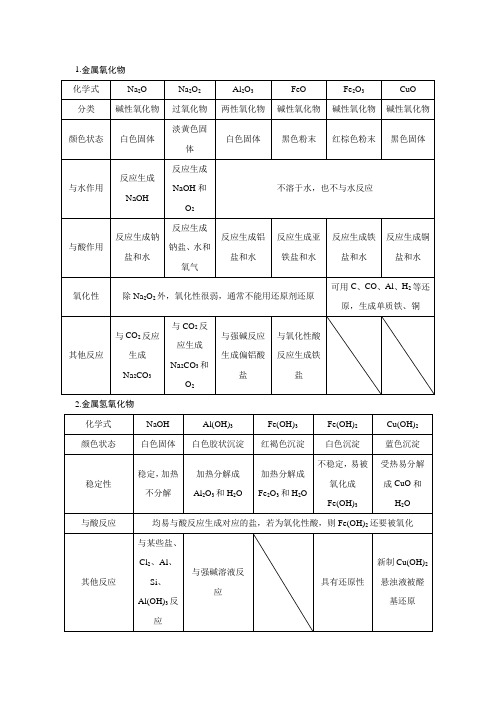
1.金属氧化物2.金属氢氧化物二、金属元素分点突破物质一 “活泼”金属代表——钠 1.思维线索2.三维考查3.认知拓展(1)钾及其重要化合物钾的活泼性超过钠,钾与O 2反应除生成K 2O 2外,还生成KO 2(超氧化钾)。
KO 2的阴离子为O -2,有极强的氧化性,与H 2O 、CO 2的反应分别为4KO 2+2H 2O===4KOH +3O 2↑、4KO 2+2CO 2===2K 2CO 3+3O 2。
(2)钙及其重要化合物Ca与水反应生成H 2:Ca +2H 2O===Ca(OH)2+H 2↑。
在空气中燃烧:Ca +O 2=====点燃CaO 2、3Ca +N 2=====点燃Ca 3N 2。
CaO 2溶于酸生成H 2O 2:CaO 2+2H +===Ca 2++H 2O 2。
与水反应:2CaO 2+2H 2O===2Ca(OH)2+O 2↑。
在碱性条件下,CaCl 2与H 2O 2反应可制得CaO 2。
草酸钙(CaC 2O 4)CaC 2O 4难溶于水。
溶于盐酸:CaC2O4+2H+===Ca2++H2C2O4物质二“两性”金属的代表——铝1.经典转化“价—类”二维图转化反应①2Al+6HCl===2AlCl3+3H2↑②2Al+2NaOH+2H2O===2NaAlO2+3H2↑③AlCl3+4NaOH===NaAlO2+3NaCl+2H2O④NaAlO2+4HCl===NaCl+AlCl3+2H2O⑤NaAlO2+2H2O+CO2===Al(OH)3↓+NaHCO3⑥AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl2.认知拓展(1)锌及其化合物物质性质与盐酸反应:Zn+2H+===Zn2++H2↑;Zn与NaOH溶液反应:Zn+2OH-===ZnO2-2+H2↑。
ZnO ZnO+2H+===Zn2++H2O;ZnO+2OH-===ZnO2-2+H2O。
Zn(OH)2Zn(OH)2+2H+===Zn2++2H2O;Zn(OH)2+2OH-===ZnO2-2+2H2O。
2020高中化学必备知识点 在化学中,物质是如何分类的?

2020高中化学必备知识点:在化学中,物质是如何分类的?按不同的角度,物质的分类有多种。
如氧化物若按组成元素可分为金属氧化物和非金属氧化物。
化合物若按原子成键特点可分为禽子化合物和共价化合物;若按熔融状态或水溶液中能否导电可分为电解质和非电解质。
1、混合物( 1 )定义:由几种不同的单质或化合物组成的物质。
(2 )特点:无固定组成的物质;无固定的熔、沸点。
(3)范围①高分子(如蛋白质、淀粉、纤维素、聚合物)②分散系(如溶液、胶体、浊液等)③同分异构体(如邻、间、对三种二甲苯)④同素异形体(如白磷和红磷、氧气和臭氧)⑤其他(如混凝土、泥沙)( 4 )常见特殊名称的混合物①固态混合物:合金、漂白粉、铅热剂、黑火药、水泥、玻璃、陶瓷等。
②液态混合物;氨水、氯水、盐酸、浓硫酸、浓硝酸、福尔马林、水玻璃、石油、石油的各种馏…分等。
③气态混合物:辛气、永煤气、夭然气、焦炉气、高炉煤气、石油气、裂解气等。
2 .纯净物( 1 )定义:由一种单质或化合物组成的物质。
( 2 )特点:有固定的组成和性质;有固定的熔、沸点。
( 3 )绝对纯净的物质是没有的,纯净是相对的。
3 .金属( 1 )定义:由金属元素组成的单质叫金属。
( 2 )金属的通性①金属具有金属光泽,一般具有延展性,是电、热的良导体。
金属这些性质跟金属晶体里的自由电子有关。
②金属在通常状况下,除汞是液体外,其余都是固体。
银的导电和导热性最好;铂的延展性最突出;饿的密度最大;钨的熔点最高(3683K )( 3 )结构特点:金属原子价电子比较少且原子半径相对较大,在化学反应中容易失电子,因此金属一般具有较强的还原性。
4 .非金属(1 )定义:由非金属元素组成的单质叫非金属。
(2 )非金属的物理性质月卜金属和金属相反,一般没有金属光泽,不是电和热的良导体,没有延展性。
通常状况下,非金属有的是固体,有的是气体,只有澳是液体。
非金属固体大多数属于分子晶体,熔沸点较低,但有的非金属固体如金刚石属于原子晶体,熔沸点很高。
高中化学必修一第一二章知识点梳理

第一章物质及其变化第一节物质的分类及转化一、物质的分类1.同素异形体:由一种元素形成的几种性质不同的单质。
如:金刚石和石墨、白磷(P4)和红磷、氧气和臭氧。
2.分类方法(1)树状分类:对同类事物进行再分类的方法。
单质:O2、Fe、He等纯净物有机化合物:CH4、葡萄糖、酒精(乙醇)等。
化合物酸:电离出的阳离子全部是氢离子。
无机化合物碱:电离出的阴离子全部是氢氧根。
物质盐:由金属阳离子或NH4+与酸根离子结合。
氧化物:只含两种元素,其中一种是氧元素。
溶液:NaCl溶液、稀硫酸等。
混合物胶体:Fe(OH)3胶体、淀粉胶体等。
浊液:泥水。
①酸的分类:一元酸:HCl、HNO3、CH3COOH等。
含氧酸:HNO3、H2SO4等。
酸二元酸:H2CO3、H2SO4等。
酸多元酸:H3PO4等。
无氧酸:HCl、H2S等。
强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI等。
酸弱酸:H2CO3、CH3COOH、HClO、HF、H2SO3等。
②碱的分类:一元碱:NaOH、NH3·H2O 等。
可溶性碱:四大强碱和NH3·H2O 碱二元碱:Mg(OH)2、Cu(OH)2 等。
碱多元碱:Fe(OH)3、Al(OH)3 等。
难溶性碱:Mg(OH)2、Cu(OH)2 等。
强碱:KOH、NaOH、Ca(OH)2、Ba(OH)2;碱弱碱:NH3·H2O、Cu(OH)2、Mg(OH)2等。
③盐的分类正盐:既不能电离出H+,也不能电离出OH-的盐,如Na2CO3、CuSO4 等。
盐酸式盐:酸根能电离出H+的盐,如NaHCO3、NaHSO4 等。
碱式盐:能电离出OH-的盐,如Cu2(OH)2CO3等。
④氧化物的分类:依据氧化物的性质,可将氧化物分为酸性氧化物、碱性氧化物、两性氧化物及不成盐氧化物。
酸性氧化物:与碱反应只生成盐和水的氧化物。
如CO2、SO2、SiO2等。
碱性氧化物:与碱反应只生成盐和水的氧化物。
2024年初升高化学无忧衔接(通用版)衔接点01物质的分类(解析版)

衔接点01 物质的分类初中要求只是了解物质的简单分类方法高中要求1. 了解分类的方法一树状分类法和交叉分类法;2. 理解氧化物的分类及其各类氧化物的性质、制法;3. 了解正盐、酸式盐、碱式盐的概念和形成原因.• 初高考点对接七初中化学盲点区 高中化学纯净物[-谜-混合物-一溶液_浊液无机物-厂金属单质一单质~\L ■非金属单质1-纯净物-「酸-化欲-碱-盐碱的分类_______■氧化物的分凳L —元酸ng 出一二元酸I 多元酸----、按电菠出电离出 __息。
基氧根高球目 一 一兀例L 多元碱「皿: 按酸碱中和费——稣盐「酸性氧化物A 按氧化物性质——碱性氧化物j 两性氧化物-酸的分类wA 盐的分类 W•••♦,初中知识温故tA-回顾一物质的简单分类1.物质的简单分类表「混合物'金属单质单质,非金属单质、稀有气体物质<纯净物<化合物,厂酸碱无机化合物〈盐氧化物I有机化合物回顾二几组重要概念1.混合物和纯净物混合物纯净物宏观由不同种物质组成由一种物质组成微观由不同种分子构成由同种分子构成性质没有固定的组成,各组分保持各自的化学性质。
没有固定的熔点和沸点具有固定的组成,具有固定的熔点、沸点;具有固定的化学性质例如空气是混合物,由氧气、二氧化碳、氮气等组成,含有N2、。
2、C02、田0等不同种分子水是纯净物,由水(H2。
)分子构成;氧气是纯净物,由氧(。
2)分子构成【易错提醒】(1)不要被“洁净、混合”等字眼迷惑,洁净物不一定是纯净物,例如:洁净的空气、干净的矿泉水就是混合物。
(2)不要被物质的名称迷惑,例如:二氧化碳是物质的名称,“氧”“碳”指组成物质的元素,不是两种物质,二氧化碳是纯净物,不是混合物。
2.单质、化合物和氧化物类别单质化合物氧化物概念由回种元素组成的纯净物由不同种元素组成的纯净物由两种元素组成,且其中一种元素是氧元素的化合物判断方法必须是纯净物;只含一种元素必须是纯净物;含两种或两种以上元素必须是化合物举例氮气(N2)、氢气(田)、氧气(02)、铁(Fe)和碳水(H2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
特殊氧化物的定义
1. 引言
特殊氧化物是指具有特殊化学性质或结构的氧化物。
在化学中,氧化物是由氧元素与其他元素结合形成的化合物。
一般情况下,氧的氧化态为-2,因此氧通常与其他元素形成离子键或共价键。
然而,特殊氧化物具有与常规氧化物不同的性质和结构,因此对于这些特殊氧化物进行研究和了解非常重要。
2. 特殊氧化物的分类
特殊氧化物可以根据其性质和结构进行分类。
以下是几种常见的特殊氧化物分类:
2.1 高温超导体
高温超导体是一种能够在相对较高温度下表现出超导性质的材料。
其中一类高温超导体就是由铜、钡和钴组成的复合氧化物,通常被称为“BCSCO”。
这种复合氧化
物在低温下能够表现出非常低的电阻和完全排斥磁场的特性,这使得它们在电力输送和磁共振成像等领域具有广泛的应用前景。
2.2 磁性氧化物
磁性氧化物是具有磁性的特殊氧化物。
其中一种常见的磁性氧化物是铁氧体,它由铁、氧和其他金属离子组成。
铁氧体具有良好的磁导率、饱和磁感应强度和抗腐蚀性能,因此被广泛应用于制造电感器、电动机和磁记录材料等领域。
2.3 光敏氧化物
光敏氧化物是一类对光敏感的特殊氧化物。
其中一种常见的光敏氧化物是二氧化钛(TiO2)。
二氧化钛具有良好的光催化活性,可以在阳光下将空气中的污染物分解为无害的物质。
因此,二氧化钛被广泛应用于环境治理、太阳能电池和自洁材料等领域。
3. 特殊氧化物的制备方法
特殊氧化物的制备方法多种多样,下面介绍几种常见的制备方法:
3.1 气相沉积法
在气相沉积法中,气相的前体物质会在高温下分解或反应,生成特殊氧化物的薄膜。
这种方法通常需要使用特殊的设备和条件来控制反应过程,以确保薄膜的质量和厚度。
3.2 溶液法
溶液法是一种常见的特殊氧化物制备方法。
在溶液中加入适当的前体物质,并通过调节温度、pH值和反应时间等条件来促使特殊氧化物的形成。
这种方法简单易行,适用于大规模制备。
3.3 固相法
固相法是一种将适当比例的前体物质混合并在高温下反应生成特殊氧化物的方法。
这种方法通常需要较高的温度和较长的反应时间,但可以得到高纯度和良好结晶性质的特殊氧化物。
4. 特殊氧化物的应用
由于其独特性质和结构,特殊氧化物在各个领域都有广泛的应用。
以下是几个典型例子:
4.1 高温超导体在能源领域中的应用
由于高温超导体具有低电阻和完全排斥磁场的特性,因此在能源输送方面具有重要应用价值。
高温超导体可以用于制造高效率的电力输送线路和超导磁体,以提高能源利用效率和减少能量损失。
4.2 磁性氧化物在电子设备中的应用
磁性氧化物如铁氧体被广泛应用于电子设备中。
铁氧体可以制成各种形状和尺寸的磁芯,用于制造电感器、变压器和传感器等元件。
此外,铁氧体还可用于制造磁记录材料,如硬盘驱动器等。
4.3 光敏氧化物在环境治理中的应用
光敏氧化物如二氧化钛具有良好的光催化活性,可将空气中的污染物分解为无害物质。
因此,二氧化钛被广泛应用于环境治理领域,如水处理、空气净化和废气处理等。
5. 结论
特殊氧化物是指具有特殊性质或结构的氧化物。
它们可以根据其性质和结构进行分类,并通过不同的制备方法来获得。
特殊氧化物在能源、电子设备和环境治理等领域有广泛的应用前景。
进一步研究和开发特殊氧化物,将为我们解决各种问题和挑战提供新的途径和解决方案。
参考文献: 1. 张三, 李四. 特殊氧化物研究进展[J]. 化学通报, 20XX, 1(1):
1-10. 2. 王五, 赵六. 特殊氧化物的制备与应用[M]. 化学出版社, 20XX.。
