化学中的配位化学
配位化学
(4)以卤素作为配位原子的配体:F-、Cl-、Br-、I-。
(5)以碳作为配位原子的配体:CO、CN-。 (6)以磷作为配位原子的配体:PH3、PCl3、PBr3、PF3。
配体类型:
(1)单基(齿)配体:一个配体只以一个配位键与中心原
子结合,如:NH3、X-。 (2)多基(齿)配体:一个配体只以两个或两个以上配位键与 中心原子结合(含两个或两个以上配位原子,如:C2O42-、 S2O32-、乙二胺:NH2CH2CH2NH2(en)螯环结合:
3 )2
Ag(NH3)3++2CN- → Ag(CN)2-+2NH3
Co2++SCN-→[Co(NCS)4]2- (异硫氰酸根, 蓝紫)
Fe2++SCN-→Fe(NCS)n3-n (血红)
IIB:
Zn Zn2+ Cd Cd2+ Hg Hg2+
变 形 性 大
稳 定 性 大
a 类:
F- >>Cl- >Br- >I- ; O>>S>Se>Te; N>>P>As>Sb
价键理论:
a.配合物的中心离子 M 同配体 L 之间以配位键结合。其中中心离子提供空轨道,接受配体 提供的孤对电子,形成σ 配键,一般表示为 M←L。 b.形成配合物时,中心离子提供的是杂化后能量相同、有一定方向性的空轨道;并且空的 杂化轨道数目等于中心离子的配位数。
c.配离子的空间构型及配离子的稳定性,主要决定于中心离子的杂化轨道类型。
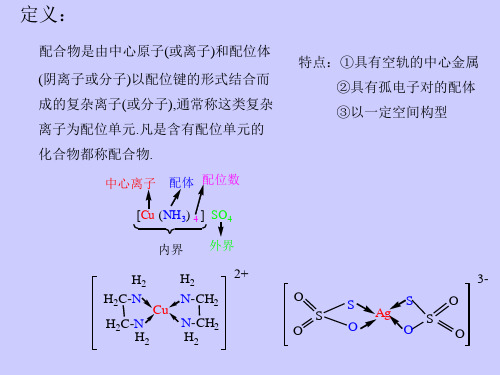
H2 H2C-N H2C-N H2
H2 Cu N-CH2 N-CH2 H2
高中化学的解析配位化学中的配位数及其影响解析

高中化学的解析配位化学中的配位数及其影响解析在高中化学中,配位化学是一个重要的研究领域。
在配位化学中,配位数是指配合物中金属离子周围配体的数目。
配位数的大小直接影响着配合物的性质和用途。
本文将解析配位化学中的配位数及其影响。
一、配位数的定义和表示方法配位数是指配合物中金属离子周围配体的数目。
金属离子通过与多个配体形成坐标键来形成配合物,其中配体与金属离子之间可以通过氧原子、硫原子、氮原子等原子之间的共价键或者坐标键进行配位。
不同的配合物具有不同的配位数。
通常情况下,配位数可以通过希腊字母表示,如:配位数为2的称为二配体,为5的称为五配体。
此外,我们还可以通过配位符号表示,配合物的化学式中可以用[ ]括起来表示配体的名称和个数。
二、配位数的影响因素1. 配体的性质:不同的配体对金属离子的配位能力不同,从而影响配位数。
例如,氨和水是常见的配体,它们对金属离子的配位能力较强,一般能够形成配位数较高的配合物。
2. 金属离子的性质:金属离子的配位数与其电子结构和价态密切相关。
金属离子的电子数和配位数之间存在着一定的关系,一般情况下,金属离子的电子数越多,其配位数也会相应增加。
3. 空间位阻效应:在配位化学中,空间位阻效应是一个重要的影响因素。
当配合物中的配体较大或者存在较长的配体-配体间距离时,形成高配位数的配合物会受到空间位阻效应的限制。
4. 配位环境:配位数还受到配合物所处的配位环境的影响。
例如,金属离子周围存在其他配体或者配体之间的相互作用等,都会影响配位数的大小。
三、配位数的影响1. 配位数与颜色的关系:一般来说,配位数较低的配合物往往呈现浅色或者无色,而配位数较高的配合物则往往呈现较深的颜色。
这是由于不同的配位数导致了配合物电子结构的不同,从而影响了吸收和发射光的频率。
2. 配位数与配合物的稳定性:配位数越高,配合物的稳定性通常越高。
这是因为配位数较高的配合物具有较多的配位键,形成的结构较为紧密,从而提高了配合物的稳定性。
无机化学中的配位化学和络合反应

无机化学中的配位化学和络合反应配位化学和络合反应是无机化学中的重要概念,也是无机化学研究和应用的基础。
本文将从配位化学与络合反应的定义和基本理论出发,结合实际应用,探讨它们的重要性和相关进展。
一、配位化学配位化学是无机化学的一个重要分支,研究的是形成配合物的原理和配位体的性质、结构、反应等基本问题。
在无机化学中,配合物是指以中心原子(通常是金属离子)为核心,围绕着它的配位体构成的一种复合物。
配位体是指与中心原子通过配位键相连的原子、离子、分子或键合基团。
1. 配位键配位键,也叫配位作用,是指配位体与中心原子的相互作用。
配位键形成的能力在化学上通常用配合物的稳定性来衡量。
形成配位键的主要力有电等效作用(即配体中的每个原子都具有局部电荷),配位作用(共用原子轨道),范德华力等。
2. 配位数配位数指一个中心原子周围形成配合物的配位体个数。
一般来说,金属离子的配位数通常是6、4或5。
其中,6配位体分别位于八面体的八个顶点,4配位体分别位于四面体的四个顶点,5配位体分别位于三棱锥的五个棱角位置。
3. 配合物的结构配合物的结构决定了它们的性质和功能。
常见的配合物结构有正方体、八面体、四面体和三棱锥等。
其中,正方体和八面体是最常见的配合物结构类型,分别对应着6和8配位的情况。
4. 配合物的性质配合物有许多独特的性质,如:(1)配合物的共价键通常是极性的。
(2)配合物可以通过对称性分析进行分类,如在八面体结构中,依据对称中心的多少可以分为两类:正八面体和扭曲八面体。
(3)配合物的色彩多种多样,如黄色、绿色、蓝色、紫色等,其中色彩变化与金属离子的氧化态、配位体、配位数和配位环境等有关。
二、络合反应络合反应是指配位体与中心离子或原子通过配位键相互作用,形成配合物的反应。
络合反应通常可分为配位反应和溶解度反应两类。
1. 配位反应配位反应是通过配位体形成配位键和配合物的化学反应。
配位反应中的反应物有两类,分别是金属离子和配位体。
配位化学的基本概念与配位化合物的性质

配位化学的基本概念与配位化合物的性质配位化学是研究过渡金属离子或中心离子与周围配体(配位体)之间配位键形成、结构及性质的科学。
配位化合物是由一个或多个配体与一个中心离子配位形成的化合物,具有独特的结构和性质。
本文将介绍配位化学的基本概念以及配位化合物的性质。
一、配位化学的基本概念配位化学的基本概念主要围绕着配位键形成、配体和中心离子的性质以及配合物的结构与性质展开。
1. 配位键形成配位键是配体中的一对电子与中心金属离子之间的共用键。
配位键的形成需要配体提供一个或多个孤对电子与中心离子形成配位键。
配位键的形成对配位化合物的性质起着关键作用。
2. 配体的性质配体是指能够提供一个或多个电子对与中心离子形成配位键的分子或离子。
配体的性质主要影响配位键的强弱和配位化合物的稳定性。
常见的配体有氨、水、氯等。
3. 中心离子的性质中心离子是指配位化合物中与配体形成配位键的金属离子或金属原子。
中心离子的性质包括电荷数、价态和配位数等。
中心离子的性质决定了配位化合物的结构和性质。
4. 配位化合物的结构与性质配位化合物的结构与性质主要受到配体种类、中心离子性质以及配位数等因素的影响。
配位化合物可以形成各种不同的结构,如线性、方向、平面、四面体等。
这些结构决定了配位化合物的性质,如颜色、磁性、溶解性等。
二、配位化合物的性质配位化合物具有许多独特的性质,以下将介绍其中的几个重要性质。
1. 颜色许多配位化合物显示出明亮的颜色,如蓝色、红色、黄色等。
这是由于配位键形成后,中心金属离子的d轨道发生分裂,产生能量差,吸收特定波长的光而呈现有色。
2. 磁性配位化合物可以表现出不同的磁性,包括顺磁性和反磁性。
顺磁性是指配位化合物中所含的未成对电子会受到外磁场的吸引,而提高磁性。
反磁性则相反,未成对电子会被排斥。
3. 溶解性配位化合物的溶解性与配体和中心离子的性质密切相关。
一般来说,具有极性配体的配位化合物在极性溶剂中溶解度较高,而中心离子大多数情况下并不直接影响溶解性。
无机化学中的配位化学理论

无机化学中的配位化学理论是研究配合物形成、结构和性质的学科。
配合物是指由两个或多个离子或分子间的配位键结合而成的复合物,其中一个离子或分子起着配位中心的作用,其他则作为配体。
配位键一般由金属离子或原子与一个或多个配体的配位作用形成。
配位化学理论是无机化学领域一个重要的分支,它能够解释许多无机化学现象和化学反应。
一、配位化学的历史配位化学是早期化学家研究无机化合物所产生的。
18世纪末,Bergman首次提出了“配位”的概念,认为金属离子可以和一些特定的分子或离子发生化学反应,在这种反应中所产生的化合物称为配合物。
19世纪中叶,水合物和铜酰胺的合成让配合物变得更加重要。
20世纪初,单位配合数的概念被提出,并在1930年代得到广泛应用。
1952年,Jørgensen首次提出了“配位键”的概念,为配位化学理论的快速发展奠定了基础。
此后,人们逐渐深入研究了配合物的结构和性质,配位化学理论也得到了更为深刻的认识。
二、配位键的形成配位化学的核心是配位键的形成。
配位键可以分为共价性和离子性两种。
共价式键通常存在于过渡金属配合物中,它由金属离子的未满足配位电子对与配体的配位电子对相互重叠形成。
而离子式键则通常存在于铜、银和金等含d10电子的金属配合物中,它由金属离子的正电荷和配体的负电荷静电作用形成。
此外,还有一种类似氢键的键,即氢键型配位键,它主要存在于氢氧根、氨、水和羟基等配体中。
三、配位环境的影响配合物的结构和性质取决于配位环境,即最内层的配体、次内层的离子和周围溶剂的影响。
其中,配体的种类、数量和配位位置是影响配合物结构的关键因素。
次内层的离子通过配位作用能够改变配合物的电荷和几何构型。
而溶剂分子也能与金属离子配位形成溶剂合金属离子,并影响配合物的物理化学性质。
此外,温度、压力、电场等外部因素也会影响配合物的性质。
四、配合物的分类配合物可以根据金属离子的性质、配体的性质和功能进行分类。
根据金属离子的性质,配合物可以分为过渡金属配合物、主族金属配合物和内过渡金属配合物。
化学反应中配位化学的基本原理研究

化学反应中配位化学的基本原理研究随着时间的推移,人们对于化学反应的认识也越来越深入,其中配位化学的基本原理的研究尤为重要。
配位化学,也称配位配合物化学,是指通过化学反应将配体与中心离子或原子组成配合物的过程。
配位化学是化学反应中重要的一个方面,也是化学分析和有机合成中不可或缺的一项技术。
配位化学的基本原理是分子的亲和力及其与离子和原子的相互作用。
通常,化学反应中的中心离子或原子被称为配位体,而与之配合的分子则被称为配体。
在化学反应中,配体通常能够与配位体中的价电子形成配位键。
配位键的形成使得原子或离子变得更加稳定,同时也带来了化学反应发生的新的方向和可能性。
在配位化学中,常见的一种配位体是金属离子。
金属离子存在于许多化学反应中,它们通过与其他分子或离子进行配位来形成配合物。
这些配合物具有各种不同的性质,可以具有重要的铁系药物、光电技术以及催化剂等应用。
另一个重要的配位体是配体中的原子或分子,例如葡萄糖酸和胺基酸。
这些原子和分子介导了许多生物化学反应,例如酶的催化和DNA的复制。
通过研究这些生物化学反应中配体的配位化学原理和机制,我们可以更好地了解生物分子如何工作,并开发新的药物和治疗方法。
在化学反应中,配位化学原理的研究也能够帮助我们预测和控制化学反应的结果。
例如,在工业催化剂的设计中,我们希望找到一种具有特定性质的催化剂来加速化学反应。
通过了解配位化学的基本原理,我们可以设计出具有不同结构和性质的催化剂,实现更加高效和环保的工业化学反应。
总之,配位化学的基本原理是化学反应中不可或缺的一部分,可以帮助我们预测和控制化学反应的结果,同时也为开发新的药物、治疗方法以及工业催化剂提供了基础研究。
因此,对于配位化学的深入研究具有重要的意义。
化学反应的配位化学的计算

化学反应的配位化学的计算配位化学是研究配合物形成、反应机理和性质的学科,主要涉及配合物的形成和配位键的形成与破裂等。
在化学反应中,配位化学的计算是非常重要的,可以用来预测反应的可能性、探索机理以及优化实验条件。
本文将介绍几种常见的配位化学计算方法。
一、配位化学的基础概念1. 配位化学基础知识配位化学是指中心金属离子通过配位键与一个或多个配体形成配合物的过程。
在配合物中,中心金属离子和配体之间通过配位键连接。
配位键形成与破裂过程中可以伴随电子转移,导致配合物的性质和结构发生变化。
2. 配位数与配位键数配位数指的是中心金属离子周围配体的个数。
而配位键数则是指配位键的数量。
通过计算配位键数,可以确定配位数,同时也可以判断配体与中心金属离子之间的键的类型(配位键、离子键等)。
二、计算配位化学的方法1. 密度泛函理论(DFT)密度泛函理论是研究材料和分子的基本性质的一种方法。
在配位化学中,可以使用DFT方法计算配体分子和金属离子之间的结合能、键长、结构和电荷分布等。
通过计算可以得出配体的相对稳定性以及得到反应的能垒等信息。
2. 分子力学方法分子力学方法是一种计算化学中常用的近似计算方法,适用于大分子的计算。
在配位化学中,可以使用分子力学方法计算配体和金属离子之间的键长、键能以及配位平面的稳定性等。
分子力学方法计算速度快,但对于反应动力学和电子结构等细节缺乏精确描述。
3. 自洽反应场(SCRF)模型自洽反应场模型考虑了溶剂效应对配位化学的影响。
在计算过程中,可以考虑一个或多个溶剂分子与配体和金属离子的相互作用。
通过自洽反应场模型可以预测在溶液中的反应情况,预测络合物的稳定性等。
三、配位化学计算在实际应用中的例子1. 配位键的强度与稳定性通过配位化学的计算方法,可以预测配位键的强度和稳定性。
例如,可以计算不同配体与相同金属离子结合时的配位键能,并比较它们之间的强度差异。
这些计算结果可以帮助选择更合适的配体,提高配合物的稳定性。
化学反应中的配位化学与金属络合物

配位化学是研究含金属离子与配体之间相互作用和反应的科学领域。
在化学反应中,金属离子常常与配体形成金属络合物,从而改变了金属离子的性质和行为。
这种络合反应在很多化学领域中都有广泛应用。
金属络合物通过配位键(金属与配体之间的键)将金属离子与配体紧密结合在一起。
配位键的形成使金属离子获得了更多配体周围的电子密度,从而改变了金属离子的电子结构和化学性质。
同时,金属离子的配位能力也会影响配体的物理和化学性质。
金属络合物在催化反应中具有重要的作用。
金属离子与配体之间的配位反应可以改变金属离子的电子结构,使其在反应过程中发挥催化作用。
例如,铂金属络合物在氢氧化物合成反应中起到了催化剂的作用,加速了氢氧化物的生成。
此外,金属络合物还可用于催化烯烃和炔烃的加成反应,高效催化剂的设计与合成是实现这些反应的关键。
配位化学与金属络合物也在医药领域中得到了广泛应用。
许多金属络合物可以作为药物的活性部分,用于治疗癌症、炎症和细菌感染等疾病。
这些金属络合物可以与生物分子(如DNA、蛋白质)发生相互作用,从而影响其结构和功能。
例如,铂金属络合物是广泛应用于癌症化疗的一类药物,它能与DNA分子发生配位反应,干扰癌细胞DNA的复制和修复过程,从而抑制癌细胞的生长和分裂。
此外,金属络合物在环境保护中也扮演着重要角色。
许多重金属离子(如铅、镉、汞)对环境和人类健康造成严重危害。
通过调控金属离子与配体的络合反应,可以将金属离子固定在水中或土壤中,减少其对环境的污染和危害。
在金属络合物的研究和应用中,还存在一些挑战和亟待解决的问题。
首先,金属络合物的合成和结构鉴定是一个复杂的过程,需要运用到先进的实验技术和分析方法。
其次,金属离子与配体之间的相互作用和反应机理还不完全清楚,需要进一步深入的理论研究。
最后,金属络合物的设计和合成也面临着一定的挑战,需要在平衡金属离子与配体之间的亲和力和选择性上取得平衡。
综上所述,配位化学与金属络合物在化学反应中起着重要的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学中的配位化学
化学中的配位化学是现代化学的重要分支之一,它研究的是含
有配体的化合物的性质和反应机理。
在配位化学中,分子中的中
心原子和其周围的配体之间形成了一种特殊的结构——配合物。
这些配合物具有独特的物理化学性质,如催化反应、生物酶的活性、光学活性等等。
本文将简要介绍配位化学的相关概念和应用。
配体和配位键
配体是指在配合物中与中心原子形成配位键的化学物质。
配体
可以是单个原子或者是一个复杂的分子。
常见的配体包括水、氨、卤素、羰基、氮气和磷酸基等等。
在配合物中,配体以配位键的
形式与中心原子结合,形成一个有机功能团体。
配合物中的配位
键是一种新的化学键,它由配位原子和中心原子之间的电子共享
所形成。
配合物的构成和稳定性
一个配合物通常是由一个中心原子和若干个配体组成的化合物。
在配合物中,配体通过形成配位键与中心原子结合,在配位键的
形成中充当了一个具有强吸电子特性的末端原子。
一个配合物中通常会存在多个配位键,这样就构成了一个三维的配位空间。
由于分子中的配体和中心原子之间的相互作用,配合物具有较高的稳定性和较低的反应活性。
配合物的结构与电子排布
在配合物中,中心原子和配体之间形成的配位键具有不同的构型和电子排布。
大多数情况下,配合物的排布是球形对称的。
但是也存在一些不规则的配合物,如四面体和八面体配合物等等。
配位键的形成导致了分子中的原子的电子状态的改变,大部分配合物具有复杂的电子排布。
特别地,在一些过渡金属化合物中,d 轨道的电子也参与到配位键的形成中,这样就会产生一些更加复杂的配位键结构。
配合物的性质和应用
配合物具有广泛的应用价值,在医药、催化剂、材料科学、化学分析等领域有着重要的应用。
其中,医药领域中的金属配合物被广泛用于肿瘤治疗、抗病毒治疗等。
催化剂领域中的过渡金属配合物可以通过空间位阻和电子效应的调节来提高催化剂的催化
效率和选择性。
材料科学领域中的金属配合物可以被用于纳米材料的制备、电子材料的研究等。
化学分析领域中的金属配合物也被广泛用于水污染、重金属检测等方面。
总结
配位化学是现代化学研究中不可或缺的一个分支,它研究的是含有配体的化合物的性质和反应机理。
配合物是一个由中心原子和若干个配体组成的化合物。
它具有独特的物理化学性质,如催化反应、生物酶的活性、光学活性等等。
配位化学在医药、催化剂、材料科学、化学分析等领域有着广泛的应用。
对于现代化学研究和技术开发都有着至关重要的作用。
