大鼠肺成纤维细胞原代提取及培养实验具体步骤及方法
原代小鼠心肌成纤维细胞提取

原代小鼠心肌成纤维细胞提取方法1.提前配置0.8%胰酶 3mL、0.1%胶原酶II 10mL(均用DMEM配置),放入37℃水浴锅中预热15min;准备1个50mL的离心管,提前加入10mL含10%FBS的完全培养基,冰浴备用;2.取5-10只7天出生内的C57乳鼠,用灭菌或消毒的组织剪剪开胸腔,迅速取出心脏,置于含2%双抗的预冷的DMEM培养基中;3.将心脏组织转移至超净台,用DMEM反复清洗,取出血液、大血管组织,将组织放入1个1.5mL的EP管中,充分剪碎(小于1mm3);4.用巴氏管向组织块中加入1mL预热的胰酶,反复吹打、吸入至含胰酶的离心管中,37℃水浴加热3min,适当振荡;[循环1]5.吸取上清液丢弃,余下的组织块中加入2mL胶原酶,37℃水浴加热5min,期间每分钟振荡1次,吸取上层液体至冰浴的完全培养基中;[循环2]6.向组织块中再次加入2mL新鲜、预热的胶原酶,用巴氏管或移液枪吹打混匀1min后(约20次)后水浴消化4min,随后吸取上层液体至冰浴的完全培养基中;[循环3]7.向组织块中再次加入2mL新鲜、预热的胶原酶,用巴氏管或移液枪吹打混匀2min后(约30次),此时肉眼可见组织块逐渐变小,呈透明粘液状,随后再次水浴消化4min,随后吸取上层液体至冰浴的完全培养基中;[循环4、5]8.向组织块中再次加入1mL新鲜、预热的胶原酶,用巴氏管或移液枪吹打混匀1min后(约20次),此时肉眼可见组织块逐渐消失,消化液变得浑浊,再次水浴消化3min,随后吸取上层液体至冰浴的完全培养基中;[循环6、7];9.将50mL离心管中的液体分装入2个15mL离心管中,1000rpm离心6min,小心吸去上清液,组织/细胞沉淀加入1mL完全培养基吹打混匀后转移至50mL的培养瓶中,加3mL完全培养基(含4%双抗),2h后可见细胞贴壁,12h内换液;2-3d后常规传代(1:2),P1-2用于实验。
大鼠胚胎成纤维细胞的分离培养及生物学特性

大鼠胚胎成纤维细胞的分离培养及生物学特性商爱民;吴靖芳;薛刚;张静;张耕【摘要】目的:探讨影响大鼠胚胎成纤维细胞(REF)分离和培养的一些因素,以建立稳定的REF培养体系.方法:取SD大鼠胚胎分离成纤维细胞,利用体外培养体系,对REF的生长形态、生长曲线进行观察,以探讨不同胚胎日龄以及不同胰酶作用时间对REF分离及培养的影响,并对其进行免疫细胞化学鉴定.结果:13.5d 胎龄鼠胚的REF分离效果优于10.5d、18.5d 胎龄鼠胚;REF在体外为贴壁生长型细胞,第三代细胞增殖旺盛;并表达波形蛋白(vimentin)、层黏连蛋白(laminin,LN)和纤维连接蛋白(fibronectin,FN)蛋白.结论:13.5d 胎龄SD大鼠REF以H-DMEM做培养基,在第3代增殖旺盛,合成多种细胞外基质,最适宜作胚胎干细胞或其它悬浮培养细胞的饲养层.【期刊名称】《神经药理学报》【年(卷),期】2010(027)003【总页数】4页(P17-20)【关键词】大鼠;胚胎;成纤维细胞;层黏连蛋白;纤维连接蛋白【作者】商爱民;吴靖芳;薛刚;张静;张耕【作者单位】河北北方学院教务处,河北,张家口,075000;河北北方学院基础医学院组织学与胚胎学教研室,河北,张家口,075000;河北北方学院附属第一医院耳鼻咽喉-头颈外科,河北,张家口,075000;河北北方学院基础医学院组织学与胚胎学教研室,河北,张家口,075000;河北北方学院基础医学院组织学与胚胎学教研室,河北,张家口,075000【正文语种】中文【中图分类】R329.2;Q256胚胎成纤维细胞饲养层是体外成功培养人胚胎干细胞(embryonic stem cells,ES)细胞的必要条件。
主要分泌某些细胞因子如成纤维细胞生长因子、白血病抑制因子[1],以促进 ES细胞增殖以及抑制分化。
同时又能分泌细胞外基质,如纤维连接蛋白(fibronectin,FN)、层黏连蛋白(laminin,LN)等。
肥大细胞提取步骤
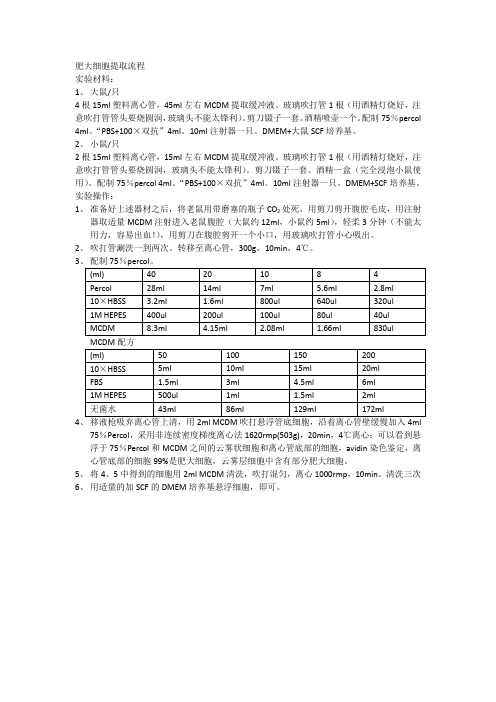
肥大细胞提取流程实验材料:1、大鼠/只4根15ml塑料离心管,45ml左右MCDM提取缓冲液。
玻璃吹打管1根(用酒精灯烧好,注意吹打管管头要烧圆润,玻璃头不能太锋利)。
剪刀镊子一套。
酒精喷壶一个。
配制75%percol 4ml。
“PBS+100×双抗”4ml。
10ml注射器一只。
DMEM+大鼠SCF培养基。
2、小鼠/只2根15ml塑料离心管,15ml左右MCDM提取缓冲液。
玻璃吹打管1根(用酒精灯烧好,注意吹打管管头要烧圆润,玻璃头不能太锋利)。
剪刀镊子一套。
酒精一盒(完全浸泡小鼠使用)。
配制75%percol 4ml。
“PBS+100×双抗”4ml。
10ml注射器一只。
DMEM+SCF培养基。
实验操作:1、准备好上述器材之后,将老鼠用带磨塞的瓶子CO2处死,用剪刀剪开腹腔毛皮,用注射器取适量MCDM注射进入老鼠腹腔(大鼠约12ml,小鼠约5ml),轻柔3分钟(不能太用力,容易出血!),用剪刀在腹腔剪开一个小口,用玻璃吹打管小心吸出。
2、吹打管涮洗一到两次。
转移至离心管,300g,10min,4℃。
34、移液枪吸弃离心管上清,用2ml MCDM吹打悬浮管底细胞,沿着离心管壁缓慢加入4ml75%Percol,采用非连续密度梯度离心法1620rmp(503g),20min,4℃离心;可以看到悬浮于75%Percol和MCDM之间的云雾状细胞和离心管底部的细胞,avidin染色鉴定,离心管底部的细胞99%是肥大细胞,云雾层细胞中含有部分肥大细胞。
5、将4、5中得到的细胞用2ml MCDM清洗,吹打混匀,离心1000rmp,10min。
清洗三次6、用适量的加SCF的DMEM培养基悬浮细胞,即可。
甲状腺成纤维细胞原代培养报告

甲状腺成纤维细胞的分离、培养和鉴定
材料和试剂:来源:SD大鼠
手术器材:手术剪(镊)、解剖镊、眼科剪(镊)、显微镊
清洗液:PBS
培养液:DMEM添加20%FBS200IU双抗
破红液:常规配方
具体操作:1、将300uL的3%戊巴比妥注入SD大鼠体内,待大鼠麻醉至昏厥状态时,将大鼠转入75%的酒精最浸泡5min。
2、在无菌条件下,将大鼠放置于泡沫板上,四肢用针头固定。
3、用左手持直头眼科镊子夹住大鼠腹部最下方的皮毛,右手拿手术剪将大鼠的皮剪开,沿着腹部下方一直剪至大鼠下颚,将下颚的皮毛去掉。
4、剪开大鼠的皮毛看见覆盖在气管上方的肌肉组织,左手换一个无菌的弯头眼科镊子,右手拿另一个无菌的手术剪,将肌肉组织剪开后即可发现气管,将气管周围的组织轻轻去除,即可看见气管及覆盖在气管周围的甲状腺组织,左手将气管下端轻轻固定,右手拿手术剪将甲状腺连着气管剪下来。
5、在无菌条件下,左手拿直头显微镊子将气管轻轻固定,右手拿弯头显微镊,除去连在气管及甲状腺外壁的结缔组织,然后用动脉剪将甲状腺从气管上剪下来,尽量不要剪刀气管,用预冷的PBS 清洗3次。
6、左手拿直头显微镊子将分离的甲状腺轻轻固定,右手用动脉剪剪成1mm³大小的组织块后,再用PBS清洗2-3次。
7、将组织块植入6孔板,组织块之间的间隙在3mm³左右,用枪头吸取多余的液体,将6孔板倒扣在培养箱中2小时,加入培养液1mL静置培养5天,5天即可观察到食管外膜成纤维细胞爬出,如图所示。
8、5天后移去组织块,待细胞长满6孔板后,用时差贴壁法纯化细胞,细胞纯度达90%以上后,可冻存保种。
图1.用Vimentin抗体鉴定甲状腺成纤维细胞
武汉云克隆诊断试剂研究所。
人类小鼠原代肺成纤维细胞分离方法

Primary human/mouse lung fibroblast isolation人类/小鼠原代肺成纤维细胞分离方法参考文献(H: 1.Katharina Heinzelmann et al. Am J Physiol Lung Cell Mol Physiol. 2018; 2. Claudia A Staab-Weijnitz et al. Am J Respir Crit Care Med. 2015. FK506-Binding Protein 10, a Potential Novel Drug Target for Idiopathic Pulmonary Fibrosis; M: Isolation and characterization of mouse fibroblasts, Benjamin L. Edelman and Elizabeth F. Redente)Materials:材料:1. Digestion solution: a).Liberase TM (5401119001, Merck) solution,2.5mg/ml (HBSS);b).DNAse (D4263-5VL, Sigma), 2000U/ml(PBS)消化液:a) Liberase TM 溶液(5401119001, Merck):溶于HBSS(终浓度2.5mg/ml)b) DNAse溶液(D4263-5VL, Sigma):溶于PBS(终浓度2000U/ml)2. Nylon filters 40/70 µm3. Complete medium (Mouse: DMEM/F12 + 20% FBS + 1% Penicillin/Streptomycin + 0.1% Amphotericin B + 1% Glu; Human: DMEM/F12 + 20% FBS + 1%Penicillin/Streptomycin + 0.1% Amphotericin B)4. Knife (disposable)5. Syringe6. PBSDigestion solution:Steps: (Mouse from 1-13, Human from 7-13)步骤:1. Weight the mouse, calculate the amount of anesthesia, Xylazin : Kelamin : NaCl =1:4:5, 100ul/10g weight;称重小鼠后麻醉2. Inject and wait 10min till the mouse sleep腹腔注射后等待10分钟3. Open abdomen and cut the artery of the kidney打开腹腔切断肾动脉4. Use syringe insert the heart and rinse with 15ml PBS until it’s white注射器灌注15ml PBS后插入心脏冲洗至肺部变白5. Take out the lung and heart in the tube with ice将心脏和肺取出置于冰盒中保存6. Wash with 80% ethanol in 10s在80%酒精中漂洗10秒7. Wash with PBS 3 times, 10min (Mouse); PBS 3 times, 30min (Human)PBS洗3次,每次10分钟(老鼠),每次30分钟(人),清洗时保存于冰盒中8. Dissected into pieces of 1cm2 in size and digested by digestion solution at 37°C for 1hours (shake vigorously every 15min)使用一次性无菌刀片将组织切成小块,并加入消化液在37度水浴锅中静置1小时(每15分钟猛烈上下摇晃试管)9. Samples were filtered through nylon filters with a pore size of 70 µm使用70微米过滤器过滤标本10. Centrifuged at 400 g, 4°C for 5 minutes, resuspended in complete medium400 g, 4°C, 离心5分钟,离心后加入完全培养基重悬11. Samples were filtered through nylon filters with a pore size of 40 µm使用40微米过滤器过滤标本12. Centrifuged at 400 g, 4°C for 5 minutes, resuspended in complete medium400 g, 4°C, 离心5分钟,离心后加入完全培养基重悬13. Medium was changed after 2 days (first check) and cells were split after reaching aconfluence of 80–90%. For the present study, phLF were used in passages 4-9.2天后检查细胞状态并换液,当密度达到80–90%时可传代,原代成纤维细胞最佳使用为4-9代。
大鼠肾脏原代细胞分离方法

大鼠肾脏原代细胞分离方法在生物医学研究领域,大鼠肾脏原代细胞的分离对于探讨肾脏生理、病理过程及疾病治疗具有重要意义。
本文将详细介绍大鼠肾脏原代细胞的分离方法,以供相关研究人员参考。
一、实验材料1.实验动物:健康成年SD大鼠。
2.主要试剂:D-Hank"s溶液、胰蛋白酶、Ⅰ型胶原酶、EDTA、胎牛血清、DMEM/F12培养基、抗生素(青霉素和链霉素)。
3.主要仪器:手术器械、显微镜、细胞计数仪、离心机、培养箱等。
二、实验步骤1.动物处理(1)将大鼠用CO2吸入法处死,取出肾脏。
(2)将肾脏放入预冷的D-Hank"s溶液中,清洗表面的血迹。
(3)去除肾脏周围的脂肪组织和包膜,分离出肾皮质。
2.细胞分离(1)将肾皮质剪成1mm的小块,放入含有胰蛋白酶、Ⅰ型胶原酶和EDTA的消化液中。
(2)在37℃、5% CO2的培养箱中消化30-60分钟。
(3)用细胞筛过滤消化液,收集细胞悬液。
(4)用D-Hank"s溶液洗涤细胞悬液,去除未消化的组织碎片。
(5)离心(1000r/min,5分钟),弃上清,加入含10%胎牛血清的DMEM/F12培养基重悬细胞。
3.细胞计数与培养(1)使用细胞计数仪对细胞进行计数。
(2)将细胞以适当的密度接种到培养瓶中,置于37℃、5% CO2的培养箱中培养。
(3)定期观察细胞生长情况,更换新鲜培养基。
三、注意事项1.在实验过程中,要确保细胞活力,减少细胞损伤。
2.消化时间需根据大鼠年龄、体重及消化酶的活性进行调整。
3.严格无菌操作,避免细胞污染。
4.细胞培养过程中,要定期观察细胞生长状态,及时更换新鲜培养基。
通过以上方法,可以成功分离出大鼠肾脏原代细胞,为后续研究提供可靠的实验材料。
大鼠膀胱原代上皮细胞的提取方法
大鼠膀胱原代上皮细胞的提取方法材料准备:1. 大鼠(如Sprague Dawley)。
2.适量的PBS(含有钙和镁离子)。
3.组织消化液(如0.25%胰蛋白酶和0.02%胰蛋白酶抑制剂混合的PBS)。
4.培养基(如DMEM/F12)。
5.15mL和50mL离心管、离心机。
6.显微镜和细胞计数器。
组织分离:1.用PBS冲洗大鼠膀胱,确保表面清洁。
2. 用无菌器械将膀胱切割成小块,大小约为1-2 mm33.将膀胱组织放入含有0.25%胰蛋白酶和0.02%胰蛋白酶抑制剂的组织消化液中,37°C孵育20-30分钟。
4.定期轻轻摇动培养皿,促进组织消化。
5.将组织过筛除去大块残留物。
6.把过滤后的细胞悬液用DMEM/F12培养基稀释。
细胞培养:1.将细胞悬液转移到15mL离心管中,离心200-300g5分钟,去除上清液。
2.加入PBS洗涤细胞,离心200-300g5分钟,去除上清液。
3.加入适量的DMEM/F12培养基,将沉淀复悬后转移到培养瓶中。
4.在37°C、5%CO2的条件下培养细胞。
5.每2-3天更换一次培养基,直至细胞密度达到80%-90%。
细胞鉴定:1.观察细胞形态和生长情况,以判断细胞纯度和健康状况。
2.可使用免疫细胞化学方法(如免疫组化和免疫荧光)来鉴定上皮细胞的特异性标记物,如细胞角蛋白、细胞间粘附分子等。
3.进行细胞功能实验,如细胞增殖、迁移和侵袭实验,以确认细胞的上皮细胞特性。
这些步骤可以帮助提取到高纯度和活力的大鼠膀胱原代上皮细胞,为后续研究提供可靠的细胞模型。
细胞生物学实验细胞原代培养
• 2、离散细胞培养:有单细胞贴壁或分裂成片
培养观察一般项目
正在培养中的细胞应每隔一定时间观察一次。 观察的内容包括:
严重者细胞脱壁悬浮。
9.将植块置于12孔培养板的培养孔中央,每孔5块,间隔约2mm,
布局合理,粘膜面向上,轻轻按压每块植块,使其紧贴培养板的
表面;
10.沿培养孔的边缘,缓慢加入约0.5ml的完全MEM培养液,
勿使培养液与植块接触;
11.将培养板置于370 C
、
5%CO2培养箱中预孵育1小时;
12.每孔加完全MEM培养液2ml,轻拿轻放,切勿使植块飘
• 学习观察体外培养细胞的形态及生 长状况。
实验原理
• 模仿体内生长环境,使来自机体 的细胞、组织、器官能够在人工 培养条件下生存、生长、繁殖。
•
培养用主要仪器设备
1、纯水设备:纯水仪 2、干燥消毒设备:电热干燥箱、高压蒸汽消毒锅、
过滤器及0.22 m滤膜; 3、超净工作台 4、培养设备: 普通培养箱、CO2培养箱; 5、贮存设备:冰箱、液氮罐 6、观察设备:倒置显微镜 7、其他设备:天平、离心机、水浴锅等
关闭超净工作台内的紫外光灯,点燃酒精灯 (一切操作均需在酒精灯火焰下进行)
将消毒过的所用物品放入超净工作台中
植块培养法培养鸡心肌细胞步骤
一、配M199完全培养液:
M199基础培养液 90%
小牛血清
10%
青霉素 链霉素
100IU/ml 100g/ml
过滤除菌。
二、获取心脏
① 消毒鸡胚蛋:泡入70%酒精 ② 取出鸡胚,Hank’s液洗涤。 ③ 取出心脏,放入Hank’s液中。
人类小鼠原代肺成纤维细胞分离方法
⼈类⼩⿏原代肺成纤维细胞分离⽅法Primary human/mouse lung fibroblast isolation⼈类/⼩⿏原代肺成纤维细胞分离⽅法参考⽂献(H: 1.Katharina Heinzelmann et al. Am J Physiol Lung Cell Mol Physiol. 2018; 2. Claudia A Staab-Weijnitz et al. Am J Respir Crit Care Med. 2015. FK506-Binding Protein 10, a Potential Novel Drug Target for Idiopathic Pulmonary Fibrosis; M: Isolation and characterization of mouse fibroblasts, Benjamin L. Edelman and Elizabeth F. Redente)Materials:材料:1. Digestion solution: a).Liberase TM (5401119001, Merck) solution,2.5mg/ml (HBSS);b).DNAse (D4263-5VL, Sigma), 2000U/ml(PBS)消化液:a) Liberase TM 溶液(5401119001, Merck):溶于HBSS(终浓度2.5mg/ml)b) DNAse溶液(D4263-5VL, Sigma):溶于PBS(终浓度2000U/ml)2. Nylon filters 40/70 µm3. Complete medium (Mouse: DMEM/F12 + 20% FBS + 1% Penicillin/Streptomycin + 0.1% Amphotericin B + 1% Glu; Human: DMEM/F12 + 20% FBS + 1%Penicillin/Streptomycin + 0.1% Amphotericin B)4. Knife (disposable)5. Syringe6. PBSDigestion solution:Steps: (Mouse from 1-13, Human from 7-13)步骤:1. Weight the mouse, calculate the amount of anesthesia, Xylazin : Kelamin : NaCl =1:4:5, 100ul/10g weight;称重⼩⿏后⿇醉2. Inject and wait 10min till the mouse sleep腹腔注射后等待10分钟3. Open abdomen and cut the artery of the kidney打开腹腔切断肾动脉4. Use syringe insert the heart and rinse with 15ml PBS until it’s white注射器灌注15ml PBS后插⼊⼼脏冲洗⾄肺部变⽩5. Take out the lung and heart in the tube with ice将⼼脏和肺取出置于冰盒中保存6. Wash with 80% ethanol in 10s在80%酒精中漂洗10秒7. Wash with PBS 3 times, 10min (Mouse); PBS 3 times, 30min (Human)PBS洗3次,每次10分钟(⽼⿏),每次30分钟(⼈),清洗时保存于冰盒中8. Dissected into pieces of 1cm2 in size and digested by digestion solution at 37°C for 1hours (shake vigorously every 15min)使⽤⼀次性⽆菌⼑⽚将组织切成⼩块,并加⼊消化液在37度⽔浴锅中静置1⼩时(每15分钟猛烈上下摇晃试管)9. Samples were filtered through nylon filters with a pore size of 70 µm使⽤70微⽶过滤器过滤标本10. Centrifuged at 400 g, 4°C for 5 minutes, resuspended in complete medium400 g, 4°C, 离⼼5分钟,离⼼后加⼊完全培养基重悬11. Samples were filtered through nylon filters with a pore size of 40 µm使⽤40微⽶过滤器过滤标本12. Centrifuged at 400 g, 4°C for 5 minutes, resuspended in complete medium400 g, 4°C, 离⼼5分钟,离⼼后加⼊完全培养基重悬13. Medium was changed after 2 days (first check) and cells were split after reaching aconfluence of 80–90%. For the present study, phLF were used in passages 4-9.2天后检查细胞状态并换液,当密度达到80–90%时可传代,原代成纤维细胞最佳使⽤为4-9代。
原代心肌细胞-原代心成纤维细胞培养方法
原代心肌细胞-原代心成纤维细胞培养方法实验准备:昆明乳鼠25~30只;生物安全柜;巴氏吸管2支;培养皿2个;原代器械盒;15ml 离心管;50ml离心管各一支;胰酶;PBS;1%双抗;封口膜;酒精灯;Dhanks;实验主要分为两大步骤进行:第一天晚上1、培养皿内加入预冷的PBS+1%双抗。
2、取乳鼠酒精喷全身取心脏放到提前准备的培养皿中无需剪碎稍抖动清洗。
3、所有心脏取完,用巴氏吸管将培养皿中的心脏吸到15ml离心管中,稍等沉降,吸去液体。
4、加入Dhanks冲洗心脏,吸出弃去,将心脏上沾有的血尽量冲洗干净。
5、加入3mlDhanks和5ml胰酶。
封口膜封好,放到饭盒里,四度摇床8-12小时。
第二天上午1、配置二型胶原酶(16.8mg二型胶原酶+21mL DMEM,配好后放到水浴锅预热,微孔滤膜过滤,现用现配)2、8-12小时后,向装有心脏的15ml离心管中加入5ml DMEM完全培养基中和胰酶。
之后小心吸去液体,加入7ml提前准备好的二型胶原酶。
放到37度摇床摇10min转速160r,摇10min后将上清吸到新的50ml离心管中。
这个过程重复3次,基本上心脏全部溶解,只有少量组织。
(每次可以少加二型胶原酶4-5ml多消化几次)3、将50ml离心管中3次收得的上清滤网过滤,离心1000r5min,弃上清,沉淀加入DMEM完全培养基,逐层吹起,加入到细胞培养瓶中。
5只鼠铺一个培养瓶。
4、1.5-2小时后差速,将培养瓶中的培养液转移到六孔板里。
心肌细胞10只鼠一个6孔板即可。
注:用心肌细胞的取6孔板中细胞培养48小时;用成纤维细胞的将培养瓶中差速的瓶用1000ul的枪冲洗30次得到的成纤维细胞相对较纯。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大鼠肺成纤维细胞原代提取及培养实验具体步骤及方法将大鼠的肺成纤维细胞从机体中取出,经胰酶、螯合剂(常用EDTA)处理,分散成单细胞,置合适的生长培养基培养基中培养,使细胞得以生存、生长和繁殖。
一、实验材料准备
1. 动物
出生后1-4天的Wistar乳鼠1只。
2. 试剂
PBS、培养液(Hyclone的低糖DMEM,含Hyclone的10%新生牛血清、100 U/ml 青链霉素、1%明胶PBS、0.25%胰酶(含EDTA,GIBCO),碘酒和酒精绵球。
3. 器械
眼科直剪2把、眼科弯剪2把、眼科直镊2把、眼科弯镊2把、玻璃平皿3套,25 cm2塑料培养瓶(Costar)。
二、具体操作
1. 明胶包被培养瓶过夜(准备2-3个),取出明胶,用2 ml培养液冲洗培养瓶一遍,置于超净台中。
2. 解剖取肺:将乳鼠在酒精中浸泡后取出,转移至超净台上的玻璃培养皿中,用碘酒消毒胸部皮肤,再用酒精棉球脱碘。
左手捏紧乳鼠颈背部皮肤以充分展露胸部,右手以眼科直剪剪开皮肤,充分撕拉开,再用酒精棉球消毒,继而以另一把眼科弯剪沿胸骨柄左下缘向上剪开肋骨,然后在切口中间横剪胸骨。
用眼科镊取出肺,置于盛有PBS(含有200
U/ml青链霉素)的玻璃平皿中,冲洗去血。
3. 用眼科剪将肺分成几个肺叶,用镊子去除周边的血凝块及纤维组织,用眼科剪剪去肺门处的支气管和血管,再用含有双抗的PBS冲洗1遍。
4. 用眼科弯剪将肺组织剪碎成1 mm3大小,加入含有双抗的PBS,将肺组织块吹打开,静置15 min后,更换新的PBS。
5. 用200 ul微量加样器(最好是超净台中专用的,临用时用酒精绵球好好擦拭枪柄)取200 ul加样枪头一个,剪去尖,在酒精灯上用火焰烧弯。
用枪头吸取组织块接种于培养瓶中,每瓶20-25块左右,每小块间距0.5 cm左右。
组织块放置好后,轻轻将培养瓶翻转,让瓶底朝上,向瓶内加入2 ml左右的培养液,盖好瓶盖,将培养瓶倾斜放置在温箱中,干贴壁2-4 h后,将培养瓶慢慢翻转平放,继续静置培养。
注意上述操作过程中动作要轻柔,让液体慢慢覆盖组织小块,严禁动作过快致使液体产生的冲力使粘贴的组织块漂起而造成原代培养失败。
48 h后换液,更换2-3 ml即可。
6. 贴块贴壁72 h后,镜下可见大量的成纤维细胞爬出,将组织块去除,继续培养2-3天,待细胞长满,即可传代。
注:因为血清浓度低,内皮细胞可以爬出少量,但是很快就
会死掉。
2.7 传代用0.25%胰酶常规消化,以1:2传代,传代完后,采用差速贴壁法纯化一次,即待细胞贴壁1.0 -1.5 h后(即绝大多数成纤维细胞都已经贴壁),弃去未贴壁的细胞和培养液,更换新的培养液。
成纤维细胞为长梭形形态,常呈漩涡状生长。
注意
1.要注意无菌操作。
2.操作过程中动作要轻柔,让液体慢慢覆盖组织小块,严禁动作过快致使液体产生的冲力使粘贴的组织块漂起而造成原代培养失败。
肺成纤维细胞能分泌多种细胞因子和其他物质,并与肺内其他细胞有着密切的相互作用,从而在支气管哮喘、慢性阻塞性肺疾病、肺纤维化等疾病的发生发展中起着重要的作用。
体外培养肺成纤维细胞是研究肺部疾病如支气管哮喘、慢性阻塞性肺疾病、肺纤维化等的重要手段和工具。
肺成纤维细胞能分泌多种细胞因子和其他物质,并与肺内其他细胞有着密切的相互作用,从而在支气管哮喘、慢性阻塞性肺疾病、肺纤维化等疾病的发生发展中起着重要的作用。
体外培养肺成纤维细胞是研究肺部疾病如支气管哮喘、慢性阻塞性肺疾病、肺纤维化等的重要手段和工具。
