人教版高中化学必修2第四章知识点总结PPT
新教材高中化学第4章第2节第2课时电解原理的应用课件新人教版选择性必修1ppt

4.电冶金 (1)金属冶炼的本质。 使矿石中的金属离子____获__得__电__子____变成金属单质的过程:Mn++ ne-═══M。 (2)电冶金。 电解是强有力的氧化还原手段,适用于制取一些__活__泼__金__属__单质, 如冶炼钠、钙、镁、铝等活泼金属。
(3)电解熔融的氯化钠。 阳极反应:___2_C_l_-_-__2_e_-_═__═_═__C_l_2↑_______; 阴极反应:___2_N__a_+_+__2_e_-_═__═_═_2_N__a____; 总反应:____2_N_a_C__l(_熔__融__)_═_电═_═解__═_2_N__a_+__C_l_2↑_____。
【解析】(1)铜极增重,说明银在铜极上析出,则铜极为阴极,X 为 负极。(2)C 中铜极增重 2.16 g,即析出 0.02 mol Ag,电路中通过 0.02 mol 电子。由 4e-~O2,可知 B 中产生的 O2 只有 0.005 mol,即 112 mL。但 B 中共收集到 224 mL 气体,说明还有 112 mL 气体是 H2,即 Cu2+全部 在阴极放电后,H+接着放电产生了 112 mL H2,则通过 0.01 mol 电子时, Cu2+恰好完全被还原。由 2e-~Cu,可知 n(Cu2+)=0.005 mol,则 c(CuSO4) =0.000.25 Lmol=0.025 mol·L-1。
(1)哪个装置是原电池?哪个装置是电解池? 【答案】甲 、乙构成原电池,丙是电解池。 (2)a、b、c、d电极名称分别是什么? 【答案】a是负极,b是正极,c是阳极,d是阴极。 (3)若模拟氯碱工业生产烧碱、氯气和氢气,如何选用电极材料和电 解质溶液? 【答案】c 电极用Pt或石墨,d电极用铁丝(导体均可),X溶液为饱 和食盐水。
高中化学人教版必修2课件:第四章第一节第2课时海水资源的开发利用

3.下列各组物质,不需要经过化学变化就能够从海 水中获得的是( )
A.氯、溴、碘 B.钠、镁、铝 C.烧碱、氢气 D.食盐、淡水
解析:海水经过蒸发即可得到食盐和淡水。A、B 选 项中,海水中存在 Cl-、Br-、I-、Na+、Mg2+、Al3+,
要获得它们的单质必须失去或得到电子才能实现。C 中,需要电解饱和食盐水获取。
(2)海水的蒸馏。
①主要仪器:A:圆底烧瓶;B:冷凝器;C:锥形瓶。 ②冷凝水的流向:a 口进,b 口出。 ③A 中加入碎瓷片的目的是防止液体暴沸。
二、海水化学资源的开发利用
1.海水中的元素。 (1)常量元素(99%):除 H、O 两种元素外,含有 Cl、 Na、K、Mg、Ca、S、C、F、B、Br、Sr 等 11 种元素。 (2)微量元素(1%):常量元素之外的元素,总计含有 80 多种。 (3)特点:种类很多,总储量很大,但许多元素的富 集程度很低。
(3)步骤③中氧化剂是________,若反应中生成 2 mol HBr,则消耗________mol SO2。
(4)根据上述反应判断 SO2、Cl2、Br2 三种物质氧化性 由强到弱的顺序是________________。
解析:(1)由流程图和反应原理可写出离子方程式和 化学方程式分别为 2Br-+Cl2===Br2+2Cl-,SO2+Br2 +2H2O===2HBr+H2SO4。(2)从理论上考虑,NaOH 具 有强碱性,能吸收 Br2,Fe2+、SO23-具有强还原性也能吸 收 Br2。
2.海水化学资源的开发利用。
易错提醒 1.海水制盐得到的是粗盐,含有 Ca2+、Mg2+、SO24- 等杂质,需精制后才能用于氯碱工业。 2.海水中的溴元素、海带中的碘元素均是以离子的 形式存在而不是以单质的形式存在,需要加入氧化剂才能 将其转化为单质。
(完整版)高中化学必修二知识点归纳总结

高中化学必修二知识点归纳总结第一章: 物质结构 元素周期律一、原子结构质子(Z 个)原子核 注意:中子(N 个) 质量数(A)=质子数(Z)+中子数(N)1.) 原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z 个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n 2;③最外层电子数不超过8个(K 层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一(能量最低) 二 三 四 五 六 七对应表示符号: K L M N O P Q 3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同的各元素从左到右排成一横行。
(周期序数=原子的电子层数)③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成一纵行。
主族序数=原子最外层电子数2.结构特点:核外电子层数 元素种类第一周期 1 2种元素短周期 第二周期 2 8种元素周期 第三周期 3 8种元素元 (7个横行) 第四周期 4 18种元素素 (7个周期) 第五周期 5 18种元素周 长周期 第六周期 6 32种元素期 第七周期 7 未填满(已有26种元素)表 主族:ⅠA~ⅦA 共7个主族族 副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行) 第Ⅷ族:三个纵行,位于ⅦB 和ⅠB 之间(16个族) 零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
人教版高中化学必修2第四章知识点总结ppt课件

分馏汽油裂能解使:高深锰度酸裂钾化溶。液褪(化色学;变不能化)
使溴水褪色。
.目的:获得化工产品--三烯
裂化或裂解汽油中含有烯烃,能使高锰 酸钾溶三液烯褪:色乙。烯能,使丙溴烯水,褪1,色3。丁二烯
学科网
催化剂
☆工业上乙烯的主要生产方法是 石油的裂解
。
裂化目的:
提高汽油的产量(主要), 和质量.
含热裂化和催化裂化
1:石油的分馏——利用各组分沸点不同,进行多级蒸馏的过程。 (物理变化、得馏分)
溶剂油C5~C8 汽 油 C5~C11 航空煤油C10~C15
煤油C11~C16 柴油C15~C18
重油: C18以上的重烷油:烃C,18以上的烷烃 石蜡主要由正构(烷润滑烃油C、nH石2蜡n+、2沥组青成) 。 碳原子数一般为22-36,主要为22烷 28烷
水煤气
直接液化——使煤与H2作用生成液体燃料。
间接液化——先将煤转化为CO和H2,在催化合
成CH3OH。
液化:
催化剂
CO(g) + 2H2(g)
CH3OH(l)
精选ppt
29
☆知识运用:煤的气化和液化
1)为了减少煤的燃烧对环境的污染可采取的措施是:
① 改进煤的燃烧技术、改善煤的排烟设备;
.
② 设法把煤转化成清洁的燃料
质铁的,陨石中含铁量高达90%以上。
古代阿拉伯人曾传说“天上的金雨落进沙漠
里变成了黑色的铁”。
新
疆
陨
铁
济南陨铁
精选ppt
南 极 洲 陨 铁
5
一、 金属的冶炼 1. 金属冶炼的实质
利用氧化还原反应,使金属化合
物中的金属阳离子得到电子变成金属原
(完整版)高中化学必修二知识点总结

1. 编排原则:
①按原子序数递增的顺序从左到右排列
②将电.子.层.数.相.同. 的各元素从左到右排成一横行..。(周期序数=原子的电子层数)
③把最.外.层.电.子.数.相.同. 的元素按电子层数递增的顺序从上到下排成一纵行 ..。 主族序数=原子最外层电子数
2. 结构特点:
核外电子层数
人教版化学必修二第四章课件ppt

赤潮、水华:含氮、磷的工业废水、生活污水排放
酸雨:目前规定PH≤5.6的各种形式的酸性降水。
SO2 和NOx是形成酸雨的主要物质 。 温室效应:人类向自然界过多排放CO2气体 臭氧层空洞:氟氯(溴)烃(CF2Cl2)、NOx 光化学烟雾 :碳氢化合物和NOx等。
一次污染物在阳光(紫外光)作用下发生光化学反
利用铜屑制硝酸铜可以采用以下三种方法:
①Cu与浓HNO3反应 ②Cu与稀HNO3反应 ③Cu与O2反应后,再与HNO3反应
从原子经济性的角度考虑,从最大限度地减少废物的 排放的角度考虑,采用Cu与O2反应后,再与HNO3反 应的方法是最好的。
-
一、煤、石油、天然气的综合利用
1、煤的组成
2、煤的有综机合物利和用无机物
一般较纯
-
2.石油的催化裂化
在催化剂作用下,将含碳原子较多、沸点 较高的烃断裂为含碳原子较少、沸点较低的 烃的过程。如汽油等。
催化剂
C16H34 加热、加压 C8H18+C8H16
催化剂
C8H18 加热、加压 C4H10+ C4H8
-
3.石油的裂解(深度裂化)
用比裂化更高的温度使长链的烃分子断裂 成碳原子数较少的气态烃分子和少量的液态 烃,获取有机化工原料,如乙烯等
主要产品:出炉煤气(焦炉气、粗氨水、粗苯)、
利煤
煤焦油、焦炭
用 的 气化:将煤转化为可燃性气体的过程。
综 合
主要反应:C(s)+H2O(g)
高温 ====
CO(g)+H2(g)
水煤气
液化:将煤转化为液体燃料的过程。
途径: 直接液化:煤+ H2 →液体燃料
间接液化:煤→CO + H2→甲醇
人教版高中化学必修2三四章知识点
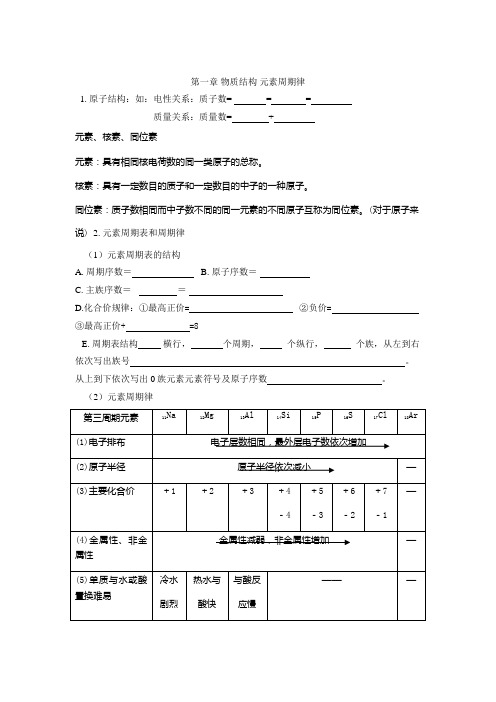
第一章物质结构元素周期律1. 原子结构:如:电性关系:质子数= = =质量关系:质量数= +元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说) 2. 元素周期表和周期律(1)元素周期表的结构A. 周期序数=B. 原子序数=C. 主族序数==D.化合价规律:①最高正价=②负价=③最高正价+ =8E. 周期表结构横行,个周期,个纵行,个族,从左到右依次写出族号。
从上到下依次写出0族元素元素符号及原子序数。
(2)元素周期律第三周期元素11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar(1)电子排布电子层数相同,最外层电子数依次增加(2)原子半径原子半径依次减小—(3)主要化合价+1 +2 +3 +4-4 +5-3+6-2+7-1—(4)金属性、非金属性金属性减弱,非金属性增加—(5)单质与水或酸置换难易冷水剧烈热水与酸快与酸反应慢———(6)氢化物的化学式——SiH4PH3H2S HCl —(7)与H2化合的难易——由难到易—(8)氢化物的稳定性——稳定性增强—(9)最高价氧化物的化学式Na2O MgO Al2O3SiO2 P2O5 SO3 Cl2O7 —最高价氧化物对应水化物(10)化学式NaOHMg(OH)2Al(OH)3 H2SiO3H3PO4 H2SO4 HClO4 —(11)酸碱性强碱中强碱两性氢氧化物弱酸中强酸强酸很强的酸—(12)变化规律碱性减弱,酸性增强—A. 元素的金属性强弱的判断依据a.b. c.(注意:单质与相应离子的性质的变化规律相反)元素的金属性强弱的判断依据a.b.c.d.B. 元素性质随周期和族的变化规律a. 同一周期,从左到右,元素的金属性逐渐,元素的非金属性逐渐。
b. 同一主族,从上到下,元素的金属性逐渐,元素的非金属性逐渐。
完整版)人教版高中化学必修2知识点总结全册

完整版)人教版高中化学必修2知识点总结全册第一章物质结构元素周期律一、元素周期表元素周期表是由俄国科学家门捷列夫发明的。
其中包括1~18号元素的原子结构示意图,周期表的结构包括7个周期(三短、三长、一个不完全),周期数等于电子层数;7个主族、7个副族、一个零族、一个Ⅷ族,主族序数等于最外层电子数。
碱金属元素的结构特点包括Li、Na、K、Rb的最外层电子数、原子半径对其性质的影响,以及Na与K分别与水、氧气反应的情况。
同族元素性质的相似性也是需要考虑的因素。
卤族元素的结构特点包括F、Cl、Br、I的最外层电子数、原子半径对其性质的影响,单质与氢气发生反应的条件与生成气态氢化物的稳定性,卤素间的置换反应,以及从上到下随着核电荷数的增加性质的递变规律。
同主族元素从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。
二、核素核素的定义是APX,同位素包括1231H、1H、1H,而原子的构成则可以用两个关系式表示:质子数等于核电荷数等于核外电子数,质量数A等于质子数P加上中子数N。
几种同位素的应用包括12、xxxxxxx6C6C、1H、1H、92U。
三、元素周期律元素周期律是随着原子序数的递增,元素的性质呈周期性变化的规律。
原子的电子层排布的周期性变化、原子半径的周期性变化以及主要化合价的周期性变化都是需要考虑的因素。
第三周期元素化学性质变化的规律包括金属性的递变规律,钠镁与水反应现象,比较钠镁与水反应的难易(方程式书写),镁铝与盐酸反应的难易(现象,方程式),比较钠镁铝最高价氧化物对应水化物的碱性强弱,以及非金属性的递变规律,比较硅、磷、硫、氯与氢气反应的难易以及气态氢化物的稳定性,比较它们的最高价氧化物对应的水化物的酸性强弱。
CH2Br2CH2XXX2Br实验现象:溴水从橙黄色变成无色,生成液体产物应用:制备溴代乙烷②乙烯与HCl化学方程式:CH2CH2XXX→CH3CH2Cl实验现象:无色气体与氯化氢气体反应,生成液体产物应用:制备氯代乙烷二、苯知识要点一:知道苯的分子结构1.苯的分子结构分子式C6H6电子式结构式结构简式六个碳原子构成一个六角形,每个碳原子上带一个氢原子2.工业制法:从煤焦油中提取3.苯的物理性质苯是一种无色透明的液体,具有芳香味,密度小于水,不溶于水,易挥发4.苯的化学性质苯分子中有6个π电子,使苯具有稳定性,不容易发生加成反应1)取代反应定义:取代反应是指有机物分子中的一个或多个H原子被其他原子或原子团所取代的反应①苯与浓硝酸反应化学方程式:C6H6HNO3C6H5NO2H2O实验现象:苯变成黄色,放出气体,生成液体产物应用:制备硝基苯②苯与浓硫酸反应化学方程式:C6H6H2SO4C6H5HSO4H2O实验现象:苯变成黑色,放出热量,生成液体产物应用:制备苯磺酸知识要点二:了解苯的同分异构体1.环丙烷分子式C3H6结构简式三个碳原子构成一个三角形,每个碳原子上带两个氢原子2.苯的同分异构体苯有两种同分异构体,它们的分子式相同,但结构不同,分别为苯和环丙烷。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原理:加热到 水的沸点,液态水 变为水蒸汽与海水 中的盐分离,水蒸 汽冷凝得到淡水
海水蒸馏原理示意图
思考与归纳
提取海带中的碘元素得到单质碘
海水
生物 富集
燃烧
海带 操作1 海带灰
加水 加热
操作2
溶解
悬浊液
过滤
操作3 滤液
CCl4
试剂1
稀硫酸
碘水
过氧化氢溶液
试剂2
操作4
萃取 分液
碘的CCl4溶液 操作5
里变成了黑色的铁”。
新
疆
陨
铁
南
极
洲
济南陨铁
陨
铁
一、 金属的冶炼 1. 金属冶炼的实质
利用氧化还原反应,使金属化合
物中的金属阳离子得到电子变成金属原
子。即: Mn+ + ne-
M
想一想人:要们日使常金应属用矿的金物属转材化料为,金多为属合 单发金炼生质或出什,纯来金金,么属属这反元,就应素这是?就人的需们化要常合把说价金的属金如从属何矿的变石冶化中炼,提。
电解法
热还原法
热分解法 物理方法
(1)为什么不同的金属的冶炼方法不同? (2)为什么人类使用铁器比使用铜器晚?
1、金属回收的意义
⑴节约矿物资源; ⑵节约能源; ⑶减少环境污染。
2、回收废旧金属的利用
湿法炼铜: Fe+CuSO4=FeSO4+Cu
火法炼铜: Cu2S+O2高=温2Cu+SO2
返回
•海洋中的化学资源的提取和检验 如何用海水制备淡水?
第四章 化学与自然资源的开发利用
第一节
开发利用金属矿物和海 水资源
人类最早发现和应用的金属
资料卡片
铜是人类第一种大量使用的金属,结 束了漫长的“石器时代”。
Cu2(OH)2CO3 = 2CuO + H2O + CO2↑ 孔雀石 C + 2CuO =高=温CO2 ↑ + 2Cu
在公元前6000年到7000年左右, 人类开始迈进了象征古代文明开端
蒸馏
单质碘
思考交流: 如何将海水中的溴离子转变成溴单质?
1、推测海水提溴的步骤和实验装置; 2、写出相关的化学方程式。
浓缩海水
通入Cl2 ①
溴单质 通入空气,SO2吸收 ②
氢溴酸 通入Cl2 ③
单质溴
想一想、猜一猜
一位遇上海难的水手,随着木排在海上漂流。他用完了淡水,感到异常口渴,但他不
喝海水,因为他知道海水会致命。原因是
2、煤的综合利用 (1)煤的干馏 ①煤的干馏原理: 把煤隔绝空气加强热使它分解的过程。
煤的干馏实验装置图
实验装置1
实验装置2
煤——由有机物和少量无机物组成的复
杂混合物。(C H O N S等)
对比理解记忆:
1:煤的干馏
焦炉气:H2 CH4 C2H4 CO 水煤气: CO 和H2 液化石油气:C3~C5 烃
2NaCl
(熔融)
电解
═
2Na
+
Cl2
↑
练习: 写出电解MgCl2、Al2O3的化学方程式
MgCl2 电═解 Mg + Cl2↑ (熔融)
═电解
2Al2O3 冰晶石 4Al +3O2↑ (熔融)
小结
金属活动性顺序与金属的冶炼方法 金属单质的还原性减弱,金属离子的氧化性增强
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
常用的还原剂有: 活泼金属、CO、H2、C(焦炭)
铝热反应
反应现象:剧烈反应,发出强 光,纸漏斗被烧穿,沙子上落 有黑色铁珠。
高温
2Al+Fe2O3
2Fe+Al2O3
注意:
镁条、氯酸钾的作用:引燃剂
铝 热 反 应
{的 焊接钢轨
应
用 冶炼(高熔点的金属)
请写出MnO2、Cr2O3、分别与Al反 应的化学方程式
的“铜器时代”。
铜镜
汉武帝时铜币
先秦刀币
铜虎头
英法联军火烧圆明园,被劫掠到国外的珍贵 文物——铜虎头,2000年在香港被拍卖。 由中国派员出高价赎回。
勿忘国耻:
中国还有上百万件珍贵文物流失海外。
人类最早是在由天而降的陨石中获得单
质铁的,陨石中含铁量高达90%以上。
古代阿拉伯人曾传说“天上的金雨落进沙漠
Hg Ag
⑴热分解法
(适用Hg及其以后的不活泼金属)
练习:写出HgO,Ag2O受热分解的化学方程式
2HgO =△ 2Hg + O2↑ 2Ag2O =△ 4Ag + O2↑
K Ca Na Mg Al Zn Fe Sn ZPnb F(He)SCnuPHbg(HA)gCu
⑵热还法
适用于金属活动性顺序表中的中 间的多数金属。它是金属冶炼的常用 方法。
干馏——隔绝空气加强热,使之发生化学反应的过程。
干馏 煤
焦炉气 H2 CH4 C2H4 CO H2S 等
粗氨水 NH3.H2O NH4+ 煤焦油 分馏
苯 甲苯 二甲苯 酚 萘等
焦炭 C
沥青
分馏是物理变化, 干馏是化学变化。如煤中不含有煤焦油,干馏后才得到。
2.煤的气化:把煤中的有机物转化为可燃气体的过程。属于化学变化。
高温
3MnO2+4Al ═ 3Mn+ 2Al2O3 Cr2O3+2Al ═高温2Cr + Al2O3
Fe2O3+3CO 高温 2Fe+3CO2
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
⑶电解法
在金属活动性顺序中,K、Na 、Ca、Mg 、Al 等几种金属的还原性很强,这 些金属的阳离子难得电子,因此不能用一般的方法和还原剂使其从化合物中还原出 来,而只能用通电分解其熔融盐或氧化物的方法来冶炼。
()
A、海水有苦涩味,根本喝不下去
B、海水中含有多种盐,能使肠胃腐烂致人死亡
D
C、海水中有许多微生物,有些微生物能致人死亡
D、海水会造成人体水分从血液和组织内脱离出来,进入肠胃中,使人脱水死亡
第二节 资源综合利用 环境保护
学科网
一、煤、石油、天然气的综合利用
2020年7月14日星期二
煤的组成:复杂的混合物,含有C、 H、 O 、N、S等元素。
快冶炼速有阅多读少课金种本属方88活法页动,内性分容顺别,序是找什出么金?属 K C适a 用Na于Mg金A属l Z活n F动e S顺n 序Pb表(H中) C的u H哪g 些Ag金Pt Au
属? 金属活动性由强逐渐减弱
二 、 金属冶炼的方法的选择 (1)热分解法 (2)热还原法 (3)电解法
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag
高温
C(s) + H2O(g)
CO(g) + H2(g)
学科网
水煤气
3.煤的液化 (化学变化)
直接液化——使煤与H2作用生成液体燃料。 间接液化——先将煤转化为CO和H2,在催化合
