培养基优化方法(Strategies for improving_fermentation_medium_performance)
实验一 培养基优化 - 副本

分析A因素各水平对试验指标的影响。由表3可以看出,A1的
影响反映在第1、2、3号试验中,A2的影响反映在第4、5、6
号试验中,A3的影响反映在第7、8、9号试验中。 A因素的1水平所对应的试验指标之和为
KA1=y1+y2+y3=0+17+24=41,kA1= KA1/3=13.7;
A因素的2水平所对应的试验指标之和为
平,列出因子水平表; 根据因子和水平数选用合适的正交表,设计 正交表头,并安排实验; 根据正交表给出的实验方案,进行实验; 对实验结果进行分析,选出较优的实验条件 以及对结果有显著影响因子。
一、实验目的
掌握微生物斜面培养基、种子培养基及发
酵培养基确定方法,学会对已确定菌种确 定实验室发酵工艺。
二、实验原理
生物量的测定方法有比浊法和直接称重法等。
由于细菌、酵母等单细胞生物在液体深层通 气发酵过程中是以均一混浊液的状态存在的, 所以可以采用直接比色法进行测定。
三、仪器与试剂
全恒温振荡培养箱,分光光度计、电热恒温
水浴槽、天平、电炉。
试剂为葡萄糖、胰蛋白胨、 酵母浸粉、
NaCl。
案(表10-5)。
上一张 下一张 主 页
退 出
表10-5 试验方案及试验结果 试验号 1 2 3 4 5 6
因
A 11(10) 1 1 22(50) 2 2 B 11(1) 22(4) 33(7) 1 2 3
素
C 11(20) 22(35) 33(50) 2 3 1 D
1(1.5) 1
2(2.5) 2 3(3.5) 3
四、实验方法
(1)培养基的配制 表1
因素水平 1 2 3 4 葡萄糖% 5 3 1.5 1
培养基优化毕业设计

培养基优化毕业设计
题目:培养基优化对细胞生长的影响研究
摘要:
本研究旨在探究不同培养基对细胞生长的影响,以及对培养基的优化方案。
选取细胞作为研究对象,采用不同培养基(包括基础培养基、添加剂培养基和改良培养基)培养细胞,比较其生长曲线和生长速率。
同时,针对不同培养基的不同成分,分别进行单因素实验和正交实验,寻找影响细胞生长的最优参数组合。
结果显示,添加剂培养基对细胞生长有显著的促进作用,而改良培养基在小规模培养中表现良好。
在优化方案中,发现培养基中葡萄糖和氨基酸浓度、CO2浓度和温度等因素对细胞生
长有显著的影响,并进行了相应的参数调节。
本研究对于细胞培养技术的进一步完善具有重要意义,为工业生产和生物医学领域的应用提供了理论基础和实用方案。
关键词:培养基优化,细胞生长,添加剂培养基,改良培养基,正交实验。
植物乳杆菌发酵培养基的优化及其高密度培养技术

恒温培养振荡器、雷磁 PHS-25 型数显 pH 计 上海智城 分析仪器制造有限公司;SPX-250B-Z 型生化培养箱 上 海精宏实验设备有限公司;FUS-15L 发酵罐 上海国强 生物设备有限公司。 1.2 方法
1.2.1 菌浓度的测定 采用菌落平板计数法[14]测定菌落数,计算发酵液中
的菌浓度。
1.2.2 还原糖含量的测定 采用直接滴定法测定还原糖含量[15]。
1.2.3 种子液的制备 转接斜面菌种于液体种子培养基中,置于 36℃恒温
培养箱中培养 12h。
1.2.4 发酵培养基的优化
1.2.4.1 不同碳源对植物乳杆菌高密度培养的影响 在 MRS 液体培养基基础上,选择蔗糖、麦芽糖、
1.2.6.2 流加法高密度培养的研究 利用 15L 发酵罐,比较恒速流加和指数流加对植物
乳杆菌高密度培养的影响,以确定一种更优的流加方 式。流加葡萄糖质量浓度为 300g/L,每隔 4h 测定菌落 数和还原糖的含量。
恒速流加:以恒定的流加速度 200g/h 流加到发酵 罐内。
指数流加:以 1.2.5.4 节最终确定的生长曲线做参
NaAc、KH2PO4 作为缓冲盐,质量分数都为 0.5%,以 不加任何缓冲盐作为空白对照。按 2% 接种量接种种子 液于发酵培养基中,初始 pH 6.0,培养温度 36℃,置 于恒温箱内静置培养 18h,测定培养液的菌落数。
1.2.4.4 不同生长因子对植物乳杆菌高密度培养的影响
选择玉米浆、番茄汁、VC 3 种作为生长因子,质 量分数都为 0.5%,以不添加任何生长因子作为空白对 照。按 2% 接种量接种种子液于发酵培养基中,初始 pH 6.0,培养温度 36℃,置于恒温箱内静置培养 18h,测 定培养液的菌落数。
培养基优化及数学分析方法
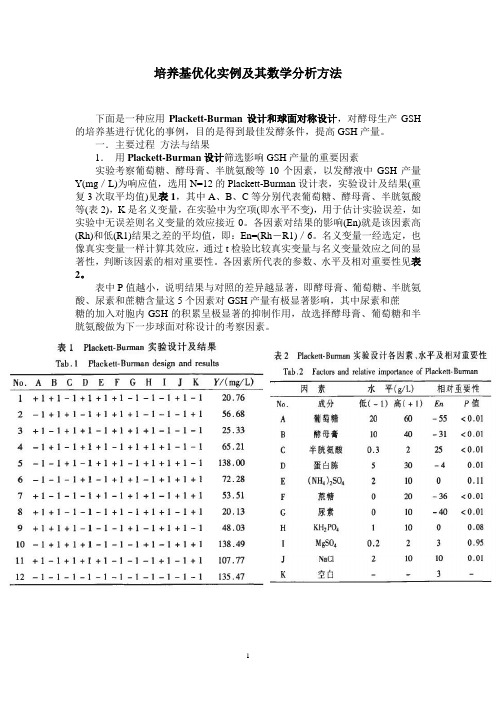
培养基优化实例及其数学分析方法下面是一种应用Plackett-Burman设计和球面对称设计,对酵母生产GSH 的培养基进行优化的事例,目的是得到最佳发酵条件,提高GSH产量。
一.主要过程方法与结果1.用Plackett-Burman设计筛选影响GSH产量的重要因素实验考察葡萄糖、酵母膏、半胱氨酸等10个因素,以发酵液中GSH产量Y(mg/L)为响应值,选用N=12的Plackett-Burman设计表,实验设计及结果(重复3次取平均值)见表1,其中A、B、C等分别代表葡萄糖、酵母膏、半胱氨酸等(表2),K是名义变量,在实验中为空项(即水平不变),用于估计实验误差,如实验中无误差则名义变量的效应接近0。
各因素对结果的影响(En)就是该因素高(Rh)和低(R1)结果之差的平均值,即:En=(Rh-R1)/6。
名义变量一经选定,也像真实变量一样计算其效应,通过t检验比较真实变量与名义变量效应之间的显著性,判断该因素的相对重要性。
各因素所代表的参数、水平及相对重要性见表2。
表中P值越小,说明结果与对照的差异越显著,即酵母膏、葡萄糖、半胱氨酸、尿素和蔗糖含量这5个因素对GSH产量有极显著影响,其中尿素和蔗糖的加入对胞内GSH的积累呈极显著的抑制作用,故选择酵母膏、葡萄糖和半胱氨酸做为下一步球面对称设计的考察因素。
2.球面对称设计优化培养基配比以影响较大的葡萄糖、酵母膏、半胱氨酸这3个因素为考察因素,以发酵液中GSH产量Y(mg/L)为响应值,每个因素选取5个水平,采用球面对称设计,各水平浓度及结果见表3,其中X1代表酵母膏,X2代表葡萄糖,X3代表半胱氨酸,每个水平重复两次取平均值,其他影响较小的因素选中低水平。
将实验数值进行计算机多元处理,得回归方程:Y=-11.0513+11.685X1-0.189 2X12+4.5013X2―0.0936X22―93.0191X3+7.8508X32-0.0443X1 X2+1.212 X2 X3+0.3619X1X3可以看出,葡萄糖、酵母膏、半胱氨酸浓度的变化都对GSH产量有显著影响,其中半胱氨酸对GSH的影响最为显著。
培养基优化经验

比如,我在实验中目前遇到的几个问题:1、我做完单因素,就在想是做PB?还是最陡爬坡?还是两个都要做呢??毕竟我快毕业了,时间紧张阿2、我现在准备做PB,突然发现很多文献上都出现了在实验中还要加几个空白项,知道主要是用于误差分析的,但我就想问下,是不是必须设置空白项呢?如果必须设,那么要设几个呢?我看大部分是设了4个的;还有就是,空白项是没有设定+1、-1的水平值,那么在实验中该如何具体操作呢,我采用的是SARS软件进行设计,那么实验设计好后遇到空白项的+1、-1该怎么弄呢?什么都不加么??还有空白项安排的位置有影响么?3、我做的是培养基优化,目前共有8种因素准备做PB,那么做完了PB,确定了显著因素,该如何设计最陡爬坡呢?是不是也需要相关软件来进行试验设计的呢?第一,你的是8个因素,直接做RSM,不可取,建议先用PB筛选主效应因素。
至于SA,并不是每个PB后都必须的,要看你的实验结果,也就是预测和实验区域的吻合情况了。
第二,8个因素,做12runs的PB,刚好有四个空列。
空列,也就是虚拟的,可以权当不存在,它只是在分析中用来估算误差的。
第三,先做好PB。
至于SA,用手算就可以了。
呵呵,很简单的。
看样子你看了很多文献,里面都应该有计算公式的。
哈哈,我这里到时有一些试验数据。
PB设计如果用SAS(应该这样写是对的哦)就会出现上面说的空白项现象。
建议使用minitab、JMP等,这些都不会出现空白项的。
PB设计是筛选重要影响因子的,从众多因子挑出重要的,舍弃不重要的(统计学上说,就是有显著影响的因素)。
因此,在逻辑上是有必要进行的。
如果还有什么问题继续提问。
高低水平的设置没有定式,无需过分遵从1.25倍这个定式。
总体上说,如果一个水平范围内,因素较为显著,可适当缩小范围(具体范围应该合理,举例说,但不一定合理:如果以菌体量最大为望目值时,温度是一个显著性影响因素(p<0.05),现研究范围为37-38℃;那你在缩小范围为37.5-37.9℃,这个就没有必要了。
生物制药中的细胞培养技术优化策略

生物制药中的细胞培养技术优化策略随着生物技术的不断发展和应用,生物制药逐渐成为医药行业的重要领域。
在生物制药的生产过程中,细胞培养技术起到了关键的作用。
细胞培养技术的优化是提高生物制药产量和质量的关键策略之一。
本文将讨论生物制药中的细胞培养技术优化策略。
一、培养基的优化培养基是细胞培养的基础,影响着细胞的生长、代谢和产物表达等。
优化培养基的配方,可以提高细胞的生长速度和细胞代谢产物质量。
对于生物制药中的细胞培养,常见的培养基包括基础培养基、补充物和调节因子。
优化培养基的方法包括成分调整、添加调节因子、调整培养基pH值和温度等。
同时,通过代谢物分析、细胞生长曲线等方法监测优化效果。
二、培养条件的优化培养条件的优化对细胞培养中细胞生长和代谢产物的表达具有重要影响。
其中包括温度、pH值、溶解氧浓度、营养物浓度、搅拌速率等。
温度是影响细胞生长的主要因素之一,不同类型的细胞对温度的要求不同。
细胞培养的pH值控制在合适的范围内,可以维持细胞对环境的适应性。
溶解氧浓度是细胞代谢活性的重要参数,通过调整搅拌速率、气体供应等方式可以实现优化。
此外,营养物浓度也是细胞生长和代谢的关键因素,通过浓度的调整可以控制产品产量。
三、细胞的种植密度和培养器具的选择细胞的种植密度对细胞培养的效果有着重要影响。
种植密度过低,会导致生物制品产量偏低;种植密度过高,会导致细胞生长受限。
因此,选择合适的种植密度对于细胞培养的效果至关重要。
培养器具的选择也是影响细胞培养的重要因素。
常见的培养器具有罐瓶培养法、悬浮式培养法等,通过选择合适的培养器具可以提高细胞培养的效果。
四、转染和表达载体的优化在生物制药中,常用的是重组蛋白的产生。
因此,转染系统和表达载体的优化对于生物制药中的细胞培养技术至关重要。
转染系统的优化包括选择适合的转染方法、优化转染条件等。
表达载体的优化主要包括选择适合的表达载体、调整启动子和选择适合的选择标签等。
通过转染和表达载体的优化,可以提高目标蛋白的表达水平和产量。
培养基优化设计提升多拉菌素生物发酵水平
文章编号:1001-8689(2020)11-1121-12遗传育种与生物合成培养基优化设计提升多拉菌素生物发酵水平赵明霞1,2栗波1,2蔡子豪3薛佳韵3王泽建3梁剑光1,4,*(1 常熟理工学院生物与食品工程学院,常熟 215500;2 苏州大学医学部药学院,苏州 215123;3 华东理工大学生物反应器工程国家重点实验室,上海 200237;4 常州大学制药与生命科学学院,常州 213164)摘要:运用响应面法优化了多拉菌素生产菌的发酵培养基。
首先通过单因素实验发现正效应因子;接着采用Plackett-Burman(P-B)设计确定了黄豆饼粉、麦芽糊精和MgSO是影响多拉菌素产量的显著因素;然后利用最陡爬坡试验分别找到3个因4的最佳浓度配比。
筛选并优化得到了最适素的合理浓度范围;并进一步利用中心组合设计优化了黄豆饼粉、麦芽糊精和MgSO41.50g/L,基于此,效价达到了589.43mg/L,验证实验结果与模的培养基浓度为黄豆饼粉17.30g/L,麦芽糊精77.30g/L,MgSO4型预测基本吻合,优化后的培养基工艺能够提升多拉菌素发酵单位20.37%。
5L反应罐上发酵过程生理代谢参数变化表明:优化的培养基能够加促菌体的比生长速率,维持较高的氧消耗速率和产物合成速率,大幅度提升了多拉菌素的发酵生产效率。
关键词:响应面;多拉菌素;培养基优化;发酵中图分类号:R978.1 文献标志码:AImproving the biosynthesis of doramectin production by mutant strain Streptomyces avermitilis 3D-5 by optimizing fermentation mediumZhao Ming-xia1,2, Li Bo1,2, Cai Zi-hao3, Xue Jia-yun3, Wang Ze-jian3 and Liang Jian-guang1,4(1 School of Biological and Food Engneering, Changshu Institute of Technology, Changshu 215500; 2 College of Pharmaceutical Science, Soochow University, Suzhou 215123; 3 State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai Institute of Biomanufacturing Technology & Collaborative Innovation Center, Shanghai 200237;4 College of Pharmaceutical and Life Sciences, Changzhou University, Changzhou 213164)Abstract Objective The fermentation medium compositions for doramectin production by mutant strain Streptomyces avermitilis 3D-5 was optimized through response surface methodology (RSM). Methods Firstly, positive effect factors on doramectin production were found by the one-factor-at-a-time method, and then, soybean cake powder, maltodextrin and MgSOwere screened as the significant factors for doramectin biosynthesis with the Plackett-4Burman (P-B) design. Furthermore, the steepest ascent path was applied to investigate the optimal range of the mediumwas determined composition. Finally, the optimal combination ratio of soybean cake powder, maltodextrin and MgSO4by the Central composite design (CCD). Results Results showed that the doramectin yield rose up to 589.43mg/L,1.50g/L. The under the achieved compositions of soybean cake powder 17.30g/L, maltodextrin 77.30g/L, and MgSO4 verification experiment showed the doramectin yield was consistent with the model prediction (589.43mg/L), which was 20.37% higher than that of the original medium condition. Conclusion The fermentation process physiological收稿日期:2019-12-08基金项目:国家重点研发计划项目(No. 2017ZX07402003)作者简介:赵明霞,女,生于1990年,在读硕士研究生,主要研究方向为微生物制药,E-mail:*********************通讯作者,E-mail:*****************多拉菌素(doramectin)是新一代大环内酯类抗寄生虫药,由阿维链霉菌(Streptomyces avermitilis )突变株在含有前体(环己甲酸(cyclohexanec arboxylic acid ,CHC))的条件下合成的抗生素[1]。
生物工艺中的细胞培养技术优化方法探究
生物工艺中的细胞培养技术优化方法探究细胞培养是生物工艺中的重要环节,这个过程涉及到细胞的生长、分裂和产物的合成。
为了提高细胞培养的效率和产物的质量,科学家们一直在努力寻找优化方法。
本文将探讨几种常用的细胞培养技术优化方法,包括培养基优化、混合培养和生物反应器设计。
首先,培养基是支持细胞生长和产物合成的关键环境因素之一。
为了优化培养基,科学家们可以调整培养基的配方以提供充足的营养物质。
例如,通过添加更多的氨基酸、糖类和微量元素,可以提供更多的能量和营养,促进细胞生长。
此外,适当调整pH值和氧气浓度也可以改善培养条件。
通过优化培养基,可以提高细胞的生存率和产物的产量。
其次,混合培养是一种常见的提高细胞培养效率的方法。
混合培养通过搅拌培养基,促进培养基中养分和氧气的均匀分布,避免细胞聚集和死亡区域的产生。
这种方法不仅可以增加细胞的生存率,还可以提高产物的合成效率。
此外,混合也可以用于细胞悬浮培养和固定化培养中,促进细胞与培养基的接触,提高细胞的生长速率和产物的产量。
最后,生物反应器的设计对细胞培养技术的优化也起着至关重要的作用。
生物反应器是一种可控制培养环境的设备,可以调节温度、pH值、氧气浓度等参数。
为了优化细胞培养过程,科学家们可以设计不同类型的生物反应器,如批量培养反应器、连续培养反应器和滚筒式培养反应器。
这些不同类型的反应器有不同的特点和适用范围,可以根据实际需要选择合适的反应器进行细胞培养。
除了上述提到的方法,还有其他一些可供选择的细胞培养技术优化方法,如温度控制、营养物料补给和细胞分离等。
细胞培养技术的优化是一个复杂的过程,需要结合实际情况和具体要求进行综合考虑和优化设计。
综上所述,生物工艺中的细胞培养技术优化方法是提高细胞培养效率和产物质量的关键环节。
通过优化培养基、混合培养和设计生物反应器,可以有效地提高细胞的生长和产物的合成效率。
未来,随着科学技术的不断进步和发展,相信会有更多的技术方法被引入到细胞培养技术的优化中,为生物工艺领域的发展做出更大的贡献。
枯草芽孢杆菌培养基优化
形、凸起、湿润。
枯草芽孢杆菌在培养过程中可产生多种代谢产物,如抗菌物质、酶等, 这些代谢产物具有潜在的商业价值。
03
培养基成分对枯草芽孢杆菌生长 的影响
碳源对枯草芽孢杆菌生长的影响
氮源是培养基中重要的营养成分之一, 对枯草芽孢杆菌的生长和代谢具有重要
影响。
常用的氮源包括有机氮源和无机氮源, 其中有机氮源如蛋白胨、酵母粉等可以 提供丰富的营养物质,促进枯草芽孢杆 菌的生长,而无机氮源如硝酸盐、氨盐
等则对其生长作用有限。
在优化培养基时,需要选择适当的氮源 及其浓度,以获得最佳的生长效果。
实验操作
根据因素和水平数量,选择合适的均匀表 ,确保每个实验组合都包含所有因素和水 平,且每个水平的出现次数相同。
数据处理
根据均匀表进行实验操作,记录每个组合 下的枯草芽孢杆菌生长情况。
分析实验数据,找出最优的培养基组合。
05
培养基优化实验结果分析
正交试验设计结果分析
• 氮源种类:在正交试验中,不同氮源种类对枯草芽孢杆菌的生长和芽孢产量有显著影响。其中,牛肉膏、蛋白 胨和尿素为较优的氮源,牛肉膏与蛋白胨的组合或牛肉膏与尿素的组合为最佳氮源。
生长因子对枯草芽孢杆菌生长的影响
生长因子是促进微生物生长和代谢的一类微量营养成分。
不同的生长因子对枯草芽孢杆菌的生长和代谢具有不同的作用,如维生素B1可以促进其生 长和产酶,而其他一些生长因子则对其生长和代谢没有明显影响。
在优化培养基时,需要添加适量的生长因子,以促进枯草芽孢杆菌的生长和代谢。
培养基pH值对枯草芽孢杆菌生长的影响
实验四大肠杆菌发酵培养基的优化ppt课件
假设某一要素k3或者k1 最大,那么阐明所选择 的该要素的程度范围不适宜, 如:对于要素C,k3 最大,阐明要素程度表中所设计的最高程度0.6% 不 一定为最正确。假设该要素的R值较大,影响较显著, 那么必需进展反复实验或对照实验。
(X1+X2+X3)/3 (X4+X5+X6)/3 (X7+X8+X9)/3
K最大- K最小B12 3 1 2 3 1 2 3
(X1+X4+X7)/3 (X2+X5+X8)/3 (X3+X6+X9)/3
K最大- K最小
C
1 2 3 3 1 2 2 3 1
(X1+X5+X9)/3 (X2+X6+X7)/3 (X3+X4+X8)/3
的次数相等 ❖ 任何两列中各横行组成的数字对,包含着一
切能够的数字对,且各种数字对出现的次数 相等
❖ 4.实验的根本步骤
❖ 〔1〕明确义务 确定目的
❖ 〔2〕制定要素程度表
❖ 1〕确定要素〔A、B、C……〕
❖ 2〕选择要素的变化范围
❖ 3〕确定要素程度数
❖ 4〕制定要素程度表
要素程度 A淀粉/% B黄豆饼粉 C蛋白胨
❖ 1.单要素法 ❖ 2.正交实验法 ❖ 3.均匀实验设计
三、正交实验法
❖ 1.概念 ❖ 利用曾经设计好的表格--正交表--来安排实验
并进展数据分析的一种方法。 ❖ 它是从全面实验中挑选出部分有代表性的点
进展实验,这些有代表性的点具备了“均匀 分散,齐整可比〞的特点,是一种高效率、 快速、经济的实验设计方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
JournalofIndustrialMicrobiology&Biotechnology(1999)23,456–475
Fermentationmediumperformance
MKennedyandDKrouse
Fermentationmediumperformance
Fermentationmediumperformance
MKennedyandDKrouse
Fermentationmediumperformance
Fermentationmediumperformance
MKennedyandDKrouse
Fermentationmediumperformance
Fermentationmediumperformance
MKennedyandDKrouse
Fermentationmediumperformance
Fermentationmediumperformance
MKennedyandDKrouse
Fermentationmediumperformance
Fermentationmediumperformance
MKennedyandDKrouse
Fermentationmediumperformance
Fermentationmediumperformance
MKennedyandDKrouse
Fermentationmediumperformance
Fermentationmediumperformance
MKennedyandDKrouse
Fermentationmediumperformance
Fermentationmediumperformance
MKennedyandDKrouse
Fermentationmediumperformance
Fermentationmediumperformance
MKennedyandDKrouse
