置换反应的基本概念
置换反应

置换反应.txt逆风的方向,更适合飞翔。我不怕万人阻挡,只怕自己投降。你发怒一分钟,便失去60分钟的幸福。忙碌是一种幸福,让我们没时间体会痛苦;奔波是一种快乐,让我们真实地感受生活;疲惫是一种享受,让我们无暇空虚。生活就像"呼吸""呼"是为出一口气,"吸"是为争一口气。、根据反应环境分类 根据反应环境的类别,置换反应有以下2种情况: (1)干态置换 在加热或高温条件下固体与固态或固体与气体发生的置换反应。 (2)湿态置换 在水溶液中进行的置换反应。 ①金属跟酸的置换 是金属原子与酸溶液中氢离子之间的反应。 要特别注意不能用浓硫酸,硝酸,它们有强氧化性,先将金属氧化成对应氧化物,氧化物再溶于酸中,然后继续氧化,继续溶解,反应得以继续 Zn+2HCl====ZnCl2+H2↑ Zn+H2SO4===ZnSO4+H2↑ 2Al+3H2SO4(稀)====Al2(SO4)3+3H2↑ 2.金属跟盐溶液的置换 是金属原子跟盐溶液中较不活动金属的阳离子发生置换。如: Cu+Hg(NO3)2====Hg+Cu(NO3)2 二、根据元素性质分类 按元素的性质划分,金属与非金属单质间的置换。 1、金属单质置换金属单质 2Al+Fe2O3=高温=Al2O3+2Fe (铝热反应。Al还可与V2O5、CrO3、WO3、MnO2等发生置换) Fe+CuSO4=FeSO4+Cu 2、金属单质置换非金属单质 Zn+2HCl=H2↑+ZnCl2 2Na+2H2O=2NaOH+H2 ↑ 2Mg+CO2=点燃=2MgO+C 3Fe+4H2O(g)=高温=Fe3O4+4H2 3、非金属单质置换金属单质 H2+CuO=Δ=Cu+H2O C+FeO=Δ=Fe+CO↑ Si+2FeO=Δ=2Fe+SiO2 C+2CuO=Δ=2Cu+CO2↑ 4、非金属单质置换非金属单质 2F2+2H2O=4HF+O2 2C+SiO2=Si+2CO C+H2O=CO+H2 2H2+SiCl4=Si+4HCl Cl2+2NaBr=Br2+2NaCl O2+2H2S=2S↓+2H2O 三、根据元素周期表中位置分类 按元素在周期表的位置划分,同族元素单质间的置换与不同族元素单质间的置换。 1、同主族元素单质间的置换 Na+KCl=高温=NaCl+K↑ (一般是774℃) 2Na+2H2O=2NaOH+H2↑ 2H2S+O2=2S+2H2O 2C+SiO2=Si+2CO↑ F2+2HCl=2HF+Cl2 2、不同主族元素单质间的置换 Mg+2HCl=MgCl2+H2↑ 2Mg+CO2=2MgO+C 2Al+6HCl=2AlCl3+3H2↑ 2F2+2H2O=4HF+O2 C+H2O(g)==高温==CO+H2 2H2+SiCl4=Si+4HCl H2S+Cl2=S+2HCl 3Cl2+8NH3=6NH4Cl+N2 4NH3+3O2==点燃==2N2+6H2O (氨气在纯氧中燃烧) 3、主族元素单质置换副族元素的单质 H2+CuO=Cu+H2O 2Al+Fe2O3=Al2O3+2Fe C+CuO=Cu+CO 2Al+3Hg2+=2Al3++3Hg 4Na+TiCl4=4NaCl+Ti 4、副族元素的单质置换主族元素单质 3Fe+4H2O(g)==加热==Fe3O4+4H2 Zn+2H+=Zn2++H2 5、副族元素的单质置换副族元素的单质 Fe+CuSO4=FeSO4+Cu 四、根据物质类别分类 按物质类别划分,单质与氧化物间的置换和单质与非氧化物间的置换。 1、单质与氧化物发生置换反应 2Na+2H2O=2NaOH+H2↑ 2Mg+CO2=2MgO+C 3Fe+4H2O=Fe3O4+4H2 H2+CuO=Cu+H2O C+FeO=高温=Fe+CO↑ 2F2+2H2O=4HF+O2 2C+SiO2=Si+2CO↑ 2Al+Fe2O3=Al2O3+2Fe C+H2O(g)=高温=CO+H2 Si+2FeO=2Fe+SiO2 3H2+Fe2O3=Δ2Fe+3H2O 2、单质与非氧化物发生置换反应 2H2+SiCl4=Si+4HCl H2S+Cl2=S+2HCl 3Cl2+8NH3=6NH4Cl+N2 4NH3+3O2=2N2+6H2O Mg+2HCl=MgCl2+H2 2Al+6HCl=2AlCl3+3H2 湿态置换遵守金属活动性顺序。 置换反应一定为氧化还原反应,氧化还原反应不一定为置换反应。 另外需要注意的是置换反应是根据金属活泼性顺序表发生的。 五、金属活动性顺序表 全部的 Cs、 Rb、 K、 Ra 、Ba 、Sr、 Ca、 Na 、Li、Ac、 La、 Ce、 Pr 、Nd 、Pm 、Sm 铯、 铷、 钾、镭、 钡、 锶、 钙、 钠、锂、锕、 镧、 铈、 镨、 钕、 钷、 钐、 Eu、Gd 、Tb 、Y 、Mg 、Dy、 Am 、Ho、 Er 、Tm 、Yb、 Lu 、 (H)、 Sc、 Pu 、Th 、Np 、Be 铕、 钆、 铽、 钇、 镁、 镅、 镝、 钬、 铒、 铥、 镱、 镥 (氢)、钪、 钚、 钍、 镎、铍、 U、 Hf 、Al 、Ti 、Zr 、V 、Mn、 Nb、 Zn、 Cr 、Ga 、Fe 、Cd 、In 、Tl 、Co 铀、铪、铝、 钛、锆、 钒、锰、 铌、 锌、 铬、 镓、 铁、 镉、 铟、铊、 钴、 Ni、 Mo、 Sn 、Pb 、(D2)、 (H2)、 Cu、 Tc、 Po、 Hg 、Ag、 Rh 、Pd 、Pt 、Au 镍、钼、 锡、 铅、(氘分子)(氢分子)、铜、 锝、 钋、 汞、 银、 铑、 钯、 铂、 金 初中要求掌握的 1.钾(K) 2.钙(Ca) 3.钠(Na) 4.镁(Mg) 5.铝(Al) 6.锌(Zn) 7.铁(Fe) 8.锡(Sn) 9.铅(Pb) 10.氢(H) 11.铜(Cu) 12.汞(Hg) 13.银(Ag) 14.铂(Pt) 15.金(Au) 其中10号氢是过渡元素,它前面的可以置换出氢,它后面的则不可以.也就是说,氢前面的可以和 酸反应生成 氢气,而氢后面的基本不和酸反应,就算反应也不生成氢气 编辑本段置换反应原则 1.一种金属可以置换出没有它活泼的金属(在非金属单质中也可使用这一原则) 2.在氢元素之前的金属元素,其物质可与酸发生置换反应,之后的不可反应(另:在金属活泼性前3的金属可直接与水反应) 化学元素的活泼性,是指元素与其他物质反应的难易程度。越易和别的物质反应,元素越活泼。越难与其他物质反应,元素越不活泼,即越稳定。 如果认为,氮气不如氧气活泼,这是单质(或者说是分子)的活泼性,而不是元素的活泼性。化学中要注意区分这些概念。因为,元素活泼性和分子活泼性的成因是完全不同的。 对于氮气和氧气,氮气的活泼型低于氧气的活泼性,本质是每个氮气分子中有三个氮氮键,加起来键能很高,所以氮分子中的氮原子结合得很牢固,其间的化学键不易断裂,导致不易发生原子重组(化学反应是原子重新组合的过程),所以不易反应,活泼性低。而氧分子中只有两个氧氧键,加起来键能比较低,所以易反应。当然,这也与氧元素的易得电子的性质有关联。但是,分子的活泼性,主要是看键能大小。(到了大学,也可以用分子轨道理论来解释,通过比较键级,从而比较分子的稳定性) 对于元素的活泼性,我们就主要考虑元素原子的最外层电子的排布情况。在这里,我也曾有过误区,现在明白了。原子最外层电子数不超过八(除第一周期外),最外层电子少于四(尤其是只有一个或两个电子时),易失电子,活泼;最外层电子大于四(尤其是有六个或七个电子),易得电子,同样活泼;而最外层电子为四或接近四时,不易得失电子,不活泼;最外层电子为八(第一周期,最外层电子为2)的元素(即稀有气体:氦氖氩氪氙氡),最稳定,组成惰性气体一族,因为不易一下失掉八个电子,也不易再得电子(因为得的电子填充到下一层,整体能量将增高,而物质要稳定是趋向于能量最低的状态,即能量最低原理)。 不要迷信金属活动性顺序表,那只是对于金属元素,而且过渡元素的不同价态还没能够考虑进去。 编辑本段金属活动顺序背诵口诀 钾钙钠镁铝,锌铁锡铅氢,铜汞银铂金。 (嫁给那美女,喜帖吸钱情,铜汞一百斤)
卤素置换反应

反应条件
反应通常在光照或加热条件下进行,无需催化 剂。
实例
如溴与乙醇反应,生成溴乙烷和水。
碘甲烷制备中碘置换甲基实例
反应原理
碘与甲基化合物在催化剂作用下发生置换反应,生成碘甲烷和相 应的卤化物。
反应条件
反应通常在加热条件下进行,需要使用特定的催化剂。
实例
如碘与甲基氯化物反应,生成碘甲烷和氯化物。
05
卤素置换反应机理
离子交换机理
卤素离子与金属离子之间的交换
在卤素置换反应中,卤素离子(如Cl-、Br-、I-等)可以与金属离子发生交换, 生成新的金属卤化物和另一种卤素离子。这种交换过程通常涉及金属离子的配位 和卤素离子的亲核攻击。
卤素离子与阴离子之间的交换
除了与金属离子的交换外,卤素离子还可以与其他阴离子发生交换反应。这种反 应通常涉及卤素离子的亲电性和阴离子的亲核性,生成新的卤化物和另一种阴离 子。
反应速率加快。
对于纯液体或固体反应物,由于其浓度可视为常数,因此改变
03
其用量不会显著影响反应速率。
温度对反应速率影响
温度升高,分子热运动加剧, 单位体积内活化分子百分数增 加,有效碰撞几率增加,反应 速率加快。
一般来说,温度每升高10℃, 反应速率大约增加2~4倍。
不同的化学反应,其反应速率 受温度影响的程度可能不同。
通过优化反应条件,如温度、压力、 溶剂等,可以提高卤素置换反应的产 率和选择性,从而得到更纯净的产物 。
催化剂的应用
催化剂的应用可以提高卤素置换反应 的效率和选择性,例如使用金属催化 剂可以促进卤素与有机物的置换反应 。
06
实验操作与注意事项
实验仪器和试剂准备
实验仪器 试管
置换反应浅议
揭示本质,掌握规律置换反应浅议030600 榆次一中王爱忠置换反应是一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应。
虽说它是众多类反应中的一种,但无论在初中、还是高中化学教学中,都是一类重要的化学反应。
因此,深入这类反应的本质来研究它的反应规律,无疑会对置换反应的理解和掌握具有巨大裨益。
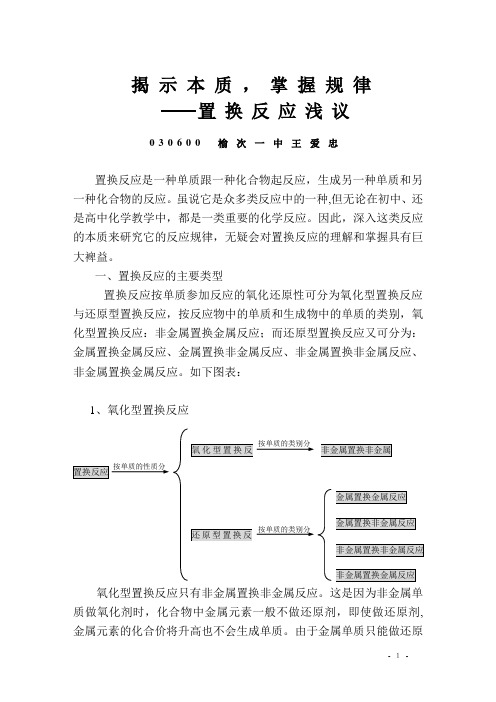
一、置换反应的主要类型置换反应按单质参加反应的氧化还原性可分为氧化型置换反应与还原型置换反应,按反应物中的单质和生成物中的单质的类别,氧化型置换反应:非金属置换金属反应;而还原型置换反应又可分为:金属置换金属反应、金属置换非金属反应、非金属置换非金属反应、非金属置换金属反应。
如下图表:1、氧化型置换反应氧化型置换反应只有非金属置换非金属反应。
这是因为非金属单质做氧化剂时,化合物中金属元素一般不做还原剂,即使做还原剂,金属元素的化合价将升高也不会生成单质。
由于金属单质只能做还原按单质的性质分按单质的类别分按单质的类别分剂,故不能进行各种氧化型置换。
氧化型置换反应主要是指活泼非金属与氧化物、氢化物、酸、盐、有机物反应而置换出不活泼的非金属。
如:3Cl 2+8NH 3 2N 2+6H 2OO 2 +2H 2S (g) 2S+2H 2O Cl 2+2NaBr(aq)2 8Cl 2 +C 10H 16(热)16HCl+10C 2、还原型置换反应 ( 1 )金属置换金属反应这类反应是活泼的金属单质与不活泼的金属氧化物、盐进行置换反应,生成新的金属单质。
如:8Al+3Fe 3O44A12O 3+9FeFe+CuSO 4(aq)FeSO 4+Cu( 2 )金属置换非金属反应这类反应是活泼金属单质与酸、氧化物、有机物进行置换,产生非金属单质。
如:Zn+H 2SO 4(aq) ZnSO 4+H 2↑2Na+2H 2O 2NaOH+H 2↑2Mg+CO 2 2MgO+C3Mg+2NH 3 Mg 3N 2+3H 2↑2Mg+SiO 2 10Na+2NaNO 3 6Na 2O+N 2↑Mg+2CH 3COOH(aq) Mg(CH 3COO)2+H 2↑C 6H 5OH (L)+2Na 2C 6H 5ONa+H 2↑( 3 )非金属置换非金属反应这类反应是指不活泼的非金属与盐、非金属氧化物等反应,置换出活泼非金属。
置换反应的离子方程式

置换反应的离子方程式置换反应是一种常见的化学反应类型,它涉及两种物质中的阳离子和阴离子之间的交换。
在这篇文档中,我们将探讨置换反应的离子方程式,了解这一重要概念。
置换反应的一般形式可以写作:A + BC → AB + C。
在这个反应中,A代表一个阳离子,BC代表一个化合物,B 代表这个化合物的阳离子,C代表这个化合物的阴离子。
通过置换反应,化合物AB和C的离子互换位置,生成新的化合物AB和C。
置换反应分为无水和水合置换反应。
无水置换反应发生在无水条件下,例如在固体中进行;水合反应发生在水溶液中。
在置换反应中,阳离子和阴离子的配对是非常重要的。
阳离子具有阳离子的性质,例如铵离子NH4+,钠离子Na+,钾离子K+等。
阴离子具有阴离子的性质,例如氢氧根离子OH-,硝酸根离子NO3-,氯离子Cl-,硫酸根离子SO4-等。
现在我们将通过几个示例来解释置换反应的离子方程式。
1. 单置换反应在单置换反应中,一个单一的阳离子与一个化合物的阴离子交换。
例如,铜和银的单置换反应可以写作:Cu + AgNO3 → Ag + Cu(NO3)2。
在这个反应中,CU和Ag+之间的离子发生置换,生成Ag和Cu(NO3)2。
2. 双置换反应双置换反应涉及两个化合物中的阳离子和阴离子的交换。
例如,氯化钠和硝酸银的双置换反应可以写作:NaCl + AgNO3 → AgCl + NaNO3。
在这个反应中,Na+和Ag+之间发生置换,生成AgCl和NaNO3。
3. 不同阳离子的置换在一个化合物中,有多种不同的阳离子可以发生置换反应。
例如,铜和铁的置换反应可以写作:CuSO4 + Fe → FeSO4 + Cu。
在这个反应中,Cu2+离子与Fe阳离子发生置换,生成FeSO4和Cu。
4. 水合置换反应水合置换反应发生在水溶液中,其中一个阳离子或一个阴离子的水合物被另一个离子所替代。
例如,铜和锌的水合置换反应可以写作:CuSO4 + Zn → ZnSO4 + Cu。
取代反应与置换反应的区别概念

取代反应与置换反应的区别概念英文版The Distinguishing Concepts of Substitution and Replacement ReactionsIn the realm of chemical reactions, substitution and replacement reactions often appear similar but differ significantly in their mechanisms and outcomes. Understanding these differences is crucial for a comprehensive grasp of chemistry.Substitution Reactions:Substitution reactions involve the replacement of one atom or group of atoms in a molecule by another atom or group. This process typically occurs when an atom or group in a molecule is attacked by a reagent, resulting in the displacement of the original atom or group. For example, in an alkyl halide reaction with a nucleophile, the halogen atom is replaced by the nucleophile, forming a new bond.Replacement Reactions:Replacement reactions, on the other hand, involve the displacement of one element by another in a compound. This type of reaction occurs when a more reactive element replaces a less reactive element in a compound. A classic example is the reaction between copper and silver nitrate, where copper replaces silver in the compound, forming copper nitrate and silver metal.Key Differences:Mechanism: Substitution reactions involve the displacement of an atom or group within a molecule, while replacement reactions involve the displacement of an entire element in a compound.Reactants: Substitution reactions typically involve a halogenated compound and a nucleophile, while replacement reactions involve two elements, one of which is more reactive than the other.Products: Substitution reactions result in the formation of a new bond between the reagent and the molecule, while replacement reactions result in the formation of new compounds with the displacement of an element.In summary, substitution and replacement reactions differ significantly in their mechanisms, reactants, and products. Understanding these distinctions is essential for a thorough understanding of chemistry and its applications.中文版取代反应与置换反应的区别概念在化学反应领域中,取代反应和置换反应虽然常常看起来相似,但它们的机制和结果却存在显著的不同。
高考氧化还原反应的常考点

高考氧化还原反应的常考点一、氧化还原反应的基本概念氧化还原反应是指在化学反应中,物质所含的电子数发生变化的反应。
通常,一个物质失去电子的过程称为氧化反应,而得到电子的过程则称为还原反应。
二、氧化数的表示方法氧化数是一个描述原子或分子电子分布的数值,常用来表示原子或分子的氧化状态。
在化合物中,正负化合价之和为零,单质化合价为零。
三、常见氧化还原反应类型及其实例1.置换反应:一种单质替代另一种单质的反应,如铁与稀硫酸反应生成硫酸亚铁和氢气。
2.分解反应:一种化合物分解成两种或多种单质的反应,如水分解为氢气和氧气。
3.歧化反应:一种物质中的同一种元素发生氧化和还原反应,如氯气与水反应生成盐酸和次氯酸。
4.归中反应:一种物质中的元素从高价变为低价或从低价变为高价的反应,如硫在氧气中燃烧生成二氧化硫。
四、氧化还原反应中的电子转移数计算在氧化还原反应中,电子转移数的计算是重要的考点。
电子转移数等于化合价变化数乘以参与反应的原子个数。
五、氧化还原反应在生活和工业领域的应用案例分析1.工业制硫酸:利用二氧化硫、氧气和水在高温下反应生成硫酸。
2.汽车尾气处理:汽车尾气中的一氧化碳和氮氧化物通过催化转化器转化为二氧化碳和水。
3.金属的冶炼:金属可以通过氧化还原反应从其化合物中被还原出来,如铁的冶炼。
六、歧化与归中反应特点及实例分析1.歧化反应:一种物质中的同一种元素发生氧化和还原反应,如氯气与水反应生成盐酸和次氯酸。
特点是在一个分子内部发生氧化还原反应。
2.归中反应:一种物质中的元素从高价变为低价或从低价变为高价的反应,如硫在氧气中燃烧生成二氧化硫。
特点是电子转移发生在同一元素之间。
七、酸碱条件对氧化还原反应的影响酸碱条件可以影响氧化还原反应的方向和速率。
在酸性条件下,氧化剂的氧化性通常增强,还原剂的还原性减弱;在碱性条件下则相反。
此外,酸碱条件还可能影响中间产物和最终产物的生成。
八、配平技巧和策略在配平氧化还原反应时,可以采用多种技巧和策略,如化合价升降守恒法、电子得失守恒法等。
镁的置换反应
镁的置换反应
(实用版)
目录
1.镁的置换反应的概念
2.镁的置换反应的类型
3.镁的置换反应的实例
4.镁的置换反应的规律
5.镁的置换反应的应用
正文
一、镁的置换反应的概念
镁的置换反应,是指镁与其他金属或非金属发生反应,取代对方原子或离子的位置,生成新的化合物的化学反应过程。
在置换反应中,镁通常表现出 +2 价。
二、镁的置换反应的类型
镁的置换反应主要有以下几种类型:
1.金属与金属盐的置换:如镁与铜盐溶液反应,生成金属铜和镁盐。
2.金属与非金属的置换:如镁与二氧化碳反应,生成碳和氧化镁。
3.金属离子间的置换:如镁离子与钙离子交换,生成钙金属和镁离子。
三、镁的置换反应的实例
以下是两个镁的置换反应的实例:
1.镁与硫酸铜溶液反应:在此反应中,镁取代了铜的位置,生成金属铜和硫酸镁。
反应方程式为:Mg + CuSO4 → Cu + MgSO4。
2.镁与盐酸反应:在此反应中,镁与氢离子发生置换,生成氢气和氯化镁。
反应方程式为:Mg + 2HCl → MgCl2 + H2。
四、镁的置换反应的规律
镁的置换反应遵循以下规律:
1.反应中,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来。
2.在金属离子间的置换反应中,电荷数大的离子容易将电荷数小的离子置换。
3.反应的速率与反应物的浓度有关,反应物浓度越高,反应速率越快。
五、镁的置换反应的应用
镁的置换反应在生产和生活中有广泛的应用,如金属提炼、腐蚀防护、电池制造等。
第1页共1页。
化学反应的基本类型和方程式
化学反应的基本类型和方程式化学反应是物质之间发生变化的过程,它是化学研究的核心内容之一。
化学反应根据反应的基本类型和方程式可以分为几类,包括单一置换反应、双替换反应、合成反应和分解反应等。
一、单一置换反应单一置换反应是指一个元素被另一个元素取代的反应,常用的表示方式是AB + C → AC + B。
这类反应中,C取代了化合物AB中的元素B,形成了新的化合物AC。
例如,2AgNO3 + Cu → 2Ag + Cu(NO3)2,铜取代了硝酸银中的银,生成了亚硝酸铜和银。
二、双替换反应双替换反应是指两个化合物中的阳离子和阴离子发生交换的反应,常用的表示方式是AB + CD → AD + CB。
这类反应常发生在水溶液中,生成沉淀或不溶于水的物质。
例如,NaCl + AgNO3 → NaNO3 + AgCl,氯化钠和硝酸银反应生成了硝酸钠和氯化银。
三、合成反应合成反应是指两种或多种物质结合形成单一化合物的反应,常用的表示方式是A + B → AB。
这类反应也被称为直接结合反应。
例如,C+ O2 → CO2,碳与氧气反应生成了二氧化碳。
四、分解反应分解反应是指一个复合物分解成两个或更多简单物质的反应,常用的表示方式是AB → A + B。
这类反应也被称为逆合成反应。
例如,2H2O → 2H2 + O2,水分解成氢气和氧气。
化学反应的方程式是用化学符号和化学式表示的。
在方程式中,反应物是位于箭头的左侧,而生成物则位于箭头的右侧。
方程式中的化学符号和化学式要准确无误,以确保反应的准确描述。
在编写方程式时,应考虑到反应物与生成物的摩尔比例。
除了以上基本类型的反应,还有其他特殊类型的化学反应,如氧化反应、还原反应、酸碱中和反应等。
这些反应对于化学领域的研究和应用都具有重要意义。
化学反应是化学领域中的基础概念,对于理解物质的性质和变化过程至关重要。
掌握化学反应的基本类型和方程式对于学习和应用化学都有着重要的意义。
通过研究和理解不同类型的反应,可以更好地理解和预测化学物质之间的相互作用,为化学研究和实践提供指导和参考。
置换反应
浩贤个性化教案学员姓名:年级:初三学校:凤城中学学科:化学课时:1小时教材版本:人教版课题名称:复习置换反应教师姓名:王老师授课时间:2011年1月21 日至教案期数:1101-2教学目标理解置换反应概念掌握置换反应重点难点重点:1理解并掌握置换反应的概念及分类2掌握置换反应原则3熟记金属活动顺序并熟练解题难点:金属活动顺序一、概念置换反应是无机化学反应的基本类型之一,指一种单质和一种化合物生成另一种单质和另一种化合物的反应,可表示为:A+BC→B+AC置换关系是指组成化合物的某种元素被组成单质的元素所替代。
二、分类(一)根据反应物分类(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)1、锌和稀硫酸反应:Zn + H2SO4 === ZnSO4 + H2↑2、镁和稀硫酸反应:Mg + H2SO4 === MgSO4 + H2↑3、铝和稀硫酸反应:2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑4、锌和稀盐酸反应:Zn + 2HCl === ZnCl2 + H2↑5、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑6、铝和稀盐酸反应:2Al + 6HCl === 2AlCl3 + 3H2↑1~6的现象:有气泡产生。
7、铁和稀盐酸反应:Fe + 2HCl === FeCl2 + H2↑8、铁和稀硫酸反应:Fe + H2SO4 === FeSO4 + H2↑7~8铁参加的置换反应显+2价,7~8的现象:有气泡产生,溶液由无色变成浅绿色。
要特别注意不能用浓硫酸,硝酸,它们有强氧化性,先将金属氧化成对应氧化物,氧化物再溶于酸中,然后继续氧化,继续溶解,反应得以继续(2)金属单质+ 盐(溶液)----- 另一种金属+ 另一种盐9、铁与硫酸铜反应:Fe+CuSO4 === Cu+FeSO4现象:铁条表面覆盖一层红色的物质,溶液由蓝色变成浅绿色。
(古代湿法制铜及"曾青得铁则化铜"指的是此反应)10、锌片放入硫酸铜溶液中:CuSO4 + Zn == ZnSO4 + Cu现象:锌片表面覆盖一层红色的物质,溶液由蓝色变成无色。
置换反应和酸溶解-概述说明以及解释
置换反应和酸溶解-概述说明以及解释1.引言1.1 概述置换反应和酸溶解是化学领域中两个重要的概念和过程。
置换反应是指发生在化学反应中原子或离子之间位置的改变,而酸溶解则是指酸溶液中物质被酸分子所溶解的过程。
在置换反应中,常常会发生原子或离子之间的位置重新排列,形成新的化合物。
这种化学变化可以是单一置换,即一个原子或离子被另一个原子或离子替代,也可以是双置换,即两个原子或离子之间相互交换位置。
置换反应的基本原理是原子或离子之间的化学键的重组,这使得新的化合物产生。
置换反应在生物化学、有机化学和无机化学等领域都有广泛的应用。
与置换反应不同,酸溶解是指当物质与酸溶液接触时,酸分子会与物质中的离子或分子发生反应,使其溶解在溶液中。
酸溶解的机制主要是酸分子的质子与物质中的阴离子或中性分子相互作用,形成离子或化合物。
酸溶解在许多化学反应和工业过程中都起着重要的作用,例如金属的腐蚀和矿石的提取等。
本文将重点介绍置换反应和酸溶解的定义、基本原理、类型以及实际应用。
通过对这两个概念和过程的深入理解,我们可以更好地理解化学反应的本质和机制,同时也能够应用于生活、科学研究和工业生产等方面。
最后,我们将总结置换反应和酸溶解的重要性,并展望未来在这些领域的发展和应用前景。
1.2文章结构文章结构部分的内容可以包括以下内容:文章结构部分主要介绍了整篇文章的组织和框架,以便读者更好地理解文章的内容和脉络。
本文主要包含以下几个部分:第一部分:引言在引言部分中,我们会对置换反应和酸溶解进行简要的概述,介绍它们的基本原理和应用。
第二部分:正文正文部分主要分为两个小节,分别介绍了置换反应和酸溶解。
2.1 置换反应在这一小节中,我们将详细解释置换反应的定义和基本原理。
首先,我们会介绍置换反应的概念,即通过原子或离子之间的交换来产生新的化合物。
然后,我们会列举不同类型的置换反应,并对其进行具体的说明和举例。
最后,我们还将探讨置换反应在实际应用中的重要性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
置换反应的基本概念
介绍
置换反应是化学中一种重要的反应类型,也被称为置换反应、置换反应或离子交换反应。
它是指化学物质之间发生的一种反应,其中一个离子或基团被替换成另一个离子或基团。
置换反应常见于无机化学和有机化学中,具有广泛的应用。
置换反应的基本原理
置换反应基于化学物质之间的相互作用和反应机制。
在置换反应中,通常涉及到两种化学物质,分别是底物(替换前)和产物(替换后)。
底物中的一个原子、离子或基团被另一个原子、离子或基团替代,从而形成产物。
置换反应可以有不同的类型和机制,包括离子置换反应、原子置换反应、自由基置换反应等。
离子置换反应
离子置换反应是最常见的一种置换反应类型,涉及到离子之间的相互作用和转化。
在离子置换反应中,一个离子被另一个离子取代,从而形成新的离子。
这种反应常见于溶液体系中,如溶液中的阴离子和阳离子之间的置换反应。
离子置换反应在工业上有广泛的应用,如水处理、电解和离子交换树脂。
离子置换反应的机理
离子置换反应的机理涉及到离子之间的相互作用和转化。
离子之间的置换反应往往涉及到离子溶液中的反应,其中溶剂可以是水或其他溶剂。
在离子置换反应中,离子的化学键被另一个离子的化学键替代,从而形成新的离子。
离子之间的置换反应可以受到多种因素的影响,包括离子浓度、溶液pH值、温度等。
离子置换反应的应用
离子置换反应具有广泛的应用,包括水处理、药物合成、金属提取等。
在水处理中,离子置换反应用于去除水中的有害离子,如铅离子、镉离子等。
在药物合成中,离子置换反应用于合成活性药物和化合物。
在金属提取中,离子置换反应用于从矿石中提取金属离子。
原子置换反应
原子置换反应是化学物质中原子替换的一种反应类型。
在原子置换反应中,一个原子被另一个原子替换,从而形成新的化学物质。
原子置换反应在无机化学和有机化学中广泛存在,包括氧化还原反应、酸碱中和反应等。
氧化还原反应
氧化还原反应是一种常见的原子置换反应,涉及到原子之间的电子转移。
在氧化还原反应中,一个物质被氧化,失去电子,而另一个物质被还原,获得电子。
这种反应可以导致原子之间的置换,从而形成新的化合物。
氧化还原反应在电化学、能源产生等领域有重要应用,如电池和燃料电池。
酸碱中和反应
酸碱中和反应是一种常见的原子置换反应,涉及到酸离子和碱离子之间的置换。
在酸碱中和反应中,酸离子和碱离子之间发生反应,形成水和盐。
这种反应在生活和工业中都有重要应用,如酸碱中和反应用于调节pH值、制备盐类化合物等。
自由基置换反应
自由基置换反应是一种有机反应,涉及到自由基之间的置换。
自由基是一种具有未配对电子的分子或原子,具有高度反应性。
在自由基置换反应中,一个自由基被另一个自由基替代,从而形成新的有机化合物。
自由基置换反应在有机合成、聚合反应等领域有重要应用。
自由基置换反应的机理
自由基置换反应的机理涉及到自由基之间的相互作用和转化。
自由基置换反应往往涉及到有机化合物中的反应,其中反应物可以是烃类、卤代烃等。
在自由基置换反应中,自由基之间的化学键被另一个自由基的化学键替代,从而形成新的有机化合物。
自由基之间的置换反应可以受到温度、光照等因素的影响。
自由基置换反应的应用
自由基置换反应在有机合成中具有广泛的应用,包括制备有机化合物、聚合反应等。
在有机合成中,自由基置换反应用于合成复杂的有机分子和天然产物。
在聚合反应中,自由基置换反应用于合成高分子材料和聚合物。
总结
置换反应是化学中一种重要的反应类型,涉及到化学物质之间的原子、离子或基团的置换。
在置换反应中,底物被替换成产物,从而形成新的化学物质。
置换反应涉及到离子置换反应、原子置换反应和自由基置换反应等不同类型。
离子置换反应在水处理、药物合成和金属提取中有广泛应用;原子置换反应包括氧化还原反应和酸碱中和反应,用于电化学、能源产生和pH调节等领域;自由基置换反应用于有机合成和聚合反应,用于制备复杂有机分子和高分子材料。
置换反应在化学和工业中具有重要的地位和应用前景。
