蔗糖的化学方程式
高二化学葡萄糖和蔗糖

2、糖的分类:
• 以水解状况进行分类:
单糖、二糖、多糖间转化关系
水解 水解
• 单糖:不能水解成更简单的糖 多糖 二糖 • 葡萄糖、果糖
缩聚
单糖
• 二糖:能水解,1mol水解产生2mol单糖 • 麦芽糖、蔗糖 • 多糖:1mol水解产生许多摩尔单糖 • 淀粉、纤维素
练习1
练习1
• 有关糖类物质的叙述中正确的是:D
2. 麦芽糖: C12H22O11(与蔗糖同分异构) (1)物理性质: ①白色晶体 ②易溶于水 ③有甜味(不及蔗糖) (2)化学性质: 还原性: 能发生银镜反应(分子中含有醛基) 还原性糖. 水解反应: 产物为葡萄糖一种.
二、蔗糖 麦芽糖:
●蔗糖与麦芽糖的比较:
蔗 糖 水解成 1 分 非还原性糖 二 子葡萄糖, 糖 (无-CHO) 1分子果糖
3、制法: 工业上淀粉催化水解法制取葡萄糖。 (C6H10O5)n+ nH2O 催化剂 n(C6H12O6) 淀粉 葡萄糖
◇果糖简介(最甜的天然糖)
与H2加成、酯化反应。 不能发生银镜反应及费林 反应。
分子式:C6H12O6 结构简式: CH2OHCHOHCHOHCHOHCOCH2OH 多羟基酮,是葡萄糖的同分异构体。
说明葡萄糖分子中有5个—OH,且分别连在5个C原子上
4、 葡萄糖分子被氧化,碳链并不断裂,而是生含6个C 原子的葡萄糖酸 说明葡萄糖分子中含有一个—CHO
葡萄糖的氧化反应:
⒈葡萄糖与银氨溶液反应: 【实验7-1】现象:在试管壁上有银镜形成 反应方程式: CH2OH(CHOH)4CHO+2 Ag(NH3)2OH 2Ag +CH2OH(CHOH)4COONH4 +3NH3 +H2O 该反应用于醛基的检验 用途:制镜工业和热水瓶胆镀银等。
(完整版)高中有机化学方程式总结
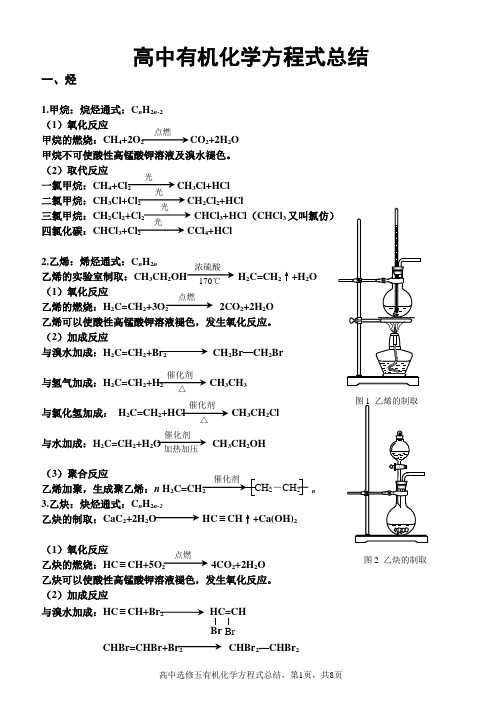
高中有机化学方程式总结一、烃1.甲烷:烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯:烯烃通式:C n H 2n乙烯的实验室制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2 n3.乙炔:炔烃通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBr点燃光光光光浓硫酸170℃ 点燃催化剂△催化剂加热加压 2-CH 2点燃图2 乙炔的制取Br 催化剂△与氢气加成:HC ≡CH+H 2 H 2C=CH2与氯化氢加成:HC ≡CH+HCl CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯:苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
十大浪漫的化学方程式

十大浪漫的化学方程式化学方程式是描述化学反应过程的一种方式,它以化学式的形式展示了反应物与生成物之间的关系。
虽然化学方程式通常被用来描述分子和原子的结构变化,但有些方程式却具有浪漫的意义。
下面将介绍十大浪漫的化学方程式,让我们一起来探索化学的浪漫之美。
1.H2O2 → 2H2O + O2这是氢过氧化物分解的方程式。
H2O2代表了氧化剂与还原剂的结合,通过分解反应,产生两份水和一份氧气。
在这个方程式中,水象征着纯洁和清新,而氧气代表着对于爱情的需求。
这样的方程式似乎在告诉我们,纯洁的爱情在不断被释放和增长。
2.C6H12O6 + 6O2 → 6CO2 + 6H2O这是葡萄糖和氧气之间的反应方程式,也是人体细胞呼吸的过程。
葡萄糖代表着能量和生命的源泉,而氧气则是支持人体正常运作的必要元素。
当葡萄糖与氧气相遇时,它们会共同转化为能量和水。
这个方程式暗示着两个人在一起,能够激发出更多的活力和生机。
3.NaCl + H2O → Na+ + Cl- + H2O这是盐和水混合的方程式。
当盐溶解在水中时,它们会分解成氯离子和钠离子,水则起到了溶剂的作用。
这个方程式可以让我们想象到两个人的关系,就像两个离子在水中融合。
通过彼此的存在,两个人能够相互支持和滋润。
4.Fe2O3 + 2Al → 2Fe + Al2O3这是铁红石和铝粉之间的反应方程式,也是热反应的代表。
当铝粉与铁红石混合时,它们会发生剧烈的反应,产生铁和氧化铝。
这个方程式似乎在告诉我们,爱情常常是火热和激烈的。
只有通过相互的碰撞和摩擦,两个人才能发生化学反应,释放出更多的热情和能量。
5.C12H22O11 + H2O → 2C6H12O6这是蔗糖和水反应生成葡萄糖的方程式。
蔗糖是种甜味物质,而水是无色无味的。
当它们结合在一起时,蔗糖分解成两份葡萄糖。
这个方程式彰显了甜蜜和爱情之间的联系。
有时候,爱情就像蔗糖一样甜美,只要遇到适当的条件,它就会转化为更多的爱。
高一化学必修二化学方程式

人教版 化学必修二必背化学方程式 1、氯水与饱和溴化钠反应:Cl 2+2NaBr===Br 2+2NaCl 2、氯水与饱和碘化钠溶液反应:Cl 2+2NaI===I 2+2NaCl3、溴水与碘化钠溶液反应:Br 2+2NaI===I 2+2NaBr4、Mg 与H 2O 反应:Mg+2H 2O === MgOH 2+H 2↑5、BaOH 28H 2O 与NH 4Cl 的反应 : BaOH 2·8H 2O+2NH 4Cl==BaCl 2+2NH 3↑+10H 2O6、原电池原理 典型的原电池Zn-Cu 原电池负极锌:Zn-2e -===Zn 2+氧化反应 正极铜:2H ++2e -===H 2↑还原反应电子流动方向:由锌经过外电路流向铜; 总反应离子方程式:Zn+2H +===Zn 2++H 2↑ 7、H 2O 2在催化剂作用下受热分解: 2H 2O 2 催化剂 △2H 2O+O 2↑ 8、高炉炼铁:2C + O 2 === 2CO Fe 2O 3 + 3CO ==2Fe + 3CO 29、甲烷的主要化学性质1氧化反应与O 2的反应:CH 4g+2O 2g −−→−点燃 CO 2g+2H 2Ol 2取代反应与Cl 2在光照条件下的反应,生成四种不同的取代物:10、乙烯的主要化学性质1氧化反应与O 2的反应:C 2H 4+3O 2 −−→−点燃 2CO 2+2H 2O 2加成反应与Br 2的反应:3乙烯还可以和氢气、氯化氢、水等发生加成反应:CH 2=CH 2 + H 2CH 3CH 3 CH 2=CH 2+HCl CH 3CH 2Cl 一氯乙烷CH 2=CH 2+H 2OCH 3CH 2OH 乙醇 4聚合反应:乙烯制聚乙烯①氯乙烯制聚氯乙烯②11、苯的主要化学性质: 1氧化反应与O 2的反应:2C 6H 6+15O 2 −−→−点燃 12CO 2+6H 2O 2取代反应: ① 与Br 2的反应: + Br 2−−→−3FeBr + HBr ② 苯与硝酸用HONO 2表示发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯;反应方程式:+ HONO 2浓硫酸△ + H 2O3加成反应 用镍做催化剂,苯与氢发生加成反应: + 3H 2 −−→−催化剂12、乙醇的重要化学性质 1乙醇与金属钠的反应:2CH 3CH 2OH+2Na2CH 3CH 2ONa+H 2↑2乙醇的氧化反应 ①乙醇的燃烧: CH 3CH 2OH+3O 2 −−→−点燃 2CO 2+3H 2O ②乙醇的催化氧化反应: 2CH 3CH 2OH+O 2 −−→−Ag Cu 或 2CH 3CHO+2H 2O ③乙醇在常温下的氧化反应: CH 3CH 2OH −−−−−−−−→−或酸性重铬酸钾溶液酸性4KMnO CH 3COOH 12、乙酸的重要化学性质1乙酸的酸性 ①乙酸能使紫色石蕊试液变红 ②乙酸能与碳酸盐反应,生成二氧化碳气体利用乙酸的酸性,可以用乙酸来除去水垢主要成分是CaCO 3:NO 22CH 3COOH+CaCO 3CH 3COO 2Ca+H 2O+CO 2↑乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:2CH 3COOH+Na 2CO 32CH 3COONa+H 2O+CO 2↑上述两个反应都可以证明乙酸的酸性比碳酸的酸性强;2乙酸的酯化反应 ①反应原理与乙醇的反应:乙酸与乙醇反应的主要产物乙酸乙酯是一种无色、有香味、密度比水的小、不溶于水的油状液体;13、糖类 油脂 蛋白质①蔗糖水解反应:C 12H 22O 11+H 2O →C 6H 12O 6+C 6H 12O 6②淀粉纤维素水解反应:③油脂的重要化学性质——水解反应: a 油脂在酸性条件下的水解: 油脂+H 2O −→−酸甘油+高级脂肪酸b 油脂在碱性条件下的水解又叫皂化反应:油脂+H 2O −→−碱甘油+高级脂肪酸蛋白质+H 2O −−→−酶等各种氨基酸14、HgO 受热分解:2HgO 2Hg + O 2↑ Ag 2O 受热分解:2Ag 2O4Ag + O 2↑ 15、CO 还原Fe 2O 3:Fe 2O 3 + 3CO 高温 2Fe +3CO 2 高炉炼铁① C 还原ZnO :2 ZnO + C 高温 2 Zn +CO 2↑ ② C 还原MgO : MgO +C 高温 Mg + CO ↑ ③ Al 还原Fe 2O 3铝热反应: Fe 2O 3 + 2Al 高温 2Fe + Al 2O 3④ Fe 还原CuSO 4: CuSO 4 + Fe ==== FeSO 4 +Cu 湿法炼铜16、电解①电解NaCl:2NaCl熔融电解2Na +Cl2↑②电解MgCl2: MgCl2熔融电解Mg +Cl2↑③电解Al2O3: 2Al2O3熔融电解冰晶石 4Al + 3O2↑。
糖类(教案)

第四节基本营养物质第1课时糖类课程标准核心素养1.认识糖类的组成、结构及其主要性质和应用。
2.能够设计实验检验淀粉水解的产物及水解程度。
3.结合实例认识葡萄糖、蔗糖、淀粉等,认识有机化合物在生产、生活中的重要应用。
1.宏观辨识与微观探析:能从葡萄糖的微观结构出发,利用官能团解释葡萄糖的化学性质。
2.科学探究与创新意识:能根据教材给出的问题,设计简单的实验方案探究葡萄糖的性质。
知识点一糖类的组成及分类葡萄糖1.基本营养物质食物中的营养物质主要包括糖类、油脂、蛋白质、维生素、无机盐和水。
2.糖类的组成糖类是由C、H、O三种元素组成的一类有机化合物,其组成大多符合C n(H2O)m的通式,因此也被称为碳水化合物。
3.糖类的分类类别特点代表物代表物的分子式是否互为同分异构体单糖不能水解为更简单的糖分子葡萄糖、果糖C6H12O6是二糖水解后能生成两分子单糖麦芽糖、乳糖和蔗糖C12H22O11是多糖水解后能生成多分子单糖淀粉、纤维素(C6H10O5)n否(1)物理性质及分子结构葡萄糖是一种有甜味的无色晶体,能溶于水,其结构简式为CH2OH(CHOH)4CHO。
(2)特征反应实验操作实验现象实验结论试管中出现砖红色沉淀葡萄糖具有还原性试管壁上形成光亮的银镜1.组成符合C n(H2O)m通式的有机化合物是否一定属于糖类?提示:否;乙酸(CH3COOH)的分子式为C2H4O2,也符合C n(H2O)m的通式,但不属于糖类。
2.丧失体内自我调节血糖水平的人会得糖尿病,病人的尿液中含有葡萄糖,怎样通过实验检验一个病人是否患有糖尿病?提示:用NaOH溶液和CuSO4溶液配成新制的Cu(OH)2,再加入某病人的尿液,微热,若观察到有砖红色沉淀生成,说明该病人患有糖尿病。
1.糖类是生命的基础能源,下列关于糖类的说法中,正确的是()A.糖类都可以水解B.糖类是具有甜味的物质C.糖类都含有C、H、O元素D.糖类都符合C n(H2O)m的通式解析:选C。
(完整版)高中有机化学方程式总结

高中有机化学方程式总结一、烃1.甲烷:烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯:烯烃通式:C n H 2n乙烯的实验室制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2 n3.乙炔:炔烃通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBr点燃光光光光浓硫酸170℃ 点燃催化剂△催化剂加热加压 2-CH 2点燃图2 乙炔的制取Br 催化剂△与氢气加成:HC ≡CH+H 2 H 2C=CH2与氯化氢加成:HC ≡CH+HCl CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯:苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
有机化学基础化学方程式

有机反应方程式一烷烃1.甲烷燃烧: 2·P34CH4 +2O2CO2 + 2H2O2.甲烷与氯气在光照条件下反应2·P56CH4 + 3Cl2CHCl3+ 3HClCH4 + 4Cl2CCl4 + 4HCl CH4 + 2Cl2CH2Cl2 + 2HCl3.甲烷在一定条件下可被氧化成一氧化碳和氢气2·P562CH4+O22CO+4H24.甲烷高温分解2·P56 CH4 C + 2H2二烯烃1.乙烯与溴的四氯化碳溶液反应2·P60 CH2=CH2 + Br2 CH2BrCH2Br3.乙烯与水反应2·P60 CH2=CH2 + H2O CH3CH2OH4.乙烯的催化氧化制乙醛2·P77 2CH2=CH2 + O22CH3CHO5.乙烯的催化氧化制乙酸2·P77 CH2=CH2 + O22CH3COOH6.乙烯的催化加氢2·P64 CH2=CH2 +H2CH3CH38.乙烯的加聚反应2·P78 n CH2=CH29.乙烯与氯气在一定条件下生成氯乙烯3·P46 CH2=CH2 + Cl2CH2=CHCl+HCl10.乙烯与氯气加成3·P46 CH2=CH2 + Cl2 CH2ClCH2Cl12. 1—丁烯与氢气催化加成3·P47 CH2=CH2CH2CH3 +H2CH3CH2CH2CH313.环己烯催化加氢3·P49H2 +14. 1,3环己二烯催化加氢3·P492H2 +16. 1,3-丁二烯与溴在温度较低和较高时的反应3·P42CH2=CH—CH=CH2+Br2 CH2BrCH=CHCH2BrCH2=CH—CH=CH2+Br2CH2BrCHBrCH=CH2 17. 1,1—二氯乙烯加聚3·P47n CCl2=CH218.丙烯加聚3·P47n H2C=CHCH319. 2—甲基—1,3—丁二烯加聚3·P47n三炔烃1.乙炔燃烧2·P37 2C2H2 + 5O24CO2 + 2H2O2.乙炔与足量溴的四氯化碳溶液反应2·P60 CH≡CH + Br2 CHBr2CHBr23.乙炔与氢气催化加成3·P47 CH≡CH + 2H2 CH3CH34.乙炔制聚氯乙烯2·P60CH≡CH +HCl H2C=CHCl n H2C=CHCl四芳香烃1.苯的燃烧2·P62 2C6H6+15O212CO2 + 6H2O2.苯的催化加氢3·P49 + 3H23.苯与液溴催化反应3·P51 + Br2+ HBr4.苯的硝化反应3·P51 +HO-NO2+ H2O9.苯乙烯与溴的四氯化碳溶液反应3·P56+Br210.甲苯与浓硝酸、浓硫酸的混合酸1000C时获得三硝基甲苯3·P53+ 3HO—NO2 + 3H2O六、卤代烃1.氯乙烷在氢氧化钠水溶液中加热反应3·P64CH3CH2Br + NaOH CH3CH2OH + NaBr2.氯乙烷在氢氧化钠醇溶液中加热反应2·P63CH3CH2Br +NaOH CH2=CH2↑+ NaBr + H2O 4. 1—溴丙烷与氢氧化钾醇溶液共热3·P65CH3CH2 CH2Br +KOH CH3CH=CH2↑ + KBr + H2O —氯丙烷与氢氧化钠水溶液共热3·P65CH3CHClCH3 +NaOH CH3CHOHCH3+ NaCl6. 2—甲基—2—溴丁烷消去溴化氢3·P65七、醇类1.乙醇与钠反应3·P672CH3CH2OH + 2Na 2CH3CH2ONa + H2↑2.乙醇的燃烧2·P34 CH3CH2OH+3O22CO2+3H2O3.乙醇的催化氧化2·P662CH3CH2OH + O2 2CH3CHO + 2H2O4.乙醇制乙烯3·P69 CH3CH2OH CH2=CH2↑ + H2O5.乙醇制乙醚3·P69 2CH3CH2OH CH3CH2OCH2CH3 + H2O6.乙醇与红热的氧化铜反应3·P88CH3CH2OH+CuO CH3CHO+H2O7.浓硫酸、乙醇和溴化钠加热反应制溴乙烷3·P68C2H5OH+NaBr+H2SO4C2H5Br+NaHSO4 + H2O八、酚类1.苯酚与氢氧化钠反应3·P73 + NaOH + H2O2.苯酚与溴水反应3·P73+3Br2↓ + 3HBr九、醛类1.乙醛的催化加氢3·P80CH3CHO + H2CH3CH2OH2.乙醛的催化氧化2·P662CH3CHO + O22CH3COOH3.乙醛与银氨溶液反应3·P80CH3CHO + 2AgNH32OH CH3COONH4+ 2Ag↓ + 3NH3 + H2O4.乙醛与新制氢氧化铜反应3·P80CH3CHO + 2CuOH2 +NaOH CH3COONa + Cu2O↓ + 3H2O5.甲醛与苯酚制酚醛树脂3·P80十、羧酸1.乙酸与乙醇发生酯化反应2·P68CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O2.乙酸与碳酸钠反应2·P67 2CH3COOH+Na2CO3==2CH3COONa+H2O+CO2↑4.两分子乳酸脱去两分子水3·P862CH3CHOHCOOH7.甲酸与银氨溶液反应3·P84HCOOH+2AgNH32OH NH42 CO 3+ 2Ag↓ + 3NH3 + H2O8.甲酸与新制氢氧化铜反应3·P84HCOOH+2CuOH2 +2NaOH Na2 CO3+ Cu2O↓ + 3H2O9.甲酸与碳酸钠反应3·P842HCOOH+Na2CO32HCOONa+H2O+CO2↑十一、糖类1.葡萄糖燃烧2·P45 C6H12O6 + 6O26CO2 + 6H2O2.葡萄糖与乙酸完全酯化3·P91CH2OHCHOH4CHO+5CH3COOH CH3COOCH2CHOOCCH3CHO+5H2O3.葡萄糖与银氨溶液反应3·P91CH2OHCHOH4CHO + 2AgNH32OH CH2OHCHOH4COONH4+ 2Ag↓ + 3NH3↑ + H2O4.葡萄糖与新制氢氧化铜反应2·P71CH2OHCHOH4CHO + 2CuOH2 +NaOH CH2OHCHOH4COONa + Cu2O↓ + 3H2O5.葡萄糖被还原为直链己六醇3·P91CH2OHCHOH4 CHO + H2CH2OHCHOH4CH2OH6.葡萄糖在酒化酶作用下获得乙醇2·P72C6H12O62CH3CH2OH + 2CO2↑7.蔗糖水解3·P93 C12H22O11蔗糖+ H2O C6H12O6葡萄糖+ C6H12O6果糖8.麦芽糖水解2·P71 C12H22O11麦芽糖+ H2O 2C6H12O6葡萄糖9.淀粉水解2·P47 C6H10O5n淀粉+ nH2O n C6H12O6葡萄糖10.纤维素水解2·P45C6H10O5n纤维素+ nH2O n C6H12O6葡萄糖11.纤维素燃烧2·P46 C6H10O5n纤维素+ 6nO26nCO2 + 6nH2O十二、酯类1.乙酸乙酯与H218O混合加入稀硫酸水解3·P13CH3COOCH2CH3 + H218O CH3CO18OH + CH3CH2OH2.油脂的氢化以油酸甘油酯加氢为例3·P993.油脂的皂化反应以硬脂酸甘油酯为例3·P99。
蔗糖脱水碳化的化学方程式

蔗糖脱水碳化的化学方程式今天咱们来聊聊一个有趣的化学现象——蔗糖脱水碳化。
听名字就觉得有点神秘,其实这就像在厨房里玩科学实验,动手动脚之间,竟然能看到糖变成黑炭的奇妙过程,真的是让人目瞪口呆。
先说说蔗糖,嘿,这玩意儿可是咱们生活中常见的东西。
喝茶加糖、做甜点、甚至煮菜,蔗糖几乎无处不在。
可你知道吗?当它被加热到一定温度时,会发生什么神奇的变化?嘿嘿,它可不是单纯地溶解在水里那么简单哦。
它的化学结构会发生变化,脱水然后碳化。
就像人们说的,水煮牛肉,牛肉要入味,糖也是一样的,得先“去水”才能“发火”。
这个过程是怎么发生的呢?简单来说,咱们把蔗糖加热,温度一升高,糖分子里的水分就会蒸发掉,像是说“我不玩了,先走一步”。
这个时候,剩下的就是真正的“糖黑”,看起来就像是黑乎乎的炭。
这一转变,可不是一瞬间的事,要慢慢加热,才能看到糖的华丽转身。
像个魔术师,把白白的糖一眨眼变成了深色的碳。
在这个过程中,咱们可以想象一下,蔗糖就像是一位优雅的舞者,热舞中把多余的水分甩掉,最终只留下炽热的舞台和那段黑色的舞裙。
就像古人所说,化腐朽为神奇,真是让人叹为观止。
化学反应的魅力就在于此,没想到平常的糖居然可以这么玩。
然后,这个碳化的蔗糖并不是毫无用途的,它可以用来制作一些独特的食品和饮料。
想象一下,咱们在一杯冰凉的饮品上洒上一点碳化糖,瞬间变得更加有趣。
它的味道和颜色,真的是让人欲罢不能,仿佛把一整个夏天都浓缩在了一口中。
吃到嘴里,唤醒的是味蕾,激发的是创意。
就像人们常说的,生活就像一盒巧克力,甜中带点苦,才更加美味。
说到这里,大家可能会想,嘿,这个蔗糖碳化的过程有什么具体的化学方程式吗?没错,科学可不止是纸上谈兵,咱们这就来看看。
这其实很简单,咱们可以写成C12H22O11(蔗糖)在加热下脱去水分(H2O),最后变成C(碳),水分子一走了之,留下的就是那股浓浓的黑炭气息。
就像一场没有回头路的旅行,一步踏出,便是全新的风景。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蔗糖的化学方程式
蔗糖(也称糖精)是人类最古老的糖类,其原料是甘蔗。
蔗糖是由一系列的化学反应产生的,并由水解产生不同的产物,其化学方程式为:
C6H12O6(糖)→ 2 C2H5OH(乙醇)+ 2 COOH(酸)+ 2CO2。
从甘蔗中分离出蔗糖的过程是一种复杂的化学反应,它具有许多步骤,它的过程概括如下:甘蔗被浸泡在水中分解成甘汁,然后经过碱液、酸液和物质沉淀等步骤,把甘蔗质中的淀粉和淀粉质分解完全,这样才能得到清澈的甘汁;然后用硫酸铵属剂作用,使淀粉质中的蔗糖部分转化为乙醇和淀粉;最后将乙醇再加以加热,水解产生蔗糖和水,从而得到蔗糖溶液。
蔗糖是一种单糖,其分子式为C12H22O11,它是由六种有机物质组成的水溶液,即糖原、果糖、葡萄糖、果糖、葡萄糖醛酸酯和葡萄糖磷酸酯。
其结构可以概括为:CnH2nOn,n=6-20(包括),湿度大于45%即可。
它是果糖和葡萄糖的混合物,是人体摄取最为广泛的有机物质之一,在食品中广泛使用,并可以用于生产酒精和热带水果的酿造。
甘蔗中的甘汁一般含有15-17%的糖原、3-5%的果糖、0.2-2%的葡萄糖、0.2-2%的葡萄糖醛酸酯和0.2-2%的葡萄糖磷酸酯。
甘蔗中糖原除了可以经过物理处理分离成蔗糖以外,还可以经酵素酶处理转化成果糖、葡萄糖和其他产物。
甘汁中还含有其它有机物质,如氨基酸、维生素、氨基酸、木质
素、类胡萝卜素、某些酶、淀粉等。
在蔗糖生产过程中,这些有机物质也要留存,因此,生产蔗糖时要把这些物质都考虑在内,以保证蔗糖的生产质量。
由于蔗糖是由有机物质和水混合而成的,因此,在生产蔗糖的过程中还需要考虑水的因素。
为了保证蔗糖的质量,生产工艺中要求使用洁净水和除颗粒杂质的水,在酸液、碱液和沉降收获等步骤中,要采取适当的浓度及存在时间,并且不宜使用类型相同的水,有利于净化甘汁中的杂质。
此外,蔗糖在生产过程中也要加入特定的抗菌剂,以防止蔗糖变质,因此,在蔗糖过程中,抗菌剂的选用也十分重要。
一般来说,抗菌剂的选用要以蔗糖的安全性为原则,选择不同的抗菌剂来防止蔗糖变质,以保证蔗糖的质量。
总之,蔗糖是一种经过特定程序转化而成的糖类,蔗糖的化学方程式为:C6H12O6↑→2C2H5OH(乙醇)+2COOH(酸)+2CO2。
在蔗糖生产过程中,不仅需要考虑有机物质和水的因素,还需要选择正确的抗菌剂,以保证蔗糖的质量。
