蔗糖水解动力学
酸催化蔗糖水解的动力学研究

酸催化蔗糖水解的动力学研究在我们生活中,蔗糖可谓是个老朋友。
说到酸催化蔗糖水解,这就像在厨房里调皮的小实验,轻松又好玩。
先来点小背景,蔗糖,大家都知道,是一种甜甜的东西,基本上能在每个家庭的厨房里找到。
它其实是由葡萄糖和果糖两种简单糖组成的。
当我们加点酸,比如说柠檬汁或者醋,哇,魔法就来了!这种酸就像是一个调皮的小精灵,瞬间改变了蔗糖的命运,让它变得更加简单。
想象一下,你在厨房里,拿出一小碗水,里面加点酸,然后放入蔗糖,开始搅拌。
刚开始的时候,没啥变化,蔗糖还在那儿懒洋洋地待着。
但是,随着时间的推移,酸的力量渐渐显现出来,糖分子开始忙碌起来。
就像一场派对,大家都开始舞动起来,拼命分开、组合,最终变成了葡萄糖和果糖。
这一过程可不是一帆风顺哦!它可受温度、酸浓度等各种因素的影响。
温度高点,反应速度就像开了挂,简直飞起来;温度低了,反应就像在慢动作重播,拖拖拉拉的。
说到这里,很多人可能会想,为什么要研究这个呢?其实啊,水解的过程在很多领域都有应用,比如食品工业、制药、甚至生物燃料的制造。
蔗糖水解得快,糖就可以更快地被利用,糖分子转变得越快,食物的口感和营养也越好。
就像你吃冰淇淋,如果它融化得快,哇,真是太幸福了,对吧?不过,研究这个也不是件简单的事。
我们需要控制各种条件,比如酸的浓度、温度,还有搅拌的速度。
这样才能“细水长流”,慢慢地深入这个甜蜜的领域。
每次实验都得像探险一样,可能会遇到各种意想不到的情况。
比如,有时候酸太多,糖变得太甜,反而不好;酸太少,反应根本就启动不了。
就像做菜,调味要得当,不然一锅好菜就毁了。
酸催化蔗糖水解的过程,就像是在讲述一个甜蜜的故事。
每一次反应都是一次新的冒险,探索未知的糖世界。
而我们这些研究者,就像是穿越在这个糖果森林中的小探险家,寻找着最完美的味道。
我们也常常会因为一些小发现而欢呼雀跃,仿佛找到了一颗埋藏已久的宝藏。
哈哈,真是让人乐在其中。
想说的就是,虽然蔗糖水解看似简单,但其背后却蕴藏着丰富的科学原理。
【化学探究实验报告】蔗糖水解反应动力学研究实验报告

西安电子科技大学
化学探究实验课程实验报告
实验名称蔗糖水解反应动力学研究
学院班Array姓名学号
同作者实验序号
实验日期2020 年4 月20日
蔗糖水解反应动力学研究
一、实验目的:
1.测定蔗糖水溶液在酸催化作用下的反应速率常数、半衰期和活化能。
2.研究温度对蔗糖水解反应速率的影响。
3.了解旋光仪的原理、使用方法及在化学反应动力学测定中的应用。
二、实验原理:
蔗糖在水中可发生水解反应,转化成葡萄糖与果糖,其反应为
二、主要仪器及试剂:
1.仪器
旋光仪1台,旋光管1支,恒温水浴1台,超级恒温槽1台,蒸馏水洗瓶1 个,150mL 带塞锥形瓶4个,刻度移液管2个,100C温度计1支。
电子天平(百分之一)
2.试剂
3.0mol/dm-3盐酸溶液,蔗糖。
四、实验主要步骤
五、数据记录处理
1. 将反应时间t、旋光度[a t-a∞]、ln[a t-a∞]列入下表中。
温度:30℃, 盐酸浓度: 2.5mol/dm-3 , α∞:-4.2;仪器的零点:。
温度:35 ℃, 盐酸浓度:2.5mol/dm-3 , α∞:-3.9。
表 实验数据列表
2. 以时间t 为横坐标,ln(t αα∞-)为纵坐标作图,由直线的斜率分别求出30℃、35℃时的k 。
30 C 时k=0.042 35 C 时k=0.077
3. 计算蔗糖反应的半衰期。
30 C 时t 1/2=16.5
35 C 时t 1/2=9.0
4. 由两个温度测得的k 值计算反应的活化能。
9.406*104J/mol 六、实验结果分析及回答问题。
实验十一蔗糖水解反应

实验十一 蔗糖水解反应【实验目的】1. 测定不同温度时蔗糖转化反应的速率常数和半衰期,并求算蔗糖转化反应的活化能。
2. 了解旋光仪的构造、工作原理,掌握旋光仪的使用方法。
【基本要求】1.了解在蔗糖反应的动力学方程式中,任何时刻t 的蔗糖浓渡可以被反应体系在该时刻的选光度α与反应终了时的选光度∞α之差所替代的依据。
2 测定蔗糖转化率的速率常数的半衰期。
3 了解旋光仪的基本原理,掌握其实用方法。
【实验原理】蔗糖转化反应为: C 12H 22O 11 + H 2O → C 6H 12O 6 + C 6H 12O 6蔗糖 葡萄糖 果糖为使水解反应加速,常以酸为催化剂,故反应在酸性介质中进行。
由于反应中水是大量的,可以认为整个反应中水的浓度基本是恒定的。
而H +是催化剂,其浓度也是固定的。
所以,此反应可视为准一级反应。
其动力学方程为kC dtdC =- (1) 式中,k 为反应速率常数;C 为时间t 时的反应物浓度。
将(1)式积分得: 0ln ln C kt C +-=(2)式中,C 0为反应物的初始浓度。
当C =1/2C 0时,t 可用t 1/2表示,即为反应的半衰期。
由(2)式可得:kk t 693.02ln 2/1== (3)蔗糖及水解产物均为旋光性物质。
但它们的旋光能力不同,故可以利用体系在反应过程中旋光度的变化来衡量反应的进程。
溶液的旋光度与溶液中所含旋光物质的种类、浓度、溶剂的性质、液层厚度、光源波长及温度等因素有关。
为了比较各种物质的旋光能力,引入比旋光度的概念。
比旋光度可用下式表示:[]lC tD αα= (4)式中,t 为实验温度(℃);D 为光源波长;α为旋光度;l 为液层厚度(m);C 为浓度(kg·m -3)。
由(4)式可知,当其它条件不变时,旋光度α与浓度C 成正比。
即:α=KC (5)式中的K 是一个与物质旋光能力、液层厚度、溶剂性质、光源波长、温度等因素有关的常数。
蔗糖转化反映动力学实验报告

蔗糖转化反应动力学班级:09111101组号:第八组一、实验目的(1)测定蔗糖水溶液在酸催化作用下的反应速率常数和半衰期(2)了解旋光度的概念,学习旋光度的测量方法及在化学反应动力学研究中的应用二、原理蔗糖砸水溶液中的转化反应C12H22O11(蔗糖)+H20 H+ C6H12O6(葡萄糖) + C6H12O6(果糖)这是一个二级反应,在纯水中反应速度极慢,通常需要在H的催化作用下进行。
当蔗糖含量不是很大的时候,反应过程中的水是大量存在的,尽管有部分水分子参与了反应,但是仍可以认为整个反应中的水的浓度是不变的;H+是催化剂,其浓度保持不变。
则此蔗糖转化反应可以看做是准一级反应,其反应速率是:v=−dc蔗dt=dc葡dt=dc果dt=kC蔗式中,k为蔗糖转化反应速率常数,c蔗为时间t时蔗糖的浓度。
当t=0时,蔗糖的浓度为C0,蔗,对上式积分:ln Co,蔗C蔗=kt当C蔗=12Co,蔗时,相应的时间t即为半衰期t1/2,且有:t1/2=ln2k =0.6931k测定不同的时间t时的C蔗可求得k。
旋光性物质的旋光角为:α=αmm A式中αm为旋光性物质的质量旋光本领,与温度、溶剂、偏振光波长等有关;m为旋光性物质在截面积为A的线性偏振光束途径中的质量。
由此式可得:α=αmnMlAl=αmMl式中,A为常数。
已知在293.15K,以钠的D光线为光源时,蔗糖、葡萄糖、果糖的旋光本领αm分别为 1.16×10-2rad·m2·kg-1,0.92×10-2rad·m2·kg-1,-1.60×10-2rad·m2·kg-1。
因此,随着反应的进行。
旋光角会发生变化,蔗糖和葡萄糖为右旋,果糖为左旋,所以在反应的过程中右旋角不断减少,反应完毕时溶液为左旋。
蔗糖水解反应中,不同的时间t时,反应物、生成物的浓度为:当t=0时,α0=A蔗Co,蔗;当t=t时,αt= A蔗Co,蔗+A葡(Co,蔗- C蔗)+A果(Co,蔗- C蔗);当t=∞时,α∞=( A葡+ A果)Co,蔗;整理有:Co,蔗=α0−α∞A蔗−A葡−A果C蔗=αt−α∞A蔗−A葡−A果因此:k=1t ln Co,蔗C蔗=1tlnα0−α∞A蔗−A葡−A果ln(αt−α∞)=−kt+ln (α0−α∞)以ln(αt−α∞)对t作图,则图为一条直线,有直线的斜率可以求得蔗糖转化反应的速率常数k.三、仪器与试剂旋光仪、恒温槽、秒表、容量瓶(250ml)、容量瓶(50ml)、磨口塞锥形瓶(250ml)、烧杯(100ml、1000ml)、移液管(50ml)、HCl溶液(3.0mol·dm-3)四、实验操作1)打开恒温槽两个,分别设定温度为25℃、55℃;2)打开旋光仪电源开光预热10min,然后打开光源开关预热20min。
蔗糖水解反应实验报告

浙江万里学院生物与环境学院化学工程实验技术实验报告实验名称:蔗糖水解反应速率常数的测定实验预习(30分)(1) 实验目的1 •根据物质的光学性质研究蔗糖水解反应,测定其反应率度常数 2•了解自动旋光仪的基本原理、掌握使用方法。
(2) 实验原理蔗糖在水中水解成葡萄糖与果糖的反应为:C 12H2Q 1 + H 2O a C 6H12C 6 +C6H2Q葡萄糖 果糖为使水解反应加速,反应常常以 HO 为催化剂,故在酸性介质中进行。
水解 反应中,水是大量的,反应达终点时,虽有部分水分子参加反应,但与溶质浓度 相比可认为它的浓度没有改变,故此反应可视为一级反应,其动力学方程式为:de kcdt(1)(2)当c2c0时,t 可用切2平表示,即为反应的半衰期上式说明一级反应的半衰期只决定于反应速度常数 k ,而与起始浓度无关,这是 一级反应的一个特点。
蔗糖及其水解产物均为旋光物质,当反应进行时,如以一束偏振光通过溶液, 则可观察到偏振面的转移。
蔗糖是右旋的,水解的混合物中有左旋的,所以偏振 面将由右边旋向左边。
偏振面的转移角度称之为旋光度,以表示。
因此可利用体系在反应过程中旋光度的改变来量度反应的进程。
溶液的旋光度与溶液中所含 旋光物质的种类、浓度、液层厚度、光源的波长以及反应时的温度等因素有关。
为了比较各种物质的旋光能力。
引入比旋光度 []这一概念,并以下式表示:蔗糖 式中:c 0为反应开始时蔗糖的浓度; c 为时间t 时蔗糖的浓度[D ]=r^ (3)式中:t 为实验时的温度;D 为所用光源的波长; 为旋光度;I 为液层厚度 (常以10cm 为单位);(3)式可写成:c 为浓度(常用100 mL 溶液中溶有m 克物质来表示), ta [a] Dl m 100( 4)或a [a]D l c由(5)式可以看出,当其他条件不变时,旋光度 即a K 'c式中:K '是与物质的旋光能力、溶液层厚度、溶剂性质、光源的波长、反 应时的温度等有关的常数。
2020蔗糖水解反应动力学研究实验讲义

蔗糖水解反应动力学研究蔗糖是重要的食品和甜味调味品,它水解生成葡萄糖和果糖的甜度比蔗糖高,其中两者为1:1时形成果葡糖浆,果葡糖浆,风味独特、口感好、发效能力强,广泛用于食品添加剂,糖果饼干等加工生产中,在食品和药品开发领域具有广阔的发展前景。
一、实验目的1. 测定蔗糖水溶液在酸催化作用下的反应速率常数、半衰期和活化能。
2. 研究温度对蔗糖水解反应速率的影响。
3. 了解旋光仪的原理、使用方法及在化学反应动力学测定中的应用。
二、实验原理蔗糖在水中可发生水解反应,转化成葡萄糖与果糖,其反应为H122211261266126C H O H O C H O C H O (A) (B) (C)++⎯⎯→+蔗糖葡萄糖果糖 (1)该反应在纯水反应速率极慢,通常需要在H +离子催化作用下进行。
此反应与蔗糖、水及催化剂H +离子的浓度相关。
当蔗糖含量不大时,反应过程中水是大量存在的,尽管有部分水分子参加反应,仍可近似认为整个反应过程中水的浓度是恒定的;H +是催化剂,其浓度也保持不变。
因此蔗糖水解反应可看作为一级反应,其动力学方程式为:AA d d c kc t−= (2)积分后可得:A A,0ln ln c kt c =−+ (3)式中:c A 为时间t 时蔗糖的浓度,单位为mol/L ;c A ,0为反应开始时蔗糖的浓度;k 为反应速率常数,单位为(时间)-1。
当c = 0.5c 0, 反应物浓度降低一半所用的时间称为反应的半衰期,记为t 1/2 。
半衰期可表示为:1/2ln 2t k=(4) 由式(3)可以看出,在不同的时间测定蔗糖的相应浓度.以ln c A 对t 作图,可得一条直线,由直线斜率即可求得反应速率常数。
如果测得不同温度(温度的单位为K)下的反应速率常数1()k T 和2()k T ,按照阿仑尼乌斯公式可计算出该反应的活化能E a (单位为J ·mol -1)。
式中-1-18.314J mol K R =⋅⋅。
蔗糖水解反应速度常数的测定

蔗糖水解反应速度常数的测定一、目的要求1、根据物质的光学性质研究蔗糖水解反应,理解反应物浓度与旋光度间的关系。
2、了解旋光仪的基本原理、掌握其使用方法。
3、测定蔗糖水解反应速率常数和半衰期。
二、实验原理蔗糖水解反应为C 12H 22O 11 + H 2O = C 6H 12O 6 + C 6H 12O 6蔗糖 葡萄糖 果糖在酸度一定的条件下,蔗糖水解反应可视为一级反应,其动力学方程为:K=(2.303/t )lg(C 0/C)或lgC=-(kt/2.303)+lgC 0 ①反应的半衰期:t(1/2) = ln2/k ②反应体系的旋光度与各物质的浓度有一定关系: C 12H 22O 11 + H 2O = C 6H 12O 6 + C 6H 12O 6蔗糖 葡萄糖 果糖(右旋) (右旋) (左旋)20][D α=66.6 20][D α=52.5 20][D α=-91.9t =0 C0 00旋光度:α0t CC0-CC0-Cαtt = 0 C0 C0α∞随反应的进行,反应体系的旋光度应如何变化?在温度、入射光波长和旋光管长度一定的条件下,旋光度与物质的浓度成正比:α=KC③所以:α0=K1C0④αt=K1C+(K2+K3)(C0-C) ⑤α∞=(K2+K3)C0⑥④~⑥式中,K1、K2、K3分别为蔗糖、葡萄糖和果糖在关系式③中的比例系数。
由④~⑥式可得:C O=(α0-α∞)/(K1-K2-K3)C=(αt-α∞)/(K1-K2-K3)代入①得到:lg(αt-α∞)=-(Kt/2.303)+lg(α0-α∞) ⑦由式⑦可见:以lg(αt-α∞)对t作图可得一直线,由直线的斜率可求得蔗糖水解反应的速率常数K。
再由式②即求得半衰期。
三、仪器和试剂旋光仪及旋光管;HK-1B玻璃恒温水槽;停表;2mol·dm-3HCl;蔗糖(分析纯);有关玻璃仪器;托盘天平。
四、操作步骤1、实验测量前十分钟打开旋光仪进行预热。
..酸催化蔗糖水解反应动力学的研究
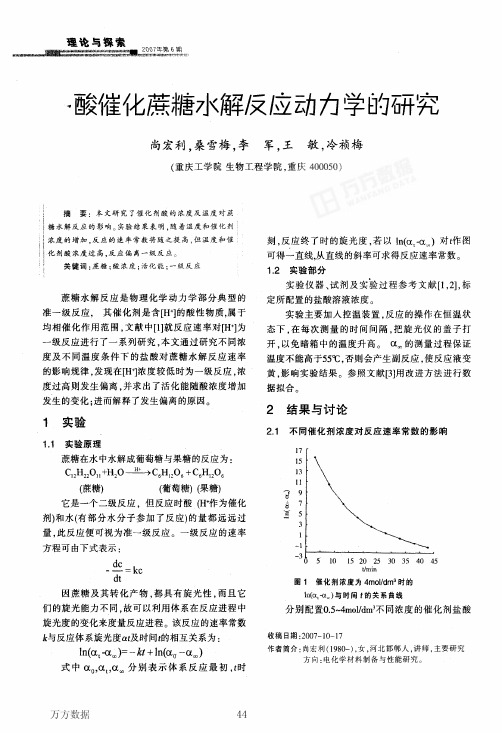
2.1 不同催化剂浓度对反||立i枣率常数的影响
“mln
圈1 催化剂浓度为4moI/dm3时的 ln缸。啦。)与时间f的关系曲线
分别配置0.5~4moWms不同浓度的催化剂盐酸
收稿日期:2007一10一17 作者简介:尚宏利(1980一),女,河北邯郸人,讲师,主要研究
方向:电化学材料制备验原理 蔗糖在水中水解成葡萄糖与果糖的反应为:
C12H2201lH{20—羔三oC6Hl:06+C6H1206
(蔗糖)
(葡萄糖)(果糖)
它是一个二级反应,但反应时酸(H作为催化
剂)和水(有部分水分子参加了反应)的量都远远过
量,此反应便可视为准一级反应。一级反应的速率
方程可由下式表示:
一。。。徽燃黧隰黑。。裟黧熙 ;;—一。;。嚣圜黼镕鬟鬈霪鬻鬻鬈鬟霪蕊鬟鬟鬃蒸鬈黧粱;:i黑。。墓捌毒蕊翥纛嚣。蒜。
..酸催化蔗糖水解反应动力学的研究
尚宏利,桑雪梅,李 军,王 敏,冷祯梅
(重庆工学院生物工程学院,重庆400050)
摘要:本文研究了催化剂酸的浓度及温度对蔗
,{
{糖水解反应的影响。实验结果表明,随着温度和催化剂
实验仪器、试剂及实验过程参考文献[1,2],标 定所配置的盐酸溶液浓度。
实验主要加入控温装置,反应的操作在恒温状 态下,在每次测量的时间问隔,把旋光仪的盖子打 开,以免暗箱中的温度升高。仪。的测量过程保证 温度不能高于55℃.否则会产生副反应,使反应液变 黄,影响实验结果。参照文献【3】用改进方法进行数 据拟合。
万方数据
44
万方数据
引浓度的增加,反应的速率常数将随之提高,但温度和催
}i
㈡化剂酸浓度过高.反应偏离一级反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蔗糖水解反应速度常数的测定
一、实验目的:
1、 根据物质的光学性质研究蔗糖水解反应,测定其反应速度常数。
2、了解旋光仪的基本原理、掌握使用方法。
二、基本原理:
1.蔗糖的转化为一级反应
蔗糖在H +催化作用下水解或葡萄糖和果糖,反应方程式为:
C 12H 22O 11 + H 2O −−→−+
H C 6H 12O 6 + C 6H 12O 6
蔗糖 葡萄糖 果糖
由于在较稀的蔗糖溶液中,水是大量的,反应过程中水的浓度可以认为不变,因此在一定酸度下,反应速度只与蔗糖的浓度有关,而反应速度与反应物浓度的一次方成正比的反应称为一级反应,故蔗糖的转化反应视为一级反应。
(1)反应速度公式和半衰期
,r kc = k —反应速度常数,为单位浓度是的反应速度,v —反应速度。
v 也可以写为
,r kt dt dc =-=
t 反应时间,c 为时间 t 时蔗糖的浓度。
不定积分: B kt c +-=ln ,B 积分常数,
当0=t 时,
0ln c B =
0c 蔗糖的起始浓度,代入上式可得定积分式
c
c t k 0ln 1= 当反应进行一半所用的时间称为半衰期,用t 1/2表示,则
2/1002
/ln
kt c c = 解得 k
k t 6932.02ln 2/1== (2)一级反应有三个特点: ① k 的数值与浓度无关,量纲:时间-1,常用单位1-s ,1min -等。
② 半衰期与反应物起始浓度无关。
③ 以c ln 对 t 作图应得一直线,斜率为k -,截距为B 。
由此可用作图法求得直线斜率,计算反应速度常数-=k 斜率。
2.反应物质的旋光性
蔗糖及其水解产物葡萄糖,果糖都含有不对称碳原子,它们都具有旋光性,即都能使透过他们的偏振光的振动面旋转一定的角度,此角度称为旋光度,以α表示。
蔗糖,葡萄糖能使偏振光的振动面按顺时针方向旋转,为右旋物质,旋光度为正值。
果糖为左旋物质,旋光度为负值,数值较大,整个水解混合物是左旋的。
所以可以通过观察系统化反应过程中旋光度的变化来量度反应的进程。
量度旋光度的仪器称旋光仪,旋光仪的原理方法将专门讲解。
2.1旋光度与比旋光度
溶液的旋光度与溶液中所含旋光物质的种类、浓度、液层厚度、光源的波长以及反应时的温度因素有关。
为了比较各种物质的旋光能力,引入比旋光度[]α这一概念,并以下式表示:
[]c l t
D ⋅=
αα (1) 式中:t 为实验时的温度;D 为所用光源的波长;α为旋光度;l 为液层厚度(常以10cm 为单位);c 为浓度(常用100ml 溶液中溶有m 克物质来表示),式(1)可写成:
[]100/m l t
D ⋅=αα (2)
或
[]c l t
D ⋅=αα (3)
由(3)式可以看出,当其他条件不变时,旋光度α与反应物成正比,即
c K '=α
式中:K '是与物质的旋光能力、溶液层厚度、溶剂性质、光源的波长、反应时的温度等有关系的常数。
蔗糖是右旋性物质(比旋光度[]
=20D α66.6°),产物中葡萄糖也是右旋性物质(比旋光度[]=20
D α52.5°),果糖是左旋性物质(比旋光度[]=20D α-91.9°)。
因此当水解反应进行时,右旋角不断减小,当反应终了时体系将经过零变成左旋。
2.2旋光度变化与浓度变化的对应关系
蔗糖水解反应中,反应物与生成物都有旋光性,旋光度与浓度成正比,且溶液的旋光度为各旋光度的和(加和性)。
若反应时间为0,t,∞时溶液旋光度各为0α,t α,∞α。
可推导出:
][K 00∞-=ααC , ][K 0∞-=ααt C
0α为开始时蔗糖的右旋角;t α为反应进行到t 时的混合物的旋角;∞α 为水解完毕时的左旋角。
可用(∞-αα0)代表蔗糖的总量,(∞-ααt )代表t 时的蔗糖量。
简单的推导证明方法可以如图示看出
∞-αα0正比, ∞-ααt 正比
3.反应速度常数k 的求法
()()∞
∞∞--=∞--==ααααααααt t t t c c t k 000ln 1K K ln 1ln 1 以ln(αt -α∞)对t 作图,由图所得直线斜率求k 值,进而求半衰期t 1/2。
三、仪器和试剂(略)
四、实验步骤:
1、将恒温槽调节到25︒C 恒温,称取10克蔗糖溶于水中,用50ml 容量瓶配成溶液。
用移液管移取25ml 蔗糖溶液溶于锥形瓶中,然后放入恒温水浴中10分钟。
另同样取25ml 盐酸溶液放入恒温槽中。
2、校正旋光度仪零点。
打开旋光度仪器预热几分钟,旋光管内注满蒸馏水,旋紧套盖,用纸擦净两端玻璃片,放入旋光仪内,盖上槽盖。
调节目镜使视野清晰。
然后旋转检偏镜能观察到明暗相等的三分视野为止,记下刻度盘读数,重复操作三次,取其平均值,此即为旋光仪零点。
测毕取出旋光管,倒出蒸馏水。
α的测定
3、蔗糖水解过程中
t
从恒温槽中取出蔗糖溶液,将25ml 2mol/L HCl溶液加入蔗糖溶液使其混合均匀。
取加入一半HCl时作为反应开始时间,迅速取少量混合液清洗旋光管两三次。
然后注满旋光管,测量各时间t时溶液的旋光度。
分别测得时间为5、10、15、20、25、30、40、50、60分钟时的旋光度。
α的测定
4、
∞
将反应剩余的混合液置50~60 ︒C的热水浴中,温热30分钟,以加速转化反应的进行,然后冷却,再恒温至25︒C,测旋光度,此值即为反应终了时的旋光度。
5、实验结束时,立刻将旋光管洗净干燥,以免酸对旋光管的腐蚀。
五、数据记录和处理
α
实验温度HCl浓度零点
∞
1.实验数据填入下表
t t∞t∞
2.以ln(αt-α∞)对t作图,由图所得直线斜率求k值。
3.计算反应的半衰期t1/2。
六、讨论与说明:
1. 蔗糖水解在酸性介质中进行,H+为催化剂,故反应是一复杂反应,反应的计算方程式显然不表示此反应的机理反应并不是因为水的浓度变化可忽略而视为一级。
本反应视为一级反应完全是实践得出的结论。
2. 速度常数k与浓度有关,所以酸的浓度必须精确,以保证反应体系中H+浓度与实验要求的相一致。
α时,每测完一次,将旋光管置于25︒C的恒3. 温度对速度常数k的影响不容忽视,在测定
t
温槽水浴中恒温,待下次测量时拿出。
4. 在放置旋光管上的玻璃片时,将玻璃盖片沿管口轻轻推上盖好,再旋紧套盖,勿使其漏水或产生气泡。
5. 旋光仪使用中,若两次测定中间间隔时间较长,则应切断电源,让灯管休息一会,在下次使用提前10分钟再开启。
6. 对三分视野的明暗判断影响实验值的精度,因此要求判断时尽可能作到快而准。
七、思考讨论题:
1. 为什么可用蒸馏水来校正旋光仪的零点?
2. 在旋光度的测量中为什么要对零点进行校正?它对旋光度的精确测量有什么影响?在本实验中若不进行校正对结果是否有影响?
3. 为什么配置蔗糖溶液可用上皿天平称量?。
