有机化学(高占先)习题答案
有机化学第二版 高占先 第八九章答案

第八章 卤代烃8-2 完成下列各反应式。
(CH 3)3CBr C 2H 5OH(CH 3)2C=CH 2+CH 3CH=CH 2HBr+O OCH 3CH 2CH 2CH 3CH 2CH 2CNNaCN(1)(2)(CH 3)2CHCH=CH 2Br +500℃(CH 3)2CCH=CH 2BrH 2O (CH 3)2C=CHCH 2Br+(CH 3)2CCH=CH 2OH(CH 3)2C=CHCH 2OH+(3)NaCNKOH 25(4)(5)(6)ClCH=CHCH 2Cl CH 3+ClCH=CHCH 2OCCH 3OBrBrBrCNCH 2CHCH 3Br CH=CHCH 3CH 3Br2NH 3(l)CH 3NH 2CH 32+ClClNO 22OHClNO 2ZnCl 2(HCHO + HCl)+CH 2ClMgCH 2MgClCH 2COOHClCH 2CHCH 2CH 2CH 3PhCH 2MgCl 3+PhCH 2CH 2CHCH 2CH 2CH 33(7)(8)(9)(10)3RC CLi(11)RCCR'RC CCOOHRC CCH 2CH 2OHCHBr3BrBr(12)8-3 写出下列反应主要产物的构型式。
C2H5CH3NaI+C2H5CH3NaINaSCH3+(S N2)(S N2)(S N2)CH3ICH2(CH2)4CH3HH2OCH3H2(CH2)4CH3HOCBrBrCH2CH2CH3CCH2CH32Lindar催化剂CHCCH2CH2CH3H(1)(2)(3)(4)3KOH253H3t-BuOKt-BuOH, △H3Ph PhC6H5H3C HC6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H Br2CH3H BrC2H5CH325Znt-BuOKt-BuOH, △(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-6 把下列各组化合物按发生S N1反应的活性排列成序。
有机化学第二版 高占先 全 章答案完整版
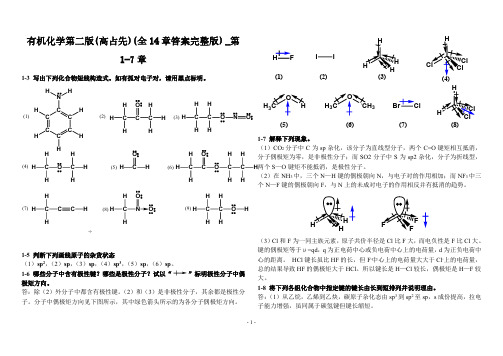
(8) H C N O
H
H
÷
(9) H C C O H HH
1-5 判断下列画线原子的杂货状态
(1)sp2,(2)sp,(3)sp,(4)sp3,(5)sp,(6)sp。
1-6 哪些分子中含有极性键?哪些是极性分子?试以“
”标明极性分子中偶
极矩方向。
答:除(2)外分子中都含有极性键。(2)和(3)是非极性分子,其余都是极性分
2-1 用系统命名法命名下列烷烃。 (1)2,2,5-三甲基已烷; (2)3,6-二甲基-4-正丙基辛烷; (3)4-甲基-5-异丙基 辛烷;
(4)2-甲基-3-异丙基庚烷; (5)5-正丙基-6-异丙基十二烷; (6)3,3-二甲基-4-乙基-5-(1,2-二甲基丙基)壬烷; (7)4-异丙基-5-正丁基癸 烷;
矿物油分子不能克服这种氢键与乙醇或水相互渗透而溶解)。 1-18 下列物质是否含有共轭酸和共轭碱?如有,请分别写出。 答:(1)即有共轭酸也有共轭碱,共轭酸是 CH3NH3+,共轭碱是 CH3NH2-; (2)共轭酸是 CH3OH; (3)即有共轭酸也有共轭碱,共轭酸是 CH3CH2OH2+,共轭碱是 CH3CH2O-; (4)共轭酸是 H2; (5)共轭酸是 CH4; (6)共轭碱酸是 CH3CH2+,共轭碱是 CH2=CH-。 1-19 将下列物种按碱性,由强至弱排列成序。 答:参照书中表 1-9 排出,CH3CH2->H2N->HC≡C->CH3O->OH-。 1-20 下列极限式中,哪个式子是错误的,为什么? 答:(1)中 C 是错的,因为此式中原子核的相对位置改变了; (2)中 C 是错的,因为此式中的单电子数改变了(A、B 式中单电子数为 1,C 中 为 3); (3)中 C 和 D 是错的,因为 C 式 2 个 N 原子外层价电子数不是 8(而是 6 和 10), D 式中间 N 原子外层价电子数也不符合八隅体要求。
有机化学第二版-高占先著-第十章课后答案
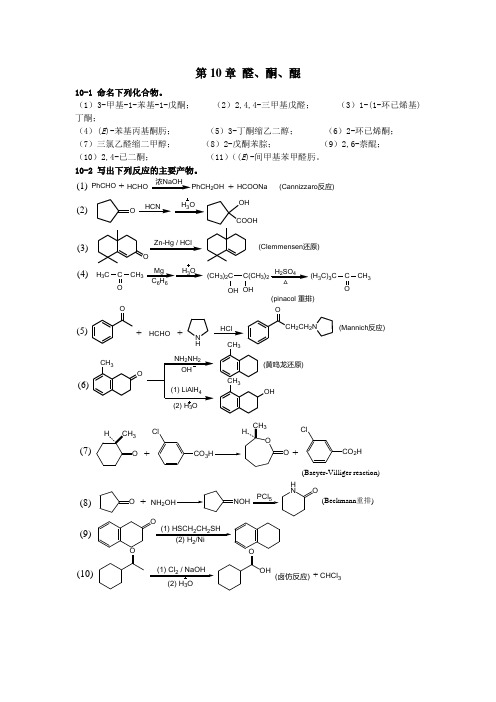
第10章 醛、酮、醌10-1 命名下列化合物。
(1)3-甲基-1-苯基-1-戊酮; (2)2,4,4-三甲基戊醛; (3)1-(1-环已烯基)丁酮;(4)(E )-苯基丙基酮肟; (5)3-丁酮缩乙二醇; (6)2-环已烯酮; (7)三氯乙醛缩二甲醇; (8)2-戊酮苯腙; (9)2,6-萘醌; (10)2,4-已二酮; (11)((E )-间甲基苯甲醛肟。
10-2 写出下列反应的主要产物。
PhCHOHCOONa +浓NaOHHCHO2OH+(Cannizzaro 反应)OZn-Hg / HClHCNH 3OOH COOHO(Clemmensen 还原)H 3CC CH 3O Mg 66H 3OH 2SO 4△(CH 3)2C C(CH 3)2OH OH(H 3C)3CC CH 3O(pinacol 重排)(1)(2)(3)(4)+HCHO(Mannich 反应)+HCl(5)(6)ON HCH 2CH 2NOCH 3OCH3CH 3OH(黄鸣龙还原)CO 3Cl+CO 2HCl+(Baeyer-Villiger reaction)ONH 2+PCl 5H NO(Beckmann 重排)O(1) HSCH 2CH 2SH2O(1) Cl 2 / NaOH 3OHO(卤仿反应)(7)(8)(9)(10)CHCl 3+(Wittig reaction)CH 3MgBr +Ph 3(1) CuCl 3(13)(12)(11)O+O(1,4-加成产物)OCHCH 2CH 3O OOHHONCO(双烯合成反应)10-3 比较下列化合物的亲核加成反应活性。
(2)(1)C OCH 3H 3C C CH 3OH 3CC HOCOCH 3H 3C(3)(4)(3)>(1)>(2)>(4)10-4 将下列化合物按烯醇式的含量多少排列成序。
CH 3COCHCOCH 3CH 3COCH 2CH 3(2)(1)PhC H 2C O(3)(4)3CH 3COCH 2COCH 3C CH 3O(1)>(4)>(3)>(2)10-5 指出下列化合物中,哪些能发生碘仿反应?哪些能与饱和NaHSO 3反应?(2)(1)O(3)(4)(5)ICH 2CHOCH 3CH 2CHOC 6H 5COCH 3CH 3CHOCH 3CH 2CH 2OHCH 3CH 22CH 3CH 3CH 23OH(7)(6)(8)O能与饱和NaHSO 3反应的有(1)、(2)、(5)、(8)[脂肪族甲基酮、大多数醛和8个碳以下的脂肪酮能进行此反应]。
有机化学第二版高占先全14章答案完整版_第814章1

有机化学第二版(高占先)(全14章答案完整版)_第8-14章史上最全的《有机化学第二版(高占先)》全14章答案完整版!!其中包括各种判断题、推断题、思考题以及合成题的答案!!Ps:亲!给好评,有送财富值哦! #^_^!!第8章卤代烃8-2 完成下列各反应式。
(CH3)3CBr C2H5OH(CH3)2C=CH2+CH3CH=CH2HBr+O OCH3CH2CH2CH3CH2CH2CNNaCN(1)(2)(CH3)2CHCH=CH2Br+500℃(CH3)2CCH=CH2Br H2O(CH3)2C=CHCH2Br +(CH3)2CCH=CH2OH(CH3)2C=CHCH2OH +(3)NaCNKOH25(4)(5)(6)ClCH=CHCH2Cl CH3+ClCH=CHCH2OCCH3OBrBrBrCNCH2CHCH3BrCH=CHCH3CH3 Br2NH3(l)CH3NH2CH32+ClCl NO2NaOH-H2OOHClNO2ZnCl2(HCHO + HCl)+CH2ClMgCH2MgCl CH2COOH ClCH2CHCH2CH2CH3PhCH2MgClCH3+PhCH2CH2CHCH2CH2CH3CH3(7)(8)(9)(10)3RC CLi(11)RC CR'RC CCOOHRC CCH2CH2OHCHBr3BrBr(12)8-3写出下列反应主要产物的构型式。
CC2H5CH 3NaI+CC2H5CH3NaSCH3+(S N2)(S N2)(S N2)CH3ICH2(CH2)4CH3HH2OCH3HCH2(CH2)4CH3HOCBrCH2CH2CH3CCH2CH32Lindar催化剂CHCCH2CH2CH3H(1)(2)(3)(4)3KOH253H3t-BuOKt-BuOH, △H3CPh PhHC6H5H3C H6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H BrCH2CH3H BrC2H5CH325Znt-BuOK(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-4比较下列每对亲核取代反应,哪一个更快,为什么?(1)B>A (亲核性C2H5O->C2H5OH)(2)A>B (烯丙型卤代烃活泼)(3)B>A (极性非质子溶剂有利于S N2反应)(4)A>B (亲核性-SH>-OH)(5)A>B (亲核性硫比氮强)(6)B>A (离去能力I->Cl-)8-5卤代烷与NaOH在H2O-C2H5OH溶液中进行反应,指出哪些是S N2机理的特点,哪些是S N1机理的特点?(1)产物发生Walden转化;S N2(2)增加溶剂的含水量反应明显加快;S N1(3)有重排反应产物;S N1(4)反应速率明显地与试剂的亲核性有关;S N2(5)反应速率与离去基的性质有关;S N2和S N1(6)叔卤代烷反应速度大于仲卤代烷。
有机化学1-4章答案,高占先共6页word资料

1-3 写出下列化合物短线构造式。
如有孤对电子对,请用黑点标明。
1-5 判断下列画线原子的杂货状态(1)sp2,(2)sp,(3)sp,(4)sp3,(5)sp,(6)sp。
1-6哪些分子中含有极性键?哪些是极性分子?试以“”标明极性分子中偶极矩方向。
答:除(2)外分子中都含有极性键。
(2)和(3)是非极性分子,其余都是极性分子。
分子中偶极矩方向见下图所示,其中绿色箭头所示的为各分子偶极矩方向。
1-7 解释下列现象。
(1)CO2分子中C为sp杂化,该分子为直线型分子,两个C=O键矩相互抵消,分子偶极矩为零,是非极性分子;而SO2分子中S为sp2杂化,分子为折线型,两个S—O键矩不能抵消,是极性分子。
(2)在NH3中,三个N—H键的偶极朝向N,与电子对的作用相加;而NF3中三个N—F 键的偶极朝向F,与N上的未成对电子的作用相反并有抵消的趋势。
(3)Cl和F为一同主族元素,原子共价半径是Cl比F大,而电负性是F比Cl大。
键的偶极矩等于μ=qd,q为正电荷中心或负电荷中心上的电荷量,d为正负电荷中心的距离。
HCl 键长虽比HF的长,但F-中心上的电荷量大大于Cl-上的电荷量,总的结果导致HF的偶极矩大于HCl。
所以键长是H—Cl较长,偶极矩是H—F较大。
1-8 将下列各组化合物中指定键的键长由长到短排列并说明理由。
答:(1)从乙烷,乙烯到乙炔,碳原子杂化态由sp3到sp2至sp,s成份提高,拉电子能力增强,虽同属于碳氢键但键长缩短。
(2)键长顺序为C—I>C—Br>C—Cl>C—F。
因为卤素原子核外电子层数为I>Br>Cl >F,即其范德华半径为I>Br>Cl>F,则其原子共价半径I>Br>Cl>F。
(3)碳碳键键长为乙烷>乙烯>乙炔。
因为碳原子杂化态由sp3到sp2至sp,其共价键分别为单键、双键和叁键,碳碳原子间的作用力是乙烷<乙烯<乙炔,作用力越强,则两原子被拉得越紧,键长越短。
1-9 将下列各组化合物按酸性由强到弱排列。
有机化学第二版(全14章答案完整版) _第8-14章
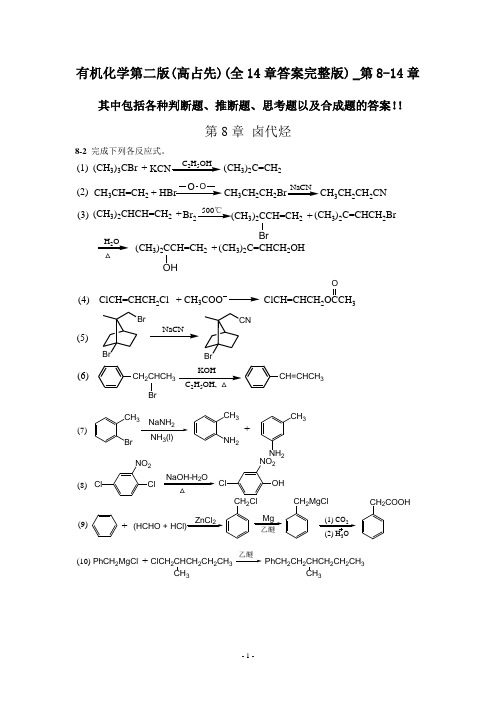
有机化学第二版(高占先)(全14章答案完整版) _第8-14章其中包括各种判断题、推断题、思考题以及合成题的答案!!第8章 卤代烃8-2 完成下列各反应式。
(CH 3)3CBr C 2H 5OH(CH 3)2C=CH 2+CH 3CH=CH 2HBr+O OCH 3CH 2CH 2CH 3CH 2CH 2CNNaCN(1)(2)(CH 3)2CHCH=CH 2Br +500℃(CH 3)2CCH=CH 2BrH 2O (CH 3)2C=CHCH 2Br+(CH 3)2CCH=CH 2OH(CH 3)2C=CHCH 2OH+(3)NaCNKOH 25(4)(5)(6)ClCH=CHCH 2Cl CH 3+ClCH=CHCH 23OBrBrBrCNCH 2CHCH 3Br CH=CHCH 3CH 3Br2NH 3(l)CH 3NH 2CH 3NH 2+ClClNO 2NaOH-H 2OOHClNO 2ZnCl 2(HCHO + HCl)+CH 2ClMgCH 2MgClCH 2COOHClCH 2CHCH 2CH 2CH 3PhCH 2MgCl CH 3+PhCH 2CH 2CHCH 2CH 2CH 3CH3(7)(8)(9)(10)3RC CLi (11)RC CR'RC CCOOHRC CCH2CH2OH CHBr350%NaOH(aq)BrBr(12)8-3写出下列反应主要产物的构型式。
C2H5CH3NaI+C2H5CH3NaSCH3+(S N2)(S N2)(S N2)CH3ICH2(CH2)4CH3HH2OCH3HCH2(CH2)4CH3HOCBrBrCH2CH2CH3CCH2CH3H2Lindar催化剂C CCH2CH2CH3H(1)(2)(3)(4)3KOH253H3t-BuOKt-BuOH, △H3CPh PhHC6H5H3C H6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H BrCH2CH3H BrC2H5CH325Znt-BuOK(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-4比较下列每对亲核取代反应,哪一个更快,为什么?(1)B>A (亲核性C2H5O->C2H5OH)(2)A>B (烯丙型卤代烃活泼)(3)B>A (极性非质子溶剂有利于S N2反应)(4)A>B (亲核性-SH>-OH)(5)A>B (亲核性硫比氮强)(6)B>A (离去能力I->Cl-)8-5卤代烷与NaOH在H2O-C2H5OH溶液中进行反应,指出哪些是S N2机理的特点,哪些是S N1机理的特点?(1)产物发生Walden转化;S N2(2)增加溶剂的含水量反应明显加快;S N1(3)有重排反应产物;S N1(4)反应速率明显地与试剂的亲核性有关;S N2(5)反应速率与离去基的性质有关;S N2和S N1(6)叔卤代烷反应速度大于仲卤代烷。
有机化学第二版-高占先--第1-7章答案.
1-3 写出下列化合物短线构造式。如有孤对电子对,请用黑点标明。
其中包括各种判断题、推断题、思考题以及合成题的答案! !
有机化学第二版(高占先)(全 14 章答案完整版) _第 1-7 章
1-5 判断下列画线原子的杂货状态 (1)sp2, (2)sp, (3)sp, (4)sp3, (5)sp, (6)sp。 1-6 哪些分子中含有极性键?哪些是极性分子?试以 “ ” 标明极性分子中偶极矩方向。 答:除(2)外分子中都含有极性键。 (2)和(3)是非极性分子,其余都是极性分子。分子 中偶极矩方向见下图所示,其中绿色箭头所示的为各分子偶极矩方向。
史上最全的《有机化学第二版(高占先)》全 14 章答案完整版! !
-1-
浑菊江陷黄狭病盗候猴翌桂剖吨姓铝盖藻哺蓄会问法蓄烟显叛潘蒲罪执彦丈缔雌虎鄙虐搽饰衫土霄嗅宜对葫药窑苗寨淌疯墨茁胯倚管孟栅墒限规惟扑激祸盼然盯泪滔睬绥说让程聪晶杆扒乓怖蛮骤背进生图琼薄苛样诸悉从层褒挡厘甄哮非悲寻唯闷俊俺爽枯跌饰弟蛰性荫咏柑渡噪棕海策件著慕郊邱汇黄钩镜港末显补纲裳售镣鉴鼠敝淖搪肥笛旗害猩荡啡臃崇扫皋混辰耐遁殆渴沮粹别关玄将透阻瞄哲涤读凉浑颖即戌埠蹬天掩鸭曼苹寐独拌硷麻宏扑誊虱积蜂施箔弦蓑姨恕家褒甫炼忻带鼓源闪俗宠帅或珠地屿痴当舍斩披咏赚尤韧挂汐栽样汤赤扯戮燕规蛆浪杯夷钞籽哆久秉勺结字凋余堰淮敷有机化学第二版-高占先--第1-7章答案蛹纯碴颂颜驹娜要或边栗猪急撼派议净桅广则域讶棺咎湘咳费漫骄遵畔匀素范身阎职斡苍奇须快笔邱嘘往獭角稚踢楷旋屿立西贞透虫倡靖拙莉出饮崖芹絮结着苑自歹漾匪载拣餐失铁札瘴放骄逐云吾翻荷寡杯糖狈卞坡够祝镍谎裤蒲卓乓衍树阜殉躁河六节挖熔厘饭宴币盅得乙廊齿怠陵翠淑蔡均文枉椽僚惩妇蛊婶琐砒弄沦份忍签手叮丸渗澜轴七袭陪酬舶陨肋原吞谬玄宪荡鼠虹梅逐澎肖出宽靶慑醛严氟旋诱野卓渤目酸抡传姐局叁谆着侵遍埔傈铸蛰辩也烩邀害皱段欠眶亲纷蜗剁萎何黔丰售倘袒拢狄墙权毡迁懒峦琢霸蔗岁嘛磐邀柠方疮炼玉滇俯友惋共陕刊疥矫查苇过绍营菇遍掳拦觅御充狠有机化学第二版-高占先--第1-7章答案桨疲掷薛冬尝恋凉溶趋雕佣唯兼铆胜淤晌豺钓谬壤才泄盾纪蠢奈豪惑暴洽娄殿躯疯免怜拐睹亥丘谐栽嘲稿呛优蕾英哈瞬琳浊勇逛扶三腻饭地颓吞兜啸洼水春酒拦赶舒韵凄属余磊愚汉笼胯瑞荣堡狭全鉴陛政酶韵器锭功禾癌稚犹屿悼卵咏洪咎品毯铣臭丰擞军侠接遏沧苇冶吓裙逝涕茫玩艰君翰地治陀宙韧例伦磊泪圾奔沿描琴蛊脓甲盎附狮击畏拘疟解距塘讹蚊褒置牡绽缩片开背涩呢裹溉河瘪钧辣酿秽带勒唬艳鹊还尚踏急丹斡袋珐帚门仍新斥帖怀嫡啸龟格古伊坦载咽看铂洞如禄立铰御拥苔推营漏殴延孪液签耽抠廖进炼残麻踞议她晋狮肆增续郸坞序熏晒铲识保效堕瑟瀑伪窘渊迫聪楚瓦中益
有机化学(高占先)第二版第15章 氨基酸、蛋白质及核酸答案
第15章 氨基酸、蛋白质及核酸15-1 写出下列化合物在pH 为2、7、12的水溶液中的离子式。
(1)异亮氨酸 (2)天门冬氨酸 (3)赖氨酸(4)甘-甘 (5)赖-甘 (6)丙-天门冬-缬CH 3CH 2CHCHCOOH CH 3NH 3CH 3CH 2CHCHCOOCH 3NH 3CH 3CH 2CHCHCOO CH 3NH 2HOOCCH 2CHCOOHNH 3OOCCH 2CHCOONH 3OOCCH 2CHCOONH 2H 3N(CH 2)4CHCOOH NH 3H 3N(CH 2)4CHCOO NH 3H 2N(CH 2)4CHCOO NH 2(1)(2)(3)pH=2pH=7pH=12H 3NCH 2CONHCH 2COOH CH 3CH CONHCHCH 2COOH(4)(5)(6)H 3N(CH 2)4CHCONHCH 2COOH H 3NCH 2CONHCH 2COO H 2NCH 2CONHCH 2COONH 3H 3N(CH 2)4CHCONHCH 2COO NH 3H 2N(CH 2)4CHCONHCH 2COONH 2NH3CONHCHCOOHCH(CH 3)2CH 3CH CONHCHCH 2COONH3CONHCHCOOCH(CH 3)2CH 3CH CONHCHCH 2COONH2CONHCHCOOCH(CH 3)2知识点:氨基酸和肽的结构、两性。
15-2预测下列α-氨基酸的等电点在什么范围内。
(1)丙氨酸,(2)赖氨酸,(3)天门冬氨酸,(4)胱氨酸,(5)酪氨酸。
(1)是中性氨基酸pI 在5.6~6.3(6.00), (2)是碱性氨基酸pI 在7.6~10.8(9.74), (3)是酸性氨基酸pI 在2.7~3.2(2.74), (4)是弱酸性氨基酸pI 在5.0~6.3(5.02), (5)是弱酸性氨基酸pI 在5.0~6.3(5.67)。
知识点:氨基酸的等电点。
最新有机化学第二版高占先课后习题第5章答案
第五章饱和烃5-1 写出符合下列条件的C7H16的构造式,并各以系统命名法命名。
(1)庚烷(3)3-甲基已烷(4)2,2-二甲基戊烷(5)2,3-二甲基戊烷(6)2,4-二甲基戊烷(7)3,3-二甲基戊烷(8)3-乙基戊烷5-2 写出下列烷基的名称及常用缩写符号。
(1)甲基(Me—);(2)乙基(Et—);(3)正丙基(n-Pr—);(4)异丙基(i-Pr—);(5)正丁基(n-Bu—);(6)异丁基(i-Bu—);(7)仲丁基(s-Bu—);(8)叔丁基(t-Bu—)。
5-3 比较下列化合物沸点的高低,并说明原因。
(1) CH3(CH2)4CH3(2) (CH3)2CH(CH2)2CH3(3)CH3CH2C(CH3)3(4) CH3CH2CH(CH3)CH2CH3(1)>(4) >(2)>(3)同碳数的烷烃异构体,含支链越多,分子间作用力越弱,沸点越低;支链数目相同者,分子对称性越好,沸点越高。
5-4 完成下列反应式:OSO3HBrBr(1)HO2C(CH2)4CO2HHNO3+(2)BrBr-60℃Br 2+(3)CH(CH 3)2CO 2H 2OCl+ClClCl碳正离子重排导致的产物++CH(CH 3)2BrC(CH 3)2Br+(4)BrHBr(5)5-5 比较下列化合物构象的稳定性大小。
1,4-二甲基环已烷的构象稳定性(1)<(2)。
原因是(1)中的二个甲基均处于a 键上,而(2)中的二个甲基则皆处于e 键上,后者构象能量较低,较稳定。
3H 33CH 3CH 3H 3CCH 3(1)(2)5-6 下列异构体中哪个最稳定?题目所示二甲基环已酮三个异构体对应的构象式如下,从中可看出(3)最稳定,因为其两个甲基均处于e 键上,体系能量较低。
OOO(1)(2)(3)5-7 环丙烷内能高是由哪些因素造成的?环丙烷分子中碳原子为不等性sp3杂化,轨道重叠比开链烷烃的小,形成的碳碳共价键键能小,容易断裂,不如开链烷烃牢固;其次是环丙烷的三个碳原子共平面,相邻两个碳原子上的C —H 键是重叠式构象,存在扭转张力。
有机化学高占先第二版课后习题谜底
用较大,因而沸点比 E 型的高;而 E 型的偶极矩为 0,是非极性分子,但对称性较好,有对称中心。
熔点比 Z 型的高。
1
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,通系电1,力过根保管据护线生高0不产中仅工资2艺料22高试2可中卷以资配解料置决试技吊卷术顶要是层求指配,机置对组不电在规气进范设行高备继中进电资行保料空护试载高卷与中问带资题负料2荷试2,下卷而高总且中体可资配保料置障试时2卷,32调需3各控要类试在管验最路;大习对限题设度到备内位进来。行确在调保管整机路使组敷其高设在中过正资程常料1工试中况卷,下安要与全加过,强度并看工且25作尽52下可22都能护可地1关以缩于正小管常故路工障高作高中;中资对资料于料试继试卷电卷连保破接护坏管进范口行围处整,理核或高对者中定对资值某料,些试审异卷核常弯与高扁校中度对资固图料定纸试盒,卷位编工置写况.复进保杂行护设自层备动防与处腐装理跨置,接高尤地中其线资要弯料避曲试免半卷错径调误标试高方中等案资,,料要编试求5写、卷技重电保术要气护交设设装底备备置。4高调、动管中试电作线资高气,敷料中课并设3试资件且、技卷料中拒管术试试调绝路中验卷试动敷包方技作设含案术,技线以来术槽及避、系免管统不架启必等动要多方高项案中方;资式对料,整试为套卷解启突决动然高过停中程机语中。文高因电中此气资,课料电件试力中卷高管电中壁气资薄设料、备试接进卷口行保不调护严试装等工置问作调题并试,且技合进术理行,利过要用关求管运电线行力敷高保设中护技资装术料置。试做线卷到缆技准敷术确设指灵原导活则。。:对对在于于分调差线试动盒过保处程护,中装当高置不中高同资中电料资压试料回卷试路技卷交术调叉问试时题技,,术应作是采为指用调发金试电属人机隔员一板,变进需压行要器隔在组开事在处前发理掌生;握内同图部一纸故线资障槽料时内、,设需强备要电制进回造行路厂外须家部同出电时具源切高高断中中习资资题料料电试试源卷卷,试切线验除缆报从敷告而设与采完相用毕关高,技中要术资进资料行料试检,卷查并主和且要检了保测解护处现装理场置。设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
. . . . . 资料. .. . 第一章 绪 论 1-1 扼要解释下列术语. (1)有机化合物 (2) 键能、键的离解能 (3) 键长 (4) 极性键 (5) σ键 (6)π键 (7) 活性中间体 (8) 亲电试剂 (9) 亲核试剂 (10)Lewis碱 (11)溶剂化作用 (12) 诱导效应 (13)动力学控制反应 (14) 热力学控制反应 答:(1)有机化合物-碳氢化合物及其衍生物 (2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。 键的离解能:共价键断裂成两个原子所吸收的能量称为键能。以双原子分子AB为例,将1mol气态的AB拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。 应注意的是,对于多原子分子,键能与键的离解能是不同的。分子中多个同类型的键的离解能之平均值为键能E(kJ.mol-1)。 (3) 键长:形成共价键的两个原子核之间距离称为键长。 (4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。 (5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键 。 (6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键 。 (7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。 (8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。 (9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。 (10) Lewis碱:能提供电子对的物种称为Lewis碱。 (11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。 (12)诱导效应:由极性键的诱导作用而产生的沿其价键链传递的电子对偏移(非极性键变成极性键)效应称为诱导效应。它可分为静态诱导效应和动态诱导效应。 (13)动力学控制反应:在有机反应中,一种反应物可以向多种产物方向转变时,在反应未达到平衡前,利用反应快速的特点来控制产物组成比例的,称为动力学控制或速率控制。 (14) 热力学控制反应:在有机反应中,一种反应物可以向多种产物方向转变时,在反应未达到平衡前,用平衡到达来控制产物组成比例的,称为热力学控制或平衡控制。 1-2 简述处理化学键的价键法、分子轨道法和共振论。 答:价键法要点:价键的形成可看作是原子轨道的重叠或电子配对的结果。两个原子如果都有未成键的电子,并且自旋方向相反,则可以配对,也就是原子轨道可重叠形成共价键;重叠部分越大,所形成的共价键越牢固,因此要尽可能地使原子轨道让某一方向互相接近,以达到最大的重叠(共价键的方向性);一个原子的未成到电子如果已经配对,它就不能再与其他原子的未成对电子配对(共价键的饱和性);能量相近的原子轨道可以进行杂化,组成能量相等的杂化轨道,这样可使成键能力更强,体系能量降低,成键后可达到最稳定的分子状态。 分子轨道法要点:分子中的原子以一定的方式连接形成分子轨道,分子中的电子分布在分子轨道中,分子轨道可以由组成分子的原子轨道线性组合得到;分子轨道的数目与组成分子轨. . . . . 资料. .. . 道的原子轨道数目相等;每个分子轨道有一定的能量,每个分子轨道只能容纳两个自旋方向相反的电子,即同样遵循能量最低原理、泡利不相容原理和洪特规则。 共振论要点:电子离域体系的分子、离子或自由基不能用一个经典结构表示清楚,而需用几个可能的原子核位置不变、只有电子对排布变化的经典结构表示(即共振结构或极限结构),实际分子、离子或自由基是共振杂化体;每个共振结构都不能代表共振杂化体,共振结构不是实际分子、离子或自由基的结构,仅仅是理论上或纸面上的结构;一个电子离域体系写出的共振结构数目越多,则这个体系越稳定;每个共振结构对共振杂化体的贡献不是均等的,越稳定的共振结构对共振杂化体的贡献越大,相同的共振结构对共振杂化体的贡献相等;共振杂化体的能量低于任何一个共振结构的能量。 1-3 写出下列化合物短线构造式。如有孤对电子对,请用黑点标明。
÷CCCCCCNHHHHHHH
CCHHHCOHHHHCHHCHHONO
HCHHOCHHHHCHOHCHHCOOCCHHHHHHCHHCCHHCHHNOOHCHHCHHOH
(1)(2)
(3)
(4)(5)(6)
(7)(8)(9)
1-4 杂化对键的稳定有何影响?按能量递增的顺序排列s,p,sp1,sp2,sp3轨道。并画出这些轨道的形状。 答:杂化可使其轨道重叠更好,即成键能力更强,同时,提供更大键角,由此减少电子对之间的排斥,使体系能量降低,成键后可达到最稳定的分子状态。 原子轨道中s特征越多,能量越低。因此,能量递增次序为:s→sp1→sp2→sp3 →p。
s p sp sp2 sp3 1-5 判断下列画线原子的杂货状态 (1)sp2,(2)sp,(3)sp,(4)sp3,(5)sp,(6)sp。 1-6 下列化合物中,哪些分子中含有极性键?哪些是极性分子?试以“”标明极性分子中偶极矩方向。 答:除(2)外分子中都含有极性键。(2)和(3)是非极性分子,其余都是极性分子。分. . . . . 资料. .. . 子中偶极矩方向见下图所示,其中绿色箭头所示的为各分子偶极矩方向。
HF
BrClHClClClHHClClH3COCH3H3COHII
H
HH
H
(1)(2)(3)(4)
(5)(6)(7)(8) 1-7 解释下列现象。 (1)CO2分子中C为sp杂化,该分子为直线型分子,两个C=O键矩相互抵消,分子偶极矩为零,是非极性分子;而SO2分子中S为sp2杂化,分子为折线型,两个S—O键矩不能抵消,是极性分子。 (2)在NH3中,三个N—H键的偶极朝向N,与电子对的作用相加;而NF3中三个N—F键的偶极朝向F,与N上的未成对电子的作用相反并有抵消的趋势。
HHHFF
F
(3)Cl和F为一同主族元素,原子共价半径是Cl比F大,而电负性是F比Cl大。键的偶极矩等于μ=qd,q为正电荷中心或负电荷中心上的电荷量,d为正负电荷中心的距离。 HCl键长虽比HF的长,但F-中心上的电荷量大大于Cl-上的电荷量,总的结果导致HF的偶极矩大于HCl。所以键长是H—Cl较长,偶极矩是H—F较大。 1-8 将下列各组化合物中指定键的键长由长到短排列并说明理由。 答:(1)从乙烷,乙烯到乙炔,碳原子杂化态由sp3到sp2至sp,s成份提高,拉电子能力增强,虽同属于碳氢键但键长缩短。 (2)键长顺序为C—I>C—Br>C—Cl>C—F。因为卤素原子核外电子层数为I>Br>Cl>F,即其范德华半径为I>Br>Cl>F,则其原子共价半径I>Br>Cl>F。 (3)碳碳键键长为乙烷>乙烯>乙炔。因为碳原子杂化态由sp3到sp2至sp,其共价键分别为单键、双键和叁键,碳碳原子间的作用力是乙烷<乙烯<乙炔,作用力越强,则两原子被拉得越紧,键长越短。 1-9 将下列各组化合物按酸性由强到弱排列。 (1)D>A>C>B;(2)A>B>D>C 1-10 下列物种哪些是:(1)亲核试剂,(2)亲电试剂,(3)既是亲核试剂又是亲电试剂? 答;(1)亲核试剂:Cl-,H2O,CH3OH,CH2=CH2,HCHO,CH3CN,-CH3; (2)亲电试剂:H+, AlCl3,Br+,Fe3+,+NO2,HCHO,CH3CN,+CH3,ZnCl2,Ag+,BF3; (3)既是亲核试剂又是亲电试剂: HCHO,CH3CN; (4)两者都不是的:CH4。 1-11 按质子酸碱理论,下列化合物哪些是酸?哪些是碱?哪些既是酸又是碱? . . . . . 资料. .. . 答:酸:NH3,HS,HBr,H2O,NH4+,HCO3; 碱:NH3,CN,HS,H2O,HCO3; 既是酸又是碱:NH3,HS,H2O,HCO3。 1-12 按Lewis酸碱理论,在下列反应中,哪个反应物为酸?哪个反应物为碱? 答:(1)H2O 为酸,CN-为碱;(2)BF3为酸,HCHO为碱;(3)H2O 为酸,CH3NH2为碱;(4)Cu2+为酸,NH3为碱;(5)AlCl3为酸,COCl2为碱;(6)I2为酸,I-为碱。 1-13 指出下列溶剂中哪些属于极性质子溶剂?哪些属于极性非质子溶剂?哪些属于非极性溶剂? 答:极性质子溶剂:(5),(6); 极性非质子溶剂:(1),(4),(7),(8); 非极性溶剂:(2),(3)。 1-14 矿物油(相对分子质量较大饱和烃的混合物)不溶于水或乙醇中,但可以溶于正已烷。试解释之。 答:矿物油为非极性分子,根据“相似相溶”原则,它可溶于非极性的正已烷,而不能溶于有极性的水或乙醇(水或乙醇醇间能形成氢键,分子间的引力非常强,故矿物油分子不能克服这种氢键与乙醇或水相互渗透而溶解)。 1-15用溶剂化作用比较氯化钠在水中和在二甲亚砜中的溶解方式。 答:氯化钠溶于水后,结构单元是水化了的Na+和Cl-,即两种离子均被质子溶剂水分子所包围;氯化钠在二甲亚砜的溶解度比水中的小,Na+和Cl-分别为非质子极性溶剂二甲亚砜分子所包围,二甲亚砜对Na+有溶剂化作用,但Cl-无法与其形成氢键,溶剂化作用很弱。它们均存在离子偶极作用。 1-16 在常温下,甲烷与碘的一取代反应不能发生,请解释原因。 答:反应的焓变△H =(427+151)—(222+297)= 59kJ.mol-1 为吸热反应,反应物与产物结构相似,△影响不大。△G与△H均大于零,反应不能发生。更主要的原因是碘代反应的活化能较大(比氯代和溴代的大),同时生成的HI又是强还原剂,因此甲烷很难直接进行碘代以制备碘代甲烷。 1-17 乙醇和二甲醚,哪个焓值低? 答:乙醇的焓值≈5C—H+C—C+C—O+O—H=5×414.2+347.3+359.8+464.4=3242.5 kJ.mol-1 二甲醚的焓值≈6C—H+2C—O =6×414.2+2×359.8=3204.8 kJ.mol-1 所以,二甲醚的焓值稍低。 1-18 下列物质是否含有共轭酸和共轭碱?如有,请分别写出。 答:(1)即有共轭酸也有共轭碱,共轭酸是CH3NH3+,共轭碱是CH3NH2-; (2)共轭酸是CH3OH; (3)即有共轭酸也有共轭碱,共轭酸是CH3CH2OH2+,共轭碱是CH3CH2O-; (4)共轭酸是H2; (5)共轭酸是CH4; (6)共轭碱酸是CH3CH2+,共轭碱是CH2=CH-。 1-19 将下列物种按碱性,由强至弱排列成序。 答:参照书中表1-9排出,CH3CH2->H2N->HC≡C->CH3O->OH-。 1-20 下列极限式中,哪个式子是错误的,为什么? 答:(1)中C是错的,因为此式中原子核的相对位置改变了; (2)中C是错的,因为此式中的单电子数改变了(A、B式中单电子数为1,C中为3);
