生物化学专题

生物化学专题
共价修饰酶
共价调节是利用蛋白质的共价变化来调节酶的活性的,有些共价变化是可逆的,如蛋白质的磷酸化;有些则是不可逆的,如酶原激活
(一)可逆共价修饰的调控(共价调节酶)
共价调节酶:酶分子被其它的酶催化进行共价修饰,从而在活性形式与非活性形式之间相互转变。有多种类型: 1 ser thr tyr 残基的磷酸化
2 thr 残基的腺苷酰化
3 arg cys 残基的ADP-核糖基化
其中磷酸化是最普遍,发生最多的,真核细胞的1/2~1/3的蛋白质被磷酸化,在这个过程中,有两种酶参与反应,一种是蛋白激酶,催化蛋白质发生磷酸化反应;另一种是蛋白质磷酸酶,催化蛋白质的去磷酸化反应。
共价调节与别构调节的区别:
1 共价修饰系统能把调节物的效应放大,即级联放大效应
2 共价修饰系统有较大的能力进行生物学整合,能把胞内代谢和胞外刺激(包括电刺激)联系起来,别构调节作用于胞内,特点在于灵敏、迅速;共价调节也作用于胞内但是涉及整体,在数分钟或者更长时间内起作用。
(二)不可逆的共价调节(酶原的激活)
有些蛋白质合成时不具有活性,经蛋白酶专一性作用后,构象发生变化,变成有活性的蛋白。这种不具生物活性的蛋白质称为前体。如果活性蛋白质是酶,这个前体就称为酶原。特点是不可逆。属于此类的有
*消化系统中的酶(胰蛋白酶,胰凝乳蛋白酶,胃蛋白酶)
*血液凝固系统中的酶
*某些蛋白质激素,如胰岛素由胰岛素原激活而成
*存在于皮肤和骨骼中的纤维蛋白——胶原,由前胶原激活而成。
例如:
胰蛋白酶原
肠激酶
胰凝乳蛋白酶原弹性蛋白酶原
胰蛋白酶
胰凝乳蛋白酶弹性蛋白酶
羧肽酶原羧肽酶
RNA转录调控(主要为原核生物转录调控)
⑴转录水平
⑵翻泽水平
⑶加工水平转录后加工、翻译后加工
⑷蛋白质活性调节
其中最关键的是⑴,基因表达的控制主要发生在转录水平,原核生物尤其如此。所以RNA转录调控专门列出
(一)几个重要概念
操纵子:在细菌基因组中,编码一组在功能上相关的蛋白质的几个结构基因,与共同的控制位点组成的一个基因表达的协同单位,称为操纵子。
结构基因(S structural gene):表达一种或功能相关的几种蛋白的基因
控制位点:操纵基因(O operator)
启动子(P promotor)位于操纵基因上游,为RNA聚合酶结合位点。
调节基因(R regulator gene):可转录翻译出诱导(或阻遏蛋白),控制操纵基因的开与关。
调节基因启动子操纵基因结构基因结构基因结构基因......结构基因R P O S1 S2 S3 ....... Sn
正调控和负调控
在没有调节蛋白存在时,基因是关闭的,加入调节蛋白后,基因表达被开启,此为正调控。
在没有调节蛋白存在时,基因是表达的,加入调节蛋白后,基因表达被关闭,此为负调控。
在正调控中,调节蛋白称诱导蛋白。
在负调控中,调节蛋白称阻遏蛋白。
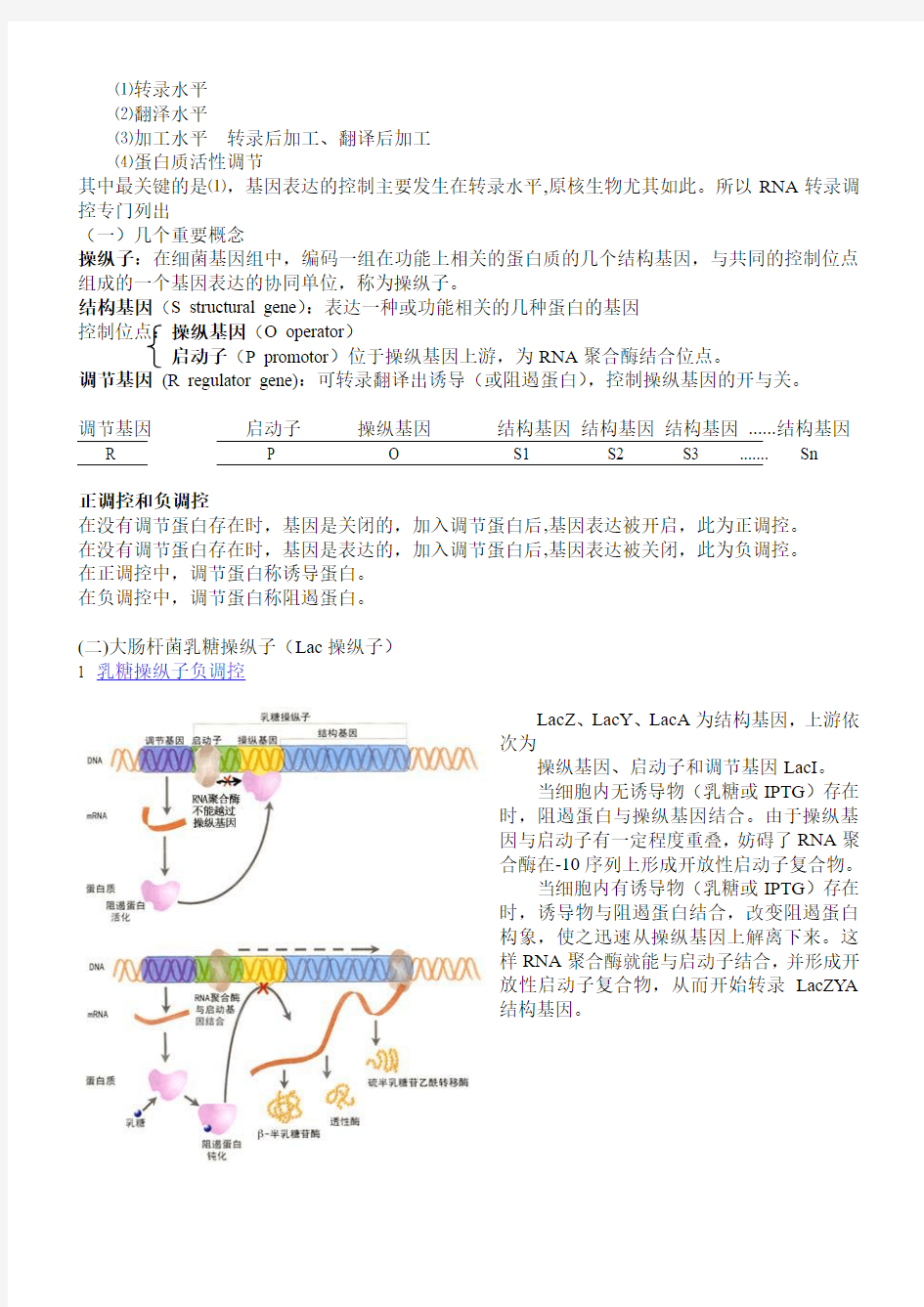
(二)大肠杆菌乳糖操纵子(Lac操纵子)
1 乳糖操纵子负调控
LacZ、LacY、LacA为结构基因,上游依
次为
操纵基因、启动子和调节基因LacI。
当细胞内无诱导物(乳糖或IPTG)存在
时,阻遏蛋白与操纵基因结合。由于操纵基
因与启动子有一定程度重叠,妨碍了RNA聚
合酶在-10序列上形成开放性启动子复合物。
当细胞内有诱导物(乳糖或IPTG)存在
时,诱导物与阻遏蛋白结合,改变阻遏蛋白
构象,使之迅速从操纵基因上解离下来。这
样RNA聚合酶就能与启动子结合,并形成开
放性启动子复合物,从而开始转录LacZYA
结构基因。
2 乳糖操纵子正调控
在启动子上游有CAP结合位点,当大肠杆菌从以葡萄糖为碳源的环境转变为以乳糖为碳源的环境时,cAMP浓度升高,与CAP结合,使CAP发生变构,CAP结合于乳糖操纵子启动序列附近的CAP结合位点,激活RNA聚合酶活性,促进结构基因转录,调节蛋白结合于操纵子后促进结构基因的转录,对乳糖操纵子实行正调控,加速合成分解乳糖的三种酶。
3调节机制
大肠杆菌根据碳源性质选择代谢方式。
倘若有葡萄糖存在时,细菌优先选择葡萄糖供应能量。葡萄糖通过降低cAMP浓度,阻碍cAMP 与CAP结合而抑制乳糖操纵子转录,使细菌只能利用葡萄糖。
在没有葡萄糖而只有乳糖的条件下,阻遏蛋白与O序列解聚,CAP结合cAMP后与乳糖操纵子的CAP位点,激活转录,使得细菌利用乳糖作为能量来源。
DNA一级结构分析及PCR技术
DNA测序的生物学意义
DNA是遗传信息的储存者和传递者,遗传信息是由碱基序列体现的,碱基序列略有改变,即可引起遗传信息的显著改变。所以DNA测序是研究DNA功能的基础。
DNA测序的实验方法
双脱氧终止法(Sanger法)
[原理]DNA 测序
DNA聚合酶催化的DNA链延伸是在3’-OH末端上进行的。由于2’,3’-双脱氧三磷酸核苷酸(ddNTP)的3’-位脱氧而失去游离-OH,当它参入到DNA链后,3’-OH末端消失,使DNA链的延伸终止。
本实验根据此原理,将待测DNA片段插入单链噬菌体M13载体,并用合成的寡聚核苷酸引物与该载体上插入待测片段的上游顺序退火,随后在T7DNA聚合酶催化下进行延伸反应。实际操作中同时进行,分别终止于A、G、C和T的4个反应体系。每个反应体系均含4种脱氧三磷酸核苷酸(dNTP)底物,其中—种dATP为32P标记物,以便能用放射自显影法读序。但在这4个反应体系中,分别加一种低浓度的ddNTP(ddATP、ddGTP、ddCTP或ddTTP),这样ddNTP 可随机参入正在延伸的DNA链上,使链延伸终止。例如在“A”管中加ddATP,反应结束时,管内所有新合成的DNA链都是以A结尾的不同长度的片段,而且这些片段都带放射性。将反应物加在高分辨凝胶上电泳,DNA片段则因其长度不同(分子量大小不同)被分离,短的走在前端,长的泳动在后面。其他3管则分别为以G,C或T结尾的不同长度DNA片段。
由于:①即使是长短相差一个核苷酸的DNA片段,亦可根据其电泳距离的差异而加以区分;
②A、G、C和T4种反应体系的产物在电泳凝胶中相邻排列。故而在阅读凝胶电泳的
放射自显影图像时,由下至上按前后顺序即可将DNA的核苷酸顺序读出。
[操作]
1.单链模板与引物退火
(1)用无菌蒸馏水按1:5稀释通用引物(约4.44μg/ml)。
(2)取1.5ml微量离心管1只,加入下列试剂:模板DNA(1.5-2ugDNA/10μl)10μl;稀释通用引物2μl;退火缓冲液2μl,总体积14μl。
2.链延伸/终止反应
(1)稀释T7DNA聚合酶:取2μl(或4μl)冷的酶稀释缓冲液至1只微量离心管中,加入0.5μl(或lμl)T7DNA聚合酶,用加样器轻轻抽吸和排出而混匀,臵冰浴中待用。
(2)另取4只微量离心管,分别用记号笔标明“A”、“G”、“C”和“T”。依次将A-Mix、G-Mix、C-Mix和T-Mix液各2.5μl分别加入这4只微量离心管中,臵37℃预温1分钟以上 (说明:4种mix液各又分为short和long两种,前者中ddNTP浓度较高,用于<500bp的DNA片段的测序,后者用于50-1000bp片段的测序。一般应用short即可)。
(3)标记反应:在操作(1)的微量离心管中加入下列试剂:模板/引物14μl(已有);标记用混合物(1abellingmix)3μ1;已标记混合物(1abelled mix)1μ1,T7DNA聚合酶稀释液2μ1。总体积20μ1。
轻轻混匀,简短离心,臵室温5分钟,立即接下步反应。
(4)从“标记反应”混合物中,分别取4.5μl加于4只预温的反应液中(注意:每一次转移均应换用新的吸头),轻轻混匀。简短离心,37℃保温5分钟。
(5)向每只离心管中加入5μl反应终止液,混匀,简短离心。
(6)变性反应:在电泳前进行。在上述链延伸反应终止后,最好即时进行变性反应并电泳,如不能及时电泳,终止反应后样品可储于冰浴或4℃。
另取4只微量离心管,标好“A”、“G”、“C”和“T”。从上述每一链延长/终止反应的试管中取3
电泳。
3.制备电泳凝胶及电泳
(1)制备胶模:取双块制胶玻板,先用泡沫海绵沾“洗洁净”液仔细擦洗,用水彻底淋洗,干燥后继用酒精清洗,晾干,再用硅烷剂(repel-silane)将玻板的—面擦一遍,蒸馏水淋洗,干燥 (注意:清洗时应戴一次性手套操作)。
将其中一块玻板平臵台上(硅烷处理过的—面朝上),两侧各放臵一条隔离条(最好选用上方厚为0.2mm,下方厚0.4mm的楔形条),另取—块玻板(硅烷化处理过的—面朝下),对准放臵在上述玻板上,两侧及—面边缘用胶带封严,并用文具夹夹紧,制成胶模。
(2)配制电泳凝胶:向1只100ml烧杯中加入下列试剂;20%丙烯酰胺溶液20ml;10×TBE缓冲液5ml;46.7%尿素溶液25ml。总体积50ml(凝胶的丙烯酰胺浓度为8%)。混匀,过滤除去不溶物,臵100ml梨形瓶中连接水泵抽气5分钟,加入250μl 10%过硫酸铵,50μlTEMED混匀。
(3)注胶:立即将配好的凝胶用50ml注射器小心注入制好的玻板胶模中(胶模宜倾斜45度左右),注意防止气泡,如有气泡产生,可敲击该部位玻璃,使气泡上升排除。从上面插入梳齿背,深入胶面约10-12mm。将胶模水平放臵45-60分钟,待凝胶聚合。
(4)电泳:凝胶聚合后,拨掉梳齿,撕去玻板下缘胶带,用蒸馏水淋洗凝胶表面,以除去未聚合物质。将胶板装臵在电泳槽上,上下槽加入缓冲液,注意排除凝胶下缘气泡。接通电源,40W预电泳45-60分钟。预电泳结束后,断电。插入样品梳,梳齿向下插入凝胶中3mm左右。用缓冲液小心冲洗每一加样小槽(齿间空隔),用记号笔标明A、G、C和T4个小槽,每槽加入变性后的链延伸/终止液1.5-2μl。接通电源,40W恒压,电泳至示踪染料溴酚蓝至底边时切断电源。如待测片段较长而需继续点样,则等示踪染料二甲苯腈蓝称至距下缘4-5cm时切断电源,用缓冲液冲洗另一组4个加样小槽(应与前一组相隔1-2个加样小槽),重复上样操作,然后继续电泳至第2组示踪染料溴酚蓝移至玻板下缘时断电,停止电泳。
4.放射自显影及结果分析
将凝胶板自电泳槽取下后水平放臵,小心分离两块玻板,让凝胶完好地留在其中一块玻板上。
可将凝胶切下一小角以示方向。
在凝胶上小心地覆盖一张厚的3号新华滤纸,移去玻板,在凝胶另一面覆盖一张保鲜膜,注意排除气泡。滤纸面朝下臵凝胶干燥器中干燥。
于暗室中,将干燥的凝胶的保鲜膜面与一张X光底片的药膜面贴合,夹在增感屏盒中,臵70℃或室温曝光4-16小时,然后显影、定影(按所用显影及定影剂说明进行),水漂洗、干燥。然后由下而上读序。
PCR技术PCR 原理动画
聚合酶链反应(Polymerase Chain Reaction ,PCR)是80年代中期发展起来的体外核酸扩增技术。它具有特异、敏感、产率高、快速、简便、重复性好、易自动化等突出优点;能在一个试管内将所要研究的目的基因或某一DNA片段于数小时内扩增至十万乃至百万倍,使肉眼能直接观察和判断;可从一根毛发、一滴血、甚至一个细胞中扩增出足量的DNA供分析研究和检测鉴定。
PCR技术基本原理
类似于DNA的天然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物。
PCR由变性--退火--延伸三个基本反应步骤构成:
①模板DNA的变性:模板DNA经加热至93℃左右一定时间后,使模板DNA双链或
经PCR扩增形成的双链DNA解离,使之成为单链,以便它与引物结合,为下轮反应
作准备;
②模板DNA与引物的退火(复性):模板DNA经加热变性成单链后,温度降至55℃左
③引物的延伸:DNA模板--引物结合物在TaqDNA聚合酶的作用下,以dNTP为反应
原料,靶序列为模板,按碱基配对与半保留复制原理,合成一条新的与模板DNA 链
互补的半保留复制链
重复循环变性--退火--延伸三过程,就可获得更多的“半保留复制链”,而且这种新链又可成为下次循环的模板。每完成一个循环需2~4分钟,2~3小时就能将待扩目的基因扩增放大几百万倍。
PCR反应体系与反应条件
标准的PCR反应体系:
10×扩增缓冲液10ul
4种dNTP混合物各200umol/L
引物各10~100pmol
模板DNA 0.1~2ug
Taq DNA聚合酶 2.5u
Mg2+ 1.5mmol/L
加双或三蒸水至100ul
PCR反应五要素:引物、酶、dNTP、模板和Mg2+
引物:引物是PCR特异性反应的关键,PCR 产物的特异性取决于引物与模板DNA互补的程度。理论上,只要知道任何一段模板DNA序列,就能按其设计互补的寡核苷酸链做引物,利用PCR就可将模板DNA在体外大量扩增。
设计引物应遵循以下原则:
①引物长度: 15-30bp,常用为20bp左右。
②引物扩增跨度:以200-500bp为宜,特定条件下可扩增长至10kb的片段。
③引物碱基:G+C含量以40-60%为宜,G+C太少扩增效果不佳,G+C过多易出现非特异条带。ATGC 最好随机分布,避免5个以上的嘌呤或嘧啶核苷酸的成串排列。
④避免引物内部出现二级结构,避免两条引物间互补,特别是3’端的互补,否则会形成引物二聚体,产生非特异的扩增条带。
⑤引物3’端的碱基,特别是最末及倒数第二个碱基,应严格要求配对,以避免因末端碱基不配对而导致PCR失败。
⑥引物中有或能加上合适的酶切位点,被扩增的靶序列最好有适宜的酶切位点,这对酶切分析或分子克隆很有好处。
⑦引物的特异性:引物应与核酸序列数据库的其它序列无明显同源性。
引物量:每条引物的浓度0.1~1umol或10~100pmol,以最低引物量产生所需要的结果为好,引物浓度偏高会引起错配和非特异性扩增,且可增加引物之间形成二聚体的机会。
酶及其浓度目前有两种Taq DNA聚合酶供应,一种是从栖热水生杆菌中提纯的天然酶,另一种为大肠菌合成的基因工程酶。催化一典型的PCR反应约需酶量2.5U(指总反应体积为100ul时),浓度过高可引起非特异性扩增,浓度过低则合成产物量减少。
dNTP的质量与浓度dNTP的质量与浓度和PCR扩增效率有密切关系,dNTP粉呈颗粒状,如保存不当易变性失去生物学活性。dNTP溶液呈酸性,使用时应配成高浓度后,以1M NaOH或1M Tris。HCL的缓冲液将其PH调节到7.0~7.5,小量分装, -20℃冰冻保存。多次冻融会使dNTP降解。在PCR反应中,dNTP应为50~200umol/L,尤其是注意4种dNTP的浓度要相等( 等摩尔配制),如其中任何一种浓度不同于其它几种时(偏高或偏低),就会引起错配。浓度过低又会降低PCR产物的产量。dNTP能与Mg2+结合,使游离的Mg2+浓度降低。
方法通常采用SDS和蛋白酶K来消化处理标本。SDS的主要功能是:溶解细胞膜上的脂类与蛋白质,因而溶解膜蛋白而破坏细胞膜,并解离细胞中的核蛋白,SDS 还能与蛋白质结合而沉淀;蛋白酶K能水解消化蛋白质,特别是与DNA结合的组蛋白,再用有机溶剂酚与氯仿抽提掉蛋白质和其它细胞组份,用乙醇或异丙醇沉淀核酸。提取的核酸即可作为模板用于PCR反应。一般临床检测标本,可采用快速简便的方法溶解细胞,裂解病原体,消化除去染色体的蛋白质使靶基因游离,直接用于PCR扩增。RNA模板提取一般采用异硫氰酸胍或蛋白酶K法,要防止RNase降解RNA。Mg2+浓度Mg2+对PCR扩增的特异性和产量有显著的影响,在一般的PCR反应中,各种dNTP浓度为200umol/L时,Mg2+浓度为1.5~2.0mmol/L为宜。Mg2+浓度过高,反应特异性降低,出现非特异扩增,浓度过低会降低Taq DNA聚合酶的活性,使反应产物减少。
PCR反应条件的选择
PCR反应条件为温度、时间和循环次数。
5’3’
3’5’
94℃变性1min
3’5’5’3’
50℃退火1min
循环35~40次
3’53’
72℃延伸2min
5’3’
3’5’
PCR产物的分析
可依据研究对象和目的不同而采用不同的分析方法。
凝胶电泳分析:PCR产物电泳,EB溴乙锭染色紫外仪下观察,初步判断产物的特异性。PCR产物片段的大小应与预计的一致,特别是多重PCR,应用多对引物,其产物片断都应符合预讦的大小,这是起码条件。
琼脂糖凝胶电泳:通常应用1~2%的琼脂糖凝胶,供检测用。
聚丙烯酰胺凝胶电泳:6~10%聚丙烯酰胺凝胶电泳分离效果比琼脂糖好,条带比较集中,可用于科研及检测分析。
酶切分析:根据PCR产物中限制性内切酶的位点,用相应的酶切、电泳分离后,获得符合理论的片段,此法既能进行产物的鉴定,又能对靶基因分型,还能进行变异性研究。
分子杂交:分子杂交是检测PCR产物特异性的有力证据,也是检测PCR 产物碱基突变的有效方法。Southern印迹杂交:在两引物之间另合成一条寡核苷酸链(内部寡核苷酸)标记后做探针,与PCR 产物杂交。此法既可作特异性鉴定,又可以提高检测PCR产物的灵敏度,还可知其分子量及条带形状,主要用于科研。
斑点杂交:将PCR产物点在硝酸纤维素膜或尼膜薄膜上,再用内部寡核苷酸探针杂交,观察有无着色斑点,主要用于PCR产物特异性鉴定及变异分析。
核酸序列分析:是检测PCR产物特异性的最可靠方法
分离纯化实验(蛋白质、核酸、酶)
?蛋白质的抽提材料预处理及细胞破碎(机械、渗透、反复冻融、超声波、酶法)
粗分离(盐析、等电点沉淀、有机溶剂沉淀、超滤、吸附)
细分离(见下分离纯化方法)
电泳法SDS 聚丙烯酰胺凝胶电泳
等电聚焦
双向电泳
脉冲电泳
?蛋白质分离
纯化主要方法层析法凝胶过滤层析
离子交换层析
亲和层析
离心法差速离心
速率区带离心
电泳法聚丙烯酰胺凝胶电泳:RNA和小于1kb的DNA片段
琼脂糖凝胶电泳:DNA,迁移率:超螺旋DNA> 线形DNA >环形DNA
脉冲电泳:可达104kb的DNA
?核酸分离纯化
主要方法层析法羟基磷灰石柱层析:除去核酸混合物中的RNA和蛋白质、
结合温度改变,可按碱基组成分离DNA
亲和层析: 分离带有特定序列的核酸,如poly(A)mRNA
离心法---氯化铯密度梯度超离心:分子密度梯度:
RNA >超螺旋DNA>环形DNA >线形DNA >蛋白质
紫外吸收法:280nm处有最大吸收
280nm-260nm吸收差法:蛋白质浓度(g/ml)=1.45OD280-0.74OD260凯氏定氮:
()
?蛋白质含量G-250(红棕色)
测定考马斯亮蓝染料结合法:Pr(10-100μg/ml) 蓝色复合物(正比)595nm比色
Cu2+
双缩脲法:双缩脲OH- 紫色复合物(正比)灵敏度差可用来快速鉴定
紫外吸收法:RNA(μg/ml):A
260
/(0.024*L)*稀释倍数
DNA(μg/ml):A
260
/(0.020*L)*稀释倍数
C
U SO
4
、K
2
SO
4
钼酸根还原剂
定磷法:H
3PO
4
+H
2
SO
4
△H
2
O
2
P(无机) H+磷钼酸复离子鉬蓝
660nm比色
?核酸含量浓HCl 3,5-二羟基甲苯(地衣酚)
测定定糖法:RNA △核糖糠醛绿色复合物670nm比色
FeCl
3,CuCl
2
H+ H+ H+
二苯胺法:DNA △脱氧核糖β,ω-羟基-1-酮基戊醛二苯胺蓝色物质595nm比色
?酶的分离纯化(见蛋白质部分)要注意:
为保持酶活力不受损失,操作应在(0℃~5℃)低温下进行,如用有机溶剂分离,温度应
更低(-20℃~-15℃)
为防止重金属离子使酶失活,需向抽提液中加入少量(EDTA)
为防止酶分子-SH被氧化,需加少量(巯基乙醇)
分离纯化的酶如需长期保存,需用(冰冻法)干燥除去水分,制成酶干粉,在低温下保存
动物生物化学试卷试题最新完整标准包括答案.docx
动物生物化学试题(A) 2006.1 一、解释名词(20分,每小题4分) 1. 氧化磷酸化 2.限制性核酸内切酶 3. Km 4.核糖体 5.联合脱氨基作用 二、识别符号(每小题 1 分,共 5 分) 1.SAM 2.Tyr 3.cDNA 4.PRPP 5.VLDL 三、填空题(15分) 1.蛋白质分子的高级结构指的是( 1分), 稳定其结构的主要作用力有(2分)。 2.原核生物的操纵子是由(1分 ) 基因,(1分 ) 基因及其下游 的若干个功能上相关的( 1 分)基因所构成。 3.NADH呼吸链的组成与排列顺序为 ( 3 分)。 4.酮体是脂肪酸在肝脏中产生的不完全分解产物,包括( 1分), ( 1 分)和( 1 分),在肝外组织中
利用。 5.脂肪酸的氧化分解首先要( 1 分)转变成脂酰辅酶A,从胞浆转入线粒 体需要一个名为( 1 分)的小分子协助;而乙酰辅酶 A 须经过 ( 1 分)途径从线粒体转入胞浆合成脂肪酸。
四、写出下列酶所催化的反应,包括所需辅因子,并指出它所在的代谢途径 (10分) 1. 氨甲酰磷酸合成酶I 2.谷丙转氨酶 五、问答题(50分) 1.什么是蛋白质的变构作用(4 分),请举例说明( 4 分)。(8 分) 2. 以磺胺药物的抗菌作用为例( 4 分),说明酶的竞争抑制原理( 4 分)。(8 分) 3. 一摩尔的乙酰辅酶A经过三羧酸循环完全氧化分解可以生成多少ATP?( 3 分)请说 明理由( 5 分)。(8分) 4. 比较在原核生物DNA复制过程中DNA聚合酶III和聚合酶I 作用的异同。(8分) 5.真核基因有什么特点,简述真核生物mRNA转录后的加工方式。(8分) 6.简述由肾上腺素经PKA途径调控糖原分解代谢的级联放大机制。(10分)
植物生理生化实验
《植物生理生化实验》复习习题 一、名词解释: 标准曲线:用标准溶液制成的曲线。 先配制一系列不同浓度的标准溶液, 在溶液最大吸收波长下,逐一测定吸光度, 然后用坐标纸以溶液浓度为横坐标,吸光度为纵坐标作图,若被测物质对光的吸收符合光的吸收定律,必然得到一条通过原点的直线,即标准曲线。 斐林(Folin)-酚试剂法:又称lowry法,它结合了双缩脲试剂和酚试剂与蛋白质的反应,是双缩脲方法的进一步发展,可利用其在650nm波长下的特定吸收进行比色测定。 茚三酮显色法: 游离氨基酸与茚三酮共热时,能定量生成紫色的二酮茚-二酮茚胺。其吸收峰在570nm,而且在一不定期范围内吸光度与游离氨基酸浓度成正比,因此可用分光光度法测定其含量。 茚三酮溶液与氨基酸共热,生成氨。 氨、茚三酮与还原性茚三酮发生反应,生成紫色化合物。 该化合物颜色的深浅与氨基酸的含量成正比,通过测定570nm 处的光密度,可测定氨基酸的含量。 氮素代谢:氮素及含氮的活体物质的同化、异化、排泄,总称为氮素代谢。 淀粉酶:水解淀粉和糖原的酶类总称 真空渗入: 指将叶片打孔放入注射器中,加水浸没,排出空气后用手指堵住前端小孔,同时把活塞向外抽拉,即可造成减压而排出组织中的空气,轻放活塞,水液即进入组织的方法。 离心技术: 根据物质颗粒在一个实用的离心场中的行为而发展起来的 是1.分离细胞器和生物大分子物质的必备的手段之一, 也是2.测定某些纯品物质的部分性质的一种方法。 差速离心法基于待测物质颗粒大小、密度、沉降速度的不同而得到分离。 电泳:各种生物大分子在一定pH条件下,可以解离成带电荷的颗粒, 这种带电颗粒在电场作用下,向着与其电性相反的电极移动 利用带电粒子在电场中移动速度不同而达到分离的技术称为电泳技术。 同工酶: 指催化同一种化学反应,但其酶本身分子结构和带电性质却有所不同的一组酶。 迁移率: 指带电颗粒在单位电场强度下的泳动速度。 溶液中带电粒子在电场中向着与它电性相反的电极移动,它的移动速度是电场和粒子的有效迁移率(m)的乘积,即:V=mE。
生物化学选择题含答案
1.在生理pH 条件下,下列哪种氨基酸带正电荷C A.丙氨酸B.酪氨酸C.赖氨酸 D.蛋氨酸E.异亮氨酸 2.下列氨基酸中哪一种是非必需氨基酸B A.亮氨酸B.酪氨酸C.赖氨酸 D.蛋氨酸E.苏氨酸 3.蛋白质的组成成分中,在280nm 处有最大吸收值的最主要成分是:A A.酪氨酸的酚环B.半胱氨酸的硫原子 } C.肽键D.苯丙氨酸 4.下列4 种氨基酸中哪个有碱性侧链D A.脯氨酸B.苯丙氨酸C.异亮氨酸D.赖氨酸 5.下列哪种氨基酸属于亚氨基酸B A.丝氨酸B.脯氨酸C.亮氨酸D.组氨酸 6.下列哪一项不是蛋白质α-螺旋结构的特点B A.天然蛋白质多为右手螺旋 B.肽链平面充分伸展 ) C.每隔个氨基酸螺旋上升一圈。 D.每个氨基酸残基上升高度为. 7.下列哪一项不是蛋白质的性质之一C A.处于等电状态时溶解度最小B.加入少量中性盐溶解度增加 C.变性蛋白质的溶解度增加D.有紫外吸收特性 8.下列氨基酸中哪一种不具有旋光性C A.Leu B.Ala C.Gly D.Ser E.Val 9.在下列检测蛋白质的方法中,哪一种取决于完整的肽链B / A.凯氏定氮法B.双缩尿反应C.紫外吸收法D.茚三酮法 10.下列哪种酶作用于由碱性氨基酸的羧基形成的肽键D A.糜蛋白酶B.羧肽酶C.氨肽酶D.胰蛋白酶 11.下列有关蛋白质的叙述哪项是正确的A A.蛋白质分子的净电荷为零时的pH 值是它的等电点 B.大多数蛋白质在含有中性盐的溶液中会沉淀析出 C.由于蛋白质在等电点时溶解度最大,所以沉淀蛋白质时应远离等电点D.以上各项均不正确 ? 12.下列关于蛋白质结构的叙述,哪一项是错误的A A.氨基酸的疏水侧链很少埋在分子的中心部位 B.电荷的氨基酸侧链常在分子的外侧,面向水相 C.白质的一级结构在决定高级结构方面是重要因素之一 D.白质的空间结构主要靠次级键维持 13.列哪些因素妨碍蛋白质形成α-螺旋结构E A.脯氨酸的存在B.氨基酸残基的大的支链 C.性氨基酸的相邻存在D.性氨基酸的相邻存在
高级生物化学历年试题及答案
2010年高级生化考试题 蛋白质组学:指应用各种技术手段来研究蛋白质组的一门新兴科学,其目的是从整体的角度分析细胞内动态变化的蛋白质组成成份、表达水平与修饰状态,了解蛋白质之间的相互作用与联系,揭示蛋白质功能与细胞生命活动规律。 蛋白质组:一个细胞或组织或机体所包含的所有蛋白质,现定义为基因组表达的全部蛋白质。具有三种含义:一个基因组、一种生物、一种细胞所表达的全部蛋白质。 疏水作用层析:就是根据蛋白质表面的疏水性差别发展起来的一种纯化技术。在疏水作用层析中,不是暴露的疏水基团促进蛋白质与蛋白质之间的相互作用,而是连接在支持介质(如琼脂糖)上的疏水基团与蛋白质表面上暴露的疏水基团结合。 DNA的三级结构:DNA分子通过扭曲和折叠形成的特定构象。核酸的三级结构反映了对整体三维形状有影响的相互作用,包括不同二级结构元件间的相互作用,单链与二级结构间的相互作用以及核酸的拓扑特征。 DNA的四级结构: 共价催化:在酶催化反应过程中,酶与底物以共价键结合成中间物过滤态以加速反应。即在催化时,亲核催化剂或亲电催化剂能分别放出点子或汲取电子,并作用于底物的缺电子反应中心或负电中心,迅速形成不稳定的共价键中间复合物,降低反应活化能,使反应加速。 Ks型不可逆抑制剂:这类抑制剂主要作用于酶活性部位的必须基团,但也作用于酶非活性部位,取决于抑制剂与酶活性部位必须基团在反应前形成非共价络合物的解离常数以及与非活性部位同类基团形成非共价络合物的解离常数之比,即Ks的比值,故称为Ks型不可逆抑制剂。 Kcat型不可逆抑制剂:这类抑制剂不但具有与天然底物相类似的结构,而且本身也是酶的底物,可被酶催化而发生类似底物的变化。但这类抑制剂还有一种潜伏性的反应基团,这种基团可因酶的催化而暴露或活化,作用于酶活性中心或辅基,使酶共价共价修饰而失活。 Ks分段盐析法:在一定的pH值和温度条件下,改变盐的离子强度I值,使不同的溶质在不同的离子强度下有最大的析出,此种方法称为Ks分段盐析法。 β分段盐析:保持溶液的离子强度不变,改变溶液的pH值和温度,使不同的溶质在不同的PH值和温度条件下台最大的析出,此种方法称为β分段盐析法。 cDNA文库:以mRNA为模板,经反转录酶催化,在体外反转录成cDNA,与适当的载体(常用噬菌体或质粒载体)连接后转化受体菌,则每个细菌含有一段cDNA,并能繁殖扩增,这样包含着细胞全部mRNA信息的cDNA克隆集合称为该组织细胞的cDNA文库。 穿梭载体(shuttle vector):是指含有两个亲缘关系不同的复制子,能在两种不同的生物中复制的。这类载体不仅具有细菌质粒的复制原点及选择标记基因,还有真核生物的自主复制序列(ARS)以及选择标记性状,具有多克隆位点.通常穿梭载体在细菌中用于克隆,扩增克隆的基因,在酵母菌中用于基因表达分析. 后生遗传:指通过遗传而产生的基因表达修饰,且不能被逆转,此类遗传改变主要指染色体结构的改变和DNA甲基化状态的改变。 对角线电泳:用于分析混合物中某一组分对某些化学处理或光处理后变化的双向电泳技术。样品加样后先从一个方向进行电泳分离,经化学或光处理后,再以与第一次电泳垂直方向进行第二次电泳分离,则经过处理未被修饰的组分皆位于电泳图谱的对角线上。 化学酶工程:也称初级酶工程是指天然酶、化学修饰酶、固定化酶及人工模拟酶的研究和应用。 生物酶工程:是用生物学方法,特别是基因工程、蛋白质工程和组合库筛选法改造天然酶,创造性能优异的新酶;它是酶学和以DNA重组技术为主的现代分子生物学技术相结合的产物。 酶提取的回收率:每次提纯后酶制剂总活力与提取液的总活力的百分比。 1,miRNA和siRNA,及其功能(网上搜索所得) SiRNA的主要特征:长约21到23nt ;双链的3’端各有2个或3个突出的核苷酸;5’端磷酸化,3’端为自由的-OH基团。siRNA可作为一种特殊引物,在RNA指导的RNA聚合酶作用下,以靶mRNA为模板合成dsRNA,后者可被降解形成新的siRNA,新生成的siRNA又可进入上述循环。这种过程称为随机降解性多聚酶链反应。MicroRNA (miRNA):是含有茎环结构的miRNA前体,经过Dicer加工之后的一类非编码的小RNA分子(~21-23个核苷酸)。MiRNA,以及miRISCs(RNA-蛋白质复合物)在动物和植物中广泛表达。因之具有破坏目标特异性基因的转录产物或者诱导翻译抑制的功能,miRNA被认为在调控发育过程中有重要作用。 miRNA的特点:广泛存在于真核生物中, 是一组不编码蛋白质的短序列RNA , 它本身不具有开放阅读框架(ORF) ;通常的长度为20~24 nt , 但在3′端可以有1~2 个碱基的长度变化;成熟的miRNA 5′端有一磷酸基团, 3′端为羟基, 这一特点使它与大多数寡核苷酸和功能RNA 的降解片段区别开来;多数miRNA 还具有高度保守性、时序性和组织特异
博士考试高级动物生物化学试题
博士考试高级动物生物 化学试题精选文档 TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-
2014年攻读博士学位研究生入学考试初试试题答案 一、名词解释(20分)(每题4分,中英文回答均可) 1. Shine-Dalharno sequence SD序列: mRNA中用于结合原核生物核糖体的序列。SD序列在细菌mRNA起始密码子AUG上游7-12个核苷酸处,有一段富含嘌呤的碱基序列,能与细菌16SrRNA3'端识别,帮助从起始AUG处开始翻译。 2、Molecular chaperon分子伴侣:细胞中的某些蛋白质分子可以识别正在合成的多肽或部分折叠的多肽并与多肽的某些部位相结合,从而帮助这些多肽转运、折叠或组装,这一类分子本身并不参与最终产物的形成,因此称为分子“伴侣” 3、Cori cycle乳酸循环:肌肉收缩通过糖酵解生成乳酸。在肌肉内无6-P-葡萄糖酶,所以无法催化葡萄糖-6-磷酸生成葡萄糖。所以乳酸通过细胞膜弥散进入血液后,再入肝,在肝脏内在乳酸脱氢酶作用下变成丙酮酸,接着通过糖异生生成为葡萄糖。葡萄糖进入血液形成血糖,后又被肌肉摄取,这就构成了一个循环(肌肉-肝脏-肌肉),此循环称为乳酸循环。 4.Melting temperature熔解温度:双链DNA熔解彻底变成单链DNA的温度范围的中点温度。 5. Specific activity比活:用于测量酶纯度时,可以是指每毫克酶蛋白所具有的酶活力,一般用单位/mg蛋白来表示 二、简答题(50分) 1、简要说明RNA功能的多样性。(8分) 1、RNA在遗传信息翻译中起决定作用。(mRNA起信使和模板的作用,rRNA起着装配作用,tRNA起转运和信息转换作用)。
植物生理生化测定
2.1.8转基因植株在盐胁迫下的超氧化物歧化酶(SOD)活性测定 将转基因植株与非转基因对照植株继代于含有0.5% NaCl的MS固体培养上进行胁迫培养,培养条件为27±1℃,每天13 h、3000 lux光照。胁迫培养4 w后,取其叶片测定其SOD 活性,每个样品设3次重复,求其平均数,并进行多重比较。 2.1.8.1主要试剂及配方 (1)0.1 mol/l pH 7.8磷酸钠(Na2HPO4-NaH2PO4)缓冲液 A液(0.1 mol/l Na2HPO4溶液):称取Na2HPO4·12H2O 7.163 g,用少量蒸馏水溶解后定容至200 ml,4℃冰箱中保存备用; B液(0.1 mol/l NaH2PO4溶液):称取NaH2PO4·2H2O 0.780 g,用少量蒸馏水溶解后定容至50 ml,4℃冰箱中保存备用; 取上述A液183 ml与B液17ml充分混匀后即为0.1 mol/l pH 7.8的磷酸钠缓冲液,4℃冰箱中保存备用。 (2)0.026 mol/l甲硫氨酸(Met)磷酸钠缓冲液 称取甲硫氨酸(C5H11NO2S)0.388 g,用少量0.1 mol/l pH 7.8的磷酸钠缓冲液溶解后,再用相同磷酸钠缓冲液定容至100 ml,现用现配,4℃冰箱中保存可用1~2 d。 (3)7.5 × 10-4 mol/l NBT溶液 称取NBT(C40H30Cl2N10O6)0.153 g,用少量蒸馏水溶解后,定容至250 ml,现用现配,4℃冰箱中保存可用2~3 d。 (4)含1.0 μmol/l EDTA的20 μmol/l核黄素溶液 A液:称取EDTA 0.003 g,用少量蒸馏水溶解; B液:称取核黄素0.075 g,用少量蒸馏水溶解; C液:合并A液和B液,定容至100 ml,此溶液即为含0.1 mmol/l EDTA的2 mmol/l 核黄素溶液,避光保存(可用黑纸将装有该液的棕色瓶包好),4℃冰箱中可保存8~10 d,当测定SOD酶活时,将C液稀释100倍,即为含1.0 μmol/l EDTA的20 μmol/l核黄素溶液。 (5)含2% PVP的0.05 mol/l pH7.8磷酸钠缓冲液 取0.1 mol/l pH7.8的磷酸钠缓冲液50 ml,加入2 g PVP(聚乙烯吡咯烷酮),充分溶解后移入100 ml容量瓶中用蒸馏水定容至刻度,充分混匀,4℃冰箱中保存备用。 2.1.8.2提取及测定方法 (1)称取1.0 g样品叶片于预冷的研钵中,加入4 ml预冷的提取介质(含2% PVP的0.05 mol/l pH7.8磷酸钠缓冲液),冰浴研磨匀浆,转入10 ml离心管,并用提取介质定容至
植物生理生化指标测定
小黑豆相关生理指标测定 1.表型变化:鲜重、株高、主根长和叶面积 鲜重:取处理好的植株,擦干根和叶表面水分,测量整株植物的重量,每个测6个重复。 株高:取处理好的植株,测量从根和茎分隔处到植株最高点的高度,记录,每个测6个重复。 主根长:取处理好的植株,测量从根和茎分隔处到主根最远点长度,记录,每个测6个重复。 叶面积:取处理好的植株,选择第二节段的叶片,测量叶面积,叶面积测量方法是测每个叶片最宽处长度作为叶的长,测叶片最窄处长度作为叶的宽,叶片长和宽的乘积即为叶表面积。每个测6个重复。 2.总蛋白、可溶性糖、丙二醛(MDA)和H2O2含量测定 样品处理:取0.5g样品(叶片要去除叶脉、根要先用清水清洗干净),速在液氮中冻存,在遇冷的研钵中加液氮研磨,然后加入1.5ml的Tris-HCl(pH7.4)抽提,将抽提液转移到2ml的EP管中,于4℃,12000rpm离心15min,取上清,保存在-20℃下,上清液可用于总蛋白、丙二醛(MDA)、可溶性糖和H2O2含量测定。 总蛋白测定(Bradford法):样品反应体系(800ul H2O+200ul Bradford+5ul 样品),空白对照为(800ul H2O+200ul Bradford)。测定后带入标准曲线Y=32.549X-0.224(Y代表蛋白含量,X代表OD595),计算得出蛋白含量。 可溶性糖测定:样品反应体系(1ml蒽酮+180ul ddH2O+20ul样品提取液);空白对照(1ml蒽酮+180ul ddH2O),测定OD625后带入标准曲线:Y=0.0345X+0.0204(Y代表OD625,X代表可溶性糖含量(ug)) 蒽酮配方:称取100mg蒽酮溶于100ml稀硫酸(76ml浓硫酸+30mlH2O).注意:浓硫酸加入水中时,一点一点递加,小心溅出受伤。 丙二醛(MDA)测定:在酸性和高温条件下,丙二醛可与硫代巴比妥(TBA)反应生成红棕色的3,5,5-三甲基恶唑2,4-二酮,在532nm处有最大吸收波长,但该反应受可溶性糖的极大干扰,糖与TBA的反应产物在532nm处也有吸收,但其最大吸收波长在450nm处。采用双组分分光光度法,可计算出MDA含量。MDA的计算公式为:MDA(umol/L)=6.45OD532-0.56OD450. 反应体系为:400ul 0.6%TBA+350ul H2O+50ul样品,80℃水浴10min后,测OD532和OD450。对照用Tris-HCl. 0.6%TBA配方:称取硫代巴比妥0.6g,溶于少量1M NaOH中,待其完全溶解后用10%TCA(称取10gTCA三氯乙酸,溶于100ml蒸馏水中,待其溶解即可)定容至100ml。 H2O2测定(二甲酚橙法):样品反应体系(82ul溶液A+820ul溶液B (A:B=1:10)+150ul样品提取液),30℃水浴30min,测OD560。标准曲线为:Y=0.01734X-0.0555(Y代表OD560,X代表H2O2含量)
生物化学B卷新编
生物化学模拟题B卷 一、A型选择题 1. 蛋白质变性后将会产生的结果是( C ) A.大量氨基酸游离出来 B.生成大量肽段 C.空间构象改变 D.肽键断裂 E.等电点变为零 2. 维系蛋白质α-螺旋和β-折叠结构稳定的化学键是( E ) A. 肽键 B. 离子键 C. 二硫键 D. 疏水作用 E. 氢键 3. 酶活性中心的叙述,正确的是( A ) A.有些酶可以没有活性中心 B.都有辅酶作为结合基团 C.都有金属离子 D.都有特定的空间构象 E.抑制剂都作用于活性中心 4. 关于同工酶的叙述,错误的是() A.生物学性质相同 B.酶分子一级结构不同 C.同工酶各成员K m 值不同 D.是一组催化相同化学反应的酶 E.酶分子活性中心结构相同 5. 1分子乙酰CoA经三羧酸循环氧化后的产物是( C ) A.柠檬酸 B.草酰乙酸 和H 2O D.草酰乙酸和CO 2 E. CO 2 和4分子还原当量 6. 磷酸戊糖途径生成的重要产物是( C ) A. 5-磷酸核糖,NADH B. 6-磷酸葡萄糖,NADPH C. 5-磷酸核糖,NADPH D. 6-磷酸果糖,NADPH E. 5-磷酸核糖,FADH
7. 长期饥饿时,血糖主要来自(D ) A.肌肉蛋白降解的氨基酸 B.肝蛋白降解的氨基酸 C.肌糖原分解 D.肝糖原分解 E.甘油的糖异生 8. 成熟红细胞获得能量的主要途径是( E ) A. 脂肪酸氧化 B. 2,3-二磷酸甘油酸旁路 C. 磷酸戊糖途径 D. 糖的有氧氧化 E. 糖酵解 9. 体内贮存的脂肪主要来自( C ) A.类脂 B.生糖氨基酸 C.葡萄糖 D.脂肪酸 E.酮体 10. 脂酰CoA进行β氧化的酶促反应顺序为( C ) A.脱氢、再脱氢、加水、硫解 B.硫解、脱氢、加水、再脱氢 C.脱氢、加水、再脱氢、硫解 D.脱氢、脱水、再脱氢、硫解 E.加水、脱氢、硫解、再脱氢 11. 有关酮体的描述错误的是( A ) A.肝脏可生成酮体,但不能氧化酮体 B.仅在病理情况下产生 C.主要成分为乙酰乙酸、β-羟丁酸和丙酮 D.合成酮体的酶系存在于线粒体 E.原料为乙酰CoA 12. 关于电子传递链的叙述错误的是( D ) A.电子传递链各组分组成4个复合体 B.主要有NADH氧化呼吸链和琥珀酸氧化呼吸链 C.每对氢原子氧化时都生成3个ATP D.抑制细胞色素氧化酶后,传递链组分都处于还原状态E.如果氧化不与磷酸化偶联,仍可传递电子
高级动物生化复习资料--研究生
1. 蛋白质一级结构、二级结构、超二级结构、结构域、三级结构、四级结构,肽平面、Rossman折叠、Bohr效应的概念、分叉进化。 (1)一级结构:指蛋白质分子中氨基酸的排列顺序。 (2)二级结构:指多肽链主链上原子的局部空间排列状态。 (3)超二级结构:在蛋白质结构中有一些二级结构的组合物,充当三级结构的构件。 (4)结构域:蛋白质三维结构中存在着易于鉴别的具有重要的功能球状亚结构,1973年温特劳弗尔(Wetlaufer)将蛋白质中的这种亚结构称为结构域。 (5)三级结构:指二级结构和非二级结构在空间进一步盘曲折叠,形成包括主、侧链原子在内的专一性三维排布。。 (6)四级结构:四级结构就是指蛋白质分子中亚基在空间排列状态、亚基间的相互作用以及接触部位的布局。 (7)肽平面:肽键具有部分双键的性质(约40%),不能自由旋转,所以肽键是一个刚性平面,称为肽平面(酰胺平面)。(8)Rossman折叠:蛋白质中常常还有两组βαβ组合成的一种更为复杂的超二级结构,这种结构称为Rossman折叠,它包括两个相邻的βαβ单元,即βαβαβ,有时还有ββααββ结构,这是βXβ单元的特殊形式。 (7)Bohr效应:H+ 浓度或pH的变化可以影响血红蛋白对氧的亲合力。在肺组织中,CO2分压低、H+ 浓度低、pH较高的情况下,血红蛋白与氧的亲合力增加,所以易与氧结合成氧合血红蛋白。但在周围组织中,CO2分压高、H+ 浓度高、pH较低的情况下,血红蛋白与氧的亲合力降低,所以氧合血红蛋白易释放出氧成为脱氧血红蛋白。这就是Bohr效应。 (8)分叉进化:这种从一个共同祖先蛋白质发展出另一种新蛋白质的现象称为分叉进化。 2试举两例说明蛋白质一级结构与功能的关系 蛋白质的氨基酸顺序与生物功能具的密切的关系,特别是蛋白质与其它生物大分子物质之间的相互作用及其作用方式都是由氨基酸顺序决定的。 牛的催产素和抗利尿素的结构相似,都是环八肽,但有两个氨基酸不同。羧基端第3个氨基酸和第8个氨基酸,前者是异亮氨酸和亮氨酸,后者是苯丙氨酸和精氨酸,导致两者有不同的生理功能和催化活性。催产素主要是促进子宫收缩的催产作用,但同时也具有微弱的抗利尿活性;抗利尿素的主要作用是抗利尿和增血压,但也具有微弱的催产活性。 正常人血红蛋白β链从N-端开始第6位氨基酸是谷氨酸,当此氨基酸被缬氨酸取代时,将导致镰刀型贫血病。谷氨酸的侧链是带有负电荷的亲水羧基,而缬氨酸的侧链是不带电荷的疏水基团。当谷氨酸被缬氨酸取代后使Hb的表面电荷性质发生了改变,于是等电点改变,溶解度降低和不正常聚合增加,以致红细胞收缩变形而成为镰刀状,且输氧能力下降,细胞脆弱,容易溶血,严重的可导致死亡。这正是我们所说的分子病中的一种,是由于基因突变引起的,具有遗传性。 3 目前已知的蛋白质的超二级结构有哪些,各有什么特征? 1. 卷曲的卷曲α-螺旋其特征是两股(或三股)右手α-螺旋彼此沿一个轴缠绕在一起,形成一个左手的超螺旋,两股右手α-螺旋之间的作用角大约为18°,超螺旋的重复距离为14nm。 2. βXβ单元(β-片-β单元)在多肽链的两股平行β-折叠中间以X连接起来,称为βXβ单元。在βXβ单元中,如果中间的连接为不规则的卷曲,就称之为βcβ单元;如果中间的连接是α-螺旋,就称为βαβ单元;如果中间连接为另一β结构,则称为βββ单元。 3.β-迂回在蛋白质中有些β-折叠层是由3个或更多相邻的反平行β-折叠形成,它们中间以短链(大多数为β-转角)连接。1980年斯查尔(Schulz)称之为β-迂回。 4.β-折叠桶蛋白质中的β-折叠层可以进一步折叠成桶状结构,1982年理查德森(Richandson)将其称为β-折叠桶,简称β-桶。β-折叠桶由β-折叠片形成。一条长的反平行的β-折叠片全部地或部分地卷成一个桶状。 5.α-螺旋-转角-α-螺旋 4、简述血红蛋白的结构特征及其在结合氧的过程中的变化 血红蛋白是由四个亚基聚合成的四聚体,在四聚体中,四个亚基成D2正四面体分布,即四个亚基分布在正四面体的四个角上。 血红蛋白与氧结合时,其分子构象要发生一系列的变化,主要的变化有以下几个方面: ①脱氧血红蛋白中Fe的配位数为5,其中4个来自卟啉环的N,另一个来自近侧组氨酸(F8)的第三位N。此时配位场较弱,Fe(Ⅱ)与卟啉环的四个N是通过电价配位键连接的,Fe(Ⅱ)采取高自旋结构,具有4个不成对电子,分布在4个轨道上,因此原子半径大,突出在卟啉环的中央空穴之外,与卟啉环平面保持0.06nm的距离。血红蛋白氧合后,Fe
植物生理生化指标测定(精)
小黑豆相关生理指标测定 1. 表型变化:鲜重、株高、主根长和叶面积 鲜重 :取处理好的植株,擦干根和叶表面水分,测量整株植物的重量,每个测 6个重复。 株高 :取处理好的植株,测量从根和茎分隔处到植株最高点的高度,记录,每个测6个重复。 主根长 :取处理好的植株,测量从根和茎分隔处到主根最远点长度,记录,每个测6个重复。 叶面积 :取处理好的植株,选择第二节段的叶片,测量叶面积,叶面积测量方法是测每个叶片最宽处长度作为叶的长, 测叶片最窄处长度作为叶的宽, 叶片长和宽的乘积即为叶表面积。每个测 6个重复。 2. 总蛋白、可溶性糖、丙二醛(MDA 和 H2O2含量测定 样品处理:取 0.5g 样品(叶片要去除叶脉、根要先用清水清洗干净 ,速在液氮中冻存,在遇冷的研钵中加液氮研磨,然后加入 1.5ml 的 Tris-HCl (pH7.4 抽提, 将抽提液转移到 2ml 的 EP 管中, 于 4℃, 12000rpm 离心 15min , 取上清, 保存在 -20℃下,上清液可用于总蛋白、丙二醛(MDA 、可溶性糖和 H2O2含量测定。 总蛋白测定(Bradford 法 :样品反应体系(800ul H2O+200ul Bradford+5ul样品 , 空白对照为(800ul H2O+200ul Bradford 。测定后带入标准曲线 Y=32.549X-0.224(Y代表蛋白含量, X 代表 OD595 ,计算得出蛋白含量。 可溶性糖测定:样品反应体系(1ml 蒽酮 +180ul ddH2O+20ul样品提取液 ; 空白对照 (1ml 蒽酮 +180ul ddH2O , 测定 OD625后带入标准曲线 : Y=0.0345X+0.0204(Y代表 OD625, X 代表可溶性糖含量(ug
生物化学选择题
生化习题 选择题 1.含有2个羧基的氨基酸是:( A ) A.谷氨酸 B. 苏氨酸 C.丙氨酸 D. 甘氨酸 2.酶促反应速度V达到最大反应速度Vmax的80%时,底物浓度[S]: ( D ) A. 1 Km B. 2 Km C. 3 Km D. 4 Km 3.三碳糖、六碳糖与七碳糖之间相互转变的糖代谢途径是:( D ) A.糖异生 B.糖酵解 C.三羧酸循环 D.磷酸戊糖途径 4.哪一种情况可用增加[S]的方法减轻抑制程度:( B ) A.不可逆抑制作用 B.竞争性可逆抑制作用 C.非竞争性可逆抑制作用 D 反竞争性抑制作用 5.鸟氨酸循环中,尿素生成的氨基来源有:( C ) A.鸟氨酸 B.精氨酸 C.天冬氨酸 D.瓜氨酸 6.糖酵解途径中,第二步产能的是: ( B ) A. 1,3-二磷酸甘油酸到 3-磷酸甘油酸 B. 磷酸烯醇式丙酮酸到丙酮酸 C. 3-磷酸甘油醛到 1,3-二磷酸甘油酸 D. F-6-P到 F-1,6-P 7.氨基酸的联合脱氨过程中,并不包括哪类酶的作用: ( D ) A 转氨酶 B L –谷氨酸脱氢酶 C 腺苷酸代琥珀酸合成酶 D 谷氨酸脱羧酶 8.下列哪一种物质不是糖异生的原料: ( C ) A. 乳酸 B. 丙酮酸 C. 乙酰CoA D. 生糖氨基酸 9.目前被认为能解释氧化磷酸化机制的假说是: ( C ) A、化学偶联假说 B、构象变化偶联假说 C、化学渗透假说 D、诱导契合假说 10、1958年Meselson和Stahl利用15N标记大肠杆菌DNA的实验证明了下列哪一种机制?(D) A.DNA能被复制 B.DNA基因可转录为mRNA C.DNA基因可表达为蛋白质
动物生物化学(1)
动物生物化学复习题 1、天然蛋白质氨基酸的结构要点? 答:在与羧基相连的α-碳原子上都有一个氨基,称为α-氨基酸。α—碳原子不是手性碳原子的是哪个氨基酸? 答:甘氨酸 具有紫外吸收特性的氨基酸有哪些? 答:酪氨酸、色氨酸、苯丙氨酸 吸收波长是多少? 答:280nm 核酸的紫外吸收波长是多少? 答:260nm 2、全酶包括哪几部分? 答:酶蛋白与辅助因子 辅基与辅酶的异同点? 答:与酶蛋白结合梳松,用透析、超滤等方法可将其与酶蛋白分开者称为辅酶;与酶蛋白结合紧密,不能用透析发分离的称为辅基。 正常情况下,大脑获得能量的主要途径是什么? 答:葡萄糖的有氧氧化 糖酵解是在细胞的是在细胞的哪个部位进行的?
答:细胞的胞液中 3、糖异生的概念和意义? 答: 概念:由非糖物质转变为葡萄糖或糖原的过程。 意义:由非糖物质合成糖以保持血糖浓度的相对恒定;有利于乳酸的利用;可协助氨基酸代谢。 生糖氨基酸、丙酮酸、乳酸、乙酰COA哪个不能异生成糖? 答:乙酰COA 4、什么是呼吸链? 答:又称电子传递链,是指底物上的氢原子被脱氢酶激活后经过一系列的中间传递体,最后传递给被激活的氧分子而生成水的全部体系。各种细胞色素在呼吸链中传递电子的顺序? 答:B-C1-C-AA3-O2 两条呼吸链的磷氧比分别是多少? 答:NADH呼吸链:P/O~2.5(接近于3) FADH2呼吸链:P/O~1.5(接近于2) 氰化物中毒是由于抑制了哪种细胞色素? 答:Cytaa3(细胞色素氧化酶) 5、为了使长链脂酰基从胞浆转运到线粒体内进行脂肪酸的β-氧 化,所需要的载体是什么? 答:肉碱
6、氨基酸脱下的氨基通常以哪种化合物的形式暂存和运输?答:谷氨酰胺 参与尿素循环的非蛋白氨基酸有哪几种? 答:瓜氨酸和鸟氨酸 7、RNA 和 DNA 彻底水解后的产物有哪些不同? 答:DNA彻底水解产物:磷酸,脱氧脱氧核糖,鸟嘌呤,腺嘌呤, 胞嘧啶,胸腺嘧啶。 RNA彻底水解产物:磷酸,核糖核酸,鸟嘌呤,腺嘌呤,尿嘧啶,胸腺嘧啶 双链DNA 解链温度的增加,提示其中碱基含量高的是哪几种碱基?答:C和G(胞嘧啶和鸟嘌呤) 8、蛋白质一级结构的概念? 答:蛋白质的一级结构是指多肽链上氨基酸残基的排列顺序,即氨基酸序列。 维系蛋白质一级结构的化学键主要是什么键? 答:肽键 9、蛋白质变性后可出现哪些变化? 答:破坏次级键和二硫键,不改变蛋白质的一级结构。如:溶解度降低,易形成沉淀析出,结晶能力丧失,分子形状改变,酶失去活力,激素蛋白失去原来的生理功能。
植物生理生化(生化部分)教学大纲
植物生理生化课程(生化部分)教学大纲 一、课程基本概况 1.课程名称:植物生理生化(生化部分) 2.课程名称(英文):physiology and Biochemistry of plant 3.课程编号:B16034 4.课程总学时:40学时(均为理论教学) 5.课程学分:2学分 6.课程分类:必修课 7.开设学期:第3学期 8.适用专业:农学教育(S)、植保教育(S)本科。 9.先行课:《物理学》、《化学》、《分析化学》、《植物学》等。 二、课程性质、目的和任务 植物生物化学是农学类各专业必修的一门专业基础课,是各专业的主干课之一,其先行课为物理学、化学、植物学。本课程的作用是为后续植物生理学及专业课的学习打下理论基础。其任务是掌握植物生物化学的基本概念,认识和掌握植物细胞的基本组成物质及其结构、性质和功能,了解和掌握有机物代谢的途径和基本条件,了解代谢调控的方式、过程及意义。从而为更好地认识植物、利用植物、影响和改造植物奠定必要的理论基础,能运用基本理论指导相关的实践过程。 三、主要内容、重点及难点 绪论 (一)目的要求:掌握植物生物化学的定义、内容和任务;了解植物生化的发展和现状;了解植物生化与其它学科的关系。 (二)主要内容:植物生化的定义;植物生化的内容;植物生化的任务;植物生理生化的发展及现状;植物生化与其它学科的关系;学习生物化学的方法。 (三)重点:植物生化的定义、内容及其在生物科学中的重要地位。 (四)难点:植物生化与其它学科的关系。 第一章蛋白质的化学 (一)目的要求:掌握蛋白质的基本组成单位——氨基酸的结构特点、性质;了解蛋白质的结构、性质和功能,理解蛋白质的结构与功能的关系。 (二)主要内容: 第一节氨基酸:氨基酸的化学结构与分类;氨基酸的重要理化性质。 第二节蛋白质的结构:一级结构;空间结构;蛋白质分子中的重要化学键;蛋白质结构和功能的关系 第三节蛋白质的性质:蛋白质的分子量;蛋白质的胶体性质;两性性质及等电点;蛋白质的沉淀;蛋白质的变性;蛋白质的颜色反应。 (三)重点:氨基酸的结构特点和性质;蛋白质的结构和性质。 (四)难点:蛋白质的结构;蛋白质结构与功能的关系。 第二章核酸 (一)目的要求:了解核酸的种类、存在位置及其在生物界的地位与作用;掌握核酸的组成、结
血常规生化指标与临床意义
血常规 1.红细胞(RBC或BLC)参考值:3.8~5.1*10^12 生理功能:(附1) 1、运输氧、二氧化碳、电解质、葡萄糖以及人体排出来的废物新陈代谢所必须的物 质;酸碱平衡功能(血红蛋白Fe2+) 2、吞噬细胞样的功能,在其细胞膜表面具有过氧化物酶,该酶是典型的溶酶体酶, 它可起着巨噬细胞样的杀伤作用。 3、免疫粘附功能:抗原-抗体复合物与补体C3b结合后,可粘附于灵长目或非灵长 目的红细胞与血小板上(C3b受体);清除免疫复合物的特性是白细胞和淋巴细胞 所不及的。 4、防御感染:细胞与细菌、病毒等微生物免疫粘附后,不仅可以通过过氧化物酶对 它们产生直接的杀伤作用,而且还可以促进吞噬细胞对它们的吞噬作用。因此,红细胞的免疫功能可以看作是机体抗感染免疫的因素之一。 5、免疫功能:识别携带抗原;清除循环中免疫复合物;增强T细胞依赖反应;效应 细胞(B/T)样作用 增多:分为相对增多(呕吐、腹泻、多汗、多尿、大面积灼伤等所致绝对增多(真性红细胞增多症等),继发性:代偿性增多(缺氧等),非代偿性增多(肝细胞癌、卵巢癌、子宫肌瘤等肿瘤相关及肾盂积水、多囊肾、肾癌等肾脏相关)。 减少:生理性:≤15岁儿童、部分老年人、妊娠中晚期等;病理性:常见于缺铁性、溶血性、再生障碍性贫血及急、慢性失血等(生成过多、破坏过多、丢失过多)。 2.血红蛋白(HB或HGB)参考值:115~150g/L 生理功能:运输氧、二氧化碳、电解质、葡萄糖以及人体排出来的废物新陈代谢所必须的物质;酸碱平衡功能(血红蛋白Fe2+) 增多:
相对增多(呕吐、腹泻、多汗、多尿、大面积灼伤等所致);绝对增多(真性红细胞增多症等):生理性增多:见于高原居民、胎儿和新生儿、剧烈劳动、恐惧等;病理性增多:由于促红细胞生成素代偿性增多所致,见于严重的先天性及后天性心肺疾病和血管畸形,如法洛四联症、紫绀型先天性心脏病、阻塞性肺气肿、肺源性心脏病、肺动-静脉瘘以及携氧能力低的异常血红蛋白病等;某些肿瘤或肾脏疾病,如肾癌、肝细胞癌、肾胚胎瘤以及肾盂积水、多囊肾等 减少:轻度:血红蛋白<90g/L、中度:血红蛋白90~60g/L、重度:血红蛋白 60~30g/L、极重度:血红蛋白<30g/L 生理性:≤15岁儿童、部分老年人、妊娠中晚期等;病理性:常见于缺铁性、溶血性、再生障碍性贫血及急、慢性失血等(生成过多、破坏过多、丢失过多) (1)红细胞压积(HCT):参考值:0.35~0.45L/L一定量的抗凝全血经离心沉淀后,测得下沉的红细胞占全血的容积比。 增多:血液浓缩;其他同红细胞 降低:同红细胞 (2)平均红细胞体积(MCV):参考值:82~100fL (3)平均红细胞血红蛋白量(MCH)参考值:27~34pg (4)平均红细胞血红蛋白浓度(MCHC)参考值:316~354g/L 平均红细胞血红蛋白浓度除了使用血红蛋白这个指标判断贫血外,还要参考红细胞数量,如二者比例失调,则需进一步参考平均红细胞体积,平均红细胞血红蛋白量及平均红细胞血红蛋白浓度及红细胞体积分布宽度,因不同病因引起的贫血,可使红细胞产生形态的变化,检查红细胞形态特点可协助临床寻找病因。 贫血形态学类型MCV(fl) MCH(pg) MCHC 病因举例 正常细胞性贫血82~95 27~31 320~360 急性失血,溶血,造血功能低下,白血病
生物化学选择+填空题-含答案
生物化学选择题和填空题 ? ? ?一、最佳选择题:下列各题有A、B、C、D、E五个备选答案,请选择一个最佳答案。 1、蛋白质一级结构的主要化学键是() A、氢键 B、疏水键 C、盐键 D、二硫键 E、肽键 2、蛋白质变性后可出现下列哪种变化() A、一级结构发生改变 B、构型发生改变 C、分子量变小 D、构象发生改变 E、溶解度变大 3、下列没有高能键的化合物是() A、磷酸肌酸 B、谷氨酰胺 C、ADP D、1,3一二磷酸甘油酸 E、磷酸烯醇 式丙酮酸 4、嘌呤核苷酸从头合成中,首先合成的是() A、IMP B、AMP C、GMP D、XMP E、ATP 5、脂肪酸氧化过程中,将脂酰~SCOA载入线粒体的是() A、ACP B、肉碱 C、柠檬酸 D、乙酰肉碱 E、乙酰辅酶A 6、体内氨基酸脱氨基最主要的方式是() A、氧化脱氨基作用 B、联合脱氨基作用 C、转氨基作用 D、非氧化脱氨基作用 E、脱水脱氨基作用 7、关于三羧酸循环,下列的叙述哪条不正确() A、产生NADH和FADH2 B、有GTP生成 C、氧化乙酰COA D、提供草酰乙酸净合成 E、在无氧条件下不能运转
8、胆固醇生物合成的限速酶是() A、HMG COA合成酶 B、HMG COA裂解酶 C、HMG COA还原酶 D、 乙酰乙酰COA脱氢酶E、硫激酶 9、下列何种酶是酵解过程中的限速酶() A、醛缩酶 B、烯醇化酶 C、乳酸脱氢酶 D、磷酸果糖激酶 E、3一磷 酸甘油脱氢酶 10、DNA二级结构模型是() A、α一螺旋 B、走向相反的右手双螺旋 C、三股螺旋 D、走向相反的左手双螺旋 E、走向相同的右手双螺旋 11、下列维生素中参与转氨基作用的是() A、硫胺素 B、尼克酸 C、核黄素 D、磷酸吡哆醛 E、泛酸 12、人体嘌呤分解代谢的终产物是() A、尿素 B、尿酸 C、氨 D、β—丙氨酸 E、β—氨基异丁酸 13、蛋白质生物合成的起始信号是() A、UAG B、UAA C、UGA D、AUG E、AGU 14、非蛋白氮中含量最多的物质是() A、氨基酸 B、尿酸 C、肌酸 D、尿素 E、胆红素 15、脱氧核糖核苷酸生成的方式是() A、在一磷酸核苷水平上还原 B、在二磷酸核苷水平上还原 C、在三磷酸核苷水平上还原 D、在核苷水平上还原 E、直接由核糖还原 16、妨碍胆道钙吸收的物质是()
高级生物化学(1)
高级生化复习题 1.酶的催化混杂性(Enzyme promiscuity):是指酶具有能催化除其天然反应外的其它反应的能力,也就是说在单个位点催化不止一类化学反应的能力混乱性。 2.活性中心的催化三联体:催化三联体通常指在水解酶和转移酶的活性位点中心同时作用的三个氨基酸残基(如蛋白酶、酰胺酶、酯酶、酰基转移酶、脂肪酶和β-内酰胺酶)。用于共价催化的亲核残基一般是酸-碱-亲核三联体。 3.聚合酶链式反应:简称PCR。聚合酶链反应(PCR)是体外酶促合成特异DNA 片段的一种方法,由高温变性、低温退火(复性)及适温延伸等几步反应组成一个周期,循环进行,使目的DNA得以迅速扩增,具有特异性强、灵敏度高、操作简便、省时等特点。 4.比较基因组学(Comparative Genomics):在基因组图谱和序列分析的基础上,对已知基因和基因的结构进行比较,了解基因的功能,表达调控机制和物种进化过程的学科。 5.酶的转化数(Kcat):在单位时间内每一活性中心或每分子酶所能转换的底物分子数。 6.Toll样受体(Toll-like receptors):是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,也是连接非特异性免疫和特异性免疫的桥梁。TLR是单个的跨膜非催化性蛋白质,可以识别来源于微生物的具有保守结构的分子。当微生物突破机体的物理屏障,如皮肤、粘膜等时,TLR可以识别它们并激活机体产生免疫细胞应答。 7.鸟枪测序法(whole genome shotgun):一种分析大片段基因组DNA序列的策略,主要是指将大片段DNA随机切成许多1~1.5kb的小片段,分别对其测序,然后借助序列重叠区域拼接成全段序列。 8.蛋白质芯片:一种高通量的蛋白功能分析技术,可用于蛋白质表达谱分析,研究蛋白质与蛋白质的相互作用,甚至DNA-蛋白质、RNA-蛋白质的相互作用,筛选药物作用的蛋白靶点等。 9.Annexin V:是一种检测细胞凋亡的试剂,在正常细胞中,磷脂酰丝氨酸(PS)只分布在细胞膜脂质双层的内侧,细胞发生凋亡早期,膜磷脂酰丝氨酸由脂膜内侧翻向外侧。Annexin V作为一种磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,它通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。因此Annexin V是检测细胞早期凋亡的灵敏指标。 10.遗传图谱(genetic map):遗传图谱又称连锁图谱,通过计算机连锁的遗传标志之间的重组频率,确定他们之间的距离,即以具有遗传多肽性的遗传标记为“坐标”,遗传学距离作为“图巨”的基因组图,一般用厘摩(cM,即每次减数分裂的重组频率为1%)来表示. 11.亲和层析:是根据生物大分子和配体之间的特异性亲和力(如酶和抑制剂、抗体和抗原、激素和受体等),将某种配体连接在载体上作为固定相,而能对与配体特异性结合的生物大分子进行分离的一种层析技术,亲和层析是分离生物大分子最为有效的层析技术,具有很高的分辨率。 12.基因物理图谱(genome physical):通过测定遗传标志的排列顺序与位置而
干旱胁迫对植物生理生化指标的影响
干旱胁迫对植物生理生化指标的影响 摘要:水是生命之源,地球上任何生物的生存都离不开水。并且,很多生物在出现缺水时都表现出一系列相应的症状,特别是植物最明显。植物常常遭受的有害影响因素之一就是缺水,当植物消耗的水分无法从外界得到补充时,就会使植物体内的一些生理生化指标发生变化,如脯氨酸(Pro)、丙二醛(MDA)、过氧化氢 (H 2O 2 )、多酚氧化酶(PPO)、过氧化物酶(POD)、谷胱甘肽(GSH)等的含量。实验通 过分光光度计分别在不同的波长中测出吸光率,间接计算出其含量,我们通过测定这些指标含量的变化就可以知道干旱对植物的损伤有多严重。植物经常遭受干旱胁迫的危害,全世界干旱、半干旱地区的面积占总面积的43%,而中国更为严重,约占51.9%,因而研究植物的抗旱性尤为重要。由实验数据可知,当小麦受 到干旱胁迫时,小麦幼苗的脯氨酸(Pro)、丙二醛(MDA)、过氧化氢(H 2O 2 )、多酚 氧化酶(PPO)、过氧化物酶(POD)、谷胱甘肽(GSH)的含量均升高。 关键词:干旱、脯氨酸(Pro)、丙二醛(MDA)、过氧化氢(H 2O 2 )、多酚氧化酶(PPO)、 过氧化物酶(POD)、谷胱甘肽(GSH) 1.引言 1.1干旱及干旱对植物的影响 干旱化已成为世界性的问题,中国干旱半干旱地区面积为256.6×104km2,占国土面积的26.73%。在我国各干旱省份中,云南又属于干旱的省份之一。对植物影响的诸多自然因素中,干旱占首位。因此研究干旱对植物的影响就尤为重要,以利于应用于农作物上。在农业上可以采取植物的各种抗旱机制来抵抗干旱对农作物的损伤,才不致使庄稼减产,利于丰收。那么,究竟什么算干旱呢?就让我们来看看它的定义吧! 当植物耗水大于吸水时,就会使组织内水分亏损,简而言之,过度水分亏缺的现象,称为干旱。干旱可分为大气干旱和土壤干旱。土壤干旱时,植物生长困难或完全停止,受害情况比大气严重。我国农业每年受旱灾面积达2500多万km2。[1] 水分在植物的生命活动中起着极大的作用,全世界由于水分亏缺导致的减产
