各类物质之间的相互转化关系的网络图剖析
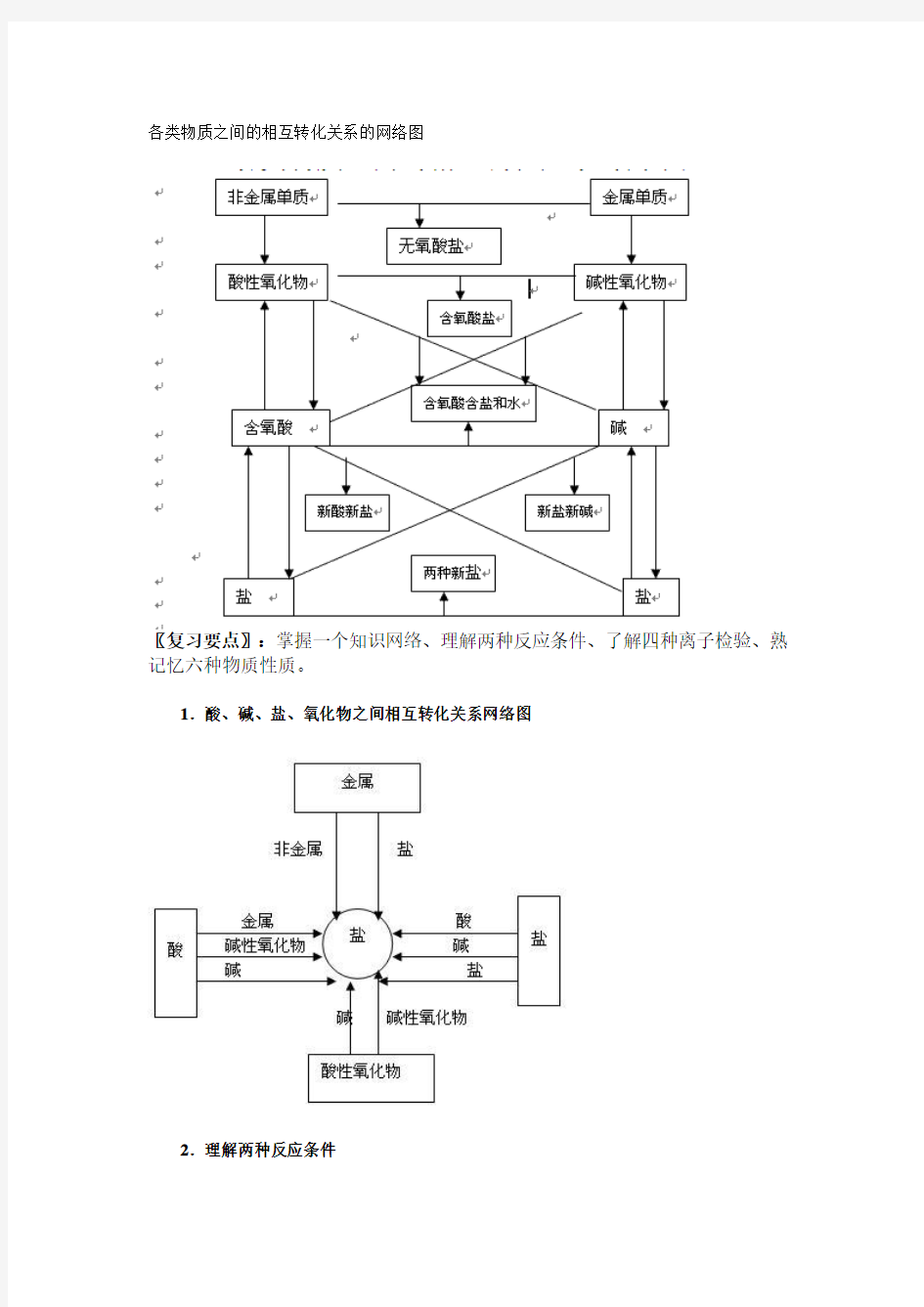

各类物质之间的相互转化关系的网络图
〖复习要点〗:掌握一个知识网络、理解两种反应条件、了解四种离子检验、熟记忆六种物质性质。
1.酸、碱、盐、氧化物之间相互转化关系网络图
2.理解两种反应条件
复分解反应发生的条件:(1)从定以上分析:复分解反应是两种化合物相互交换成份
生成另外两种化合物的反应。判断一个反应是否是复分解反应不能仅仅依据反应物和生成物的种类来判断,还必须看反应的实质。如:2NaOH + CO2=Na2CO3+H2O就不属于复分解反应,因为两种反应物没有相互交换成份。再如:CaCO3+2HCl=CaCl2+H2O+CO2↑,从形式上来看,虽然该反应的产物有三种化合物生成,但却属于复分解反应,该反应的实质是:CaCO3+2HCl=CaCl2+H2CO3,H2CO3不稳定分解为H2O和CO2,因此该却反应属于复分解反应。(2)复分解反应发生的条件是:①对于反应物来说:酸与碱反应,二者至少有一种要溶于水;酸与盐反应是酸必须溶于水;盐与碱、盐与盐反应时,两种反应物必须全部溶于水。②对于生成物来说要么有水生成,要么有沉淀生成,要么有气体生成。
金属与盐溶液发生置换反应的条件:金属与盐溶液发生置换反应的条件是(1) 金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;(2) 特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3) 盐必须溶于水。(4) 铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时,要用+2价的亚铁盐。
3.四种离子的检验检验方法
(1)SO
42-的检验: Ba2+和HNO
3
→BaSO
4
(白色沉淀)
(2)Cl-的检验: AgNO
3和HNO
3
→AgCl(白色沉淀)
(3)NH4+的检验:OH-→NH
3
→湿润的红色石蕊试纸由红色变蓝色
(4)CO
32-的检验:HCl→CO
2
→ 澄清的石灰水变浑浊
4.熟记六种物质
复习时,应重点记忆三类物质的典型代表物的物理性质、化学性质、用途:(1)酸的代表物:盐酸、稀硫酸;(2)碱的代表物:氢氧化钠、氢氧化钙;(3)盐的代表物:碳酸钠、硫酸铜。
【复习方法】
1.列表法:将酸、碱、盐、氧化物分别以他们所具有的相关性质、反应现象、相关的化学方程式进行列表总结,熟知其通性。
2.图示法:将酸、碱、盐、氧化物之间的关系,用网络图示的方法表达出来,以次为依据强化化学方程式的书写与训练。
3.比较、归纳法:比较硫酸与盐酸的化学性质,进而归纳出酸的通性;比较氢氧化钠与氢氧化钙的化学性质,进而归纳出碱的通性;比较碳酸钠、硫酸铜的化学性质,进而归纳出盐的性质。通过比较,找出其组成与性制方面的异同,进一步加深理解、巩固和记忆所学知识。
【典型例题】
例1 La(镧)是一种活动性比锌强的元素,其氧化物为La
2O
3
,对应的碱
La(OH)
3难溶于水,而LaCl
3
、La(NO
3
)
3
都易溶于水。下列物质中,不能直接反应
制得LaCl
3
的是()
A.La+HCl B.La
2O
3
+ HCl C.La(OH)
3
+ HCl D.BaCl
2
+
La(NO
3) 3
【解析】本题所给信息是:La(OH)
3难溶于水、LaCl
3
、La(NO
3
)
3
都易溶于水,
根据复分解反应的条件可知:BaCl
2与La(NO
3
)
3
反应的产物中没有气体、沉淀或
水生成,因此应选(D)。
例2 从你最熟悉的酸、碱、盐中,任意选出四种物质,使其符合下图中的关系,图中连线的物质间均能发生反应,请将物质的化学式填在相应的方框内。
【解析】本题属于结论开放考题。解题的关键是熟悉有关酸、碱、盐的化学性质、相关反应的原理,把握物之间反应的规律。解答时,可从确定酸开始,
根据每种酸(HCl、H
2SO
4
、HNO
3
)的特性去选择满足题目要求的碱和盐。可供选
择的答案为:
例3 某校初中化课外活动兴趣小组的学生,将一些可溶性化合物溶于水,
配成甲、乙两瓶溶液,共含有H+、K+、Ag+、Ba2+、OH-、Cl-、CO
32-、NO
3
-八种离子,
每瓶溶液里含有四种离子各不相同。已知向甲瓶溶液中滴入紫色石蕊试液后,溶液变成蓝色,据此推知乙瓶溶液中的离子应该是____________(填离子符号)
【解析】:甲瓶溶液使紫色石蕊试液变成蓝色,说明甲溶液显碱性,肯定含有OH-;则与之不能大量共存的H+肯定在乙溶液中,与H+不能大量共存的CO
3
2-肯定
在甲溶液中; 与CO
3
2-不能大量共存的Ag+、Ba2+肯定在乙溶液中;与Ag+不能共存的
Cl-肯定在甲溶液中,则NO
3
-属于乙溶液。因此乙瓶溶液中的离子应该是:H+、Ag+、
Ba2+、NO
3-。
例4 如图所示,甲、乙两个相邻的工厂向河水中排放的废水中分别含有
CuSO
4、NaOH、BaCl
2
、FeCl
3
四种物质种的两种。某中学环保小组对河水取样测试
时发现A处河水的pH>7。试回答:
(1)乙工厂排放的废水中,含有的两物质是______________。
(2)请你从环境保护的角度出发,给甲、乙两厂提出合理化建议:
__________________。
【解析】:本题是一道化工生产中的废水为载体的考查复分解反应习题,主要考查酸、碱、盐的溶液间相互反应的知识。
(1)A处河水的pH>7说明甲工厂排放的废水中含有NaOH,NaOH与CuSO
4
、
FeCl
3两溶液不能共存,因此乙工厂排放的废水中,含有的两物质是CuSO
4
、FeCl
3
(2)为了保护环境,使两厂排放的废水不污染环境,建议:两场建立废水处理厂,将两厂废水按一定比例混合、沉淀、再经过必要的工艺处理后排放;甲、乙两厂分别用必要的试剂和工艺对废水进行净化处理后再排放。
例5.“三酸两碱”是几种重要的无机化工原料,下图是它们与其它物质相
互间的关系。已知:①A、A
1、A
2
是工业上常见的三大强酸,B、B
1
、B
2
是正盐,C、
C 1、C
2
是碱;②B
2
是食盐的主要成分,且B、B
1
、B
2
、C
1
中含有相同的金属离子;
③A+B→CO
2
,B+C→难溶于水的白色沉淀沉淀完全溶解并放出二氧化碳,A+C→难溶于水的白色沉淀沉淀不溶解。请回答:
(1)有关物质的化学式:B
2__________,C
1
___________。
(2)有关反应的化学方程式:
A+B:______________;B+C________________;A+C________________。(3)C
2
可能的化学式(写两个)___________、___________。
【解析】本题是一道考查酸、碱、盐相互关系的综合推断题。解题时应抓住
关键:“B
2是食盐的主要成分”可知B
2
的化学式为NaCl,A为酸且B、B
1
、B
2
、
C 1中含有相同的金属离子、A+B→CO
2
,可知B为Na
2
CO
3
,根据B、B
1
、B
2
是正盐和
它们碱的转化关系可推知B
1为Na
2
SO
4
,A、A
1
、A
2
是工业上常见的三大强酸、根据
其相互间的转化关系可推至A为H
2SO
4
、A
1
为HCl、A
2
为HNO
3
;C
1
是碱且与B
2
含有
相同的金属离子,C
1
是NaOH,B与C反应生成难溶于水的白色沉淀且白色沉淀溶
于稀HNO
3,A与C反应生成难溶于硝酸的白色沉淀,说明C为Ba(OH)
2
,根据三
种碱之间的转化关系,可推知C
2为不溶性碱,如Cu(OH)
2
、Mg(OH)
2
、Fe(OH)
3
等。
可供参考的答案为:
(1)NaCl NaOH(2)H
2SO
4
+Na
2
CO
3
= Na
2
SO
4
+H
2
O+CO
2
↑;Na
2
CO
3
+
Ba(OH)
2=BaCO
3
↓+2NaOH;H
2
SO
4
+ Ba(OH)
2
=BaSO
4
↓+2H
2
O;(3)Cu(OH)
2
、Mg(OH)
2
、
Fe(OH)
3
等
酸、碱、盐、氧化物知识小结——“三表一图”(二)
一. 本周教学内容:
酸、碱、盐、氧化物知识小结——“三表一图”(二)
二. 教学目的要求:
熟练掌握酸、碱、盐及氧化物之间的相互转化关系,并能灵活运用该关系制取有关物质。
三. 重点、难点:
八圈图的灵活应用。
四. 知识要点:
(四)酸、碱、盐及氧化物、金属和非金属单质等物质之间的相互转化关系——八圈图
记忆口诀:两条纵线通到底(6条规律)
四条横线相联系(5条规律)
六条交叉成网络(6条规律)
17条规律要牢记(横、纵各有1条重复6+5+6=17)规律:
分解反应
以上规律的应用:
①可知某物质性质②某物质制法
(箭尾)(箭头指向)
③各类物质间相互关系
从上述规律中可以总结出制盐的十种方法,包括:(2)~(16)
【典型例题】
[例1] 现有石灰石、水、碳酸钠,怎样制取烧碱(不能引入其他物质),写出化学方程式。
解析:此题是物质的制备题。在具备单质、氧化物、酸、碱、盐的相互关系,各种物质的制备规律和条件时,还要掌握酸、碱、盐的溶解性,就可以考虑解题方法了。本题应采用倒推法,即从产品烧碱出发向原料推。在考虑过程中应注意烧碱是一种可溶性碱,制备时应用盐+碱—新盐+新碱这一规律,此规律的条件是反应物都是可溶于水的物质且生成物必有一种物质是难溶于水时,此复分解反应才能发生,而且能把烧碱分离出来。再
考虑给出的物质有,还缺少可溶性的一种碱,必须从石灰石和水两种物质中制备,由于氧化钙溶于水可得氢氧化钙,水已给出。最后再考虑如何制得氧化钙,我们已很熟悉煅烧石灰石这一反应,因此,该题用倒推法解题思路如下:
化学方程式:(1)
(2)
(3)
[例2] 用锌粒、盐酸、氧化铁、硫酸铜为原料制取硫酸亚铁,写出有关方程式。
解析:
∵产物中元素为价,因此只能通过置换反应来制取,即
金属+酸盐+或金属+盐新盐+新金属
∴首先应设法制取,因此题原料中无,
∴只能采用后种方法,
使与盐溶液(铜盐溶液)反应。
答:
注意:
以下思路为错误解法:
∵在置换反应中,只能呈0价和价,不能用活泼金属将直接转化为。
[例3] 试用七种不同的方法制备氯化锌,并写出有关的化学方程式。
解析:
此题必须在熟悉酸、碱、盐、氧化物之间的相互关系后,才能正确的表示。
另外是用不同的方法制备氯化锌。最后还必须明确氯化锌属于盐类,制盐的方法有十种。从中选择适合并能完成的化学反应。
答案:制备氯化锌的七种方法是
(1)锌跟氯气反应
(2)锌跟盐酸反应
(3)锌跟氯化铜溶液反应
(4)氧化锌跟盐酸反应
(5)氢氧化锌跟盐酸反应
(6)碳酸锌跟盐酸反应
(7)硫酸锌跟氯化钡反应
[例4] 氯化镁、氢氧化镁、碳酸镁和硫酸镁四种物质,都可以跟某物质反应生成同一物质X,则X的化学式是__________________,分别写出有关化学反应方程式。
解析:由题意知,X必定为盐。∵为难溶的碱,MgCO3微溶,均只能与酸反应制得盐,题目中同时氯化镁和硫酸镁都是反应物,所以X只能是Mg(NO3)2
答案:
[例5]下列变化不能通过一步实现,写出转化的各步化学方程式:
(1)CuO→(2)CaCO3→
(3)→(4)→
解析:根据反应规律,确定反应路线。
(1)CuO铜盐
(2)CaCO3CaO
(3)铜盐镁盐
(4)
【模拟试题】(答题时间:80分钟)
一. 写出下列一系列变化的化学反应方程式(不得重复)
1.
(1).(5).
(2).(6).
(3).(7).
(4).(8).
2.
(1).(2).
(3).(4).
(5).(6).
(7).
3.
(1).(2).
(3).(4).
(5).(6).
(7).(8).
(9).(10).
(11).(12).
(13).(14).
4.
(1).(2).
(3).(4).
5.
(1).(2).
(3).
二. 按照反应类型,根据给出的下列物质完成化学方程式
1. 现有碳酸钙、镁条、盐酸、氧气
(1)化合反应
(2)分解反应
(3)置换反应
(4)复分解反应
2. 从铁、生石灰、硫酸铜溶液、烧碱溶液、水和空气中,按下列要求选择反应
(1)化合反应
(2)分解反应
(3)置换反应
(4)复分解反应
3. 碱式碳酸铜、石灰石、盐酸、镁条、空气
(1)化合反应
(2)置换反应
(3)分解反应(生成物中有黑色固体)
(4)复分解反应(生成物有水和气体)
4. 从铁、氧气、氢氧化钡、稀硫酸、碳酸钠、氯化钙和碳酸钙中选择适当的物质
(1)化合反应
(2)分解反应
(3)复分解反应
中和反应
有沉淀生成的反应
有气体生成的反应
(4)置换反应
5. 用氢、碳、氧、铜、氯五种元素组成的物质,按下列要求写出有水生成的化学方程式:
(1)化合反应
(2)分解反应
(3)置换反应
(4)复分解反应
6. 从、、、四种固体和、、、稀盐酸及等物质中选择适当的物质,按下列要求各写出一个化学方程式:
(1)化合反应
(2)置换反应(有红色物质析出)
(3)既有碱性氧化物又有酸性氧化物生成的分解反应
(4)复分解反应
①酸与盐的反应
②碱与盐的反应
③盐与盐的反应
④有铁盐生成的中和反应
三. 物质的制取
1. 制盐
(1)用六种方法制取,请写出有关化学方程式:
①.②.
③.④.
⑤.⑥.
(2)用三种方法制取,请写出有关化学方程式:
①.②.
③.
(3)有铁屑、铜粉、高锰酸钾、稀四种物质为原料,采用两种不同方法制取硫酸亚铁,请写出各步化学方程式:
(4)用锌粒、盐酸、氧化铁、硫酸铜为原料制取硫酸亚铁,写出有关方程式:
2. 制可溶性碱
(1)现有水、空气、生石灰、硝酸、镁条、碳酸钠溶液,从中选取恰当的物质作原料制取烧碱,写出化学方程式:
(2)现有石灰石、纯碱和水为原料,通过必要的途径制取烧碱,写出各步反应的化学方程式:
(3)现有、、、、、六种物质,从中选用一些物质为反应物,用两种方法制取KOH,写出化学方程式:
3. 制难溶性碱
(1)从Cu、CuO、H2O、NaOH溶液,溶液、溶液中选择合适的物质,通过必要的反应过滤得到,写出反应的化学方程式:.
(2)从Mg、O2、NaOH、SO3、蒸馏水中选择合适的物质,通过必要的反应制取,写出各步反应的方程式:.
(3)从氧化铁、铁、三氧化硫、生石灰、纯碱和水等物质中选取适当的物质,经过必要的反应制取氢氧化铁:.
4. 制取氧化物
(1)用铁、溶液和水制取,写出各步反应方程式:.
(2)以、、稀硫酸、空气为原料制取写出各步反应方程式:.
(3)以水、、、等物质为原料制取和烧碱:.
5. 各写一个方程式,记录下列各物质的制取方法:
(1)用比较活泼的金属制取盐
(2)用碱性氧化物制取盐
(3)用可溶性碱制取难溶性碱
(4)用难溶性碱制取可溶性盐
(5)用可溶性盐制取难溶性盐
(6)用难溶性盐制取可溶性盐
6. 用铜、空气、盐酸、硫酸、氢氧化钠为原料制取氧化铜、氯化铜、硫酸铜、氢氧化铜,写出有关的化学方程式:.
四. 综合练习:
1. 有、稀、、溶液、溶液,哪两种物质间能发生化学反应,写出有关化学方程式:.
2. 有、、、和、、三种溶液共七种物质,哪两种物质间能发生化学反应,写出有关化学方程式:.
3. 、、和稀盐酸四种无色溶液之间,每两种溶液可以发生化学反应,请写出方程式:.
4. 现有铁粉、、溶液、溶液、溶液和稀硫酸六种物质,若取少量两两混合,能发生的反应中,属于置换反应的有多少个?属于复分解反应的有多少个?写出方程式。.
5. 有空气、碳、一氧化碳、二氧化碳、碳酸钙、氢氧化钠溶液、石灰水、稀硫酸、硫酸铜溶液、锌,从中选出反应物(每种物质只允许用一次)按下列要求写出化学方程式:.
(1)实验室制氢气
(2)生成碱性氧化物的分解反应
(3)有浅蓝色难溶物质生成的反应
(4)生成一种剧毒气体的反应
6. 从SO3、、、、溶液、溶液、溶液和稀中选择适当物质写出符合下列要求的一个化学方程式:
(1)两种物质反应,有不支持燃烧的气体生成
(2)两种物质发生中和反应,得到蓝色溶液
(3)一种物质跟水反应,所得溶液
(4)两种物质反应,生成物中有
(5)两种物质反应生成一种盐和一种金属
7. 按下列要求各写一个化学方程式:
(1)有水生成的化合反应
(2)氧化铜作氧化剂的置换反应
(3)有氯化银和硝酸生成的复分解反应
8. 现有铁粉、、铜粉三种固体和、、、、、硫酸六种溶液,从中选出适当物质写出符合下列要求的化学方程式:
(1)固体甲+液体B→溶液E+H2↑
(2)固体乙+溶液B→溶液C+H2O
(3)溶液A+溶液C→固体乙+溶液D
判断下列物质:甲乙
A.B.C.D.
9. 根据下列要求写出有关的化学方程式,只要用A组物质与B组物质反应,每种物质只能用一次,且符合下列要求:
A组:水,稀硫酸,纯碱,氯化钡溶液,硝酸银溶液
B组:锌,三氧化硫,烧碱,盐酸,硫酸锌溶液
(1)化合反应(2)置换反应
(3)中和反应(4)复分解反应
(5)有CO2生成的反应
10. 按下列要求完成化学反应方程式:
(1)生成白色沉淀的中和反应:.
(2)难溶碱参加的中和反应:.
(3)生成硝酸镁的中和反应:.
(4)可溶性碱参加的中和反应:.
(5)有沉淀生成的酸和盐的反应:.
(6)生成硝酸钡的酸和盐的反应:.
(7)难溶盐和酸的反应:.
(8)易溶盐和酸的反应(有气体生成):.
(9)有蓝色沉淀生成的碱和盐的反应:.
(10)有红褐色沉淀生成的碱和盐的反应:.
(11)生成烧碱的复分解反应:.
(12)生成氢氧化镁的复分解反应:.
(13)有双沉淀生成的碱和盐的反应:.
(14)生成硫酸钡的两种盐的反应:.
(15)生成氯化银的两种盐的反应:.
【试题答案】
一.
1.
(1)
(2),,
(3)
(4);、等
(5)
(6)
(7)
(8)
2.
(1)
(2)
(3)
(4)
(5)
(6)
(7)
3.
(1)
(2)2
(3)
(4)
(5)
(6)
(7)
(8)
(9)
(10)
(11)/(12)
(13)
(14)
4.
(1)
(2)
(3)
(4)
5.
(1)
(2)
(3)
二.
1.
(1)
(2)
(3)
(4)
2.
(1)(注意:)(2)
(3)
(4)
3.
(1)
(2)
(3)
(4)
4.
(1)
(2)
(3)
或
注意:不要用与
(4)(稀)
5.
(1)
(2)
或,
(3)
(4)或
6.
(1)
(2)
(3)
(4)
①或
②
③
④
三.
1.
(1)
①
②
③
④
⑤
⑥
(2)
①
②
③
(3)
①
②
(4)
注意:
(×)
∵Fe在置换反应中只能呈0,+2价
2.
(1)
(2)
(3)
①
②
3.
(1)
注意:不能用∵产物为双,无法分离
(2)
①
②
(3)
注:不行4.
(1)
(2)
①
②
(3)——①烧碱——②
①
②
5.
(1)
(2)
(3)
(4)
(5)
(6)
6. 氧化铜——①、氯化铜——②、硫酸铜——③、氢氧化铜——④
①
②
③
④
四.
1.
,
,
2.
,,
,
双代号网络图解析
一、双代号网络图6个时间参数的计算方法(图上计算法) 从左向右累加,多个紧前取大,计算最早开始结束; 从右到左累减,多个紧后取小,计算最迟结束开始。 紧后左上-自己右下=自由时差。 上方之差或下方之差是总时差。 计算某工作总时差的简单方法:①找出关键线路,计算总工期; ②找出经过该工作的所有线路,求出最长的时间 ③该工作总时差=总工期-② 二、双代号时标网络图 双代号时标网络计划是以时间坐标为尺度编制的网络计划,以实箭线表示工作,以虚箭线 表示虚工作,以波形线表示工作的自由时差。 双代号时标网络图 1、关键线路 在时标双代号网络图上逆方向看,没有出现波形线的线路为关键线路(包括虚工作)。如图中①→②→⑥→⑧ 2、时差计算 1)自由时差 双代号时标网络图自由时差的计算很简单,就是该工作箭线上波形线的长度。 如A工作的FF=0,B工作的FF=1 但是有一种特殊情况,很容易忽略。 如上图,E工作的箭线上没有波形线,但是E工作与其紧后工作之间都有时间间隔,此时
E工作 的自由时差=E与其紧后工作时间间隔的最小值,即E的自由时差为1。 2)总时差。 总时差的简单计算方法: 计算哪个工作的总时差,就以哪个工作为起点工作(一定要注意,即不是从头算,也不是从该工作的紧后算,而是从该工作开始算),寻找通过该工作的所有线路,然后计算各条线路的波形线的长度和,该工作的总时差=波形线长度和的最小值。 还是以上面的网络图为例,计算E工作的总时差: 以E工作为起点工作,通过E工作的线路有EH和EJ,两条线路的波形线的和都是2,所以此时E的总时差就是2。 再比如,计算C工作的总时差:通过C工作的线路有三条,CEH,波形线的和为4;CEJ,波形线的和为4;CGJ,波形线的和为1,那么C的总时差就是1。
初中化学物质转化关系图
一、初中化学物质的转化关系 1、氧气、氧化物、酸、氢气、水 H2O KMnO4↘↓↑↗CO、CO2 ↗SO2H2SO4 H2O2→O2→P2O5+ Mg Al Zn Fe→H2→H2O ↘MgO HCl KClO3↗↓↘Al2O3 Fe3O4 % 2、碳与碳的化合物 3、氢氧化钠、碳酸钠、氯化钠 + CO2↗Na2SO4 →BaSO4↓(白) NaOH →Na2CO3 →CaCO3↓(白) (变质)↘NaCl →AgCl↓(白) 4、含钙化合物的关系: ; ↙↗―――――――↘↖ CaCO3→CaO→Ca(OH)2→CaCl2 ↖CO2↙ 5、氧化钡、氢氧化钡与硫酸钡 ↗BaCl2→BaSO4↓(白) BaO →Ba(OH)2↗ ↘+ CuS O4 , ↘Cu(OH)2↓(蓝) 6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵 CuO ↗CO2 ↙↘Ca(HCO3)2 →CaCO3→CaO →CuSO4→Cu ↘H2O
↗Na2CO3↗NH3 → NaHCO3 →CO2NH4HCO3→H2O … ↘H2O →H2CO3↘CO2 →H2CO3 7、铝、镁、锌、铁、铜及其化合物 ↗ZnSO4↖↗AlCl3↖ Zn →ZnO Al →Al2O3 ↘ZnCl2↙↘Al2(SO4)3↙ Fe Al ↗MgCl2↖↙﹉﹉﹉﹉↗CuCl2↘↖. Mg →MgO Cu←→CuO Cu(OH)2↘MgSO4↙↖____↘CuSO4↗↙ Fe Al ↙FeCl3↖ C CO H2Mg Al↗FeSO4 Fe(OH)3 Fe2O3←――――→Fe ↖Fe2(SO4)3↙O2H2O ↘FeCl2 8、常见物质的相互转化关系(即注明必要的反应物、反应条件) CO2 CO C或O2 O2H2O H2O2 Al2O3AlCl3 Al CuO CuSO4 ; Cu ⑴⑵⑶⑷ MgO MgSO4 & Mg Cu H2 Fe CaO Ca(OH)2 CaCO3 CaCl2Ca(OH) 2 CaCO3《 CaCO3Na2CO3 CO2 · CO2 NaOH Na2CO3 CO2O H2O NaOH NH4Cl NH3 ⑼⑽⑾⑿
ER图转换为关系模型
将ER模型转换成关系数据库 ER模型转换关系数据库的一般规则: (1)将每一个实体类型转换成一个关系模式,实体的属性为关系模式的属性。(2)对于二元联系,按各种情况处理,如下面所示。 二元 关系ER图 转换成的关 系 联系的处理主键外键 1:1(2个关系) 模式A 模式B (有两种) 处理方式(1): (1)把模式B的 主键,联系的属性 加入模式A 处理方式(2): (2)把模式A的 主键,联系的属性 加入模式B (略) (依据联系 的处理方式) 方式(1): 模式B的主键 为模式A外 键 方式(2): 表A的主键 为表B的外键
1:M (2个关系) 模式A 模式B 把模式A的主键, 联系的属性加入 模式B (略) 模式A的主 键为模式B的 外键 M:N (3个关系) 模式A 模式B 模式A-B 联系类型转换成 关系模式A-B; 模式A-B的属性: (a)联系的属性 (b)两端实体类型 的主键 两端实体 类型的主 键一起构 成模式 A-B主键 两端实体类 型的主键分 别为模式A-B 的外键 M:N联系的示例比如,ER图如下:
可以转换成以下模式: 学生(学号,姓名,性别,年龄) 主键为学号 课程(课程号,课程名,任课教师) 主键为课程号 选课(学号,课程号,成绩) 主键为课程号、学号,外键为课程号,学号; 1:N联系的示例 比如,ER图如下: 可转换为如下关系模式: 商店模式(商店编号,店名,店址,店经理) 主键为商店编号
商品模式(商品编号,商品名,单价,产地,商店编号,月销售量) 主键为商品编号,外键为商店编号 职工模式(职工编号,职工名,性别,工资,商店编号,开始时间) 主键为职工编号,外键为商店编号 真子集就是一个集 合中的元素全部是另一 个集合中的元素,但不 存在相等; 1、完全依赖与部分依赖: 对于函数依赖W A,如果存在V是W的真子集而函数依赖V A成立,则称A部分依赖于W;否则,若不存在这种V,则称A完全依赖于W; 2、传递依赖: 对于函数依赖X Y,如果Y X(X不函数依赖于A)而函数依赖Y Z成立,则称Z 对X传递依赖; 例:设有关系模式选课SC1(SNO,CNO,GRADE,CREDIT),其中,SNO 表示学号,CNO表示课程号,GRADE表示成绩,CREDIT表示学分。(SNO,CNO)-F->GRADE (完全函数依赖)
常见物质的转化关系网络图
常见物质的转化关系网络图 一、钠及其化合物之间的相互转化 3 粗盐提纯(含有泥沙、Ca2+、Mg2+、SO42-) 涉及的化学方程式: (1)4Na+O2=2Na2O(白色固体) (2)2Na2O+O2=2Na2O2(淡黄色固体) (3)2Na2O2+2CO2=2Na2CO3+O2(作为潜水艇供氧剂的原理) (4)2Na+O2Na2O2 (5)Na2O+ CO2= Na2CO3 (6)Na2CO3+CO2+H2O=2NaHCO3(除去NaHCO3溶液中的少量Na2CO3) (7)NaHCO3+NaOH=Na2CO3+H2O(除去Na2CO3溶液中 ...的少量NaHCO3) 2 NaHCO3Na2CO3+ CO2 +H2O(除去Na2CO3固体中 ...的少量NaHCO3)(俗名:碳酸钠-纯碱碳酸氢钠-小苏打) (8)Na2O+H2O= 2NaOH (9)2Na2O2+2H2O =4NaOH +O2 (10)2Na+2H2O=2NaOH+H2 [现象:浮、熔、游、响、红(滴加酚酞的溶液)] (11)Na2CO3+C a(O H)2=CaCO3 +2NaOH(土法炼碱原理) (12) 2NaOH+CO2(少量)= Na2CO3+H2O (13) NaOH+HCl=NaCl+H2O (14) Na2CO3+2HC l(足量)=2NaCl+CO2 +H2O 可用互相滴加的方法鉴别 (15) NaHCO3+HCl(少量)=NaCl+CO2 +H2O 盐酸和碳酸钠溶液 (16)NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3 (2 NaHCO3Na2CO3+ CO2 +H2O )(侯氏制碱法原理)
图与网络分析例题讲解
图与网络分析例题讲解
————————————————————————————————作者:————————————————————————————————日期:
图与网络分析例题讲解 例1求救信号的采集问题 紧急呼救电话发挥着极其重要的作用,现在的问题是往往在呼救时当事者大多处于紧张或身体状况不佳的状态,难以清晰表达自己所处位置,给救援工作带来极大的困难,对于有线电话来说,定位相对容易,而对于移动设备由于其可移动性,则确定位置相对比较困难。一种可行的办法是依赖通信基站,按照移动设备接收附近几个基站信号强弱进行定位。区域内的某个点接收到各基站的信号强度组成一个向量,该向量唯一标志区域内的一个点。 采用这种方法定位就需要采集区域内各点的信号强度,派遣一辆装载信号采集设备和GPS 的车辆,从研究所出发,依次到达各主要地点采集信号,最后回到研究所提交数据。 考察某大城市的一个特定区域,示意图共5个节点。主要信号采集点在图中已标出(即图中的节点),如何选择一条最短路线,使得信号采集车辆能够顺利地采集信号并返回研究 所。图的邻接矩阵为:01412710140913512906871360111058110?? ?? ?? ???? ?? ????。0100000100100 000000100010H ?? ??????=???????? 解 该问题实际上就是一个TSP (旅行商问题),要求寻找遍历图中所有节点,并返回起 点的最短路。 TSP 属于组合优化的范畴,可以采用组合优化的方法求解TSP 。 设ij d 表示,i j 两个城市之间的距离,决策变量是0ij x =或1(0表示不连接,1表示连接),由ij x 组成的邻接矩阵H 是图G 的哈密顿圈等价于H 中每个节点都只有一个入度和一个出度,且去掉任何一个节点H 将不是圈。此时求解TSP 就等价于求解下面0-1规划问题: ,min ij ij i j V z d x ∈= ∑ 1() ..1()0,1(,)ij j V ij i V ij x i V s t x j V x i j V ∈∈?=∈?? =∈???=∈? ∑∑ (1) 对于模型(1)容易用LINGO 软件求解,其程序如下: model : sets : city/1..5/:u; !Hamilton 路标号; link(city,city):distance,x; !邻接矩阵和决策矩阵; endsets data : distance=
各类物质之间的相互转化关系的网络图
各类物质之间的相互转化关系的网络图 〖复习要点〗:掌握一个知识网络、理解两种反应条件、了解四种离子检验、熟记忆六种物质性质。 1.酸、碱、盐、氧化物之间相互转化关系网络图 2.理解两种反应条件
复分解反应发生的条件:(1)从定以上分析:复分解反应是两种化合物相互交换成份 生成另外两种化合物的反应。判断一个反应是否是复分解反应不能仅仅依据反应物和生成物的种类来判断,还必须看反应的实质。如:2NaOH + CO2=Na2CO3+H2O就不属于复分解反应, 因为两种反应物没有相互交换成份。再如:CaCO3+2HCl=CaCl2+H2O+CO2↑,从形式上来看,虽然该反应的产物有三种化合物生成,但却属于复分解反应,该反应的实质是:CaCO3+2HCl=CaCl2+H2CO3,H2CO3不稳定分解为H2O和CO2,因此该却反应属于复分解反应。(2)复分解反应发生的条件是:①对于反应物来说:酸与碱反应,二者至少有一种要溶于水;酸与盐反应是酸必须溶于水;盐与碱、盐与盐反应时,两种反应物必须全部溶于水。②对于生成物来说要么有水生成,要么有沉淀生成,要么有气体生成。 金属与盐溶液发生置换反应的条件:金属与盐溶液发生置换反应的条件是(1) 金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;(2) 特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3) 盐必须溶于水。(4) 铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时,要用+2价的亚铁盐。 3.四种离子的检验检验方法 (1)SO 42-的检验: Ba2+和HNO 3 →BaSO 4 (白色沉淀) (2)Cl-的检验: AgNO 3和HNO 3 →AgCl(白色沉淀) (3)NH4+的检验:OH-→NH 3 →湿润的红色石蕊试纸由红色变蓝色 (4)CO 32-的检验:HCl→CO 2 →澄清的石灰水变浑浊 4.熟记六种物质 复习时,应重点记忆三类物质的典型代表物的物理性质、化学性质、用途:(1)酸的代表物:盐酸、稀硫酸;(2)碱的代表物:氢氧化钠、氢氧化钙;(3)盐的代表物:碳酸钠、硫酸铜。 【复习方法】 1.列表法:将酸、碱、盐、氧化物分别以他们所具有的相关性质、反应现象、相关的化学方程式进行列表总结,熟知其通性。 2.图示法:将酸、碱、盐、氧化物之间的关系,用网络图示的方法表达出来,以次为依据强化化学方程式的书写与训练。 3.比较、归纳法:比较硫酸与盐酸的化学性质,进而归纳出酸的通性;比较氢氧化钠与氢氧化钙的化学性质,进而归纳出碱的通性;比较碳酸钠、硫酸铜的化学性质,进而归纳出盐的性质。通过比较,找出其组成与性制方面的异同,进一步加深理解、巩固和记忆所学知识。 【典型例题】 例1 La(镧)是一种活动性比锌强的元素,其氧化物为La 2O 3 ,对应的碱
一建考试网络图案例分析
一级建造师 综合科目培训 建设工程项目管理 1Z203000 建设工程进度控制 要求: 熟练计算双代号网络计划的时间参数会计算双代号网络计划的工期会画双代号网络计划图会画早时标网络计划图 知道某工序时间变动对工期的影响 25/7/2004 1 一级建造师 综合科目培训 建设工程项目管理 1Z203000 建设工程进度控制 [案例四] P172[背景材料] 某石油管道工程的施工合同工期为17个月,该工程要进行管沟的开挖,焊接,敷设,回填,恢复地貌等工作,延续数公里,其初始计划(双代号网络图)如图2-1-7所示: 由于工作A 、I 、J 在不同施工段上,又均为土方工程而必须使用同一台挖土机顺序施工,则调整后的施工进度计划如图2-1-8所示。 25/7/2004 2 一级建造师 综合科目培训 建设工程项目管理 1Z203000 建设工程进度控制 1 2 345 6 7 8 9 10 图2-1-7 双代号网络图(初始计划) A 4 E 2G 4J 3 B 3 C 4 L 3 H 5D 2 I 4 K 2M 4N 2 4 6 3 5 9 10 25/7/2004 3 一级建造师 综合科目培训 建设工程项目管理 1Z203000 建设工程进度控制 1 2 345 6 7 8 9 10 图2-1-8 调整后的施工进度计划图 A 4E 2G 4J 3 B 3 C 4 L 3 H 5D 2 I 4 K 2M 4N 2 4 6 3 5 9 10 25/7/2004 4 一级建造师 综合科目培训 建设工程项目管理 1Z203000 建设工程进度控制 [问题] 1、该计划是否可行、合理?为什么?挖土机在现场闲置时间为多少? 2、当该计划执行2个月后,业主提出增加一项新的工作P 。根据施工工艺要求,工作P 必须安排在工作A 完成之后开始,并在工作I 开始之前完成。工作P 的持续时间为2个月,试绘制相应的双代号网络计划,并确定计算工期。 3、根据上述问题2,所给条件,因增加工作P 增加挖土机闲置多少时间?作G 拖延半个月,承包商原因使工作H 拖延4个月,公网停电使工作I 拖延1个月,事后承包商立即提出工程延期申请,可批准工程延期多少时间?为什么? (印刷错误) 25/7/2004 5 一级建造师 综合科目培训 建设工程项目管理 1Z203000 建设工程进度控制 4、由于业主原因使工作G 拖延半个月、H 拖延4个月,不可抗力公网停电I 使工作时间拖延1个月,可要求工期延长多少时间?[参考答案] 1、计划的可行性、合理性分析如图2-1-9所示: 25/7/2004 6
各类物质之间的相互转化关系
天 才 在 于 勤 奋,聪 明 在 于 积 累。 班级 姓名 小组 1 专题复习之各类物质之间的相互转化关系 〖复习目标〗: 掌握一个知识网络、理解两种反应条件、了解四种离子检验、熟记忆六种物质性质。 1.酸、碱、盐、氧化物之间相互转化关系网络图 2.理解两种反应条件 复分解反应发生的条件: (1)从定以上分析:复分解反应是两种化合物相互交换成份生成另外两种化合物的反应。判断一个反应是否是复分解反应不能仅仅依据反应物和生成物的种类来判断,还必须看反应的实质。如:2NaOH + CO 2=Na 2CO 3+H 2O 就不属于复分解反应,因为两种反应物没有相互交换成份。再如:CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑,从形式上来看,虽然该反应的产物有三种化合物生成,但却属于复分解反应,该反应的实质是:CaCO 3+2HCl=CaCl 2+H 2CO 3,H 2CO 3不稳定分解为H 2O 和CO 2,因此该却反应属于复分解反应。(2)复分解反应发生的条件是:①对于反应物来说:盐与碱、盐与盐反应时,两种反应物必须全部溶于水。②对于生成物来说要么有水生成, 要么有沉淀生成, 要么有气体生成。 金属与盐溶液发生置换反应的条件:金属与盐溶液发生置换反应的条件是(1) 金属的位 置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;(2) 特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3) 盐必须溶于水。(4) 铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时,要用+2价的亚铁盐。 酸、碱、盐及氧化物、金属和非金属单质等物质之间的相互转化关系——八圈图 记忆口诀: 两条纵线通到底(6条规律) 四条横线相联系(5条规律) 六条交叉成网络(6条规律) 17条规律要牢记(横、纵各有1条重复6+5+6=17) 规律:
各类有机物的转化关系图
用于备课的资料 各类有机物的转化关系图: 1. 常见官能团与性质 官能团结构性质 碳碳双键易加成、易氧化、易聚合 碳碳三键易加成、易氧化、易聚合 卤素(X=Cl、Br等) 易取代(如溴乙烷与NaOH水溶液共热生成乙醇)、易消去(如 溴乙烷与NaOH醇溶液共热生成乙烯) 醇羟基易取代、易消去(如乙醇在浓硫酸、170℃条件下生成乙烯)、易催化氧化(如乙醇在酸性K2Cr2O7溶液中被氧化为乙醛甚至乙酸) 酚羟基极弱酸性(酚羟基中的氢与NaOH溶液反应,但酸性极弱,不能使指示剂变色)、易氧化(如无色的苯酚晶体易被空气中的氧气氧化为粉红色)、显色反应(如苯酚遇FeCl3溶液呈紫色)、苯酚遇浓溴水产生白色沉淀 醛基易氧化(如乙醛与银氨溶液共热生成银镜)
羰基 易还原(如在Cu/Ag 催化加热条件下还原为)羧基 酸性(如乙酸的酸性强于碳酸,乙酸与NaOH溶液反应)、易取 代(如乙酸与乙醇在浓硫酸、加热条件下发生酯化反应) 酯基 易水解(如乙酸乙酯在稀硫酸、加热条件下发生酸性水解, 乙酸乙酯在NaOH溶液、加热条件下发生碱性水解) 烷氧基如环氧乙烷在酸催化下与水一起加热生成乙二醇 硝基还原(如酸性条件下,硝基苯在铁粉催化下还原为苯胺) 2. 有机反应类型与重要的有机反应 反应类型重要的有机反应 取代反应烷烃的卤代:CH4+Cl2CH3Cl+HCl 烯烃的卤代: 卤代烃的水解:CH3CH2Br+NaOH CH3CH2OH+NaBr 皂化反应:+3NaOH3C17H35COONa+ 酯化反应:+C2H5OH+H2O 糖类的水解: 122211 C H O 蔗糖+H2O 6126 C H O 果糖+ 6126 C H O 葡萄糖 二肽的水解:+H2O 取代反应 苯环上的卤代:+Cl2+HCl 苯环上的硝化:++H2O 苯环上的磺化:++H2O (续表)
双代号网络图解析实例
一、双代号网络图6个时间参数的计算方法(图上计算法)从左向右累加,多个紧前取大,计 算最早开始结束;从右到左累减,多个紧后取小,计算最迟结束开始。 紧后左上-自己右下=自由时差。上方之差或下方之差是总时差。 计算某工作总时差的简单方法:①找出关键线路,计算总工期; ②找出经过该工作的所有线路,求出最长的时间 ③该工作总时差=总工期-② 二、双代号时标网络图双代号时标网络计划是以时间坐标为尺度 编制的网络计划,以实箭线表示工作,以虚箭线 表示虚工作,以波形线表示工作的自由时差。 双代号时标网络图 1、关键线路 在时标双代号网络图上逆方向看,没有出现波形线的线路为关键线路(包括虚工作)如图中①一②一⑥一⑧ 2、时差计算1)自由时差 双代号时标网络图自由时差的计算很简单,就是该工作箭线上波形线的长度。 如A工作的FF=O, B工作的FF=1 但是有一种特殊情况,很容易忽略。
如上图,E工作的箭线上没有波形线,但是E工作与其紧后工作之间都有时间间隔,此时E X作的自由时差=E与其紧后工作时间间隔的最小值,即E的自由时差为1。 2)总时差。 总时差的简单计算方法: 计算哪个工作的总时差,就以哪个工作为起点工作(一定要注意,即不是从头算,也不 是 从该工作的紧后算,而是从该工作开始算),寻找通过该工作的所有线路,然后计算各 条线路的 波形线的长度和,该工作的总时差=波形线长度和的最小值。 还是以上面的网络图为例,计算E工作的总时差: 以E工作为起点工作,通过E工作的线路有EH ffi EJ,两条线路的波形线的和都是2,所以此时E 的总时差就是2。 再比如,计算C工作的总时差:通过C工作的线路有三条,CEH波形线的和为4; CEJ 波形线的和为4;CGJ波形线的和为1,那么C的总时差就是1
必修1 物质转化关系图及相应化学方程式
必修1 物质转化关系图及相应化学方程式 一、金属钠及其重要化合物的相互转化(括号内写离子方程式) 1、 2、 3、 ( ) 4、 ( ) * 5、 ( ) * 6、 7、 ( ) 8、 ( ) 9、 ( ) 10、 ( ) 11、 ( ) 12、[NaHCO 3溶液] ( ) [NaHCO 3固体] Na 2O Na ① NaCl NaHCO 3 Na 2CO 3 Na 2O 2 ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿
1、 2、 3、 4、 5、 ( ) 6、 ( ) 7、 ( ) 8、 ( ) 9、 ( ) 10、 ( ) 11、 ( )12、 ( ) ( ) 13、 ( ) ( ) 14、 NaCl 2 3 AgCl ⑤ ⑥ ⑦ ⑧
1. 2. 3. ( ) 4. ( ) 5. ( ) 6. ( ) 7、 ( ) 8、 ( ) 9、实验制取Al (OH )3: ( ) Al Al (OH )3 NaAlO 2 Al 23 AlCl 3 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
四、金属铁及其化合物的相互转化(括号内写离子方程式) 1、 2、 ( ) ( ) 3、 ( ) 4、 ( ) 5、 ( ) 6、 ( ) 7、 ( ) 8、 ( ) 9、 ( )10、属于化合反应的 ( ) 印刷腐蚀电路板的 ( ) 11、 12、白色沉淀,然后迅速变为灰绿色,最后变为红褐色 ① Fe 3O 4 ② 2 3 ⑾ ⑿
必修1 物质转化关系图及相应化学方程式 一、金属钠及其重要化合物的相互转化(括号内写离子方程式) 1、4 Na + O 2 === 2 Na 2O 2、2 Na +O 2 △ Na 2O 2 3、2 Na +2 H 2O===2 NaOH +H 2↑ (2 Na +2 H 2O===2 Na ++2 OH -+H 2↑) 4、Na 2O + H 2O===2 NaOH (Na 2O +H 2O===2 Na ++2 OH -) * 5、2Na 2O 2 +2H 2O === 4 NaOH +O 2↑ (2Na 2O 2+2 H 2O =4Na ++4OH -+O 2↑) * 6、2 Na 2O 2 + 2 CO 2 === 2 Na 2CO 3+O 2 7、2 NaOH + CO 2 === Na 2CO 3+H 2O (CO 2+ 2 OH - = CO 32-+H 2O ) 8、NaOH + HCl === NaCl +H 2O (OH — + H += H 2O) 9、Na 2CO 3+2HCl =2NaCl +CO 2↑+H 2O (CO -23+ 2H + = CO 2↑ + H 2O ) 10、NaHCO 3+HCl =NaCl +CO 2↑+H 2O (HCO -3+ H + = CO 2↑ + H 2O ) 11、Na 2CO 3+CO 2+H 2O= 2 NaHCO 3 (CO 32— + CO 2 + H 2O= 2 HCO 3—) 12、NaHCO 3+NaOH =Na 2CO 3+H 2O (HCO -3+OH - = CO -23 + H 2O ) 2 NaHCO 3 △ Na 2CO 3+CO 2↑+H 2O Na 2O Na ① NaCl NaHCO 3 Na 2CO 3 Na 2O 2 ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿
(完整版)各类有机物的转化关系图.doc
用于备课的资料 各类有机物的转化关系图:1.常见官能团与性质 官能团碳碳双键碳碳三键 卤素醇羟基酚羟基 醛基 羰基 羧基 结构性质 易加成、易氧化、易聚合 易加成、易氧化、易聚合 易取代 ( 如溴乙烷与 NaOH水溶液共热生成乙醇) 、易消去 ( 如(X=Cl 、 Br等 ) 溴乙烷与 NaOH醇溶液共热生成乙烯) 易取代、易消去 ( 如乙醇在浓硫酸、 170℃条件下生成乙烯 ) 、易 催化氧化 ( 如乙醇在酸性 K2Cr2O7溶液中被氧化为乙醛甚至乙酸 ) 极弱酸性 ( 酚羟基中的氢与 NaOH溶液反应 , 但酸性极弱 , 不能 使指示剂变色 ) 、易氧化 ( 如无色的苯酚晶体易被空气中的氧气 氧化为粉红色 ) 、显色反应 ( 如苯酚遇 FeCl3溶液呈紫色 ) 、苯 酚遇浓溴水产生白色沉淀 易氧化 ( 如乙醛与银氨溶液共热生成银镜) 易还原 ( 如在Cu/Ag催化加热条件下还原为) 酸性 ( 如乙酸的酸性强于碳酸, 乙酸与 NaOH溶液反应 ) 、易取 代 ( 如乙酸与乙醇在浓硫酸、加热条件下发生酯化反应)
易水解 ( 如乙酸乙酯在稀硫酸、加热条件下发生酸性水解, 酯基 乙酸乙酯在 NaOH溶液、加热条件下发生碱性水解 ) 烷氧基如环氧乙烷在酸催化下与水一起加热生成乙二醇 硝基还原 ( 如酸性条件下 , 硝基苯在铁粉催化下还原为苯胺) 2.有机反应类型与重要的有机反应 反应类型重要的有机反应 取代反应 取代反应 反应类型加成反应烷烃的卤代 :CH4+Cl 2CH3Cl+HCl 烯烃的卤代 : 卤代烃的水解 :CH3CH2Br+NaOH CH3CH2OH+NaBr 皂化反应 :+3NaOH3C17H35COONa+ 酯化反应 : +CH OH +H O 2 5 2 糖类的水解 : C 12 H 22 O 11 +HO C 6 H 12 O 6 + C 6 H 12 O 6 蔗糖果糖葡萄糖 2 二肽的水解 :+H2O 苯环上的卤代 :+Cl 2+HCl 苯环上的硝化 :++H2O 苯环上的磺化 :++H2O ( 续表 ) 重要的有机反应 烯烃的加成 :+HCl
计算机组成原理第五章答案
第5章习题参考答案 1.请在括号填入适当答案。在CPU中: (1)保存当前正在执行的指令的寄存器是( IR ); (2)保存当前正在执行的指令地址的寄存器是( AR ) (3)算术逻辑运算结果通常放在( DR )和(通用寄存器)。 2.参见图5.15的数据通路。画出存数指令“STO Rl,(R2)”的指令周期流程图,其含义是将寄存器Rl的容传送至(R2)为地址的主存单元中。标出各微操作信号序列。 解: STO R1, (R2)的指令流程图及微操作信号序列如下:
STO R1, (R2) R/W=R DR O, G, IR i R2O, G, AR i R1O, G, DR i R/W=W 3.参见图5.15的数据通路,画出取数指令“LAD (R3),R0”的指令周期流程图,其含义是将(R3)为地址主存单元的容取至寄存器R2中,标出各微操作控制信号序列。 解: LAD R3, (R0)的指令流程图及为操作信号序列如下:
PC O , G, AR i R/W=R DR O , G, IR i R 3O , G, AR i DR O , G, R 0i R/W=R LAD (R3), R0 4.假设主脉冲源频率为10MHz ,要求产生5个等间隔的节拍脉冲,试画出时序产生器的逻辑图。 解:
5.如果在一个CPU 周期中要产生3个节拍脉冲;T l =200ns ,T 2=400ns ,T 3=200ns ,试画出时序产生器逻辑图。 解:取节拍脉冲T l 、T 2、T 3的宽度为时钟周期或者是时钟周期的倍数即可。所以取时钟源提供的时钟周期为200ns ,即,其频率为5MHz.;由于要输出3个节拍脉冲信号,而T 3的宽度为2个时钟周期,也就是一个节拍电位的时间是4个时钟周期,所以除了C 4外,还需要3个触发器——C l 、C 2、C 3;并令 211C C T *=;321C C T *=;313C C T =,由此可画出逻辑电路图如下:
初三化学-物质的转化
【物质的转化】 一.经典回顾: 1(2015武汉).有关物质之间的部分转化关系如右图所示。其中“—”表示物质之间能发生化学反应,“→”表示物质之间的转化关系。下列说法中正确的是()A.物质X是一种常见的有机化合物 B.反应②是一定有盐参加反应 C.向Ca(OH)2溶液中加入CaO,所得溶液的溶质质量分数一定增大 D.图中的所有反应均不属于置换反应 2. (2016武汉)甲、乙、丙、丁均为初中化学常见物质,它们之间的部 分转化关系如图所示,关于该转化关系图,下列说法正确的是() A.如果丙是碳酸钠,乙是氢氧化钠,则甲是硝酸钠 B.若甲、乙、丁都是氧化物,则丙一定是碳酸钙 C.甲、乙、丙、丁之间的转化可以全部通过复分解反应实现 D.若甲、乙、丙、丁均含有同一种元素,且乙可用来灭火,则丙一定是单质碳 二.提高训练 1 .(荆州)小明设计了下列四组物质,要求在一定条件下都能一步转化,其中错误的是() A.Na2CO3→NaCl→NaNO3→NaOH B.C→CO→CO2→Na2CO3 C.Cu→CuO→CuSO4→Cu(OH) 2D.CaCO3→CaO→Ca(OH) 2→NaOH 2. 下列各组变化中,每一转化在一定条件下均能一步实现的是() ) A.①和②B.②和③C.①和③D.①②③ 3.甲、乙、丙、丁四种物质的相互反应关系如图所示(“—”表示相连的物质间能发生反应)下列符合对应反应关系的选项是 D 选项A B- C 物甲Ca(OH)2CO2H2Fe 乙Na2CO3NaOH O2HCl
】 4.甲乙丙丁四种物质的转化关系如图所示。下列说法正确的是 A.若丙为沉淀,则甲、乙中一定有一种物质是碱 B.若丙为气体,则甲、乙中一定有单质 C.若丁为水,则该反应一定是复分解反应 D.若甲、丁为单质,则该反应一定是置换反应 5(双选题).现有铁、氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液 五种物质.存在如图 所示的相互反应和转化关系。图中“——”表示两端的物质间可以发生化学反应.“→” 表示物质问存在相应的转化关系。下列判断合理的是 A .X 一定是碳酸钠溶液 B .Y 一定是稀盐酸 C .N 转化为铁的反应都属于置换反应 D .X 、Y 、M 两两之间都可以发生复分解反应 6. 如果将物质按单质、氧化物、酸、碱、盐、有机物分类,右图中甲、 乙、丙是三种不同类别的物资,且相连物之间均能发生化学反应, 下列说法符合图示要求的是 A. 当甲为氯化铵时,X 可以为氢氧化钾 B. 当甲、乙、丙分别为酸、碱、盐时,X 一定不可能为碳酸钠 ! C. 当X 为氧气时,甲、乙、丙可以为氢气、红磷、葡萄糖 D. 当X 为稀盐酸时,甲、乙、丙可以为铜、氢氧化铜、硝酸银 7.下图中甲、乙、丙是初中化学中常见的物质,图中“—”表示 相连的物质之间可以在溶液中发生化学反应,“→”表示 由某种物质可转化为另一种物质(部分反应物、生成物及 反应条件已略去)。下列说法中不正确的是 A .甲、乙、丙可能依次为Fe 、NaOH 、CO 2 B .丙物质只能是氧化物或盐 C .当乙为NaOH 时,它可由Ca(OH)2与Na 2CO 3反应生成 D .当甲为一种碱时,它与硫酸铜溶液的反应可能产生两种沉淀 8.已知A 、B 、C 、D 、E 五种物质中都含有人体含量最多的 一种金属 元素,其中A 是单质,B 、C 含有两种元素,D 、E 含有三种元素,反应 ⑤是放热反应,它们之间的转化关系如图所示,下列推理不正确的是 ( ) A .E 是碳酸钙 B .反应④一定是中和反应 质 丙 H 2SO 4 CaCl 2 ; CuO CuSO 4 丁 BaCl 2 AgNO 3 HCl NaOH X · M Y 铁 N
初中化学物质转化关系图
1、氧气、氧化物、酸、氢气、水 H2O KMnO4↘↓↑↗CO、CO2 ↗SO2 H2SO4 H2O2 →→P2O5 + Mg Al Zn Fe→ H2→H2O ↘MgO HCl KClO3↗↓↘Al2O3 Fe3O4 2、碳与碳的化合物 3、氢氧化钠、碳酸钠、氯化钠 + CO2↗ Na2SO4 → BaSO4↓(白) NaOH → Na2CO3 → CaCO3↓(白) (变质)↘ NaCl → AgCl↓(白) 4、含钙化合物的关系: ↙↗―――――――↘↖ CaCO3→CaO→Ca(OH)2→CaCl2
↖CO2↙ 5、氧化钡、氢氧化钡与硫酸钡 ↗BaCl2→ BaSO4↓(白) BaO → Ba(OH)2↗ ↘ + CuS O4 ↘Cu(OH)2↓(蓝) 6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵 CuO↗ CO2 ↙↘Ca(HCO3)2 →CaCO3→CaO →CuSO4→ Cu ↘H2O ↗Na2CO3↗NH3 → NaHCO3 →CO2 NH4HCO3→ H2O ↘H2O → H2CO3↘ CO2 →H2CO3 7、铝、镁、锌、铁、铜及其化合物 ↗ZnSO4↖↗ AlCl3↖ Zn → ZnO Al → Al2O3 ↘ZnCl2↙↘Al2(SO4)3↙ Fe Al ↗MgCl2↖↙﹉﹉﹉﹉↗ CuCl2↘↖ Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO4↙↖____↘ CuSO4↗↙ Fe Al
↙ FeCl3↖ C CO H2Mg Al↗FeSO4 Fe(OH)3 Fe2O3←――――→ Fe ↖Fe2(SO4)3↙O2 H2O ↘ FeCl2 二、物质之间的转化关系的分析推断题。
物质之间的相互转化
物质之间的相互转化关系1 2.
3.(单向箭头类)下列框图中的反应物与生成物都已给出,请推断每个框图中可能发生的化学反应。 Ⅰ Ⅲ Ⅳ Ⅴ (1)Ⅰ图中,发生的两类复分解反应是____________________________、__________________________;(2)Ⅱ图中,发生的三个分解反应是______________________________、____________________________、_________________________________; (3)Ⅲ图中, ①若A为单质,其余是化合物,则可能的反应是________________________________; ②若B为单质,其余是化合物,则可能的反应是________________________________; ③若A、B为单质,C、D是化合物,则可能的反应是______________________、______________________、 ______________________。 ④若A、B、C、D都是化合物,则可能的反应是_________________________、______________________。(4)Ⅳ图中,A、B、C、D分别是_______、_______、_______、_______; (5)Ⅴ图中,A、B、C、D分别是①_______、_______、_______、_______;②_______、_______、_______、_______;③_______、_______、_______、_______。 4.(双向箭头类)下列框图中的反应物与生成物都已给出,请推断每个框图中可能发生的化学反应。 (7)VI图中,A、B、C、D分别是_______、_______、_______、_______; (8)Ⅶ图中,A、B、C分别是①_______、_______、_______;②_______、_______、_______; 5.(反应物相同,生成物不同)图中的反应物与生成物都已给出,请推断每个框图中可能发生的化学反应。 ⅨⅩⅪ (1)Ⅸ图中,反应①②的化学方程式是___________________________、____________________________。(2)Ⅹ图中,反应①②的化学方程式是___________________________、____________________________。
必修一物质转化关系图示
必修1 物质转化关系图及相应化学方程式 一、金属钠及其重要化合物的相互转化(括号内写离子方程式) (一)能够熟练书写下列转化化学方程式和离子方程式 1. 2. 3. 现象 : ( ) 4. ( ) * 5. ( ) * 6. 7. ( ) 8. ( ) 9. ( ) 10. ( ) 11. ( ) Na 2O Na ① NaCl NaHCO 3 Na 2CO 3 NaOH Na 2O 2 ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿
[NaHCO 3固体] (二) 熟记下列物质的颜色状态 Na: Na 2O: Na 2O 2: NaHCO 3: Na 2CO 3: (三) 熟记下列信息 溶解度: NaHCO 3 Na 2CO 3 溶液碱性强弱: NaHCO 3 Na 2CO 3 俗名: NaHCO 3: Na 2CO 3: Na 的保存: Na 2O 2的用途: 二、金属铝及其重要化合物的相互转化(括号内写离子方程式) 1. 2. 3. ( ) Al Al (OH )3 NaAlO 2 Al 2O 3 AlCl 3 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
5. ( ) 6. ( ) 7. ( ) 8. ( ) 9.实验制取Al (OH )3: ( ) 10.Al 2O 3的用途: 三、金属铁及其化合物的相互转化(括号内写离子方程式) 1. 2. ( ) 3. ( ) 4. ( ) 5. ( ) ① Fe 3O 4 ② 2 3 ⑿
7. ( ) 8. ( ) 9. ( ) 10.属于化合反应的 ( )印刷腐蚀电路板的 ( ) 11. 12.白色沉淀,然后迅速变为灰绿色,最后变为红褐色 13.离子颜色:Fe2+ Fe3+ 四、非金属氯及其化合物的相互转化(括号内写离子方程式) 1. 2. 3. 4. NaCl 2 3 AgCl ⑤ ⑥ ⑦ ⑧
元素化合物的转化关系网络图
元素化合物的转化关系 一、常见金属元素(Na 、Al 、Fe 、Cu )单质及其重要化合物。 1、钠及其重要化合物间的转化关系。 写出图中标号反应的化学方程式或离子方程式。 ① 2Na + O 2 Na 2O 2(淡黄色) ② 2Na 2O 2 + 2H 2O = 4NaOH + O 2↑ 2Na + 2H 2O = 2Na + + 2OH - + H 2↑ ③ 2Na 2O 2 + 2H 2O = 4NaOH + O 2↑ 2Na 2O 2 + 2H 2O = 4Na + + 4OH - + O 2↑ ④ 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2 ⑤ 2NaCl +2 H 2O 通 电 2NaOH + H 2↑ + Cl 2↑(氯碱工业) 2Cl - +2 H 2O 通 电 2OH - + H 2↑ + Cl 2↑ ⑥ Na 2CO 3 + H 2O +CO 2 = 2NaHCO 3 CO 3 2-+ H 2O +CO 2 = 2HCO 3- ⑦ 2NaClO + H 2O +CO 2 = Na 2CO 3+ HClO 2、铝及其重要化合物间的转化关系。 写出图中标号反应的化学方程式或离子方程式。 ① 4Al + 3O 2 点 燃 2Al 2O 3 2Al + Fe 2O 3 高 温 2 Fe + Al 2O 3 ② 2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2↑ 2Al +2OH - +2H 2O = 2AlO 2- +3H 2↑ ③ 2Al 2O 3 通 电 4Al+3O 2↑ ④ Al 2O 3+6HCl = 2AlCl 3+3H 2O Al 2O 3 + 6H + = 2Al 3+ + 3H 2O ⑤ Al 2O 3 + 2NaOH = 2NaAlO 2 +H 2O Al 2O 3 + 2OH - = 2AlO 2- + H 2 O
物质转化关系图精编
物质转化关系图精编 High quality manuscripts are welcome to download
物质转化关系图 1.氯及其化合物 2.硫及其重要化合物 3.氮气其重要化合物 4.碳及其重要化合物 5.硅及其重要化合物 6.钠及其化合物 7.镁及其化合物 8.铝及其重要化合物 9.铁及其重要化合物10.有关O2、H2、 H2O、H2O2的转化关系。11.磷及其重要化合物 有关氯元素的转化关系 NaClO HClO Cl 2 HCl NaCl CuCl 2 FeCl 3 Ca(ClO) 2 AgCl H 2 NaOH Cu Fe Ag AgNO 3 AgNO 3 AgNO 3 H 2 NaOH Ca(OH) 2 HCl H 2 O 光照
S SO 2 Na 2SO 3 Na 2SO 4 H 2SO 4 SO 3 H 2SO 3 O 2 O 2 H 20 H 20 Cu HClO 3 NaOH NaOH Na 2SO 3
NH 3N2NO NO2 HNO 3 NH 4 HCO 3 4 放 电 O 2 H 2 H 2 O 2 Ca(OH) 2 HCl △ H 2 O NaOH Cu Cu O 2
3.碳及其重要化合物
硅及其重要化合物 4.钠及其化合物 Na Na 2O 2 NaOH Na 2 CO 3 NaHCO 3 NaCl Na 2 O Si SiO2Na2SiO3H2SiO3 CaSiO3 SiF4 C O 2 CaCO 3 HF NaOH HC l H 2 SiCl4 Cl 2
