关于药物筛选模型征集的通知

关于药物筛选模型征集的通知
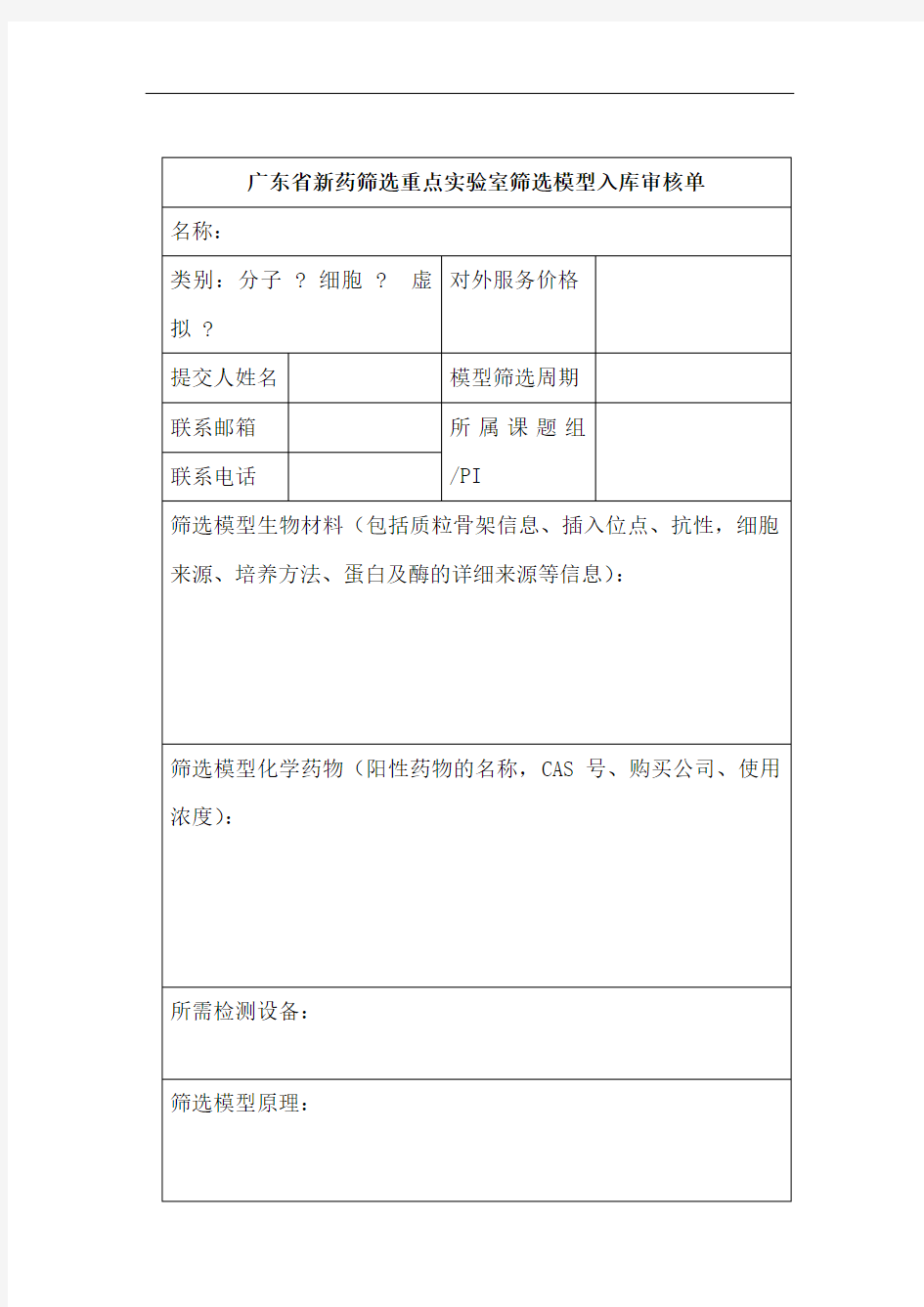
依据广东省新药筛选重点实验室的要求,为药学院的药物筛选和新药发现提供保证,现计划从药学院现有药物筛选模型和相关资源中发掘和开发特色药物筛选模型。
1、药学院药理学相关课题组向广东省新药筛选重点实验室提供本领域的特色筛选模型,按照1000元/种的标准给予资助。
每种筛选模型需提供两个版本,一个详细操作的PROTOCOL版本(筛选中心在获得全部细胞和试剂后,按此规程操作,能重复实验结果),一个是挂网宣传的版本。
2、提供的筛选模型必须保证其稳定性和有效性,广东省新药筛选重点实验室全套备份筛选模型,并在网上挂出。
3、成立新药筛选模型评估委员会,负责审核课题组提交的新药筛选模型,并及时将审核结果反馈给课题组。
4、筛选平台可提供实体和虚拟两种筛选平台,虚拟筛选平台的资助标准为实体筛选平台的1/5。
5、广东省新药筛选重点实验室在未获得药物筛选模型提交课题组PI或者实验室负责人知情时,不得向任何人提供筛选平台的详细流程和相关使用材料信息。
注意:
1、本表一式两份,双面打印。一份课题组保存,一份广东省新药筛选重点实验室保存,供年终评估使用。
2、电子版发广东省新药筛选重点实验室,可添加纸双面打印。
化合物征集办法
为了响应广东省新药筛选重点实验室的要求,为药学院的药物筛选和新药发现提供保证,现计划从药学院现有合成的药物资源中征集新的小分子实体。
1、以课题组为单位向广东省新药筛选重点实验室提交小分子化合物每种10-100 mg,并提供相应完整谱图,按照100元/个(合成化合物),200元/个(天然产物)的基准向提供课题组提供资助。若与购买的商品化合物库中化合物重复,资助标准减半;若证明为全新化合物,资助标准翻倍。
2、同一化合物入库遵从先到先入原则,每个化合物入库需要跟库里已有的化合物查重。
3、采用ISIS25软件进行登记,化合物提供纯度和检测说明。
4、由广东省新药筛选重点实验室负责,审核课题组提交的小分子实体,并及时将审核结果反馈给课题组。
5、广东省新药筛选重点实验室在未获得小分子实体提交课题组PI或者实验室负责人知情时不能提供任何结构信息。
6、合乎筛选要求的化合物(国家新药筛选中心标准)
普遍要求:分子量介于175和800之间的固体有机化合物。
杂环和稠(杂)环
饱和非芳香性杂环:需带有两个或以上取代基团
桥连双环化合物:二环可全部由碳原子组成,或含有氧、硫、氮
原子;带有两个或以上取代基团。
天然产物及其衍生物:分离得到,或合成的。
7、不合乎筛选要求的化合物(国家新药筛选中心标准)
液体
分子量小于175或大于800
不稳定或水/光敏感的化合物
聚合物
无机物
不含杂原子的化合物
多核芳香烃
含有重金属(Hg, Pb, As, Sn, Cr等)的有机物
氧-硅烷基化合物
腙
亚胺
吖啶
吡喃鎓盐
冠醚
磷酰卤
三烃基膦
西弗碱类化合物
二硫化物(非环状)
硫酯
简单(硫)脲(分子量小于350)高氯酸盐,高碘酸盐
全卤代芳香族化合物
环氧化物
酰氯
酐
异(硫)氰酸酯(盐)
反应活性醌类
叠氮化物,重氮盐,偶氮苯
肼
氮-氧化物
亚硝基化合物
氮-卤化物
注意:
1、本表一式两份,双面打印。一份课题组保存,一份广东省新药筛选重点实验室保存,供年终评估使用。
2、电子版发广东省新药筛选重点实验室,可添加纸双面打印。
关于药物筛选模型征集的通知
关于药物筛选模型征集的通知 依据广东省新药筛选重点实验室的要求,为药学院的药物筛选和新药发现提供保证,现计划从药学院现有药物筛选模型和相关资源中发掘和开发特色药物筛选模型。 1、药学院药理学相关课题组向广东省新药筛选重点实验室提供本领域的特色筛选模型,按照1000元/种的标准给予资助。 每种筛选模型需提供两个版本,一个详细操作的PROTOCOL版本(筛选中心在获得全部细胞和试剂后,按此规程操作,能重复实验结果),一个是挂网宣传的版本。 2、提供的筛选模型必须保证其稳定性和有效性,广东省新药筛选重点实验室全套备份筛选模型,并在网上挂出。 3、成立新药筛选模型评估委员会,负责审核课题组提交的新药筛选模型,并及时将审核结果反馈给课题组。 4、筛选平台可提供实体和虚拟两种筛选平台,虚拟筛选平台的资助标准为实体筛选平台的1/5。 5、广东省新药筛选重点实验室在未获得药物筛选模型提交课题组PI或者实验室负责人知情时,不得向任何人提供筛选平台的详细流程和相关使用材料信息。
注意: 1、本表一式两份,双面打印。一份课题组保存,一份广东省新药筛选重点实验室保存,供年终评估使用。 2、电子版发广东省新药筛选重点实验室,可添加纸双面打印。
化合物征集办法 为了响应广东省新药筛选重点实验室的要求,为药学院的药物筛选和新药发现提供保证,现计划从药学院现有合成的药物资源中征集新的小分子实体。 1、以课题组为单位向广东省新药筛选重点实验室提交小分子化合物每种10-100 mg,并提供相应完整谱图,按照100元/个(合成化合物),200元/个(天然产物)的基准向提供课题组提供资助。若与购买的商品化合物库中化合物重复,资助标准减半;若证明为全新化合物,资助标准翻倍。 2、同一化合物入库遵从先到先入原则,每个化合物入库需要跟库里已有的化合物查重。 3、采用ISIS25软件进行登记,化合物提供纯度和检测说明。 4、由广东省新药筛选重点实验室负责,审核课题组提交的小分子实体,并及时将审核结果反馈给课题组。 5、广东省新药筛选重点实验室在未获得小分子实体提交课题组PI或者实验室负责人知情时不能提供任何结构信息。 6、合乎筛选要求的化合物(国家新药筛选中心标准) 普遍要求:分子量介于175和800之间的固体有机化合物。 杂环和稠(杂)环 饱和非芳香性杂环:需带有两个或以上取代基团 桥连双环化合物:二环可全部由碳原子组成,或含有氧、硫、氮
抑制肿瘤细胞增殖的药物筛选方法
抑制肿瘤细胞增殖的药物筛选方法 09级生科3班余振洋200900140156 一、【实验原理】 1.关于恶性肿瘤和抗肿瘤药物: 恶性肿瘤是一种常见病,严重威胁着人类的生存质量,被称为人类健康的第一杀手。多年来人类一直在不断的进行抗肿瘤药物的研究,抗肿瘤药物的筛选是整个研究过程中很重要的个环节,而进行药物的筛选首先离不开合理的筛选方法和系统。寻找选择性强、对实体瘤有效的新型抗肿瘤药物,是摆在抗肿瘤药物研究人员面前的重要任务。世界各国对抗肿瘤药物的筛选都非常重视,投入了大量的人力、物力、财力,每年都有大量的化合物(合成药、天然产物和微生物发酵产物)待筛,抗肿瘤药物筛选方法的发展经历了一个探索的过程。 8O年代中期以前,普遍采用的筛选方法是以体内小鼠白血病/淋巴瘤模型P388和L1210为基础的 J,所有化合物在进一步的临床研究之前必须通过这种小鼠肿瘤模型的筛选。即小鼠白血病P388和L1210作为第一轮初筛,能通过第一轮初筛的化合物才能被允许进入第二轮筛选。这种方法有一个很明显的缺陷就是一些在临床上有活性的药物将被筛选掉,无法保证所有具有抗肿瘤作用的药物都能通过筛选。鉴于以前的筛选方法存在较大的缺陷,1985年之后以NCI为首的一些研究单位普遍开始采用针对疾病的筛选方法来代替针对化合物的筛选方法,即放弃体内小鼠筛选,代之为体外代表各种常见实体瘤的人类肿瘤细胞株筛选。这种筛选系统是一种高通量的抗肿瘤筛选体系,其主要优势有两点:其一是多种细胞株初筛有可能筛选出对特殊的人类肿瘤或对特殊组织亚型有活性的物质;其二是这种体外筛选尤其适合于复杂天然产物提取物中有效成份的证实,过去动物筛选需较大量的天然产物,而现在天然产物的需要量就大大减少,可以指导有效成份的进一步分离纯化,使得从天然产物中发现新的抗肿瘤药物更加便利。 2.关于筛选方法: 下面为现阶段较为普遍采用的一些抗肿瘤药物的筛选方法的实验原理。 1)以端粒酶活性为作用靶点筛选抗肿瘤药物 端粒是染色体特殊结构,起着保护染色体的完整和稳定性的作用,端粒酶是一种核糖核蛋白返转录酶,由RNA和蛋白质组成,可以以自身的RNA为模板合成端粒末端。已发现在正常的体细胞和良性肿瘤组织中端粒酶活性是阴性,而在人体恶性肿瘤组织和人的肿瘤细胞株中都表达了很高的活性。因此,认为端粒酶与恶性肿瘤的发生发展有密切的关系,有可能成为肿瘤治疗的靶点。 2)应用快速荧光素测定法筛选抗肿瘤药物 快速荧光素测定法是一种近几年发展起来的应用非常广泛的体外药物敏感性测定方法,其原理为采用一些特殊的荧光染料,对细胞的特定成份进行染色或标记。或通过细胞酶的作用使无荧光性的材料分解或转换为荧光材料,通过测定荧光强度从而测定出活细胞的量。现在普遍采用一种特殊的荧光染 FDAL1u(Fluoreseein diacetate),在正常情况下它不具有荧光,但当它加人到具有完整细胞膜的肿瘤细胞的营养液中时,由于细胞分泌的水解酶的作用,FDA
附录一药物溶出释放比较研究基本方法
附录一、药物溶出/释放比较研究基本方法 一、基本原则 药品获准上市后,溶出度或释放度检查是药品生产和质量控制的一项重要内容,对保证批间产品质量一致性有重要作用。当药品处方、生产工艺、生产地点和生产规模等发生变更后,溶出度或释放度检查是比较变更前后产品相似性或差异程度的重要方法和研究工作的重要内容。对于口服固体制剂微小的处方、工艺、产地等方面变更,一般通过溶出度和释放度比较研究已可以证明变更前后产品质量的一致性。 溶出度或释放度检查方法需符合药典有关规定。由于溶出/释放比较研究可能需采用与原上市注册时不一致的方法,此时应注意进行相应的方法学验证,注意研究这些方法对区分药品质量及体内行为的分辨能力。 二、药物溶出比较研究基本方法 口服固体制剂给药后体内吸收主要依赖于制剂中药物溶解、溶出及药物在胃肠道的通透性等方面,基于这一过程中药物溶解、溶出的重要性,体外药物溶出行为与体内药物吸收在某些情况下是相关的。药物的水溶解性、药物对肠壁的通透性是溶出比较研究中需要注意的问题,不同特性的药物研究工作侧重点不尽相同。 药物水溶解性、通透性本文附注有相应说明,具体界定及研究工作可参照相关技术指导原则进行。 如果无法判定药物是属于高通透性,还是低通透性的,建议根据
药物的水溶解性,分别参照下述1.2项或1.3项进行变更前后溶出行为比较研究。 1、实验方法 1.1、原料药属于高溶解性,高通透性的 一般认为餐后胃平均保留(排空)T50%是15~20分钟。因此,当此类药物在0.1N盐酸中15分钟溶出85%以上时,一般认为药物体内吸收速度与程度不再依赖于胃排空速率,这种情况下,只要处方中不含显著影响药物吸收的辅料,药品一般不会有生物利用度方面的问题。反之,如果药物溶出比胃排空速率慢,则需要在多种介质中对药物溶出行为进行考察。 此类药物溶出比较试验介质建议首先选择900mL0.1N HCl,可采用药典收载的转蓝法(转速100rpm),也可选择药典收载的桨法(转速50rpm)。如果15分钟内药物溶出85%以上,则不需要再比较其他pH条件下或介质中药物溶出情况。 如果15分钟内药物溶出未达到85%,则需要按下述1.2或1.3对变更前后溶出行为进行比较。 1.2、原料药属于高溶解性,低通透性的 此类药物由于通透性低而溶解性好,体内吸收的主要限速步骤是药物的渗透过程,而不是药物的溶出过程。因此,一般不需要在不同pH条件下考察产品变更前后溶出情况。溶出比较研究可选择质量标准中规定的检查方法进行,如标准中未收载溶出度检查方法,可选择产品申请上市注册时质量研究和稳定性考察中选择的溶出度检查方法。
抗癌药物的研究和发展
抗癌药物的研究与发展 陆志红罗伯特·巴.·戴安修 美国伯明翰阿拉巴马大学药理与毒理学系、临床药理学部癌症是当今世界上大多数国家的主要死因之一。尽管到目前为止已有数十种化疗或辅助抗癌药物可以用于临床治疗,但大多数药物只能使病情缓解,无法达到治愈的目的。虽然一些儿童的癌症或成人皮肤肿瘤有治愈或长期缓解的可能,但大多数死亡率很高而又很常见的癌症如胃癌、食道癌、肺癌等仍缺乏有效的抗癌药物。近年来,各国都在抗癌药物的研究与发展上投入了大量的人力、物力,希望在不久的将来能有所突破。本章就抗癌药物的研究与发展的分子生物学基础、药物的筛选与评价以及非临床研究和临床试验的特点作一综述,以帮助读者对这一领域的进展有所了解。 第一节抗癌药物研究的分子生物学基础 抗癌药物研究的依据是人们对癌症生物学的理解。早期人们对于癌症的了解限于细胞水平,所以大多数药物的发展着眼于细胞分裂分化和免疫等环节。近年来,肿瘤生物学的进展非常迅速,人们对癌症的了解深入到了分子水平,比如癌基因的发现,细胞凋亡学说的形成,肿瘤抑制基因的发现等为抗癌药物的研究与发展提供了新的分子生物学基础。以下简述这些方面的研究进展。 一、细胞分裂 自50年代,人们认为肿瘤细胞比正常细胞分裂快,并应用这一概念发展了一系列的抗癌药物用于干扰或阻止细胞的分裂。主要包括破坏细胞脱氧核糖核酸(DNA)以及蛋白
质代谢的药物。比如烷化剂(Alkylating Agents),DNA拓扑异构酶抑制剂(Topoisomerase Inhibitors)以及抗生素类(Antibiotics)。通过对细胞周期的仔细研究,现在我们知道肿瘤细胞并不比正常细胞分裂得快,只是在任何时间都有较高比例的肿瘤细胞处于分裂期。 二、细胞增殖周期调控中国医药资讯网https://www.360docs.net/doc/08384178.html, 因为肿瘤细胞失去了正常细胞的控制机制,在癌组织中的细胞更倾向处于细胞分裂期。根据这一理论,许多抗癌药物作用于处于分裂期的细胞。如抑制DNA合成的抗代谢药物(Antimetabolites)和抑制微小管有丝分裂形成的微小管蛋白结合剂(Tubulin—Binding Atents)就是根据此概念发展而来的。 三、肿瘤抗原 研究表明某些癌症组织在免疫学上不同于正常细胞,癌症细胞在一定程度上是“异物”,或者是去分化的细胞,且可能存在特异的肿瘤抗原,这一发现是肿瘤免疫治疗的基础。根据这一概念,人们试图用各种特异及非特异的方法,提高人体对肿瘤的免疫功能。比如用细胞毒性免疫细胞、单克隆抗体、细胞因子(Cytokins)以及核受体结合剂(VitaminD3 、Retinoids)等治疗癌症。 四、癌基因及其活化 80年代以来的研究发现,在某些肿瘤细胞中,一些癌基因被激活。若能抑制癌基因的激活,应可治疗癌症。例如研究发现ras癌基因蛋白的激活需要farnesyl蛋白转移酶的存在,因此farnesyl蛋白转移酶抑制剂被发展成为抗癌药物。另外,许多人类肿瘤,如膀
药物释放度研究概述
药物释放度研究概述 药物释放度是指药物从缓释制剂、控释制剂、肠溶制剂及透皮贴剂等在规定条件下释放的 速率和程度,是 评价药物制剂质量的内在指标,是制剂质量控制的重要手段。释放度是随着科学技术和生物药剂学的发展而迅速发展起来的一种新的药品检验方法。20世纪70年代确立了溶出度在口服固体制剂中的重要地位,至20世纪80年代,缓释、控释技术发展迅速,释放的概念随之提出。美国药典1985年版(第21版)率先引入释放度检查法,对缓释制剂、肠溶制剂的溶出进行监控,2000年版(第24版)收载释放度检查品种36个。中国药典1995年版引入释放度检查法,2000年版收载释放度检查品种15个,2005年版收载释放度检查品种26个。 1释放度研究的意义 释放度研究的对象一般为半衰期相对较短(2~4h),首过效应明显,治疗剂量范围较窄, 在很广的pH值内较稳定,并经胃肠道充分吸收的药物。将此类药物制成缓、控释制剂,可通过控制释药速率来降低临床不期望的高峰血药浓度,减少“峰谷”现象,避免血药浓度频繁波动起伏或是控制血药浓度在一个较长的时间内维持在有效浓度以上,从而提高药物疗效,提高患者用药的顺应性。与普通制剂相比较,药物治疗作用持久,毒副作用低,用药次数减少,药物缓慢地释放进入体内,血药浓度“峰谷”波动小,能保持在有效浓度范围内以维持疗效。研究药物释放度,在有效控制制剂质量,指导制剂处方筛选和指导制剂制备工艺优化方面有着重要意义。 2体外药物释放度试验 体外药物释放度试验是在模拟体内消化道条件(如温度、介质的pH值、搅拌速率等)下,对制剂进行药物释放速率试验,以监测产品的生产过程与对产品进行质量控制,同时也是筛选缓、控释制剂处方的重要手段。 仪器装置 USP25共收录了7种装置用于释放度测定。装置1(转篮法)、装置2(桨法)、
药物筛选细胞模型的种类
药物筛选细胞模型的种类 目前用于药物筛选的细胞模型可分为三大类:基于靶点的细胞模型、基于表型的细胞模型和抗病毒药物筛选的细胞模型等。 1. 基于靶点的细胞模型建立基于靶点的细胞模型,要明确药物可能作用的靶点,进而建立靶点过表达的细胞,筛选对靶点有明确作用的药物。基于靶点的细胞模型是目前用于药物筛选的细胞模型的主要类型,可以分为四类。 (1)以受体为靶点的细胞模型:如以维甲酸受体为靶点的药物筛选细胞模型。 (2)以通道为靶点的细胞模型:如囊性纤维化相关的氯离子通道CFTR激活剂/抑制剂筛选细胞模型。 (3)以信号通路为靶点的细胞模型:如NF2κB信号通路的抗阿尔茨海默病药物筛选细胞模型。 (4)以报告基因和其他类型联用为靶点的细胞模型:事实上前三种药物筛选细胞模型通常是和报告基因联用来建立的,这样能够比较快速直观地观察到药物作用后细胞的变化。目前常用的报告基因有绿色荧光蛋白(GFP)和分泌型碱性磷酸酶(SEAP)等。 由人胎盘基因编码的分泌型碱性磷酸酶,能分泌至细胞外,无须裂解细胞就能进行检测,有较强的耐热性,通过热处理就可以排除细胞内源性碱性磷酸酶的干扰。在用碱性磷酸酶做报告基因时,通常是将其与要检测的靶点通过基因重组构建共表达的载体,然后稳定转染到细胞内,在筛选药物时,通过检测SEAP,就可以达到检测药物靶点检测水平的目的。 绿色荧光蛋白的发现,特别是在其基础上通过改造形成的,如黄色荧光蛋白(YFP)、增强型绿色荧光蛋白(EGFP)及其他突变体的产生,极大促进了药物筛选细胞模型的发展。绿色荧光蛋白是一类对离子变化敏感的荧光蛋白分子。将绿色荧光蛋白与目的药靶稳定共转染于细胞模型中,药物作用于药靶后,会引起细胞内环境的变化,从而使荧光强度发生改变。通过荧光测定装置来捕捉用药前后的荧光强度变化,可以快速直观地观察到药物与药靶的作用情况。 2.基于表型的细胞模型基于表型的药物筛选模型通过筛选那些能造成细胞产生期望的生理变化的化合物,将有助于新蛋白、新靶点的发现。如目前在2 型糖尿病药物筛选中应用较多的有胰岛素抵抗细胞模型和葡萄糖消耗运转细胞模型、用于抗 I 型超敏反应药物筛选的肥大细胞模型等。
药物溶出释放比较研究基本方法
药物溶出释放比较研究基本方法 一、基本原则 药品获准上市后,溶出度或释放度检查是药品生产和质量控制的一项重要内容,对保证批间产品质量一致性有重要作用。当药品处方、生产工艺、生产地点和生产规模等发生变更后,溶出度或释放度检查是比较变更前后产品相似性或差异程度的重要方法和研究工作的重要内容。对于口服固体制剂微小的处方、工艺、产地等方面变更,一般通过溶出度和释放度比较研究已可以证明变更前后产品质量的一致性。 溶出度或释放度检查方法需符合药典有关规定。由于溶出/释放比较研究可能需采用与原上市注册时不一致的方法,此时应注意进行相应的方法学验证,注意研究这些方法对区分药品质量及体内行为的分辨能力。 二、药物溶出比较研究基本方法 口服固体制剂给药后体内吸收主要依赖于制剂中药物溶解、溶出及药物在胃肠道的通透性等方面,基于这一过程中药物溶解、溶出的重要性,体外药物溶出行为与体内药物吸收在某些情况下是相关的。药物的水溶解性、药物对肠壁的通透性是溶出比较研究中需要注意的问题,不同特性的药物研究工作侧重点不尽相同。 药物水溶解性、通透性本文附注有相应说明,具体界定及研究工作可参照相关技术指导原则进行。
如果无法判定药物是属于高通透性,还是低通透性的,建议根据药物的水溶解性,分别参照下述1.2项或1.3项进行变更前后溶出行为比较研究。 1、实验方法 1.1、原料药属于高溶解性,高通透性的 一般认为餐后胃平均保留(排空)T50%是15~20分钟。因此,当此类药物在0.1N盐酸中15分钟溶出85%以上时,一般认为药物体内吸收速度与程度不再依赖于胃排空速率,这种情况下,只要处方中不含显著影响药物吸收的辅料,药品一般不会有生物利用度方面的问题。反之,如果药物溶出比胃排空速率慢,则需要在多种介质中对药物溶出行为进行考察。 此类药物溶出比较试验介质建议首先选择900mL0.1N HCl,可采用药典收载的转蓝法(转速100rpm),也可选择药典收载的桨法(转速50rpm)。如果15分钟内药物溶出85%以上,则不需要再比较其他pH条件下或介质中药物溶出情况。 如果15分钟内药物溶出未达到85%,则需要按下述1.2或1.3对变更前后溶出行为进行比较。 1.2、原料药属于高溶解性,低通透性的 此类药物由于通透性低而溶解性好,体内吸收的主要限速步骤是药物的渗透过程,而不是药物的溶出过程。因此,
抗菌药物筛选的实验方法与技术
抗菌药物筛选的实验方法与技术 博哥 (中山大学化学与化学工程学院,广州510275) 摘要为了筛选出活性更好的抗菌药物,本实验采用微量稀释法通过体外实验对44种化合物进行了筛选,测定其对大肠杆菌和金黄色葡萄球菌的最小抑菌浓度或IC50来评定药物活性。结果显示,样品1(环丙沙星)对二者有杀菌作用,最小抗菌浓度都为1.56 μmol·L-1。样品30仅对大肠杆菌有杀菌作用,最小抗菌浓度为1.56 μmol·L-1。样品17、19、20、24、26、28,表现出对大肠杆菌较好的抑制作用,其中抑制活性最好的为样品28(2,5-二羟基苯甲基-N-4-羟基苯基亚胺),IC50值为1.72 μmol·L-1。样品31、42表现出对金黄色葡萄球菌较好的抑制活性,IC50值分别为11.04 μmol·L-1和24.44 μmol·L-1。 关键词抗菌药物筛选体外实验微量稀释法 1 引言 一个新的化合物或分离提取的有效成分是否有抗菌作用,需要药理实验来证实。一般采用体外实验方法,观察试验物对细菌有无杀灭作用或抑制作用。药物对细菌代谢的影响、可以使 细胞呼吸量减低,或酶系统受到抑制等,因而出现细菌不生长或部分抑制,可借以判断药物对 细菌有无抗菌作用,或抗菌范围。因此,体外实验是筛选抗菌药物或测试新药抗菌性能的重要 环节。体外实验的重要性在于方法简便,用药量少,短时间内能判断药物抗菌的广度和强度, 为深入体外实验和体内药效研究提供数据。但是,体外实验是细菌与药物直接接触,没有机体 诸因素参与,故体外和体内实验的结果不一定完全一致,需两方面综合分析进行评价。 本实验进行微生物培养基的配置、灭菌与接种等操作,以熟悉细菌培养的过程,并采用微量稀释法通过体外实验对44种化合物进行了筛选,测定其对大肠杆菌和金黄色葡萄球菌的最 小抑菌浓度或IC50来评定药物活性。 2实验部分 2.1药品 牛肉膏、蛋白胨、NaCl、胰蛋白胨、琼脂、1mol/L NaOH、1mol/L HCl溶液、DMSO以44种化合物(见表1)。
抗肿瘤药物体内筛选试验标准操作规程(SOP)
抗肿瘤药物体内筛选标准操作规程概述: 抗肿瘤药物是指能够直接杀伤或抑制肿瘤细胞生长或增殖的一类药物,作用机制包括抑制肿瘤细胞核酸或蛋白质的合成、干扰大分子物质代谢、干扰微管系统、抑制拓扑异构酶等。 本操作规程包括与抗肿瘤药物申请临床试验和申请上市有关的非临床有效性和安全性研究的内容,其中着力强调非临床有效性和安全性之间的关联性,以及非临床研究和临床试验之间的关联性。旨在一方面为抗肿瘤药物的非临床研究提供技术参考;另一方面,通过技术要求引导科学有序的研发过程,使国内此类药物的研发更趋规范和合理。 本操作规程仅代表目前对抗肿瘤药物非临床研究的一般性认识。具体药物的非临床研究应在本指导原则的基础上,根据药物的自身特点制订研究方案。 研究目的: 建立一套包括抗肿瘤药物体内作用的药效学研究和评价体系及相应的标准操作规程以 及抗肿瘤药物安全性和作用新机制的研究。 ①有效性研究 抗肿瘤药物有效性研究的目的主要在于探索受试物的作用机制、作用强度、抗瘤谱等,为之后的安全性评价以及临床试验中适应症、给药方案的选择提参考信息。 ②安全性评价 安全性评价的目的主要包括:(1)估算 I 期临床试验的起始剂量;(2)预测药物的毒性靶器官或靶组织;(3)预测药物毒性的性质、程度和可逆性;(4)为临床试验方案的制订提供参考。 研究计划: (a)小鼠急性毒性测试
按照急性毒性测试的常规方法,选用昆明种小鼠,通过腹腔注射方式给药,测定体外抗肿瘤活性突出的化合物的半数致死量(LD50),参考给药小鼠体重变化情况,评价化合物的急性毒性,并确定小鼠体内抗肿瘤活性测试的给药剂量。 (b)小鼠体内抗肿瘤活性测试 根据动物体内抗肿瘤活性测试的标准方法,选用昆明种小鼠,皮下接种肉瘤S180或肺癌H22瘤株,选择体外活性突出且急性毒性较低的化合物,设定合适的剂量通过腹腔注射方式给药,以临床常用抗肿瘤药物环磷酰胺作为阳性对照药物,测定肿瘤生长抑制作为体内活性评价指标。 (c)专利保护范围内的化合物的继续合成 申请保护范围较大的专利,合成部分可能具有良好活性的新的化合物,拓展研究范围,发现活性更强的化合物,并申请新的发明专利。并可针对具体化合物申请从属专利,延长高活性化合物的保护期限。 (d)体外抗肿瘤活性的广泛筛选 采用MTT法或台盼蓝染色法,测定化合物对多种人肿瘤细胞株的增殖抑制活性,确定化合物在不同瘤株间抗肿瘤活性的选择性,为裸鼠模型实验提供依据。 (e)抗肿瘤作用机理的深入研究 根据抗肿瘤(f)人癌裸鼠移植瘤模型实验活性化合物作用机理特征,选用微管蛋白聚合等实验从分子水平确认化合物的作用机理;利用人脐静脉血管内皮细胞探讨化合物对内皮细胞骨架的影响及诱导凋亡的途经,从细胞水平上阐明化合物的作用机理。 根据抗肿瘤新药审批办法的要求,采用裸小鼠皮下接种模型和/或原位移植瘤模型,以相对肿瘤增值率和生存时间为指标,确定化合物的抗肿瘤活性。 (g)动物体内药物代谢动力学实验
药物释放模型
药物释放模型的公式及计算 ●Freundlich model The modified Freundlich model suggests the fitting of experimental data on ion exchange and diffusion-controlled process with the following equation: ●parabolic diffusion model The parabolic diffusionmodel elucidates that the release process is controlled by a diffusion process such as intraparticle diffusion or surface diffusion: where C0 and Ct are the amounts of drug in the CaP carriers at the release time 0 and t; k is the release rate constant, and a and b are constants whose chemical significance is not clearly resolved. Zero order release profile ?First order release equation ?Log Q t=Log Q0 + K t/2.303 ?Where ?Q0=initial amount of drugs ?Q t=cumulative amount of drug release at time t ?K=first order release constant ?t= time in hours
抗肿瘤药物体内筛选试验标准操作规程(SOP)
抗肿瘤药物体内筛选标准操作规程 概述: 抗肿瘤药物是指能够直接杀伤或抑制肿瘤细胞生长或增殖的一类药物,作用机制包括抑 制肿瘤细胞核酸或蛋白质的合成、干扰大分子物质代谢、干扰微管系统、抑制拓扑异构酶等。 本操作规程包括与抗肿瘤药物申请临床试验和申请上市有关的非临床有效性和安全性 研究的内容,其中着力强调非临床有效性和安全性之间的关联性,以及非临床研究和临床试 验之间的关联性。旨在一方面为抗肿瘤药物的非临床研究提供技术参考;另一方面,通过技术要求引导科学有序的研发过程,使国内此类药物的研发更趋规范和合理。 本操作规程仅代表目前对抗肿瘤药物非临床研究的一般性认识。具体药物的非临床研究 应在本指导原则的基础上,根据药物的自身特点制订研究方案。 研究目的: 建立一套包括抗肿瘤药物体内作用的药效学研究和评价体系及相应的标准操作规程以 及抗肿瘤药物安全性和作用新机制的研究。 ①有效性研究 抗肿瘤药物有效性研究的目的主要在于探索受试物的作用机制、作用强度、抗瘤谱等, 为之后的安全性评价以及临床试验中适应症、给药方案的选择提参考信息。 ②安全性评价 安全性评价的目的主要包括:(1)估算I期临床试验的起始剂量;(2)预测药物的毒性靶器官或靶组织;(3)预测药物毒性的性质、程度和可逆性;(4)为临床试验方案的 制订提供参考。 研究计划: (a)小鼠急性毒性测试 按照急性毒性测试的常规方法,选用昆明种小鼠,通过腹腔注射方式给药,测定体
外抗肿瘤活性突出的化合物的半数致死量(LD5o),参考给药小鼠体重变化情况,评价化合物的急性毒性,并确定小鼠体内抗肿瘤活性测试的给药剂量。 (b)小鼠体内抗肿瘤活性测试 根据动物体内抗肿瘤活性测试的标准方法,选用昆明种小鼠,皮下接种肉瘤 S180或肺癌H22瘤株,选择体外活性突出且急性毒性较低的化合物,设定合适的剂量通过腹腔注射方式给药,以临床常用抗肿瘤药物环磷酰胺作为阳性对照药物,测定肿瘤生长抑制作为体内活性评价指标。 (c)专利保护范围内的化合物的继续合成 申请保护范围较大的专利,合成部分可能具有良好活性的新的化合物,拓展研究范围, 发现活性更强的化合物,并申请新的发明专利。并可针对具体化合物申请从属专利,延长高活性化合物的保护期限。 采用MTT法或台盼蓝染色法,测定化合物对多种人肿瘤细胞株的增殖抑制活性,确 定化合物在不同瘤株间抗肿瘤活性的选择性,为裸鼠模型实验提供依据。 (e)抗肿瘤作用机理的深入研究 根据抗肿瘤(f)人癌裸鼠移植瘤模型实验活性化合物作用机理特征,选用微管蛋白 聚合等实验从分子水平确认化合物的作用机理;利用人脐静脉血管内皮细胞探讨化合物对内 皮细胞骨架的影响及诱导凋亡的途经,从细胞水平上阐明化合物的作用机理。 根据抗肿瘤新药审批办法的要求,采用裸小鼠皮下接种模型和/或原位移植瘤模型, 以相对肿瘤增值率和生存时间为指标,确定化合物的抗肿瘤活性。 (g )动物体内药物代谢动力学实验 选择在人癌裸鼠移植瘤模型实验中活性良好的化合物,开展动物体内药物代谢动力学实验,考查化合物的吸收、分布、代谢、排泄性质。 (h)动物亚急性,长毒实验 根据抗肿瘤新药审批办法的要求,测定动物亚急性、长毒性质,进行药物安全性评价。 基本方法: ①小白鼠的灌胃法
附录一药物溶出释放比较研究基本方法
附录一、药物溶出/ 释放比较研究基本方法 一、基本原则 药品获准上市后,溶出度或释放度检查是药品生产和质量控制的一项重要内容,对保证批间产品质量一致性有重要作用。当药品处方、生产工艺、生产地点和生产规模等发生变更后,溶出度或释放度检查是比较变更前后产品相似性或差异程度的重要方法和研究工作的重要内容。对于口服固体制剂微小的处方、工艺、产地等方面变更,一般通过溶出度和释放度比较研究已可以证明变更前后产品质量的一致性。 溶出度或释放度检查方法需符合药典有关规定。由于溶出/ 释放比较研究可能需采用与原上市注册时不一致的方法,此时应注意进行相应的方法学验证,注意研究这些方法对区分药品质量及体内行为的分辨能力。 二、药物溶出比较研究基本方法口服固体制剂给药后体内吸收主要依赖于制剂中药物溶解、溶出及药物在胃肠道的通透性等方面,基于这一过程中药物溶解、溶出的重要性,体外药物溶出行为与体内药物吸收在某些情况下是相关的。药物的水溶解性、药物对肠壁的通透性是溶出比较研究中需要注意的问题,不同特性的药物研究工作侧重点不尽相同。 药物水溶解性、通透性本文附注有相应说明,具体界定及研究工 作可参照相关技术指导原则进行。 如果无法判定药物是属于高通透性,还是低通透性的,建议根据 药物的水溶解性,分别参照下述1.2 项或1.3 项进行变更前后溶出行为比较研究。 1、实验方法
1.1、原料药属于高溶解性,高通透性的 一般认为餐后胃平均保留(排空)T50%是15~20分钟。因此,当此类药物在0.1N 盐酸中15 分钟溶出85%以上时,一般认为药物体内吸收速度与程度不再依赖于胃排空速率,这种情况下,只要处方中不含显著影响药物吸收的辅料,药品一般不会有生物利用度方面的问题。反之,如果药物溶出比胃排空速率慢,则需要在多种介质中对药物溶出行为进行考察。 此类药物溶出比较试验介质建议首先选择900mL0.1N HC,l 可采用药典收载的转蓝法(转速100rpm),也可选择药典收载的桨法(转速 50rpm)。如果15分钟内药物溶出85%以上,则不需要再比较其他pH条件下或介质中药物溶出情况。 如果15 分钟内药物溶出未达到85%,则需要按下述1.2 或1.3 对变更前后溶出行为进行比较。 1.2、原料药属于高溶解性,低通透性的此类药物由于通透性低而溶解性好,体内吸收的主要限速步骤是药物的渗透过程,而不是药物的溶出过程。因此,一般不需要在不同pH 条件下考察产品变更前后溶出情况。溶出比较研究可选择质量标准中规定的检查方法进行,如标准中未收载溶出度检查方法,可选择产品申请上市注册时质量研究和稳定性考察中选择的溶出度检查方法。 一般每批样品至少采用12个剂量单位(如片剂为12片,胶囊为 12 粒)进行测定,除0时外,一般至少选择3个时间点进行测定,如5、15、30、45min,或采用其他适宜的时间间隔取样,直到药物溶出90%
菌种的分离与筛选
一、微生物工业对菌种的要求 (一)、微生物工业的生产水平由三个要素决定:生产菌种的性能、发酵及提纯工艺条件、生 产设备。其中生产菌种的性能是最重要的因素。 (二)、微生物工业对菌种的要求是: (1)菌株高产,在较短的时间内发酵产生大量发酵产物的能力; (2)在发酵过程中不产生或少产生与目标产品相近的副产品及其他产物; (3)生长繁殖能力强,较强的生长速率,产孢子的菌种应该具有较强的产孢子能力; (4)能够高效地将原理转化为产品; (5)能利用广泛的原材料,并对发酵原料成分的波动敏感性小; (6)对需要添加的前体物质有耐受能力,并且不能将这些前体物质作为一般碳源利用; (7)在发酵过程中产生的泡沫要少; (8)具有抗噬菌体的能力; (9)遗传稳定性, 二、工业用微生物菌种的来源及选育 (一)微生物菌种的来源 一般通过以下几个途径收集菌种、采集样品和分离筛选: (1)是根据资料直接向有科研单位、高等院校、工厂或菌种保藏部门索取或购买; (2)从大自然中采集样品分离; (3)从一些发酵制品中分离筛选目的菌株。 当前发酵工业所用菌种总趋势是从野生菌转向变异菌,自然选用转向代谢育种,从诱发基因突变转向基因重组的定向育种。 (二)微生物工业菌种的分离 1、野生菌株的分离、筛选过程 (1)新菌种分离与筛选的步骤 菌种分离的流程如下: 标本采集→标本材料的预处理→富集培养→菌种初筛→ 菌种复筛→性能鉴定→ 菌种保藏①采样 采样季节:以温度适中,雨量不多的秋初为好。 采土方式:在选好适当地点后,用小铲子除去表土,取离地面5-15cm处的土约10g,盛入清洁的牛皮纸袋或塑料袋中,扎好,标记,记录采样时间、地点、环境条件等,以备查考。 为了使土样中微生物的数量和类型尽少变化,宜将样品逐步分批寄回,以便及时分离。 ②标本预处理 ④纯种分离:采用划线分离法、稀释分离法等纯化方法获取单菌落。 ⑤高产菌株的筛选:这一步是采用与生产相近的培养基和培养条件,通过三角瓶的容量进行 小型发酵试验,获得适合于工业生产用菌种。还要对菌种进行发酵性能测定, ⑥毒性试验:据有的国家规定,微生物中除啤酒酵母、脆壁酵母、黑曲霉、米曲霉和枯草杆 菌作为食用无须作毒性试验外,其他微生物作为食用,均需通过两年以上的毒性试验。 2、菌种的分离方法 (1)施加选择性压力分离法 主要是利用不同种类的微生物其生长繁殖对环境和营养的要求不同,如温度、pH、渗透压、氧气、碳源、氮源等,人为控制这些条件,使之利于某类或某种微生物生长,而不利于其他 种类微生物的生存,以达到使目的菌种占优势.而得以快速分离纯化的目的。如可以控制培
高通量药物筛选模型031121
高通量药物筛选模型* 姚佳杨建波杨洁* (南京大学生命科学院生物化学系,医药生物技术国家实验室,南京210093) 摘要:本文介绍了可用于药物筛选的三种新的快速高通量筛选方法,包括基于反酵母双杂交的筛选系统;细胞平台伤的高通量筛选系统以及动物水平的筛选系统。并对其应用原理,应用情况和有缺点进行了阐述。 关键词:高通量筛选(HTS),酵母双杂交,靶点,受体 Abstract: This article mainly deals with three new dominant plat forms of HTS(High-Throughput Screen) which are fairly useful in drug screen——the reverse yeast two hybrid system, the cell-based screen and the animal platform, including their principles, their appliance and their advantages together with disadvantages. Key Words: High-Throughput Screen, yeast two-hybrid system, target, receptor 学科分类号:Q7 药物筛选模型研究经历了三个不同的发展阶段:最初意义上的筛选方法、分子生物学筛选方法和高通量筛选方法,而每一个阶段都源于一种新技术的诞生。最初的药物筛选是直接利用动物组织或天然产物进行的,并不涉及到疾病发生的分子机制。在这样粗略的筛选系统中只有有限的样品得到筛选,而且大多数样品只是基于疾病表征而非靶点的筛选。因此,药物的发现会带有偶然性。1980年以来,随着有机化学和分子生物学的发展,更加系统化的筛选方法应用到药物研究与开发中。一方面,有机化学的飞速发展为筛选提供了庞大的人工合成小分子库;另一方面,分子生物学为筛选提供了靶蛋白。通过比较正常人群与疾病患者间在机体组织细胞分子上的差异以及阐明模型组织中相应蛋白质的功能,从而正确地选择、描述并确认某些靶蛋白,有助于更加理性地进行药物筛选,不足的是上述过程往往费时耗财。而基因组学的发展对这个问题提供了很好的解决方法,基因组学能够更加有效地验证潜在的靶蛋白,并通过功能基因组研究能够快速有效地确认与特定疾病有关的靶蛋白[ 1 ]。 *本课题为国家自然科学基金资助项目(项目编号30171094和30271497)。联系人:杨洁,南京大学生命科学学院,医药生物技术国家重点实验室,南京210093,中国;电话:86-25-3594060,传真:86-25-3324605;Email:luckyjyj@https://www.360docs.net/doc/08384178.html,。
国家新药筛选中心模型
国家新药筛选中心筛选模型 模型编号模型名称筛选目的化合物需要量送样备注筛选周期 是否接收 免费初筛 抗肿瘤药物筛选 C003白血病细胞株(HL-60)白血病 2 mg;混合物 15 mg初筛细胞株2个月否C004白血病细胞株(K-562)白血病 2 mg;混合物 15 mg至少10个样品2个月否C084白血病细胞株(Molt-4)白血病 2 mg;混合物 15 mg初筛细胞株2个月否C005白血病细胞株(Raji)白血病 2 mg;混合物 15 mg至少10个样品2个月否C002白血病细胞株(U-937)白血病 2 mg;混合物 15 mg至少10个样品2个月否C020大肠癌细胞株(HCT-116)大肠癌 2 mg;混合物 15 mg至少10个样品2个月否C026大肠癌细胞株(HCT-15)大肠癌 2 mg;混合物 15 mg至少10个样品2个月否C023大肠癌细胞株(HT-29)大肠癌 2 mg;混合物 15 mg至少10个样品2个月否C022大肠癌细胞株(LoVo)大肠癌 2 mg;混合物 15 mg至少10个样品2个月否C021大肠癌细胞株(SW-1116)大肠癌 2 mg;混合物 15 mg至少10个样品2个月否C025大肠癌细胞株(WiDr)大肠癌 2 mg;混合物 15 mg至少10个样品2个月否C006肺癌细胞株(A-549)肺癌 2 mg;混合物 15 mg初筛细胞株2个月否C096肺癌细胞株(NCI-H187)肺癌 2 mg;混合物 15 mg至少10个样品2个月否C010肺癌细胞株(NCI-H23)肺癌 2 mg;混合物 15 mg至少10个样品2个月否C030肝癌细胞株(BEL-7402)肝癌 2 mg;混合物 15 mg初筛细胞株2个月否C027肝癌细胞株(BEL-7404)肝癌 2 mg;混合物 15 mg至少10个样品2个月否C097肝癌细胞株(Hep3B)肝癌 2 mg;混合物 15 mg至少10个样品2个月否C028肝癌细胞株(HepG2)肝癌 2 mg;混合物 15 mg至少10个样品2个月否C029肝癌细胞株(SMMC-7721)肝癌 2 mg;混合物 15 mg至少10个样品2个月否C041宫颈癌细胞株(HELA)宫颈癌 2 mg;混合物 15 mg至少10个样品2个月否C042鳞癌细胞株(A-431)鳞癌 2 mg;混合物 15 mg至少10个样品2个月否C039鳞癌细胞株(KB)鳞癌 2 mg;混合物 15 mg至少10个样品2个月否C035卵巢癌细胞株(3AO)卵巢癌 2 mg;混合物 15 mg至少10个样品2个月否C034卵巢癌细胞株(AO)卵巢癌 2 mg;混合物 15 mg至少10个样品2个月否C033卵巢癌细胞株(HO-8910)卵巢癌 2 mg;混合物 15 mg至少10个样品2个月否C088卵巢癌细胞株(OVCAR-3)卵巢癌 2 mg;混合物 15 mg至少10个样品2个月否C098卵巢癌细胞株(SK-OV-3)卵巢癌 2 mg;混合物 15 mg至少10个样品2个月否 C053内皮细胞增殖试验:采用人皮肤微 血管内皮细胞(HMEC) 血管生成抑制 2 mg;混合物 15 mg至少10个样品2个月否 C092人前列腺癌(PC-3)前列腺癌 2 mg;混合物 15 mg至少10个样品2个月否C044乳腺癌细胞株(MCF-7)乳腺癌 2 mg;混合物 15 mg至少10个样品2个月否C073乳腺癌细胞株(MDA-MB-231)乳腺癌 2 mg;混合物 15 mg至少10个样品2个月否C089乳腺癌细胞株(MDA-MB-435)乳腺癌 2 mg;混合物 15 mg至少10个样品2个月否C074乳腺癌细胞株(MDA-MB-468)乳腺癌 2 mg;混合物 15 mg至少10个样品2个月否C090乳腺癌细胞株(SK-BR-3)乳腺癌 2 mg;混合物 15 mg至少10个样品2个月否C085胃癌细胞株(AGS)胃癌 2 mg;混合物 15 mg至少10个样品2个月否C016胃癌细胞株(MKN-1)胃癌 2 mg;混合物 15 mg至少10个样品2个月否C014胃癌细胞株(MKN-28)胃癌 2 mg;混合物 15 mg至少10个样品2个月否C017胃癌细胞株(MKN-45)胃癌 2 mg;混合物 15 mg至少10个样品2个月否C015胃癌细胞株(SGC-7901)胃癌 2 mg;混合物 15 mg至少10个样品2个月否 C108酪氨酸激酶活性测定(c-Kit)酪氨酸激酶 2 mg;混合物 15 mg 至少10个样品, 需咨询 1个月否 C109酪氨酸激酶活性测定(c-Src)酪氨酸激酶 2 mg;混合物 15 mg 至少10个样品, 需咨询 1个月否 C051酪氨酸激酶活性测定(表皮生长因 子受体EGFR) 酪氨酸激酶 2 mg;混合物 15 mg 至少10个样品, 需咨询 1个月否
抗菌药物筛选的实验方法与技术
抗菌药物筛选的实验方法与技术 一、实验原理 体外实验是筛选抗菌药物或测试新药抗菌性能的重要环节。药物对细菌代谢的影响、可以使细胞呼吸量减低,或酶系统受到抑制等,因而出现细菌不生长或部分抑制,可借以判断药物对细菌有无抗菌作用,或抗菌范围。 培养基是指利用人工方法将适合微生物生长繁殖成积累代谢产物的各种营养物质混合配制而成的营养基质。主要用于微生物的分离、培养、鉴定以及菌种保藏等方面。培养基一般应含有微生物生长繁殖所需要的碳源、氮源、能源、无机盐、生长因子和水等营养成分。此外,为了满有微生物生长繁殖或积累代谢产物的要求,还必须控制培养基的pH。 按培养基的物理状态,可将培养基分为固体培养基、半固体培养基和液体培养基。固体培养基是指在液体培养基中加入一定量的凝固剂(常加1.5%-2%的琼脂)经融化冷凝而成。半固体培养这是指在液体培养基中加入0.8%-1%左右的琼脂,经融化冷凝而成。液体培养基是指培养基中不加凝固剂琼脂,培养基呈液体状态。 正确掌握培养基的配制方法是从事微生物学实验工作的重要基础。由于微生物种类及代谢类型的多样性,因而用于培养微生物培养基的种类也很多,它们的配方及配制方法虽各有差异。但一般培养基的配制程序却大致相同,例如器皿的准备,培养基的配制与分装,棉塞的制作,培养基的灭菌,斜面与平板的制作以及接菌等基本环节大致相同。 微量稀释法常用于测定细菌对药物敏感性或新药对细菌的抗菌活性试验。一般应用96孔微量稀释板,孔底呈U型,每孔容量为0.20-0.30ml。本法操作较便,用培养基量少,可作大批量药敏试验。 二、材料与方法 1,药品 牛肉膏、蛋白胨、NaCl、胰蛋白胨、琼脂等。1mol/L NaOH、1mol/L HCl溶液。 2,材料与仪器 天平、高压蒸汽灭菌锅、生化培养箱、超净工作台、酒精灯、移液器、试管、烧杯、量筒、锥形瓶、培养皿、玻璃漏斗、药匙、称量纸、pH试纸、记号笔、棉花、纱布、线绳、塑料试管、报纸、96孔板等。 3,实验方法
药物筛选
药物筛选 药物筛选是现代药物开发流程中检验和获取具有特定生理活性化合物的一个步骤,系指通过规范化的实验手段从大量化合物或者新化合物中选择对某一特定作用靶点具有较高活性的化合物的过程。药物筛选的过程从本质上讲就是对化合物进行药理活性实验的过程,随着药物开发技术的发展,对新化合物的生理活性实验从早期的验证性实验,逐渐转变为筛选性实验,即所谓的药物筛选。作为筛选,需要对不同化合物的生理活性做横向比较,因此药物筛选的实验方案需具有标准化和定量化的特点。随着组合化学和计算化学的发展,人们开始有能力在短时间内大规模合成和分离多种化合物,因而在现代新药开发流程中药物筛选逐渐成为发现先导化合物的主要途径之一。 筛选模型: 筛选模型就是在药物筛选实验中所应用的药理实验模型,由于药物筛选要求实验方案有标准化和定量化的特征,因而在传统药理实验中常见的动物实验在药物筛选中较少应用,根据实验模型的不同,药物筛选可以分为生化水平的筛选和细胞水平的筛选。 生化水平的药物筛选用拟开发药物作用的靶点设计实验,一般而言这种作用靶点是具有特定生理功能的蛋白质,如酶和受体等,此外一些编码功能明确的DNA也越来越多地成为药物作用的靶点。候选化合物与靶点混合后,可以通过酶连免疫、荧光显色、核磁共振等方法定量测定化合物与靶点的相互作用,从而成为筛选化合物的依据。 细胞水平的药物筛选是更接近生理条件的一种药物筛选模型,其模型是拟设计药物作用的靶细胞,应用细胞培养技术获取所需细胞,将这些细胞与候选化合物相互作用,通过与生化水平筛选类似的检测技术测定化合物的作用能力,从而对化合物进行筛选。 生化水平的药物筛选操作相对简单,成本较低,但是由于药物在体内的作用并不仅仅取决于其与靶酶的作用程度,吸收、分布、代谢、排泄均会对药物的作用产生极大的影响,仅仅一道薄薄的细胞膜就能够阻挡住许多候选化合物成为药物的道路,因而生化水平的药物筛选不确定因素更多,误筛率更高。细胞水平的药物筛选模型更接近生理条件,筛选的准确率更高,但是需要建立细胞模型,操作更复杂,成本更高,数据之间的平行形较差,另外由于技术的限制,有些靶标还不能进行细胞水平的药物筛选。 高通量筛选 高通量筛选最初是伴随组合化学而产生的一种药物筛选方式。1990年代末,组合化学的出现改变了人类获取新化合物的方式,人们可以通过较少的步骤在短时间内同时合成大量化合物,在这样的背景下高通量筛选的技术应运而生。高通量筛选技术可以在短时间内对大量候选化合物完成筛选,经过近十年的发展,已经成为比较成熟的技术,不仅仅应用于对组合化学库的化合物筛选,还更多地应用于对现有化合物库的筛选。目前世界各大药物生产商都建立有自己的化合物库和高通量筛选机构,对有潜力形成药物的化合物进行篦梳式的筛选。 一个高通量药物筛选体系包括微量和半微量的药理实验模型、样品库管理系统、自动化的实验操作系统、高灵敏度检测系统以及数据采集和处理系统,这些系统的运行保证了筛选体系能够并行操作搜索大量候选化合物。高通量筛选技术结合了分子生物学、医学、药学、计算科学以及自动化技术等学科的知识和先进技术,成为当今药物开发的主要方式。完整的高通量筛选体系由于高度的整合和自动化,因而又被称作“药物筛选机器人系统”
