【信号通路解析】Hippo信号通路
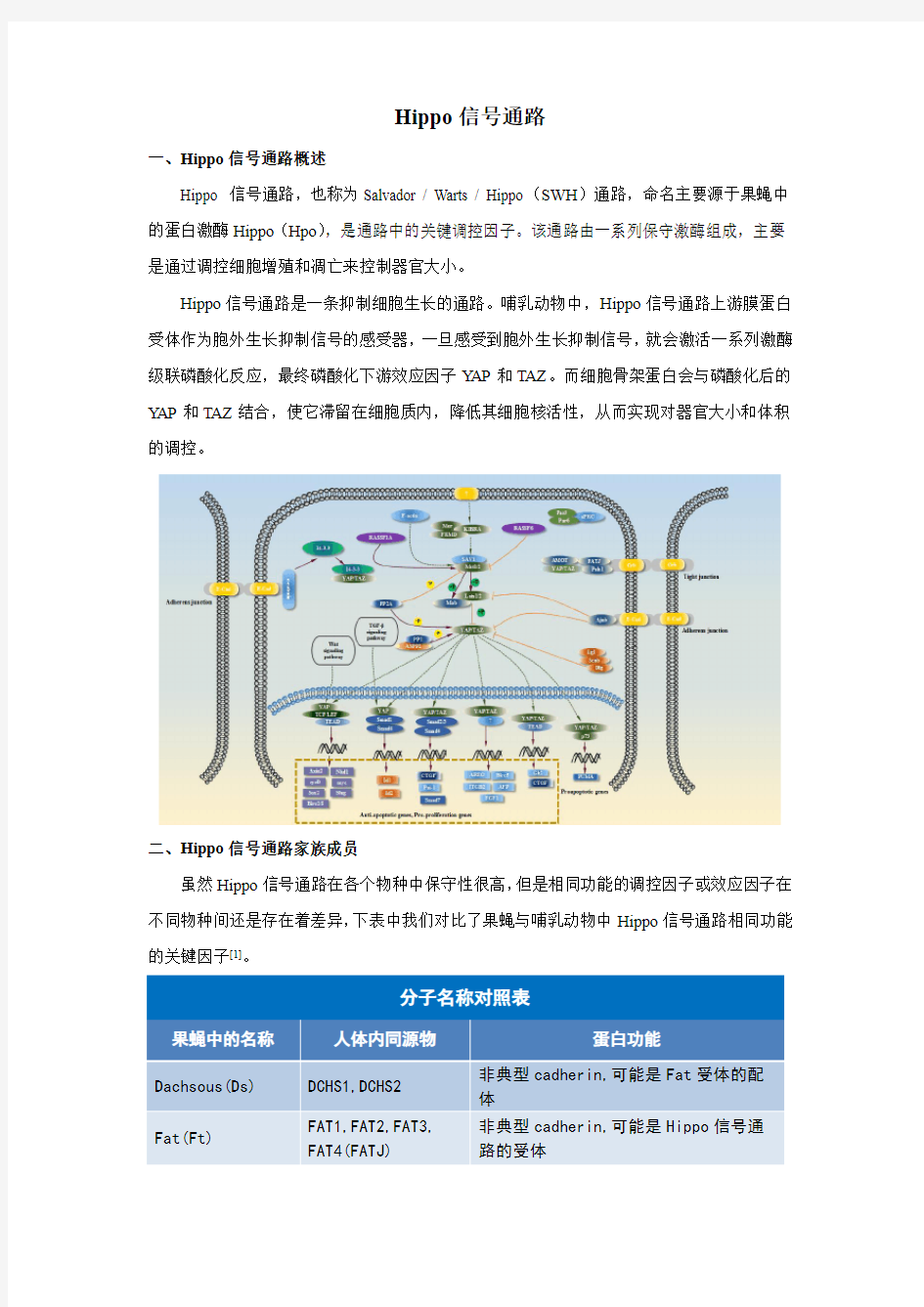

Hippo信号通路
一、Hippo信号通路概述
Hippo 信号通路,也称为Salvador / Warts / Hippo(SWH)通路,命名主要源于果蝇中的蛋白激酶Hippo(Hpo),是通路中的关键调控因子。该通路由一系列保守激酶组成,主要是通过调控细胞增殖和凋亡来控制器官大小。
Hippo信号通路是一条抑制细胞生长的通路。哺乳动物中,Hippo信号通路上游膜蛋白受体作为胞外生长抑制信号的感受器,一旦感受到胞外生长抑制信号,就会激活一系列激酶级联磷酸化反应,最终磷酸化下游效应因子YAP和TAZ。而细胞骨架蛋白会与磷酸化后的YAP和TAZ结合,使它滞留在细胞质内,降低其细胞核活性,从而实现对器官大小和体积的调控。
二、Hippo信号通路家族成员
虽然Hippo信号通路在各个物种中保守性很高,但是相同功能的调控因子或效应因子在不同物种间还是存在着差异,下表中我们对比了果蝇与哺乳动物中Hippo信号通路相同功能的关键因子[1]。
Expanded(Ex) FRMD6/Willin 含有FERM结构域的蛋白,能与Kibra及Mer结合,调控Hippo信号通路的上游信号
Dachs(Dachs) 肌浆球蛋白myosin的一种,能结合Wts 并促进其降解
Kibra(Kibra) WWC1 含有WW结构域的蛋白,能与Ex及Mer 结合,调控Hippo信号通路的上游信号
Merlin(Mer) NF2 含有FERM结构域的蛋白,能与Kibra及Ex结合,调控Hippo信号通路的上游信号
Hippo(Hpo) MST1,MST2 Sterile-20-样激酶,磷酸化并激活Wts
Salvador(Sav) WW45(SAV1) 含有WW结构域的蛋白,能起到一个脚手架蛋白的作用,易化Hippo对Warts的磷酸化
Warts(Wts)LATS1,LATS2 核内DBF-2相关激酶,能磷酸化Yki并使之失活
Mob as tumor suppressor(Mats) MOBKL1A,MOBKL1B
能与Wts结合的激酶,与Wts结合后能
促进Wts的催化活性
Yorkie(YKi) YAP,TAZ 转录共激活因子,能在非磷酸化的激活状态下与转录因子Sd结合,并激活下游靶基因的转录。这些受调控的下游靶基因主要参与了细胞的增殖、生长并抑制凋亡的发生
Scalloped(Sd) TEAD1,TEAD2,TEAD3,
TEAD4
能与Yki结合的转录因子,与Yki共同
作用,调控靶基因的转录
三、Hippo信号通路的功能
近十年相关研究结果表明,无论是果蝇还是哺乳动物,Hippo信号通路都可以通过调节细胞增殖、凋亡和干细胞自我更新能力实现对器官大小的调控。Hippo信号通路异常会导致大量组织过度生长。此外,大量研究证实,Hippo信号通路在癌症发生、组织再生以及干细胞功能调控上发挥着重要功能[2][3][4]。
a.Hippo信号通路在器官大小控制中的作用
起初,关于Hippo信号通路的研究主要集中在器官大小的调控。大量研究表明,Hippo 途径主要通过抑制细胞增殖并促进细胞凋亡,继而实现对器官大小的调控。激酶级联反应是该信号传导的关键。Mst1/2激酶与SA V1形成复合物,然后磷酸化LATS1/2;活化后的LATS1/2激酶随即磷酸化Hippo信号通路下游关键效应分子——Y AP和TAZ,同时抑制了
YAP和TAZ的转录活性。反之,未磷酸化的YAP/TAZ会进入细胞核与TEAD1-4或其他转录因子结合,继而诱导促增值和抑凋亡的基因表达上调。Hippo通路在器官大小中的调控作用已在小鼠模型中得到证实。比如肝脏中的YAP特异性过表达会导致肝脏增大,但一旦停
止YAP过表达,肝脏大小可以恢复正常[5][6]。
b.Hippo信号通路在破骨细胞形成中的作用
成骨细胞骨形成与破骨细胞骨吸收间的平衡在保持骨稳态中起关键作用。相关研究表明,Hippo信号通路是调控该平衡的途径之一,涉及的主要调控因子包括RASSF2,NF2,MST1/2,SA V1,LATS1/2,Ajuba,MOB1,YAP和TAZ。其中,RASSF2,NF2和MST1/2主要参与破骨细胞增殖前期调控,而SA V1,LATS1/2,Y AP和TAZ参与破骨细胞分化调节[7][8][9][10]。此外,参与骨凋亡调节的基因RASSF,MST和TAZ,它们同样也是Hippo信号传导途径的下游基因[11][12][13]。
一般来说,破骨细胞的细胞过程包括破骨细胞前体增殖,破骨细胞分化及凋亡,其中凋亡又涉及了不同分子级联。大量的证据表明,Hippo通路可能通过与NF-κB,MAPK和钙信号通路相互作用在这些过程中发挥作用。在Hippo-和NF-κB信号通路中,RASSF2和MST2可以分别通过抑制IKK和I-κBα活性来阻断NF-κB信号通路。在Hippo-和MAPK信号传导途径中,Ajuba可以激活TRAF6,YAP / TAZ / TEAD可以激活ERK、JNK、p38和AP1。此外,在Hippo和钙信号传导途径中,Y AP激活CREB和TEADs依赖于降低神经钙蛋白活性,从而抑制NFATc1[7]。
四.Hippo信号通路和疾病
a. Hippo信号通路和癌症
癌症是涉及异常细胞生长,可能侵入或蔓延到其他多个身体部位的疾病。虽然第一次发现Hippo通路是因为它可以通过促进细胞凋亡及抑制细胞周期来控制成像椎间盘生长,但是目前在动物模型中的研究已经将该通路的功能扩展到了其他癌症,如乳头状肾癌,结直肠癌,卵巢癌,乳腺癌和胃癌[14][15][16][17][18]。Carole Sourbier的研究显示,用达沙替尼靶向抑制YAP激活肿瘤中的Yes可能对失去Hippo信号通路调节的NF2缺陷型PRCC肿瘤患者具有治疗潜力。另一研究表明TFAP2C通过转录激活Hippo信号传导的负调控因子ROCK1和ROCK2促进CSCs特征和化疗耐药,导致结肠直肠癌(CRC)细胞中Hippo信号的失活。YAP / TAZ-TEAD转录因子复合物代表致癌转化的普遍目标。已经证实YAP基因位点在人和小鼠
肿瘤如髓母细胞瘤,肺癌,胰腺癌,食管癌,肝癌和乳腺癌中以不同频率上调[19]。
b.心血管发展中的Hippo信号通路
无论是发达国家还是发展中国家,心脏病仍然是主要的致死因素。心脏畸形可直接导致胚胎死亡或出生后死亡,而且在强烈刺激如压力超负荷或局部缺血情况下,导致的心脏损伤是不可逆转的。相关研究显示,Hippo信号通路参与了多个生理病理过程的调控,包括心血管发育、肥大、细胞凋亡、自噬、血管生成和再生[20][21][22][23][24]。
Heallen等人研究证实,心脏特异性敲除SA V1,会阻断Hippo信号传导途径,明显降低YAP磷酸化水平,从而导致心脏扩大,但细胞大小不变。这一结果在MST1/2和LATS2基因敲除小鼠中也得到了验证[20]。而且在经腺病毒处理的RASSF1A转基因小鼠中,磷酸化MST1明显增多,加速了心肌细胞的凋亡。但若是将成纤维细胞和心脏暴露于超负荷压力下,可以减弱他们的增殖能力[21]。
Hippo信号通路相关抗体的应用:
Hippo信号通路的抗体可应用于WB、IHC、IF、IP、Chip等的检测。
参考文献:
[1]Azucena Ramos, Fernando D. Camargo. The Hippo signaling pathway and stem cell biology[J]. Trends in Cell Biology. 2012, 22(7):339-346.
[2] Zhao B, Tumaneng K, et al. The Hippo pathway in organ size control, tissue regeneration and stem cell self-renewal. Nat. Cell Biol. 2011, 13(8):877-83.
[3] Yang W, Han W, et al. The emerging role of Hippo signaling pathway in regulating osteoclast
formation[J]. J Cell Physiol. 2018, 233(6):4606-4617.
[4] Pan D. The hippo signaling pathway in development and cancer[J]. Dev Cell. 2010,19(4):491-505.
[5] Camargo FD. YAP1 increases organ size and expands undifferentiated progenitor cells. Curr. Biol. 2007, 17:2054-2060.
[6] Dong J. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell. 2007, 130:1120-1133.
[7] Wanlei Yang, Weiqi Han, et al. The emerging role of Hippo signaling pathway in regulating osteoclast formation[J]. J Cell Physiol. 2018, 233(6):4606-4617.
[8] Song, H., Kim, H.,et al. Ablation of Rassf2 induces bone defects and subsequent haematopoietic anomalies in mice[J]. EMBO J. 2012, 31:1147-1159.
[9] Larsson, J., Ohishi, M.,et al. Nf2/merlin regulates hematopoietic stem cell behavior by altering microenvironmental architecture[J]. Cell Stem Cell. 2008, 3: 221-227.
[10] Allen, N.P., Donninger, H., et al. RASSF6 is a novel member of the RASSF family of tumor suppressors[J]. Oncogene. 2007, 26: 6203-6211.
【信号通路解析】Hippo信号通路
Hippo信号通路 一、Hippo信号通路概述 Hippo 信号通路,也称为Salvador / Warts / Hippo(SWH)通路,命名主要源于果蝇中的蛋白激酶Hippo(Hpo),是通路中的关键调控因子。该通路由一系列保守激酶组成,主要是通过调控细胞增殖和凋亡来控制器官大小。 Hippo信号通路是一条抑制细胞生长的通路。哺乳动物中,Hippo信号通路上游膜蛋白受体作为胞外生长抑制信号的感受器,一旦感受到胞外生长抑制信号,就会激活一系列激酶级联磷酸化反应,最终磷酸化下游效应因子YAP和TAZ。而细胞骨架蛋白会与磷酸化后的YAP和TAZ结合,使它滞留在细胞质内,降低其细胞核活性,从而实现对器官大小和体积的调控。 二、Hippo信号通路家族成员 虽然Hippo信号通路在各个物种中保守性很高,但是相同功能的调控因子或效应因子在不同物种间还是存在着差异,下表中我们对比了果蝇与哺乳动物中Hippo信号通路相同功能的关键因子[1]。
Expanded(Ex) FRMD6/Willin 含有FERM结构域的蛋白,能与Kibra及Mer结合,调控Hippo信号通路的上游信号 Dachs(Dachs) 肌浆球蛋白myosin的一种,能结合Wts 并促进其降解 Kibra(Kibra) WWC1 含有WW结构域的蛋白,能与Ex及Mer 结合,调控Hippo信号通路的上游信号 Merlin(Mer) NF2 含有FERM结构域的蛋白,能与Kibra及Ex结合,调控Hippo信号通路的上游信号 Hippo(Hpo) MST1,MST2 Sterile-20-样激酶,磷酸化并激活Wts Salvador(Sav) WW45(SAV1) 含有WW结构域的蛋白,能起到一个脚手架蛋白的作用,易化Hippo对Warts的磷酸化 Warts(Wts)LATS1,LATS2 核内DBF-2相关激酶,能磷酸化Yki并使之失活 Mob as tumor suppressor(Mats) MOBKL1A,MOBKL1B 能与Wts结合的激酶,与Wts结合后能 促进Wts的催化活性 Yorkie(YKi) YAP,TAZ 转录共激活因子,能在非磷酸化的激活状态下与转录因子Sd结合,并激活下游靶基因的转录。这些受调控的下游靶基因主要参与了细胞的增殖、生长并抑制凋亡的发生 Scalloped(Sd) TEAD1,TEAD2,TEAD3, TEAD4 能与Yki结合的转录因子,与Yki共同 作用,调控靶基因的转录 三、Hippo信号通路的功能 近十年相关研究结果表明,无论是果蝇还是哺乳动物,Hippo信号通路都可以通过调节细胞增殖、凋亡和干细胞自我更新能力实现对器官大小的调控。Hippo信号通路异常会导致大量组织过度生长。此外,大量研究证实,Hippo信号通路在癌症发生、组织再生以及干细胞功能调控上发挥着重要功能[2][3][4]。 a.Hippo信号通路在器官大小控制中的作用 起初,关于Hippo信号通路的研究主要集中在器官大小的调控。大量研究表明,Hippo 途径主要通过抑制细胞增殖并促进细胞凋亡,继而实现对器官大小的调控。激酶级联反应是该信号传导的关键。Mst1/2激酶与SA V1形成复合物,然后磷酸化LATS1/2;活化后的LATS1/2激酶随即磷酸化Hippo信号通路下游关键效应分子——Y AP和TAZ,同时抑制了
Notch信号通路研究进展
224 中国医药生物技术 2009年6月第4卷第3期Chin Med Biotechnol, June 2009, V ol. 4, No. 3 DOI:10.3969/cmba.j.issn.1673-713X.2009.03.012 · 综述·Notch信号通路研究进展 王利祥,华子春 1917 年,Morgan 及其同事在果蝇体内发现一种基因,因其功能部分缺失可导致果蝇翅缘出现缺口,故命名该基因为 Notch。随后的研究发现,Notch 从无脊椎动物到脊椎动物的多个物种中表达,其家族成员的结构具有高度保守性,在细胞分化、发育中起着关键作用。迄今研究已阐明 Notch 信号通路的主要成员及核心转导过程,然而随着研究的深入,人们逐渐认识到该通路实际上处于十分复杂的调控网络之中,而这与其在发育过程中功能的多样性相符合。本文结合最新进展,系统阐述 Notch 信号通路的组成,功能,作用机制及调控,并揭示该通路异常与疾病的联系。 1 Notch 受体 Notch 受体是一个相对分子量约为 30 000 的 I 型膜蛋白,由胞外亚基和跨膜亚基组成,2 亚基之间通过 Ca2+ 依赖的非共价键结合形成异源二聚体。胞外亚基包含一组串联排列的 EGFR 和 3 个家族特异性的 LNR 重复序列。EGFR 在 Notch 受体与配体的结合中起关键作用,在果蝇中,Notch 受体的第 11 位和 12 位 EGFR 介导了其与配体的结合。LNR 位于 EGFR 的下游,富含半胱氨酸,介导了 2 亚基之间 Ca2+ 依赖的相互作用。跨膜亚基包括跨膜区、RAM 序列、锚蛋白重复序列、核定位序列、多聚谷氨酰胺序列以及 PEST 序列。RAM 结构域是 Notch 信号效应分子 CBF1/RBPJk 主要的结合部位。ANK 重复序列结构域是 Deltex、Mastermind 等的结合部位,这些蛋白对Notch 信号通路有修饰作用。PEST 结构域与泛素介导的Notch 胞内段降解有关[1]。 2 Notch 配体 Notch 配体与受体一样为 I 型跨膜蛋白。果蝇 Notch 配体有 2 个同源物 Delta 和 Serrate,线虫的 Notch 配体为 Lag 2,故又称 Notch 配体为 DSL 蛋白。脊椎动物体内也发现了多个 Notch 配体,与 Delta 同源性高的称为Delta 样分子,与 Serate 同源性高的被称作 Jagged。目前,发现人的 Notch 配体有 D ll l、3、4和 Jagged l、2。配体胞外 DSL 结构域在进化中高度保守,是配体与受体结合、激活 Notch 信号所必需的。Notch 配体的胞内域较短,仅70 个左右氨基酸残基,功能尚未阐明。近来研究发现,Delta 1 的胞内域能够诱导细胞的生长抑制[2]。有人推测,配体胞内段可能类似与受体胞内段,具有信号转导功能,但具体机制有待进一步研究。3 Notch 信号传递与效应因子 迄今研究发现主要有 6 种信号通路在多细胞生物的生长中发挥关键作用,分别是刺猬、骨形态发生蛋白、无翅、类固醇激素受体、Notch 和受体酪氨酸激酶。Notch 相对于其他信号通路结构较简单,没有第二信使的参与。现有研究提出了 Notch 信号活化的“三步蛋白水解模型”[3]。首先,Notch 以单链前体模式在内质网合成,经分泌运输途径,在高尔基体内被 Furin 样转化酶切割成相对分子质量为180 000 含胞外区的大片段和 120 000 含跨膜区和胞内区的小片段。两者通过 Ca2+依赖性的非共价键结合为异源二聚体,然后被转运到细胞膜。当 Notch 配体与受体结合,Notch 受体相继发生 2 次蛋白水解。第一次由 ADAM 金属蛋白酶家族的 ADAM 10/Kuz 或 ADAM 17/TACE 切割为 2 个片段。N 端裂解产物(胞外区)被配体表达细胞内吞,而 C 端裂解产物随后由早老素 1/2,Pen-2,Aph1 和Nicastrin 组成的γ-促分泌酶复合体酶切释放 Notch 受体的活化形式 NICD。 经典的 Notch 信号通路又称为 CBF-1/RBP-Jκ依赖途径。CBF-1/RBP-Jκ本身是 1 个转录抑制因子,能够特异性地与 DNA 序列“CGTGGGAA”相结合,并招募 SMRT,SKIP,I/II 型组蛋白去乙酰化酶等蛋白形成共抑制复合物,抑制下游基因的转录。当 Notch 信号激活后,NICD 通过上述酶切反应被释放进入胞核,通过 RAM 结构域及 ANK 重复序列与 CBF-1/RBP-Jκ结合使共抑制复合物解离,并募集 SKIP,MAML 1 组成共激活复合体,激活下游基因的转录。Notch 信号的靶基因多为碱性螺旋-环-螺旋转录抑制因子家族成员,如哺乳动物中的 HES、非洲爪蟾中的XHey-1,以及近来发现的 BLBP [3]。此外,存在非CBF-1/RBP-Jκ依赖的 Notch 信号转导途径。最近有研究报道,果蝇 Notch 结合蛋白 Deltex 是某些组织特异性非 Su (H)依赖性信号所必需的,同时发现 Deltex 也具有拮抗Notch 的功能 [4]。 4 Notch 信号途径功能 Notch 信号途径的功能最初是在果蝇神经系统发育的 基金项目:国家自然科学基金(30425009,30730030);江苏省自然科学基金(BK2007715) 作者单位:210093 南京大学医药生物技术国家重点实验室 通讯作者:华子春,Email:zchua@https://www.360docs.net/doc/0e17153096.html, 收稿日期:2009-02-01
ATM和ATR的信号传导通路综述
ATM Ataxia telangiectasia mutated (ATM) is a serine/threonine protein kinase that is recruited and activated by DNA double-strand breaks. It phosphorylates several key proteins that initiate activation of the DNA damage checkpoint, leading to cell cycle arrest, DNA repair or apoptosis. Several of these targets, including p53, CHK2 and H2AX are tumor suppressors. The protein is named for the disorder Ataxia telangiectasia caused by mutations of ATM.[1] Contents 1 Introduction 2 Structure 3 Function 4 Regulation 5 Role in cancer 6 Interactions 7 See also 8 References 9 Further reading 10 External links Introduction[edit] Throughout the cell cycle the DNA is monitored for damage. Damages result from errors during replication, by-products of metabolism, general toxic drugs or ionizing radiation. The cell cycle has different DNA damage checkpoints, which inhibit the next or maintain the current cell cycle step. There are two main checkpoints, the G1/S and the G2/M, during the cell cycle, which preserve correct progression. ATM plays a role in cell cycle delay after DNA damage, especially after double-strand breaks (DSBs).[2] ATM together with NBS1 act as primary DSB sensor proteins. Different mediators, such as Mre11 and MDC1, acquire post-translational modifications which are generated by the sensor proteins. These modified mediator proteins then amplify the DNA damage signal, and transduce the signals to downstream effectors such as CHK2 and p53. Structure[edit] The ATM gene codes for a 350 kDa protein consisting of 3056 amino acids.[3] ATM belongs to the superfamily of Phosphatidylinositol 3-kinase-related kinases (PIKKs). The PIKK superfamily comprises six Ser/Thr-protein kinases that show a sequence similarity to phosphatidylinositol 3-kinases (PI3Ks). This protein kinase family includes amongst others ATR (ATM- and RAD3-related), DNA-PKcs (DNA-dependent protein kinase catalytic subunit) and mTOR (mammalian target of rapamycin). Characteristic for ATM are five domains. These are from N-Terminus to C-Terminus the HEAT repeat domain, the FRAP-ATM-TRRAP (FAT) domain, the kinase domain (KD), the PIKK-regulatory domain (PRD) and the FAT-C-terminal (FATC) domain. The
ERK5信号通路研究现状
World Journal of Cancer Research 世界肿瘤研究, 2014, 4, 41-46 Published Online October 2014 in Hans. https://www.360docs.net/doc/0e17153096.html,/journal/wjcr https://www.360docs.net/doc/0e17153096.html,/10.12677/wjcr.2014.44008 Review of the ERK5 Signaling Pathway Research Song Luo*, Shengfa Su, Weiwei Ouyang#, Bing Lu# Teaching and Research Section of Oncology, Guiyang Medical University, Guiyang Email: 4567436@https://www.360docs.net/doc/0e17153096.html,, #ouyangww103173@https://www.360docs.net/doc/0e17153096.html,, #lbgymaaaa@https://www.360docs.net/doc/0e17153096.html, Received: Sep. 25th, 2014; revised: Oct. 16th, 2014; accepted: Oct. 20th, 2014 Copyright ? 2014 by authors and Hans Publishers Inc. This work is licensed under the Creative Commons Attribution International License (CC BY). https://www.360docs.net/doc/0e17153096.html,/licenses/by/4.0/ Abstract Extracellular signal regulated kinase 5 (ERK5) is an important part of mitogen activated protein kinase (MAPK) system, and also is a new signal transduction pathway of MAPK signaling system, which has attracted much attention in recent years. ERK5 can be activated by many stimulating factors and plays an important role in cell survival, proliferation and differentiation. Furthermore, ERK5 is closely related to vascular development and proliferation, and other critical functions. This paper focuses on the origin, structure, property, physiological features of ERK5, and the relation-ship between ERK5 and tumor and non-oncologic diseases, and reviews the research direction in the future. Keywords ERK5, Signaling Pathways, MAPK ERK5信号通路研究现状 罗松*,苏胜发,欧阳伟炜#,卢冰# 贵阳医学院肿瘤学教研室,贵阳 Email: 4567436@https://www.360docs.net/doc/0e17153096.html,, #ouyangww103173@https://www.360docs.net/doc/0e17153096.html,, #lbgymaaaa@https://www.360docs.net/doc/0e17153096.html, 收稿日期:2014年9月25日;修回日期:2014年10月16日;录用日期:2014年10月20日 *第一作者。 #通讯作者。
(完整版)细胞信号转导研究方法
细胞信号转导途径研究方法 一、蛋白质表达水平和细胞内定位研究 1、信号蛋白分子表达水平及分子量检测: Western blot analysis. 蛋白质印迹法是将蛋白质混合样品经SDS-PAGE后,分离为不同条带,其中含有能与特异性抗体(或McAb)相应的待检测的蛋白质(抗原蛋白),将PAGE胶上的蛋白条带转移到NC膜上此过程称为blotting,以利于随后的检测能够的进行,随后,将NC膜与抗血清一起孵育,使第一抗体与待检的抗原决定簇结合(特异大蛋白条带),再与酶标的第二抗体反应,即检测样品的待测抗原并可对其定量。 基本流程: 检测示意图:
2、免疫荧光技术 Immunofluorescence (IF) 免疫荧光技术是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光素制成荧光标记物,再用这种荧光抗体(或抗原)作为分子探针检查细胞或组织内的相应抗原(或抗体)。在细胞或组织中形成的抗原抗体复合物上含有荧光素,利用荧光显微镜观察标本,荧光素受激发光的照射而发出明亮的荧光(黄绿色或桔红色),可以看见荧光所在的细胞或组织,从而确定抗原或抗体的性质、定位,以及利用定量技术测定含量。 采用流式细胞免疫荧光技术(FCM)可从单细胞水平检测不同细胞亚群中的蛋白质分子,用两种不同的荧光素分别标记抗不同蛋白质分子的抗体,可在同一细胞内同时检测两种不同的分子(Double IF),也可用多参数流式细胞术对胞内多种分子进行检测。 二、蛋白质与蛋白质相互作用的研究技术 1、免疫共沉淀(Co- Immunoprecipitation, Co-IP)
Co-IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“protein A”能特异性地结合到免疫球蛋白的FC片段的现象而开发出来的方法。目前多用精制的protein A预先结合固化在agarose的beads 上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A就能吸附抗原抗体达到沉淀抗原的目的。 当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。如果用蛋白质X的抗体免疫沉淀X,那么与X在体内结合的蛋白质Y也能沉淀下来。进一步进行Western Blot 和质谱分析。这种方法常用于测定两种目标蛋白质是否在体内结合,也可用于确定一种特定蛋白质的新的作用搭档。缺点:可能检测不到低亲和力和瞬间的蛋白质-蛋白质相互作用。 2、GST pull-down assay GST pull-down assay是将谷胱甘肽巯基转移酶(GST)融合蛋白(标记蛋白或者饵蛋白,GST, His6, Flag, biotin …)作为探针,与溶液中的特异性搭档蛋白(test protein或者prey被扑获蛋白)结合,然后根据谷胱甘肽琼脂糖球珠能够沉淀GST融合蛋白的能力来确定相互作用的蛋白。一般在发现抗体干扰蛋白质-蛋白质之间的相互作用时,可以启用GST沉降技术。该方法只是用于确定体外的相互作用。
蛋白质组学方法在细胞内信号转导研究中的应用
生物技术通讯 LETTERSINBIOTECHNOLOGYVol.18No.2Mar.,2007 综述 文章编号:1009-0002(2007)02-0336-03 蛋白质组学方法在细胞内信号转导研究中的应用 李敏,周慧,崔银秋 吉林大学生命科学学院生物大分子实验室,吉林长春130021 [摘要]蛋白质组学的新技术为我们研究细胞内的信号转导过程提供了更广泛和崭新的思路,它克服了传统技术的局限 性,实现了对蛋白的高通量分析。简要综述了蛋白质组学技术在信号转导过程中信号分子的确定、定量,磷酸化等翻译后修 饰的识别,以及蛋白质之间相互作用研究等方面的应用。 [关键词]蛋白质组学;信号转导 [中图分类号]Q25FQ503[文献标识码]A ApplyingProteomicMethodstoCellularSignalTransductionResearch LIMin,ZHOUHui,CUIYin-qiu BiomacromoleculeLab,CollegeofLifeScience,JilinUniversity,Changchun130021,China [Abstract]Improvedtechnologiesthathaveemergedinproteomicsprovideusmuchmorecomprehensiveandnewin- sightsintocellularsignaltransductionresearch.Ithasovercomethelimitationsoftraditionalmethodsandrealizedthe high-throughputproteinanalysismode.Inthisletter,theapplyingofproteomictechnologiesindefiningandquantitating signalingmolecules,identifyingpost-translationalmodificationssuchasphosphorylation,andprotein-proteininteractionsre- searchduringcellularsignaltransductionwerereviewed. [Keywords]proteomicsFsignaltransduction 20世纪90年代以来,对细胞内信号转导途径的研究逐渐成为国内外生物学界广泛关注的热点。由于信号的传递在细胞的增殖、分化和生存等过程中都起着十分关键的作用,因而逐渐成为解决许多重要理论及实践问题的基本思路和有力武器。近年来有关细胞信号转导研究的方法层出不穷。传统地,人们主要利用RNA干扰技术、抗体免疫沉淀、32P标记结合蛋白质印迹法(Westernblotting)、SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)等方法来检测和鉴定信号传递过程中差异表达的信号分子及关键蛋白的磷酸化。这些方法和技术能够做小量的分析,但无法进行大规模的研究。随着双向电泳(twodimensionalelectrophoresis,2-DE)和质谱技术的不断完善与发展,蛋白质组学方法越来越多地被用于研究胞内信号转导过程。它弥补了传统方法的不足之处,实现了高通量大规模的研究模式。近年来,蛋白质组学方法应用于信号转导的研究,主要在对蛋白表达谱的检测和定量、翻译后修饰的识别,以及蛋白质之间相互作用图谱的绘制等方面。蛋白质组学方法为我们完整地绘制细胞内信号转导网络图提供了更为可靠的依据。以下就近年来该领域的一些新技术及应用做一简要综述。 1信号蛋白的寻找和确定 细胞受到外界的刺激后,首先吸引许多锚定蛋白、衔接蛋白的结合,引起蛋白的相互作用,并随之引发胞内的一系列信号蛋白的改变(如级联磷酸化事件的发生),最终信号传递到核基因,表达或阻抑表达一些特征蛋白,或者作用于某些特定的细胞器,引发其他生物学效应。由此可见,要了解一种信号途径的具体过程,首先要对该过程的特征信号分子及下游所表达的蛋白进行确定。目前,二维电泳结合质谱技术(MALDI-TOF-MS或ESI-MS)已经成为蛋白质组学的首选工具,来获得不同状态下的细胞全蛋白质组。许多研究通过选择性抑制或激活信号通路并筛选2-DE的效应分子成功地鉴定了信号转导过程中的靶标。本文作者所在研究室[1]利用2-DE结合MALDI-TOF-MS,对处于不同生理条件下的NIH3T3细胞的全细胞裂解液进行双向电泳分离及软件分析。在我们筛选的aFGF拮抗剂小肽存在的条件下,鉴定出3种表达量下调、1种表达量上升的蛋白,其中鸟苷酸结合蛋白α-11亚单位和1C型核因子分别参与胞内aFGF信号传导以及转录调控。近来人们又开发出许多以2-DE为基础的改进方法,包括从样本制备、分离到染色等各方面,来对蛋白进行更好的分离分析,如亚细胞分离、差异凝胶电泳(DIGE)技术等[2]。 2-DE的优势是能够更直观地提供信号蛋白的相对分子质量、等电点、相对表达丰度等信息,但它在分离一些pI过大或过小、疏水性强的低丰度蛋白时有很大的困难。最近研究较多的多维蛋白质鉴定技术(multidimensionalproteinidentificationtech-nique,MudPIT)[3]弥补了上述缺陷。MudPIT能够更有效地检测疏水蛋白,且在分析来自胞内细胞器的蛋白时具有更高的效率。最常用的是二维液相色谱(2D-LC),它首先对蛋白复合物进行酶 [收稿日期]2006-08-30 [基金项目]吉林省科技发展计划项目(20040411-3) [作者简介]李敏(1982-),女,硕士研究生 [通讯作者]崔银秋,(E-mail)cuiyq@jlu.edu.cn 336
常见的信号通路
1JAK-STAT信号通路 1)JAK与STAT蛋白 JAK-STAT信号通路是近年来发现的一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程。与其它信号通路相比,这条信号通路的传递过程相对简单,它主要由三个成分组成,即酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT。(1)酪氨酸激酶相关受体(tyrosinekinaseassociatedreceptor) 许多细胞因子和生长因子通过JAK-STAT信号通路来传导信号,这包括白介素2?7(IL-2?7)、GM-CSF(粒细胞/巨噬细胞集落刺激因子)、GH(生 长激素)、EGF(表皮生长因子)、PDGF(血小板衍生因子)以及IFN(干扰素)等等。这些细胞因子和生长因子在细胞膜上有相应的受体。这些受体的共同特点是受体本身不具有激酶活性,但胞内段具有酪氨酸激酶JAK 的结合位点。受体与配体结合后,通过与之相结合的JAK的活化,来磷酸化各种靶蛋白的酪氨酸残基以实现信号从胞外到胞内的转递。 (2)酪氨酸激酶JAK(Januskinase) 很多酪氨酸激酶都是细胞膜受体,它们统称为酪氨酸激酶受体(receptor tyrosinekinase,RTK),而JAK却是一类非跨膜型的酪氨酸激酶。JAK是英文Januskinase的缩写,Janus在罗马神话中是掌管开始和终结的两面神。之所以称为两面神激酶,是因为JAK既能磷酸化与其相结合的细胞因子受体,又能磷酸、JAK1个成员:4蛋白家族共包括JAK结构域的信号分子。SH2化多个含特定
JAK2、JAK3以及Tyk2,它们在结构上有7个JAK同源结构域(JAKhomologydomain,JH),其中JH1结构域为激酶区、JH2结构域是“假”激酶区、JH6和JH7是受体结合区域。 (3)转录因子STAT(signaltransducerandactivatoroftranscription)STAT被称为“信号转导子和转录激活子”。顾名思义,STAT在信号转导和转录激活上发挥了关键性的作用。目前已发现STAT家族的六个成员,即STAT1-STAT6。STAT蛋白在结构上可分为以下几个功能区段:N-端保守序列、DNA结合区、SH3结构域、SH2结构域及C-端的转录激活区。其中,序列上最保守和功能上最重要的区段是SH2结构域,它具有与酪氨酸激酶Src的SH2结构域完全相同的核心序列“GTFLLRFSS”。 2)JAK-STAT信号通路 与其它信号通路相比,JAK-STAT信号通路的传递过程相对简单。信号传 递过程如下:细胞因子与相应的受体结合后引起受体分子的二聚化,这使得与受体偶联的JAK激酶相互接近并通过交互的酪氨酸磷酸化作用而活化。JAK激活后催化受体上的酪氨酸残基发生磷酸化修饰,继而这些磷酸化的酪氨酸位点与周围的氨基酸序列形成“停泊位点”(dockingsite),同时含有SH2结构域的STAT蛋白被招募到这个“停泊位点”。最后,激酶JAK 催化结合在受体上的STAT蛋白发生磷酸化修饰,活化的STAT蛋白以二 聚体的形式进入细胞核内与靶基因结合,调控基因的转录。值得一提的是,一种JAK激酶可以参与多种细胞因子的信号转导过程,一种细胞因子的信号通路也可以激活多个JAK激酶,但细胞因子对激活的STAT分子却具有一定的选择性。例如IL-4激活STAT6,而IL-12 。STAT4却特异性激活
资深PI最新文章解析信号通路
资深PI最新文章解析信号通路 ------------------------------------------------------------------------------------------------------------------------------------ 摘要:来自新加坡分子与细胞生物学研究院,癌症与发育细胞生物学部的研究人员获得了YAP-TEAD4复合物在YAP因子N端结构域相互作用,以及在TEAD4 C端结构域与YAP相互作用的晶体结构,从中研究人员认为YAP中的PXXΦP片段是与TEAD4相互作用的关键结构,这为研究Hippo信号通路提供了重要的分子机理线索。这一研究成果公布在《Genes Development》杂志上。 生物通报道:来自新加坡分子与细胞生物学研究院,癌症与发育细胞生物学部的研究人员获得了YAP-TEAD4复合物在YAP因子N端结构域相互作用,以及在TEAD4 C端结构域与YAP相互作用的晶体结构,从中研究人员认为YAP中的PXXΦP片段是与TEAD4相互作用的关键结构,这为研究Hippo信号通路提供了重要的分子机理线索。这一研究成果公布在《Genes Development》杂志上。 领导这一研究的是新加坡分子与细胞生物学研究院宋海卫博士,其早年毕业于河南大学化学系,之后进入中科院生物物理研究院进行分子生物学方面的学习,1998年获得利兹大学(The University of Leeds)分子生物学专业博士学位。目前任新加坡分子与细胞生物学研究所资深研究员。 Hippo信号转导通路是几年前发现的一个信号转导通路。研究发现Hippo信号通路是参与调控器官大小发育的关键信号通路,这一观点首先在果蝇中被发现,后来的研究发现在哺乳动物的发育过程中Hippo有相同的功能。06年Cell发表的一篇文章证实Hippo 是一种细胞分裂和死亡的控制开关。Hippo信号转导通路通过促进细胞调亡和限制细胞
信号通路研究思路
信号通路研究思路
证明一个药物能通过抑制P38表达而发挥保护细胞的作用,需要做的是: 要证明你的药物是通过抑制P38表达而发挥保护作用,首先要证明P38表达增加会导致损伤。 其次,要证明你的药物存在保护作用。 再次,证明你的药物可以抑制P38表达。 最后,证明你的药物是由于抑制了P38表达而发挥保护作用。 首先证明P38表达增加会导致损伤。 这里需要建立一个损伤模型。正如你提到的,钙离子导致P38mapk的增高,如果某种损伤可以通过钙离子导致P38mapk的增高,那么你就建立起了一个损伤模型。这时,对P38做个RNA干扰,使其表达下降,再来损伤刺激,如果这时损伤刺激不会导致损伤,那么可以说P38mapk的增高会导致损伤。 这里最好不要用P38的抑制剂SB来处理,因为这个抑制剂是针对P38活性的抑制剂,抑制的是P38的磷酸化,而不是表达量。 如果说明的问题是p38磷酸化水平增加而导致损伤,那么我建议用抑制剂。这时还可以用Dominant-negative。抑制剂的实验证实该药物不影响P38表达,而影响其活化。(应该首先考虑选用抑制剂,因为目前一些药物的作用机制不是抑制靶点的表达,而是抑制靶点的激活。如果在此应用RNAi的话,很可能会漏掉这个机制或增加实验步骤。) 其次,要证明你的药物存在保护作用。
当然就是用你的药物先处理一下,再来损伤刺激,如果这时损伤刺激不会导致损伤,那么可以说你的药物存在保护作用。 再次,证明你的药物可以抑制P38表达。 用你的药物先处理一下,再来损伤刺激,再检测P38表达,如果用药组相对于没有用药组P38表达下降,那么可以说你的药物可以抑制P38表达。 最后,证明你的药物是由于抑制了P38表达而发挥保护作用。 这一步看似不必要,其实是最重要的步骤,而国内的文章往往忽略了这一关键环节。 这里建议还是用RNA干扰P38表达,再用你的药物处理,再进行损伤刺激,如果用药组与没有用药组的损伤程度一致,那么才可以说你的药物是由于抑制了P38表达而发挥保护作用。 抑制剂也有其局限性,有时是“致命”的,主要原因是抑制剂缺乏特异性。虽然我们在文章里看到用抑制剂的时候都说是什么什么的特异性抑制剂,但真的那么特异吗?其实往往是作者为了写文章发文章的需要而夸大了抑制剂的特异性。细胞里无数的信号通路,谁也不能保证抑制剂在作用于靶分子时不会影响其他信号通路。其实无论什么抑制剂,对剂量的要求都相对比较苛刻,为什么?就是因为一旦浓度高了,就不知道会干扰到其他哪些信号通路,从而产生很多说不清道不明的现象。 PI3K的抑制剂---LY294002和wortmannin,它们都能抑制PI3K和相关的激酶,但LY294002的浓度达到200μM常用来抑制DNA依赖的蛋白激酶(DNA-PK);wortmannin在浓度超过3μM常用来抑制运动失调性毛细血管扩张基因
常见的信号通路
1 JAK-STAT信号通路 1) JAK与STAT蛋白 JAK-STAT信号通路是近年来发现的一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程。与其它信号通路相比,这条信号通路的传递过程相对简单,它主要由三个成分组成,即酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT。 (1) 酪氨酸激酶相关受体(tyrosine kinase associated receptor) 许多细胞因子和生长因子通过JAK-STAT信号通路来传导信号,这包括白介素2?7(IL-2?7)、GM-CSF(粒细胞/巨噬细胞集落刺激因子)、GH(生长激素)、EGF(表皮生长因子)、PDGF (血小板衍生因子)以及IFN(干扰素)等等。这些细胞因子和生长因子在细胞膜上有相应的受体。这些受体的共同特点是受体本身不具有激酶活性,但胞内段具有酪氨酸激酶JAK的结合位点。受体与配体结合后,通过与之相结合的JAK的活化,来磷酸化各种靶蛋白的酪氨酸残基以实现信号从胞外到胞内的转递。 (2) 酪氨酸激酶JAK(Janus kinase) 很多酪氨酸激酶都是细胞膜受体,它们统称为酪氨酸激酶受体(receptor tyrosine kinase, RTK),而JAK却是一类非跨膜型的酪氨酸激酶。JAK是英文Janus kinase的缩写,Janus在罗马神话中是掌管开始和终结的两面神。之所以称为两面神激酶,是因为JAK既能磷酸化与其相结合的细胞因子受体,又能磷酸化多个含特定SH2结构域的信号分子。JAK蛋白家族共包括4个成员:JAK1、JAK2、JAK3以及Tyk2,它们在结构上有7个JAK同源结构域(JAK homology domain, JH),其中JH1结构域为激酶区、JH2结构域是“假”激酶区、JH6和JH7是受体结合区域。 (3) 转录因子STAT(signal transducer and activator of transcription)STAT被称为“信号转导子和转录激活子”。顾名思义,STAT在信号转导和转录激活上发挥了关键性的作用。目前已发现STAT家族的六个成员,即STAT1-STAT6。STAT蛋白在结构上可分为以下几个功能区段:N-端保守序列、DNA结合区、SH3
细胞常见信号通路图片合集
目录 actin肌丝 (5) Wnt/LRP6 信号 (7) WNT信号转导 (7) West Nile 西尼罗河病毒 (8) Vitamin C 维生素C在大脑中的作用 (10) 视觉信号转导 (11) VEGF,低氧 (13) TSP-1诱导细胞凋亡 (15) Trka信号转导 (16) dbpb调节mRNA (17) CARM1甲基化 (19) CREB转录因子 (20) TPO信号通路 (21) Toll-Like 受体 (22) TNFR2 信号通路 (24) TNFR1信号通路 (25) IGF-1受体 (26) TNF/Stress相关信号 (27) 共刺激信号 (29) Th1/Th2 细胞分化 (30) TGF beta 信号转导 (32) 端粒、端粒酶与衰老 (33) TACI和BCMA调节B细胞免疫 (35) T辅助细胞的表面受体 (36) T细胞受体信号通路 (37) T细胞受体和CD3复合物 (38) Cardiolipin的合成 (40) Synaptic突触连接中的蛋白 (42) HSP在应激中的调节的作用 (43) Stat3 信号通路 (45) SREBP控制脂质合成 (46) 酪氨酸激酶的调节 (48) Sonic Hedgehog (SHH)受体ptc1调节细胞周期 (51) Sonic Hedgehog (Shh) 信号 (53) SODD/TNFR1信号 (56) AKT/mTOR在骨骼肌肥大中的作用 (58) G蛋白信号转导 (59) IL1受体信号转导 (60) acetyl从线粒体到胞浆过程 (62) 趋化因子chemokine在T细胞极化中的选择性表达 (63) SARS冠状病毒蛋白酶 (65) SARS冠状病毒蛋白酶 (67) Parkin在泛素-蛋白酶体中的作用 (69)
integrin review 整合素受体信号通路综述
Rheumatol Int DOI 10.1007/s00296-014-3137-5 Role of integrins and their ligands in osteoarthritic cartilage Jian Tian · Fang?Jie Zhang · Guang?Hua Lei Received: 25 May 2014 / Accepted: 17 September 2014 ? Springer-Verlag Berlin Heidelberg 2014 [1]. Radiographic evidence of OA occurs in the majority of people by 65 years of age, and among them about 80 % in people who aged over 75 years [2]. However, the pathogen-esis of this disease is not fully elucidated. Cartilage damage is one of the major pathological changes in OA. Articular cartilage is an avascular, a neu-ral, alymphatic, and viscoelastic connective tissue that functions autonomously to bear loads and provide almost friction-free movement of diarthrodial joints [3]. Chondro-cytes, the only cell population of adult articular cartilage, are strongly involved in maintaining the dynamic equi-librium between synthesis and degradation of the extra-cellular matrix (ECM) [4]. Collagens represent the major structural components of the articular cartilage. Cartilage is made up of two main ECM macromolecules: type II collagen and aggrecan, a large aggregating proteoglycan [5, 6]. Cartilage destruction is thought to be mediated by two main enzyme families: the matrix metalloproteinases (MMPs) are responsible for the cartilage collagen break-down, whereas enzymes from disintegrin and metallopro-teinase domain with thrombospondin motifs (ADAMTS) family mediate cartilage aggrecan loss [7]. Activation of biochemical pathways involves the production of proin-flammatory cytokines, inflammation, degradation of the ECM by MMPs and ADAMTS, and cessation of ECM syn-thesis via dedifferentiation and apoptosis of chondrocytes [8, 9]. Therefore, the ECM is a vital cellular environment, and interactions between the cell and ECM are important in regulating many biological processes, which include cell growth, differentiation, and survival [10, 11]. Cell–matrix interactions control cell function and behav-ior by signal transduction through a variety of cell sur-face receptors. The integrins are the major family of ECM receptors, which can transmit information from the matrix to the cell. Integrin binding of ECM ligands results in the Abstract Osteoarthritis (OA) is a degenerative disease, which is characterized by articular cartilage destruction, and mainly affects the older people. The extracellular matrix (ECM) provides a vital cellular environment, and interactions between the cell and ECM are important in reg-ulating many biological processes, including cell growth, differentiation, and survival. However, the pathogenesis of this disease is not fully elucidated, and it cannot be cured totally. Integrins are one of the major receptors in chondro-cytes. A number of studies confirmed that the chondrocytes express several integrins including α5β1, αV β3, αV β5, α6β1, α1β1, α2β1, α10β1, and α3β1, and some integrins ligands might act as the OA progression biomarkers. This review focuses on the functional role of integrins and their extracellular ligands in OA progression, especially OA car-tilage. Clear understanding of the role of integrins and their ligands in OA cartilage may have impact on future develop-ment of successful therapeutic approaches to OA.Keywords Chondrocyte · Integrin · Fibronectin · Tenascin C · Osteopontin · Osteoarthritis · Cartilage Introduction Osteoarthritis (OA) is a degenerative disease and is char-acterized by articular cartilage destruction along with changes occurring in other joint components including bone, menisci, synovium, ligaments, capsule, and muscles Rheumatology INTERNATIONAL J. Tian · F.-J. Zhang · G.-H. Lei (*) Department of Orthopaedics, Xiangya Hospital, Central South University, No. 87 Xiangya Road, Changsha 410008, Hunan, China e-mail: gh.lei9640@https://www.360docs.net/doc/0e17153096.html,; lgh9640@https://www.360docs.net/doc/0e17153096.html,
