eTMF鏂囨。鐩綍缁撴瀯-(IVD鐗
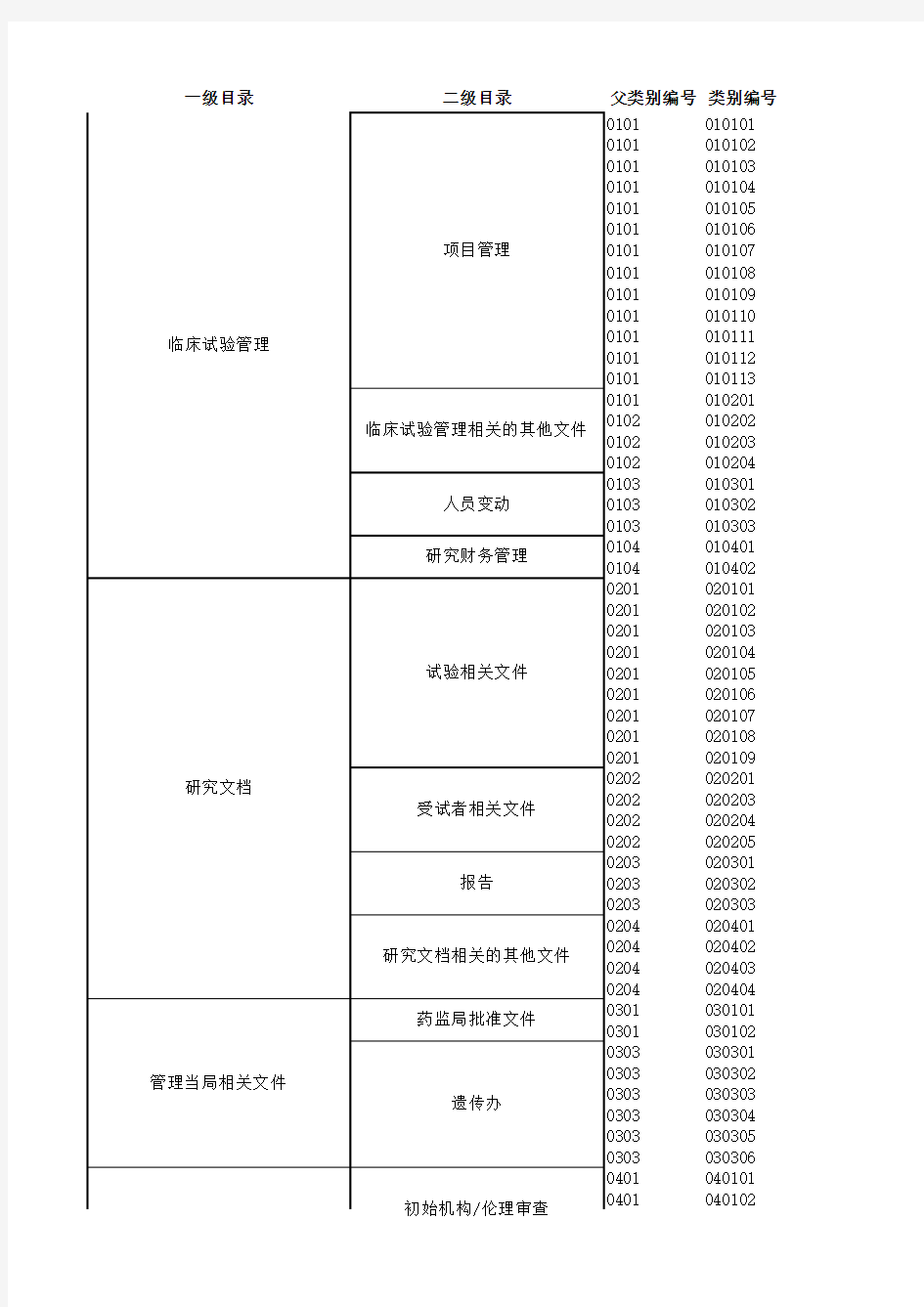

一级目录二级目录父类别编号类别编号
010101
010102
010103
010104
010105
010106
010107
010108
010109
010110
010111
010112
010113
010201
010202
010203
010204
010301
010302
010303
010401
010402
020101
020102
020103
020104
020105
020106
020107
020108
020109
020201
020203
020204
020205
020301
020302
020303
020401
020402
020403
020404
030101
030102
030301
030302
030303
030304
030305
030306
040101
040102
060103
100202
节点名称上传授权角色下载授权角色项目管理计划CRA CTA/CRA/PM
已批准的项目费用预算CRA PM
研究者通讯录CRA CTA/CRA/PM
申办者委托书 委托CRO CRA CTA/CRA/PM
申办者名称确认函CRA CTA/CRA/PM
申办方资质证明文件CRA CTA/CRA/PM CRO资质证明文件CRA CTA/CRA/PM
与申办方的沟通记录/会议纪要CRA CTA/CRA/PM
稽查报告及CAPA CRA CTA/CRA/PM
临床试验文档核查记录CRA CTA/CRA/PM
项目执行团队培训资料CRA CTA/CRA/PM
项目组人员培训记录CRA CTA/CRA/PM
项目管理的其他文档CRA CTA/CRA/PM
项目启动通知书CRA CTA/CRA/PM
项目启动会会议纪要CRA CTA/CRA/PM
项目相关沟通记录CRA CTA/CRA/PM
重要的邮件记录CRA CTA/CRA/PM
项目经理交接报告CRA CTA/CRA/PM
非项目经理交接报告CRA CTA/CRA/PM
人员变动的其他文档CRA CTA/CRA/PM
临床研究合同(申办者&研究机构)CRA CTA/CRA/PM
研究财务管理的其他文档CRA CTA/CRA/PM
保密协议CRA CTA/CRA/PM
试验方案CRA CTA/CRA/PM
试验方案最终版样稿CRA CTA/CRA/PM
病例报告表最终版样稿CRA CTA/CRA/PM
研究病历书写指南 CRA CTA/CRA/PM
研究产品说明书CRA CTA/CRA/PM
对CRA CTA/CRA/PM
研究者手册CRA CTA/CRA/PM
试验相关文件的其他文档CRA CTA/CRA/PM
知情同意书模板CRA CTA/CRA/PM
受试者招募广告CRA CTA/CRA/PM
提供给受试者的其他资料CRA CTA/CRA/PM
受试者相关文件的其他文档CRA CTA/CRA/PM
临床试验总报告CRA CTA/CRA/PM
分中心小结报告CRA CTA/CRA/PM
报告的其他文档CRA CTA/CRA/PM
相关沟通记录CRA CTA/CRA/PM
其他会议材料文档CRA CTA/CRA/PM
备注文档CRA CTA/CRA/PM
文件夹标签CRA CTA/CRA/PM 《医疗器械临床试验备案表》及变更资料CRA CTA/CRA/PM
药监局批准文件的其他文档CRA CTA/CRA/PM
遗传办审查申请书CRA CTA/CRA/PM
合作单位意见书CRA CTA/CRA/PM
承诺书CRA CTA/CRA/PM
受理通知单CRA CTA/CRA/PM
遗传办批件及更新件 CRA CTA/CRA/PM
遗传办的其他文档CRA CTA/CRA/PM
初始机构/伦理递交函及递交资料CRA CTA/CRA/PM
初始伦理委员会审核意见和/或批件CRA CTA/CRA/PM
伦理委员会成员名单CRA CTA/CRA/PM 初始机构/伦理审查的其他文档CRA CTA/CRA/PM 资料变更递交函CRA CTA/CRA/PM 资料变更的伦理审查申请CRA CTA/CRA/PM 资料变更的伦理审查意见和/或批件CRA CTA/CRA/PM 资料变更伦理审查的其他文档CRA CTA/CRA/PM 向IRB或IEC通报安全性信息CRA CTA/CRA/PM 伦理委员会跟踪审查报告CRA CTA/CRA/PM 致机构/伦理的试验终止/中止的通知CRA CTA/CRA/PM 试验进展报告的其他文档CRA CTA/CRA/PM 伦理费用发票CRA CTA/CRA/PM 相关沟通记录CRA CTA/CRA/PM 研究机构筛选报告原件CRA CTA/CRA/PM 中心筛选的其他文档CRA CTA/CRA/PM 研究者费用发票CRA CTA/CRA/PM PI简历CRA CTA/CRA/PM 其他研究者简历CRA CTA/CRA/PM 所有研究者的资质证明文件CRA CTA/CRA/PM 受试者补偿规定CRA CTA/CRA/PM 其他财务协议CRA CTA/CRA/PM 研究者签字样张CRA CTA/CRA/PM 研究者授权分工表CRA CTA/CRA/PM 申办者委托书:委托研究机构&PI CRA CTA/CRA/PM CRO委托书:委托项目经理CRA CTA/CRA/PM CRO委托书:委托监查员(附监查员GCP证书)CRA CTA/CRA/PM 中心启动前准备的其他文档CRA CTA/CRA/PM 启动会申请表CRA CTA/CRA/PM 启动会会议纪要/启动会报告CRA CTA/CRA/PM 启动会日程CRA CTA/CRA/PM 启动会签到表CRA CTA/CRA/PM 启动会照片(照到PPT)CRA CTA/CRA/PM 启动会演示文档CRA CTA/CRA/PM 临床试验标准操作规程(SOP、分中心)CRA CTA/CRA/PM 中心启动的其他文档CRA CTA/CRA/PM 监查计划CRA CTA/CRA/PM 监查报告CRA CTA/CRA/PM 协同访视CRA CTA/CRA/PM 项目进度报告CRA CTA/CRA/PM 受试者筛选入选表CRA CTA/CRA/PM 研究者的SAE报告 原件(初始、随访、结束报告)CRA CTA/CRA/PM 沟通记录CRA CTA/CRA/PM 研究者培训记录CRA CTA/CRA/PM 方案或GCP偏离记录CRA CTA/CRA/PM 研究机构拜访记录表CRA CTA/CRA/PM 中心日常管理的其他文档CRA CTA/CRA/PM 研究结束通知函CRA CTA/CRA/PM 研究机构关闭报告 原件CRA CTA/CRA/PM 至EC的研究完成报告CRA CTA/CRA/PM 完成试验受试者编码目录CRA CTA/CRA/PM 研究者致谢函CRA CTA/CRA/PM 中心关闭的其他文档CRA CTA/CRA/PM 研究专用的标签模板CRA CTA/CRA/PM 研究产品运输及交接记录CRA CTA/CRA/PM 研究产品清点记录CRA CTA/CRA/PM
研究产品发放/使用/回收记录CRA CTA/CRA/PM 研究产品销毁证明CRA CTA/CRA/PM 研究产品返还记录CRA CTA/CRA/PM 对照产品批次检验报告CRA CTA/CRA/PM 试验用医疗器械研制符合适用的医疗器械生产质量管理规范声明CRA CTA/CRA/PM 试验用医疗器械研制的质量保证和质量控制文件CRA CTA/CRA/PM 研究产品技术要求及预评价意见CRA CTA/CRA/PM 对照产品注册证CRA CTA/CRA/PM 对照产品的注册证(非属于器械管理的,提供说明)CRA CTA/CRA/PM 配套试剂、仪器的注册证(非属于器械管理的,提供说明)CRA CTA/CRA/PM 合法途径购买证明CRA CTA/CRA/PM 研究产品相关记录的其他文档CRA CTA/CRA/PM (进口注册)原产国注册准许上市证明(中英文版)CRA CTA/CRA/PM (进口注册)质量体系证书(如13485证书等)(中英文版)CRA CTA/CRA/PM (进口注册)代理人委托书(申办者委托代理人)(中英文版)CRA CTA/CRA/PM 研究产品(器械)自检报告CRA CTA/CRA/PM 研究产品注册检验报告CRA CTA/CRA/PM 研究产品发放程序的其他文档CRA CTA/CRA/PM 研究产品贮存条件记录CRA CTA/CRA/PM 试验相关设施/设备校准/维护证书/合格证明CRA CTA/CRA/PM 试验用产品的贮存的其他文档CRA CTA/CRA/PM 其他相关物品交接单CRA CTA/CRA/PM 研究物资销毁记录CRA CTA/CRA/PM 研究物资返还记录CRA CTA/CRA/PM 研究物资相关记录的其他文档CRA CTA/CRA/PM 试验仪器使用记录CRA CTA/CRA/PM 室间质评证书CRA CTA/CRA/PM 实验室正常值范围CRA CTA/CRA/PM 设施设备相关文件的其他文档CRA CTA/CRA/PM 样本运送记录CRA CTA/CRA/PM 样本储存条件记录CRA CTA/CRA/PM 样本使用记录CRA CTA/CRA/PM 样本销毁/废弃记录CRA CTA/CRA/PM 样本文件的其他文档CRA CTA/CRA/PM 供应商资质证明文件CRA CTA/CRA/PM 供应商资质文件的其他文档CRA CTA/CRA/PM 供应商服务协议CRA CTA/CRA/PM 供应商签署的保密协议CRA CTA/CRA/PM 供应商选择CRA CTA/CRA/PM 供应商财务管理CRA CTA/CRA/PM 供应商选择的其他文档CRA CTA/CRA/PM 原始数据记录CRA CTA/CRA/PM 临床数据记录表CRA CTA/CRA/PM 完成签字及签日期的CRF表CRA CTA/CRA/PM 完成的数据审核报告CRA CTA/CRA/PM 数据管理计划CRA CTA/CRA/PM 数据管理文件的其他文档CRA CTA/CRA/PM 数据库锁库与解锁申请表CRA CTA/CRA/PM 数据库的其他文档CRA CTA/CRA/PM 统计分析计划CRA CTA/CRA/PM 统计分析管理文件的其他文档CRA CTA/CRA/PM 统计分析报告CRA CTA/CRA/PM 报告的其他文档CRA CTA/CRA/PM
文档级别Site里程碑序号Site里程碑名称Country里程碑序号Study
Study
Study
Study
Study
Study
Study
Study
Study
Study
Study
Study
Study
Study
Study
Study
Study
Study
Study
Study
Site4协议签署
Site1事件
Site3伦理批件获取
Site、Country、Study2方案定稿2
Study
Study
Study
Study
Study
Study
Site、Country、Study1事件1
Study
Site5启动会召开
Site1事件
Site、Study1事件
Country、Study8
Site、Country8CSR签章8
Site、Country、Study1事件1
Site1事件
Site1事件
Site1事件
Site、Country、Study5启动会召开5 Country、Study5
Site、Country、Study1事件1
Study
Site、Country、Study4协议签署4
Site、Country、Study4协议签署4
Site、Country、Study4协议签署4
Site、Country、Study1事件1
Site、Country、Study1事件1
Site3伦理批件获取
Site3伦理批件获取
Site3伦理批件获取Site1事件
Site3伦理批件获取Site6数据库锁定Site6数据库锁定Site1事件
Site6数据库锁定Site6数据库锁定Site1事件
Site1事件
Site1事件
Site1事件
Study
Site、Study1事件
Site1事件
Site3伦理批件获取Site5启动会召开Site5启动会召开Site5启动会召开Site5启动会召开Site5启动会召开Site5启动会召开Site5启动会召开Site3伦理批件获取Site3伦理批件获取Site1事件
Site5启动会召开Site5启动会召开Site5启动会召开Site5启动会召开Site5启动会召开Site5启动会召开Site5启动会召开Site1事件
Site1事件
Site1事件
Site1事件
Study
Site1事件
Site1事件
Site1事件
Site1事件
Site1事件
Site1事件
Site、Study1事件
Site9关中心
Site10试验结束Site10试验结束Site10试验结束Site10试验结束Site1事件
Study
Site9关中心
Site9关中心
Site9关中心
Site9关中心
Site9关中心
Site9关中心
Study
Study
Study
Study
Study
Study
Study
Site、Study1事件
Study
Study
Study
Study
Study
Study
Site9关中心
Site9关中心
Site1事件
Site9关中心
Site9关中心
Site9关中心
Site1事件
Site9关中心
Site9关中心
Site9关中心
Site1事件
Site9关中心
Site9关中心
Site9关中心
Site9关中心
Site1事件
Country、Study5 Country、Study1 Country、Study1 Country、Study1 Country、Study1 Country、Study1 Country、Study1 Site6数据库锁定
Site6数据库锁定
Site6数据库锁定
Site、Study6数据库锁定
Study6数据库锁定
Site、Study1事件
Site6数据库锁定
Site1事件
Study
Study
Site、Study7SAR
Site、Study1
Country里程碑名称Study里程碑序号Study里程碑名称open close核心文档?
2方案定稿-3030必须
2方案定稿-55必须
2方案定稿-55必须
2方案定稿-55必须
2方案定稿-55必须
2方案定稿-55必须
2方案定稿-55必须
1事件00必须
10试验结束-55必须
5启动会召开-55必须
5启动会召开-55必须
5启动会召开-55必须
1事件00必须
2方案定稿-55必须
2方案定稿-55必须
1事件00必须
1事件00必须
1事件00必须
1事件00必须
1事件00必须
-55必须
00必须
-55必须
方案定稿2方案定稿-55必须
3伦理批件获取-55必须
3伦理批件获取-55必须
3伦理批件获取-55必须
2方案定稿-55必须
2方案定稿-55必须
3伦理批件获取-55必须
事件1事件00必须
3伦理批件获取-55必须
-55必须
-55必须
1事件00必须CSR签章8CSR签章-55必须CSR签章-55必须
事件1事件00必须
00必须
00必须
00必须
启动会召开5启动会召开-55必须
启动会召开5启动会召开05必须
事件1事件00必须
4协议签署-55必须
协议签署4协议签署-55必须
协议签署4协议签署-55必须
协议签署4协议签署-55必须
事件1事件00必须
事件1事件00必须
-55必须
-55必须
-55必须
-55必须
00必须
-55必须
-55必须
00必须
00必须
00必须
00必须3伦理批件获取-55必须1事件00必须
00必须
015必须
-55必须
-55必须
05必须
-55必须
-55必须
-55必须
-55必须
-55必须
-55必须
00必须
-55必须
00必须
-55必须
-55必须
-55必须
-55必须
-55必须
00必须
00必须
00必须
00必须1事件00必须
00必须
00必须
00必须
00必须
00必须
00必须1事件00必须
-305必须
-55必须
-55必须
020必须
-55必须
00必须5启动会召开-55必须
-55必须
-55必须
-55必须
5启动会召开-55必须
5启动会召开-55必须
5启动会召开-55必须
5启动会召开-55必须
5启动会召开-55必须
5启动会召开-55必须
5启动会召开-55必须
1事件00必须
5启动会召开-55必须
5启动会召开-55必须
5启动会召开-55必须
5启动会召开-55必须
5启动会召开-55必须
1事件00必须
-55必须
-1530必须
00必须
-55必须
-55必须
-55必须
00必须
-1530必须
-1530必须
-1530必须
00必须
-55必须
-55必须
-55必须
-55必须
00必须启动会召开5启动会召开-55必须事件1事件00必须事件1事件00必须事件1事件00必须事件1事件00推荐事件1事件00必须事件1事件00必须
-55必须
-55必须
6数据库锁定-55必须
6数据库锁定-55必须
6数据库锁定-3030必须
1事件00必须
-1515必须
00必须
7SAR-305必须
1事件00必须
7SAR-1515必须事件1事件00必须
需审核?Site负责部门Study负责部门Country负责部门是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部
是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部是IVD事业部IVD事业部IVD事业部
