病例报告表格模板CRF

欢迎共阅
XXXXXX临床试验
病例报告表
(CaseReportForm)
(版本号:第二版2010年8月3日)
试验组□对照组□
是否完成研究:□是□否
承担临床试验的医疗机构:1.__□
2.□
受试者拼音缩写:□□□□
试验编号:□□□
研究者姓名:
研究开始日期:______年____月____日
研究结束日期:______年____月____日
实施者:XXXXXXXXXXXXXXXX公司
填表说明
1、筛选合格者填写正式病例报告表。
2、病例填写务必准确、清晰,病历及本表作为原始记录,不得随意涂改,错误之处更正时,在错误处划一水平线居中,仍能看到其原始内容,将更正的记录写在旁边,并写上研究者的姓名和更改日期。
举例:原记录为:8.5,修改后式样为8.5
3、填写本表一律使用黑色中性笔。
4、患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字第二字母,四字姓名填写每一个字的首字母。
举例:张悦ZHYU,李新华LXHU,欧阳冰冰OYBB。
5、所有选择项目的□内用“X”标注。
6、试验期间应如实填写不良事件记录表。记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。如有严重不良事件发生,请及时报告本中心临床试验负责人、伦理委员会、实施者、药监局。
(发现严重不良反应时需在24小时以内上报有关单位)
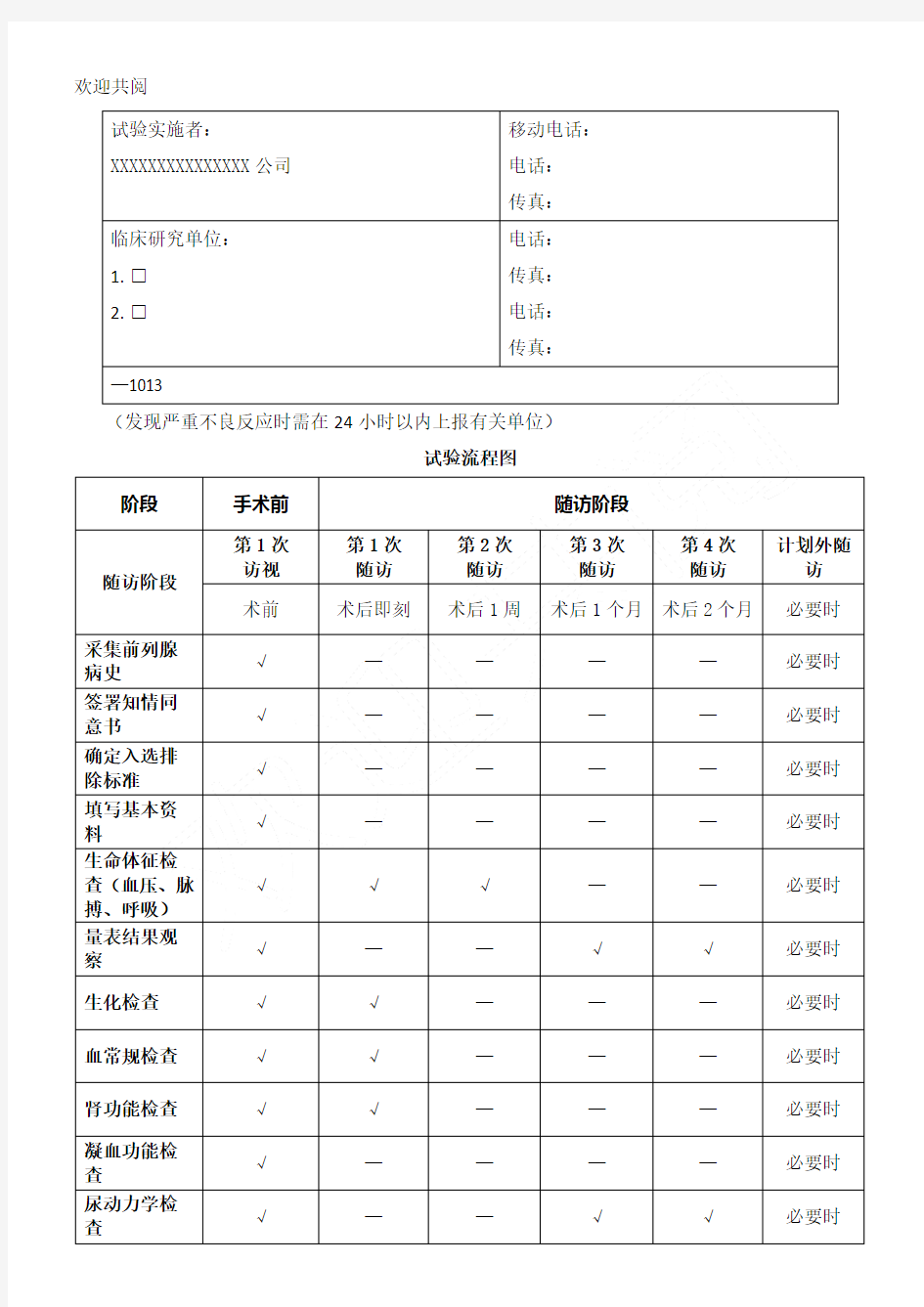
试验流程图
阶段手术前随访阶段
随访阶段第1次
访视
第1次
随访
第2次
随访
第3次
随访
第4次
随访
计划外随
访
术前术后即刻术后1周术后1个月术后2个月必要时
采集前列腺
病史
√————必要时签署知情同
意书
√————必要时确定入选排
除标准
√————必要时填写基本资
料
√————必要时生命体征检
查(血压、脉
搏、呼吸)
√√√——必要时
量表结果观
察
√——√√必要时生化检查√√———必要时血常规检查√√———必要时肾功能检查√√———必要时
凝血功能检
查
√————必要时
尿动力学检查√——√√必要时
试验实施者:XXXXXXXXXXXXXXX公司移动电话:电话:
传真:
临床研究单位:
1.□
2.□电话:传真:电话:传真:
—1013
膀胱B 超 √ — — √ √ 必要时 安全性观察 — √ √ √ √ 必要时 操作性观察 — √ — — — 必要时 记录不良事件
—
√ √
√ √ 必要时
其它工作 √
√
√
√
√
必要时 患者一般资料
出生日期:□□□□年□□月□□日 年龄:□□周岁 病史时间:□□.□年 前列腺重量:□□□g 血压:□□□/□□□mmHg 脉搏:□□□次/分钟 心率:□□□次/分钟 呼吸:□□□次/分钟 体温:□□.□℃
患者检查/诊断信息 患者主要症状描述: 检查/诊断结果:
患者既往病史及用药情况是否有既往病史:□无□有(请填写下表)
疾病名称
用药情况
起止日期 年月日
是否继续
药物名称
给药途径
剂量
年月日 □是□否
年月日
□是□否
年月日
□是□否
研究医师签名日期20___年月日
临床试验
试验编号
□□□
患者姓名缩写
□□□□
第1页 受试者筛选
欢迎共阅
一、入选
标准
根据病史和体格检查,请确认以下内容:
是 否 1 自愿受试并签署知情同意书; □ □ 2
年龄50-85岁,符合良性前列腺增生诊断标准,需要行手术干预的男性患者;
□ □ 3 能够与研究者良好交流及遵照整个试验要求。
□
□
如果以上任何一项回答“否”,则受试者不能进入该研究。
二、排除标准?
根据病史和体格检查,请确认以下内容 是 否 1 拒绝签署知情同意书参加试验的患者; □ □ 2 年龄不在50-85岁范围内的患者 □ □ 3 术前IPSS 评分<15分 □ □ 4 术前最大尿流率>15ml/min
□ □ 5 膀胱容量<200ml ,或合并有尿道狭窄者
□ □ 6 总PSA>10ng/ml 或总PSA 介于4-10ng/ml 但游离PSA/总PSA<0.16 □ □ 7 合并有未控制的泌尿系感染 □ □ 8 合并有中枢或末梢神经病变 □ □ 9 患者有进展性恶性肿瘤
□ □ 10
尿流动力学诊断膀胱颈部硬化、膀胱无力、逼尿肌/尿道括约肌协同失调、不稳定膀胱
□ □ 11 患者有手术禁忌症:如严重的心肺疾病、凝血功能障碍 □ □ 12
老年性痴呆、脑萎缩、脑血管疾病急性期或后遗症、认知能力障碍者
□
□
13 既往有良性前列腺增生外科干预史者,因良性前列腺增生行耻骨上造瘘者
□ □ 14 局部或全身细菌感染急性期未能有效控制者 □ □ 15 合并休克及危重病患,不能配合操作及评价效果者
□
□
临床试验
试验编号 □□□ 患者姓名缩写
□□□□
第2页 受试者筛选
16 精神及神经疾患不能与医生合作者 □ □ 17 研究者认为不宜参加研究的其他情况
□ □
如果以上任何一项回答“是”,则受试者不能进入该研究
研究医师签名日期20____年月日
治疗前检查
测定项目
测定值
单位
与正常值比较
临床意义判定
正常 异常 1234 血常规检查日期:20年月日
血红蛋白 g/l
□ □ □□□□
红细胞 ×1012/L
□ □ □□□□ 白细胞 ×109
/L □ □ □□□□ N (%) % □ □ □□□□ 血小板
×109/L □ □ □□□□
凝血检查检查日期:20年月日 PT S □ □ □□□□ APTT S □ □ □□□□ FIB
g/L □ □ □□□□ 尿动力学检查日期:20年月日 最大尿流率
ml/min □ □ □□□□ 膀胱超声检查日期:20年月日 残余尿量
mL □ □ □□□□ 生化指标检查日期:20年月日 血清钾 mmol/L □ □ □□□□ 血清钠 mmol/L □ □ □□□□ 血清氯 mmol/L □ □ □□□□ 血清钙
mmol/L □ □ □□□□ 肾功能检查日期:20年月日 血肌酐 umol/L □ □ □□□□ 血尿素氮
mmol/L □
□
□□□□
注:临
床意
义判
定:1=正常;2=异常但无临床意义;3=异常但有临床意义;4=未查。 研究医师签名日期20__年月日 术前评分
临床试验
试验编号 □□□
患者姓名缩写 □□□□
第3页
第一次访视(术前)
临床试验
试验编号
□□□ 患者姓名缩写
□□□□
第4页 第一次访视(术前)
国际前列腺症状评分表(IPSS )
过去1个月,您是否有以下症状 没有 5次少于一次
少于半数 大约半数 多于半数 几乎每次 1.是否经常有尿不尽感 0 1 2 3 4 5 2.两次排尿时间是否常小于两小时
0 1 2 3 4 5 3.是否经常有间断性排尿 0 1 2 3 4 5 4.是否经常有憋尿困难的现象 0 1 2 3 4 5 5.是否经常有尿线变细的现象 0 1 2 3 4 5 6.是否经常需要用力才能开始排尿 0 1 2 3 4 5
没有 1次 2次 3次 4次 5次 7.从入睡到早起需起来排尿几次
1
2
3
4
5
症状计分的总评分= 生活质量评分(QOL )
如果在您的后半生始终伴有现在的排尿症状,您认为如何?
高兴 满意 大致满意 还可以 不太满意 苦恼 很糟 0
1
2
3
4
5
6
生活质量总评分=
手术信息 手术名称:
手术起止时间:年月日小时分至年月日小时分 手术方案:
研究医师签名日期20__年月日
术中情
况
操作流畅程度
□流畅:视野清晰,便于控制仪器,对病灶进行有效的切除; □欠流畅:视野较清晰,可以控制仪器,能够对病灶进行操作; □不流畅:视野不清晰,无法顺利控制仪器,不能对病灶进行操作。 手术时间:□□□分钟 实验室检查
临床试验
试验编号
□□□ 患者姓名缩写
□□□□
第5页 第一次随访(术后即
测定项目
测定值
单位
与正常值比较 临床意义判定
正常 异常 1234 血常规检查日期:20年月日 血红蛋白 g/l
□ □ □□□□
红细胞 ×1012/L □ □ □□□□ 白细胞 ×109/L □ □ □□□□ N (%) % □ □ □□□□ 血小板
×109/L □ □ □□□□
生化指标检查日期:20年月日 血清钾 mmol/L □ □ □□□□ 血清钠 mmol/L □ □ □□□□ 血清氯 mmol/L □ □ □□□□ 血清钙
mmol/L □ □ □□□□ 肾功能检查日期:20年月日 血肌酐 umol/L □ □ □□□□ 血尿素氮 mmol/L
□
□
□□□□
注:临床意义判定:1=正常;2=异常但无临床意义;3=异常但有临床意义;4=未查。
安全性评估
患者术后情况:体温□□.□℃,血压□□□/□□□mmHg ,心率□□□次/分,呼吸□□□次/分 脉搏□□□次/分
术中及术后是否出现并发症:□否
□是,为□尿路感染、□尿路出血、□急性附睾炎、□尿道狭窄、
□尿失禁、□再次手术、□尿路损伤穿孔、□其他________________
(如发生并发症或其它伤害,须记录在不良事件中)
手术过程是否对操作者有损害:□无□有,请详细描述
研究医师签名日期20____年月日 术后情况
术后留置尿管时间:□□□小时,或□尚未拔管 术后住院时间:□□天,或□尚未出院 安全性评估
患者术后情况:体温□□.□℃,血压□□□/□□□mmHg ,心率□□□次/分,呼吸□□□次/分 脉搏□□□次/分
临床试验
试验编号 □□□
患者姓名缩写 □□□□
第6页 第二次随访(术后1
周)
目前术后是否出现并发症:□否
□是,为□尿路感染、□尿路出血、□急性附睾炎、□尿道狭窄、□
尿失禁、□再次手术、□尿路损伤穿孔、□其他
________________
(如发生并发症或其它伤害,须记录在不良事件中)
研究
医师
签名日期20____年月日
术后情况
术后留置尿管时间:□□□小时,或□尚未拔管
术后住院时间:□□天,或□尚未出院
安全性评估
目前术后是否出现并发症:□否
□是,为□尿路感染、□尿路出血、□急性附睾炎、□尿道狭窄、□
尿失禁、□再次手术、□尿路损伤穿孔、□其他
________________
(如发生并发症或其它伤害,须记录在不良事件中)
有效性评估
尿动力学膀胱超声
最大尿流率ml/min 残余尿量ml
术后评分(一)
国际前列腺症状评分表(IPSS)
过去1个月,您是否有以下症状没有5次少
于一次
少于半
数
大约半
数
多于半
数
几乎每
次
1.是否经常有尿不尽感0 1 2 3 4 5
2.两次排尿时间是否常小于两
小时
0 1 2 3 4 5
3.是否经常有间断性排尿0 1 2 3 4 5
4.是否经常有憋尿困难的现象0 1 2 3 4 5
5.是否经常有尿线变细的现象0 1 2 3 4 5
6.是否经常需要用力才能开始排尿0 1 2 3 4 5
临床试验
试验编号
□□□□
患者姓名缩写
□□□□
第7页
第三次随访(术后1个月)
没有 1次 2次 3次 4次 5次 7.从入睡到早起需起来排尿几次
1
2
3
4
5
症状计分的总评分= 生活质量评分(QOL )
如果在您的后半生始终伴有现在的排尿症状,您认为如何?
高兴 满意 大致满意 还可以 不太满意 苦恼 很糟 0
1
2
3
4
5
6
生活质量总评分= 研究医
师签名日期20____年月日 安全性评估
目前术后是否出现并发症:□否
□是,为□尿路感染、□尿路出血、□急性附睾炎、□尿道狭窄、□
尿失
禁、□再次手术、□尿路损伤穿孔、□其他________________ (如发生并发症或其它伤害,须记录在不良事件中)
有效性评估 尿动力学 膀胱超声 最大尿流率
ml/min
残余尿量
ml
术后评分(二)
国际前列腺症状评分表(IPSS )
过去1个月,您是否有以下症状 没有 5次少于一次 少于半数 大约半
数 多于半数 几乎每次 1.是否经常有尿不尽感 0 1 2 3 4 5 2.两次排尿时间是否常小于两小时
0 1 2 3 4 5 3.是否经常有间断性排尿 0 1 2 3 4 5 4.是否经常有憋尿困难的现象 0 1 2 3 4 5 5.是否经常有尿线变细的现象 0 1 2 3 4 5 6.是否经常需要用力才能开始排尿 0 1 2 3 4 5
没有
1次
2次
3次
4次
5次
临床试验
试验编号
□□□□ 患者姓名缩写
□□□□
第8页
第四次随访(术后2个月)
7.从入睡到早起需起来排尿几次
0 1 2 3 4 5
症状计分的总评分= 生活质量评分(QOL )
如果在您的后半生始终伴有现在的排尿症状,您认为如何?
高兴 满意 大致满意 还可以 不太满意 苦恼 很糟 0
1
2
3
4
5
6
生活质量总评分=
研
究
医
师
签名日期20__年月日
试验过程中患者是否有合并用药:□无□有(请填写下表) 药品名 (商品名) 剂量
每日用药次数 给药途径
开始服药日期 (年/月/日) 结束服药日期 (年/月/日) 继续
年月日 年月日 □ 年月日 年月日 □ 年月日 年月日 □ 年月日 年月日 □ 年月日 年月日 □ 年月日 年月日 □ 年月日 年月日 □ 年月日 年月日 □ 年月日 年月日 □ 年月日 年月日 □
年月日
年月日
□
研究医师签名日期20____年月日
临床试验
试验编号
□□□□ 患者姓名缩写
□□□□
第9页
合并用药用药记录
欢迎共阅 不良事
件观察表
该受试验者整个试验期间有无经历不良事件?有□无□如“有”请填下表。
不良事件名称 (填写字迹要清晰)
开始发生的日期与时间
20年月日 (24小时制) 20年月日 (24小时制) 20年月日
(24小时制) 不良事件的严重程度*
□轻度□中度□重度 □轻度□中度□重度 □轻度□中度□重度 是否采取措施
□否□是 □否□是 □否□是
是否与研究器械相关
□肯定有关□可能
无关□极可能有关 □可能有关□肯定无关
□肯定有关□可能无关□极可能有关 □可能有关□肯定
无关
□肯定有关□可能无关□极可能有关 □可能有关□肯定无
关
是否属于严重不良事件
□否□是
如是,请填下页SAE 表
□否□是
如是,请填下页SAE 表
□否□是
如是,请填下页SAE 表
在不良事件终止或研究结束填写以下部分
所发生不良事件的结局
□仍存在□不知道
□已缓解缓解日期: 20年月日 □仍存在□不知道
□已缓解缓解日期: 20年月日 □仍存在□不知道
□已缓解缓解日期: 20年月日 受试者是否因此 事件而退出试验?
□否□是 □否□是 □否□是 医师签名
日期
20年月日
20年月日
20年月日
如为严重不良事件,请填写严重不良事件表,并请在24小时内上报蓝莫德(天津)科学仪器有限公司、临床试验组长单位、伦理委员会和当地省级药品监督管理部门和国家食品药品监督管理局。并填写SAE 报告表。
*请参考临床试验方案中的不良事件严重程度及相关性判断标准进行选择
临床试验
试验编号 □□□□ 患者姓名缩写
□□□□
第10页 不良事件观察记
录
欢迎共阅
研究医师签名日期
20____年月日
严重不良事件报告表(SAE )
□首次报告□跟踪报告报告时间:□□□□年□□月□□日
医疗机构及专业名称
1.□
电话
2.□
电话
实施单位名称 电话
试验用器械名称
受试者情况
姓名
性别
出生年月
民族
疾病诊断:
SAE 名称
□致死□危及生命□功能障碍/致残□延长住院时间 □遗传疾患□肿瘤□其它
发生时间:年月日 反应严重程度:□轻度□中度□重度
与试验器械关系
□肯定有关□极可能有关□可能有关□可能无关□肯定无关
严重不良事件的详细说明:
严重不良事件处理情况:
报告单位:报告人签名:
临床试验
试验编号
□□□□ 患者姓名缩写
□□□□
第11页 严重不良事件观察
记录
欢迎共阅 试验完成情况
总结 安全性评价
术中及术后是否出现并发症:□否,□是 有效性评价
项目
术前 术后2个月 结论 1 IPSS □有效,□无效 2 QOL
□有效,□无效 3 最大尿流率(ml/min ) □有效,□无效 4
残余尿量(mL )
□有效,□无效 整体总评
□有效,□显效,□无效
如有1-2项有效则判为整体有效,如有3-4项有效则判为整体显效,无有效则判为无效。 操作性评价 操作流畅程度
□流畅:视野清晰,便于控制仪器,对病灶进行有效的切除; □欠流畅:视野较清晰,可以控制仪器,能够对病灶进行操作; □不流畅:视野不清晰,无法顺利控制仪器,不能对病灶进行操作。
手术时间:□□□分钟,术后留置尿管时间:□□□小时,术后住院时间:□□天。 研究完成:
按方案执行并完成□是□否
退出研究:退出试验的日期为:20______年月日 退出的主要原因:
受试者不配合□是
不良事件□是请在附表中详细记录 患者要求退出□是 失访□是
其它原因□是请详述:
临床试验
试验编号 □□□□ 患者姓名缩写
□□□□
第12页 试验结果总结
欢迎共阅
研
究医师
签名日期20____年月日
病例报告表(CRF )审核声明
本人作为该试验中心负责人特此声明:
经审核,此病例报告表中的所有项目的记录都是真实、完整和准确的。 我和我们委派的人员按要求完成了数据的收集和记录工作。 项目负责人签名: 日期:年月日
监査员声明
经监査,本病例报告表的各项内容均符合临床方案的要求,所有信息都是真实、准确和完整的。
临床监查员签名:
____________年月日
临床试验
试验编号
□□□□ 患者姓名缩写
□□□□
第13页 CRF 表审核声明
完整版病例报告表(CRF表)
XXXX临床研究 病例报告表 受试者姓名拼音缩写:|__|__|__|__| 受试者编号:|__|__|__|__|__|研究者签名:________________ 主要研究者:XX 教授 申办单位: XX医院
正式填表前,请认真阅读以下说明 填表说明 1.参加本研究的人员均需经过GCP培训,并充分阅读了解本试验方案及相关资料,严格按方案执行,并如实填写。 2.已入选的受试者,不论是否剔除或淘汰,都需要填写病例报告表。 3.填写务必认真.准确.清晰.如实,不能随意涂改,如填写确有错误,修改时不能涂黑或使用涂改液,应将填写错误的数据用横线居中划出,在旁边写上正确的数据,并由临床试验负责医师在修改处签名.注明日期。例如:10 20 刘明请在各选择项□内划“×”,在|_|填写相应的数字,所有栏目内应填写,在____填写文字。选用钢笔或签字笔用力填写表格,以便第三份亦能看清。为防止复写至一下页,请在填写时用垫板衬在下一页前。 5.患者姓名拼音缩写需填满四格,两字姓名分填两字前两个字母,三字姓名填前两字首字母与第三字 青山 6.所有检查项目因故未查或漏查请填写ND,具体用药剂量和时间不明请填写NK。 7.严格观察和如实填写不良事件记录表。记录不良事件的发生时间.严重程度.持续时间.采取的措施和转归。临床研究过程中发生的任何严重不良事件,必须立即报告协办单位.临床研究负责单位主要研究者和伦理委员会。 严重不良事件报告单位 报告单位联系人联系电话XX医院伦理委员会XXXX 国家食品药品监督管理局注册司-0/32/42/20
筛选期签署知情同意书 知情同意书签署日期:20|__|__|年|__|__|月|__|__|日访视日期:20|__|__|年|__|__|月|__|__|日 人口学资料 肿瘤诊断 肿瘤手术史 是否有肿瘤手术史□是□否
全英文病例报告表模板
CASE REPORT FORM TEMPLATE Version: 6.0 (8 November 2012) PROTOCOL: [INSERT PROTOCOL NUMBER] [INSERT PROTOCOL TITLE] Participant Study Number: Study group:
BASELINE DATA General Instructions for Completion of the Case Report Forms (CRF) Completion of CRFs ? A CRF must be completed for each study participant who is successfully enrolled (received at least one dose of study drug) ?For reasons of confidentiality, the name and initials of the study participant should not appear on the CRF. General ?Please print all entries in BLOCK CAPITAL LETTERS using a black ballpoint pen. ?All text and explanatory comments should be brief. ?Answer every question explicitly; do not use ditto marks. ?Do not leave any question unanswered. If the answer t o a question is unknown, write “NK” (Not Known). If a requested test has not been done, write “ND” (Not Done). If a question is not applicable, write “NA” (Not Applicable). ?Where a choice is requested, cross (X) the appropriate response. Dates and Times ?All date entries must appear in the format DD-MMM-YYYY e.g. 05-May-2009. The month abbreviations are as follows: January = Jan May = May September = Sep February = Feb June = Jun October = Oct March = Mar July = Jul November = Nov April = Apr August = Aug December = Dec In the absence of a precise date for an event or therapy that precedes the participant’s inclusion into the study, a partial date may be recorded by recording “NK” in the fields that are unknown e.g. where the day and month are not clear, the following may be entered into the CRF: N K N K 2 0 0 9 DD MMM YYYY ?All time entries must appear in 24-hour format e.g. 13:00. Entries representing midnight should be recorded as 00:00 with the date of the new day that is starting at that time. Correction of Errors ?Do not overwrite erroneous entries, or use correction fluid or erasers. ?Draw a straight line through the entire erroneous entry without obliterating it. ?Clearly enter the correct value next to the original (erroneous) entry. ?Date and initial the correction. Protocol Number: Page 1 of 15
临床试验观察表(CRF)讲解
阿美宁病例报告表(Case Report Form) 受试者姓名:________________________________ 家庭地址:__________________________________ 联系电话:__________________________________ 试验中心名称:______________________________ 申办单位:江苏豪森药业股份有限公司
在正式填表前请认真阅读下列填表说明 病例报告表填写说明: 1?筛选合格者填写病例报告表。 2?病例报告表填写务必准确、清晰,不得任意涂改,错误之处纠正时需用横线居中化出,并签署修改者姓名缩写及修改时间。 3?填写记录一律用钢笔或碳素签字笔。 4?患者姓名拼音缩写四个需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每个字的首字母。 5?表中凡有“□”的项,请在符合的条目上划“/'。表格中所有栏目均应填写相应的文字或数字,不得留空。 6?所有检验项目因故未查或漏查,请填写ND ;具体合并用药剂量和时间不明,请先写NK。 7?试验期间应如实填写合并用药记录表、不良事件记录表。记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。如有严重不良事件发生(包括临床验证过程中发生需住院治疗、延长住院时间、伤残、影响工作能力危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究单位伦理委员会及申办单位。 8 ?临床试验应严格按照临床试验方案要求进行。试验不同时期需完成的检查和需记录的 项目,请对照临床流程图执行。
受试者知情同意书 敬爱的患者: 我们现在正在进行一项临床研究,该项临床研究是经吉林省药品监督管理局备案的,研究的目的是评价物理治疗的高科技产品----温热电位治疗仪的疗效和安全性。 温热磁疗仪是XXX医疗器械有限公司根据韩国专利技术研制生产的医疗器械,本治疗仪 是通过XXXXXXXXXXXXXXXXXXXXXXXXXX机XXX 主要用于XXXXXXXXXXXX治疗。具有平衡机体阴阳,增强脏腑机能,促进新陈代谢,调节植物神经,改善心脑血管血液供应,促进血液循环,调节血管张力,降低血液粘稠度,防治动脉粥样硬化,促进组织的再生修复功能,增强机体免疫功能及消炎止痛等作用。其注册标准已经XX 省食品药品监督管理局备案,其 技术指标经XX省医疗器械检验所检测合格。现拟进行临床验证。 在临床观察过程中,请您在可能的前提下积极配合临床医生按方案要求进行临床试验观察。本仪器是安全的,无任何风险和副作用的,医生和使用单位将会尽力防止由于本试验可能带来的伤害,如果产生由于本次试验因素给您带来任何不良影响,您将会得到及时、必要的治疗,所需要的费用由生产该仪器的企业承担,并将会按有关规定得到相应的补偿。 绝大多数患者能从本研究中获益。您将有权在任何时间询问有关本研究的任何问题。您 参加本研究完全是自愿的,您将有权决定在任何时间退出本研究,将不会再任何方面影响医 生对您的治疗,您的权利将得到充分的保障。医生和研究单位将尽力防止由于本研究可能带来的伤害。 本研究的所有资料将是保密的,有关您的个人资料不会出现在总结报告或发表文献中。伦理委员会将公正此项研究是安全和合乎道德的,并在赫尔辛基宣言指导下进行。 志愿受试者声明: 作为受试者,我已了解以上情况,同意参加本研究,按照临床试验方案的要求,按时用药,按时复诊,及时报告出现的不良反应。我有权随时退出该项试验。但在无特殊情况下,尽可能完整的接受本次临床试验研究。 受试者签字:研究者签字: 期:期:
病例报告表样板
碳水化合物交换份法在糖尿病饮食干预中的应用研究 多中心随机对照临床试验 病例报告表 (Case Report Form,CRF □ 01 医院 □ 02 医院 □ 03 医院 □ 04 医院 受试者姓名(拼音缩写):□□□口 研究者签名:______________________________ 浙江医院 申办者:
注意事项 1 ?本试验主要研究者必须经过GCP培训,必须事先充分了解试验方案及有关资料,严格按 方案执行,病例筛选合格者按数字随机表分组,不得随意更改分配。 2.筛选合格者填写正式病例报告表,病例报告表填写务必准确、清晰,不得随意涂改,错误之处纠正时需用双横线居中划出,并签署修改者姓名缩写及修改时间。 3.每页页眉均应填写,其中中心代码填 1 ,2,3,4 等;入组顺序号由各医院按受试者就诊时间顺序填写(入组顺序号的次序应与就诊先后时间及住院号顺序相符合); 随机对应号请按试验设计要求填写;受试者姓名拼音缩写四格应填满,两字姓名按每个字前两个字母填写;三字姓名按每个字的首个字母和第三个字的第二个字母填写;四字姓名按每个字的首个字母填写。举例:张红ZHHO 李书名LSMI 欧阳小惠OYXH 4.血糖因故未查或漏查,应填写ND。 5?填写数字时应将□都填满,位数不够的靠右侧填写,左侧空出填“ 0”如①□。
入组选择表 请回答以下问题 纳入标准 是 否 无关 1.2014年6月-2016年6月收治内分泌科被诊断为2型 □ □ □ 糖尿病患者; 2.年龄在18?80岁之间; □ □ □ 3.确诊2型糖尿病1年以上 □ □ □ 4.受试者自愿参加研究并己签署知情同意书 □ □ □ 5.神志清,可自行进行饮食控制; □ □ □ 上述问题任一回答是“否”时,该病例不能纳入研究 排除标准 是 否 无关 1.预计住院时间不满3天 □ □ □ 2.近期接受过大手术或任何一项超过 2小时的手术 □ □ □ 3.正在接受糖皮质激素治疗者 □ □ □ 4.正在接受肠内或肠外营养 □ □ □ 5.肝、肾功能障碍及其他禁忌症 □ □ □ 6.糖尿病酮症酸中毒 □ □ □ 7.妊娠期女性 □ □ □ 8.不愿意接受饮食管理或无法签署知情同意书者 □ □ □ 上述问题任一回答是“是”时,该病例不能纳入研究 知情同意书 疾病情况及血糖记录 疾病情况 血糖记录
病例报告模板
附件4:病例报告书写格式 病例报告 你所遇到的实际病例教科书(文献)描述的典型病例 一般情况:(一般情况——家族史,占30分) 流行病学讨论:(好发性别、年龄、职业等)姓名:性别: 年龄:出生地: 职业:民族: 婚姻: 联系地址: 入院日期: 记录日期: 主诉:(患者就诊的主要症状(或体征)及持续临床表现及相关情况:(结合临床表现特征性症时间)状与体征特点及其发展变化情况、伴随症状以及 与鉴别诊断有关的阳性或阴性资料等) 现病史:(本次疾病的发生、演变、诊疗等方面 的详细情况,应按时间顺序书写) 既往史:(患者过去的健康与疾病情况,如疾病病因学及可能发病原因:(结合病因学及可能发史、传染病史、手术外伤史等)病因素,分析既往病史与该疾病有无关联) 个人史:(生活居住情况,出生地和曾居住地,流行病学特点:
文化程度,有无烟、酒等嗜好) 家族史:(父母、兄弟、姐妹及子女健康情况。病因学方面的遗传性、家族聚集性等特点: 家族成员中有无遗传病、与遗传有关的疾病及传 染病) 体格检查:(包括全身检查、腹部检查及专科检体格检查:(结合疾病发生部位、类型、大小、 查情况)(体格检查——辅助检查,占20分) 良恶性和并发症) 辅助检查:(具重要意义的阳性、阴性结果)辅助检查:(实验室检查、超声及影像学检查、 相关标志物检查等;结合文献,目前尚可采取的 检测手段及可能结果的分析)
初步诊断:(初步诊断——鉴别诊断,占30分)初步诊断和鉴别诊断:(结合临床表现、体格检 查及辅助检查,进行诊断、鉴别诊断及诊断依据)鉴别诊断: 诊疗计划:(1.常规检查评价;2.为明确诊断进 诊疗:(根据该疾病目前治疗的方法种类,结合一步需检查的项目;3.初步的治疗方案,包括拟 该患者疾病类型、分期进行个体化治疗。并对预进行的手术)(占10分) 后作出判断) 体会:(对该疾病的认识、临床思维的要点及今 后工作的启示等)(体会——思考,占10分) 社会、伦理、道德、法律、经济等相关问题思考:
病例报告表格模板CRF
欢迎共阅 XXXXXX临床试验 病例报告表 (CaseReportForm) (版本号:第二版2010年8月3日) 试验组□对照组□ 是否完成研究:□是□否 承担临床试验的医疗机构:1.__□ 2.□ 受试者拼音缩写:□□□□ 试验编号:□□□ 研究者姓名: 研究开始日期:______年____月____日 研究结束日期:______年____月____日 实施者:XXXXXXXXXXXXXXXX公司 填表说明 1、筛选合格者填写正式病例报告表。 2、病例填写务必准确、清晰,病历及本表作为原始记录,不得随意涂改,错误之处更正时,在错误处划一水平线居中,仍能看到其原始内容,将更正的记录写在旁边,并写上研究者的姓名和更改日期。 举例:原记录为:8.5,修改后式样为8.5 3、填写本表一律使用黑色中性笔。 4、患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字第二字母,四字姓名填写每一个字的首字母。 举例:张悦ZHYU,李新华LXHU,欧阳冰冰OYBB。 5、所有选择项目的□内用“X”标注。 6、试验期间应如实填写不良事件记录表。记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。如有严重不良事件发生,请及时报告本中心临床试验负责人、伦理委员会、实施者、药监局。
(发现严重不良反应时需在24小时以内上报有关单位) 试验流程图 阶段手术前随访阶段 随访阶段第1次 访视 第1次 随访 第2次 随访 第3次 随访 第4次 随访 计划外随 访 术前术后即刻术后1周术后1个月术后2个月必要时 采集前列腺 病史 √————必要时签署知情同 意书 √————必要时确定入选排 除标准 √————必要时填写基本资 料 √————必要时生命体征检 查(血压、脉 搏、呼吸) √√√——必要时 量表结果观 察 √——√√必要时生化检查√√———必要时血常规检查√√———必要时肾功能检查√√———必要时 凝血功能检 查 √————必要时 尿动力学检查√——√√必要时 试验实施者:XXXXXXXXXXXXXXX公司移动电话:电话: 传真: 临床研究单位: 1.□ 2.□电话:传真:电话:传真: —1013
病例报告表(样板)
碳水化合物交换份法在糖尿病饮食干预中的应用研究多中心随机对照临床试验 病例报告表 (Case Report Form,CRF) □ 01 医院 □ 02 医院 □ 03 医院 □04 医院 受试者姓名(拼音缩写):□□□□ 研究者签名: 申办者:浙江医院
注意事项 1.本试验主要研究者必须经过GCP培训,必须事先充分了解试验方案及有关资料,严格按方案执行,病例筛选合格者按数字随机表分组,不得随意更改分配。 2.筛选合格者填写正式病例报告表,病例报告表填写务必准确、清晰,不得随意涂改,错误之处纠正时需用双横线居中划出,并签署修改者姓名缩写及修改时间。 3.每页页眉均应填写,其中中心代码填 1,2,3,4等;入组顺序号由各医院按受试者就诊时间顺序填写(入组顺序号的次序应与就诊先后时间及住院号顺序相符合); 随机对应号请按试验设计要求填写;受试者姓名拼音缩写四格应填满,两字姓名按每个字前两个字母填写;三字姓名按每个字的首个字母和第三个字的第二个字母填写;四字姓名按每个字的首个字母填写。举例:张红 ZHHO 李书名 LSMI 欧阳小惠 OYXH 4.血糖因故未查或漏查,应填写ND。 5.填写数字时应将□都填满,位数不够的靠右侧填写,左侧空出填“0”。如□0□4。
入组选择表 请回答以下问题 纳入标准是否无关1. 2014年6月-2016年6月收治内分泌科被诊断为2型 □□□糖尿病患者; 2. 年龄在18~80岁之间;□□□ 3. 确诊2型糖尿病1年以上□□□ 4. 受试者自愿参加研究并己签署知情同意书□□□ 5. 神志清,可自行进行饮食控制;□□□ 上述问题任一回答是“否”时,该病例不能纳入研究 排除标准是否无关 1. 预计住院时间不满3天□□□ 2. 近期接受过大手术或任何一项超过2小时的手术□□□ 3. 正在接受糖皮质激素治疗者□□□ 4. 正在接受肠内或肠外营养□□□ 5. 肝、肾功能障碍及其他禁忌症□□□ 6. 糖尿病酮症酸中毒□□□ 7. 妊娠期女性□□□ 8. 不愿意接受饮食管理或无法签署知情同意书者□□□ 上述问题任一回答是“是”时,该病例不能纳入研究 研究者签名日期□□□□年□□月□□日
完整word版COPDCRF表格试验组副本.docx
COPD 稳定期中医呼吸康复治疗模式的临床研究 COPD 稳定期中医呼吸康复治疗模式的 临床研究病例报告表 ( Case Report Form) 受试者编号:□□ 受试者姓名及拼音缩写:(□□□□) 研究者姓名: 入组时间:□□□□年□□月□□日 入组组别:A□B□C□ 2010年4月1日
COPD 稳定期中医呼吸康复治疗模式的临床研究研究病例报告表填表说明 1. 2. 3.筛选合格受试者填写研究病例报告表。 请用钢笔或签字笔填写本表格,不得使用铅笔、圆珠笔等。 研究者必须在接诊受试者同时填写研究病例报告表,保证数据记录及时、准确、真实、完整。所有项目均应填写,因故未查或漏查,请写明未查或不详,不得留空。 4. 5.表中有“□”的选项,在符合的条目上打“√”;有“”或空格者,直接用文字或数据描述。填写受试者姓名拼音缩写,四格需填满。二字姓名填写二字拼音的前两个字母,三字拼音填写三 字首字母及第三字的第二个字母,四字姓名填写每一个字的首字母。 6.研究病例报告表中各项请认真、详细、如实填写,尽量不要涂改。如填写错误,修改时不得涂黑, 只得在错误之处划一横线,在其上方书写正确值,在修正处附近签署修改者姓名及修改时间。7.检查报告应粘贴在相应的研究病例报告表“检查报告粘贴页”上。
COPD 稳定期中医呼吸康复治疗模式的临床研究 知情同意书 亲爱的受试者: 您的医师现邀请您参加一项医疗临床研究! 这项研究的主要目的是通过体重指数、肺功能、6min 步行距离测试(6MWD)、 Borg 呼吸困难评分、慢 阻肺生存质量问卷。摸索出适合中国国情的稳定期COPD患者中医呼吸康复模式,形成中医综合治疗开展 慢性呼吸病康复的特色,为提供走出适合我国国情的慢性呼吸病康复的一条新路,向社区医院及国内外作 技术推广。 本项研究预计一共有60名受试者自愿参加,A对照组( 20例), B西医康复组(20例), C中医综合康复组( 20例)。A组仅用 GOLD指南推荐稳定期药物,B组在 A组基础上增加自行车锻炼,C组在 A组基础上增加穴 位敷贴及注射、松静内养功、止喘颗粒剂。疗程共12周。如果您符合入选标准并愿意参加本研究,您将要 按照课题要求,配合医生完成以下两件事情: (一)在接受治疗前、治疗后36周、 48周分别进行 3次免费评估,包括体重指数、肺功能、6min 步行距离测试、 Borg 呼吸困难评分、慢阻肺生存质量问卷。检查无痛无创,对您的身体不会产生任何损害; (二)在接受治疗前、治疗后 36周、 48周分别填写一份生存质量评分表,并确保填写和提供数据的真实性。 这对我们研究的真实性和科学性非常重要,这对COPD疾病的科学研究也非常重要。 您的加入,将为医学研究做出重要贡献!研究期间,您有权在任何时间询问有关研究的任何问题及 您的检查报告。无论您决定参加或拒绝参加本项研究都不会影响您和医师的医患关系及医疗措施。 伦理委员会已经审议、批准此项研究是安全的和符合医德的,并遵从赫尔辛基宣言的原则。您参与本 研究的相关资料都将会得到严格的保密及进行严格可信的处理,不会出现在任何研究报告和公开发表的出 版物中。 我已阅读并理解上述有关本研究的情况,我确认已有充足的时间考虑,所有疑问都已得到圆满的解答。 我自愿参加本研究,并保证尽量遵从医嘱。 受试者(或代理人)签名:日期:年月日 我确认已向受试者解释了本研究的详细情况,包括其权利以及可能的获益和风险。 研究者签名:日期:年月日 如果您有有关试验的任何问题,您可联系医生咨询。 医生姓名:联系电话:
病例报告表
*************期临床试验 病例报告表 (Case Report Form) 试验单位:中山大学肿瘤防治中心 申办单位:*************** 入组序号:□□□ 患者姓名拼音首字:□□□□ 研究开始日期: 研究结束日期: 填表医师:____________________________ 研究者:____________________________ 病例报告表填写说明 (开始研究前请仔细阅读!) 1、病例报告表第一联申办者保存,第二联工作联,第三联由研究者保存。 2、病例报告表填写应用黑色签字笔用力填写(请用垫板垫于将要填写的CRF页下,以防无碳复写印到下页),数据及用语务必准确、清晰,不得随意涂改,错误之处纠正时需用横线居中划出,并签署修改者姓名缩写及修改时间。举例:99.6 LZH00.11.10(勿用橡皮擦、修正液遮盖或划许多道线)。 3、患者姓名拼音缩写四格必须填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字第二字母,四字姓名填写每一个字的首字母。举例:张红ZHHO 张红旗ZHQI 欧阳校风OYXF 5、所有选择项目的□内用×标注。所有应填写数字的□填写阿拉伯数字。缺省方框用0填写。例:20应在三格框中书写0 2 0。 6、所有检验项目因故“未查或漏查”,请填写ND,并注明原因;“不知道”则填入“UK”;“不能提供”或“不适用”则填入“NA”。 7、临床研究期间应如实填写不良事件记录表。记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。如有严重不良事件发生,请及时报告本研究单位临床研究负责人。 筛选期 入选标准
病例报告表(1)
受试者ID:|__|__|__|—|__|__|__|__| 项目名称:秀身贴治疗单纯性肥胖的疗效评价临床研究试验 秀身贴治疗单纯性肥胖的疗效评价 临床研究试验 病例报告表 (Case Report Form) 版本号:V1.1 版本日期:2018年10月17日 研究中心 病例随机号:|__|__|__|__| 受试者姓名缩写:|__|__|__|__| 医生姓名(正楷):______________ 研究时间:2018年11月-2019年3月
病例报告表填写说明 (在正式填表前,请认真阅读下列填表说明) 1. 此病例报告表必须由专职评价者填写,并尽可能由同一人完成;封面、结束页的医生签名由负责该份病例的研究人员填写。 2. 本CRF中的大量数据是从原始资料(受试者治疗情况表等)中统计、计算、汇总而得到的,请填写者务必认真核对并精确统计、计算,注意避免人工统计误差! 3. 封面右上角的“受试者ID”前3位填写中心编号,位数不足的以0补齐;后4为填写病例随机号。例如:湖北省中医院随机号为1234的受试者,受试者ID:001-123 4. 4. 本表请用钢笔或签字笔填写,不得用铅笔或圆珠笔填写。 5. 筛选合格者正式填写病例报告表,中止治疗者以最后一次数据结转为其最后的数据,并如实记录退出本研究的时间和原因。 6. 表中凡有“□”的选项,请在正确的选项“□”里面打“×”。 7. 请在开放的方格中填写数字,每一格填写一个数字,如果位数不够请在前面或后面的格子加零,例如:体重58kg,填入空格中为:体重:| 0 | 5 | 8 |.| 0 | kg。 8. 所有检查项目均须填写,因故未做/未查/漏查,请填写“ND”;数据不详/未知的,请填写“UK”;选项不适用时请填写“NA”。 9. 受试者姓名填写方法:受试者姓名拼音缩写四格需填满,两字姓名填写各字拼音的前两个字母;三字姓名填写各字拼音的首字母及第三字拼音第二字母;四字姓名填写各自拼音的首字母;四字以上姓名填写前四字拼音的首字母。举例:张芳□Z□H□F□A李正芬□L□Z□F□E上官小云□S□G□X□Y。研究者须填写受试者身份登记表,便于在试验中和试验后识别受试者的身份。 10. 填写务必准确、清晰,不得随意擦除或涂改,错误之处纠正时需用横线居中划出,并签署修改者姓名(医师姓名缩写,大写字母)及修改时间,必要时说明理由。不要掩盖填入的原始数据,禁用橡皮擦、修正液或划刮去原填写内容。 举例:填写错误2011/07/13[年、月、日]
病例报告表样板
病例报告表样板 Standardization of sany group #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#
碳水化合物交换份法在糖尿病饮食干预中的应用研究多中心随机对照临床试验 病例报告表 (Case Report Form,CRF) □ 01 医院 □ 02 医院 □ 03 医院 □04 医院 受试者姓名(拼音缩写):□□□□ 研究者签名: 申办者:浙江医院
注意事项 1.本试验主要研究者必须经过GCP培训,必须事先充分了解试验方案及有关资料,严格按方案执行,病例筛选合格者按数字随机表分组,不得随意更改分配。 2.筛选合格者填写正式病例报告表,病例报告表填写务必准确、清晰,不得随意涂改,错误之处纠正时需用双横线居中划出,并签署修改者姓名缩写及修改时间。3.每页页眉均应填写,其中中心代码填 1,2,3,4等;入组顺序号由各医院按受试 者就诊时间顺序填写(入组顺序号的次序应与就诊先后时间及住院号顺序相符合); 随机对应号请按试验设计要求填写;受试者姓名拼音缩写四格应填满,两字姓名按每个字前两个字母填写;三字姓名按每个字的首个字母和第三个字的第二个字母填写;四字姓名按每个字的首个字母填写。举例:张红 ZHHO 李书名 LSMI 欧阳小惠 OYXH 4.血糖因故未查或漏查,应填写ND。 5.填写数字时应将□都填满,位数不够的靠右侧填写,左侧空出填“0”。如□0□4。
入组选择表 请回答以下问题 纳入标准是否无关 1. 2014年6月-2016年6月收治内分泌科被诊断为2型 □□□糖尿病患者; 2. 年龄在18~80岁之间;□□□ 3. 确诊2型糖尿病1年以上□□□ 4. 受试者自愿参加研究并己签署知情同意书□□□ 5. 神志清,可自行进行饮食控制;□□□ 上述问题任一回答是“否”时,该病例不能纳入研究 排除标准是否无关 1. 预计住院时间不满3天□□□ 2.近期接受过大手术或任何一项超过2小时的手术□□□ 3.正在接受糖皮质激素治疗者□□□ 4. 正在接受肠内或肠外营养□□□ 5. 肝、肾功能障碍及其他禁忌症□□□ 6. 糖尿病酮症酸中毒□□□ 7. 妊娠期女性□□□ 8. 不愿意接受饮食管理或无法签署知情同意书者□□□ 上述问题任一回答是“是”时,该病例不能纳入研究 研究者签名日期□□□□年□□月□□日 知情同意书 疾病情况及血糖记录 疾病情况
病例报告表(样板)
碳水化合物交换份法在糖尿病饮食干预中的应 用研究 多中心随机对照临床试验 病例报告表 (Case Report Form,CRF) □ 01 医院 □ 02 医院 □ 03 医院 □ 04 医院 受试者姓名(拼音缩写):□□□□ 研究者签名: 申办者:浙江医院
注意事项 1.本试验主要研究者必须经过GCP培训,必须事先充分了解试验方案及有关资料,严格按方案执行,病例筛选合格者按数字随机表分组,不得随意更改分配。 2.筛选合格者填写正式病例报告表,病例报告表填写务必准确、清晰,不得随意涂改,错误之处纠正时需用双横线居中划出,并签署修改者姓名缩写及修改时间。 3.每页页眉均应填写,其中中心代码填 1,2,3,4等;入组顺序号由各医院按受试者就诊时间顺序填写(入组顺序号的次序应与就诊先后时间及住院号顺序相符合);随机对应号请按试验设计要求填写;受试者姓名拼音缩写四格应填满,两字姓名按每个字前两个字母填写;三字姓名按每个字的首个字母和第三个字的第二个字母填写;四字姓名按每个字的首个字母填写。举例:张红 ZHHO 李书名 LSMI 欧阳小惠 OYXH 4.血糖因故未查或漏查,应填写ND。 5.填写数字时应将□都填满,位数不够的靠右侧填写,左侧空出填“0”。 如□0□4。
入组选择表 请回答以下问题 纳入标准是否无关1. 2014年6月-2016年6月收治内分泌科被诊断 □□□为2型糖尿病患者; 2. 年龄在18~80岁之间;□□□ 3. 确诊2型糖尿病1年以上□□□ 4. 受试者自愿参加研究并己签署知情同意书□□□ 5. 神志清,可自行进行饮食控制;□□□ 上述问题任一回答是“否”时,该病例不能纳 入研究 排除标准是否无关 1. 预计住院时间不满3天□□□ 2. 近期接受过大手术或任何一项超过2小时的手 □□□术 3. 正在接受糖皮质激素治疗者□□□ 4. 正在接受肠内或肠外营养□□□ 5. 肝、肾功能障碍及其他禁忌症□□□ 6. 糖尿病酮症酸中毒□□□ 7. 妊娠期女性□□□ 8. 不愿意接受饮食管理或无法签署知情同意书者□□□上述问题任一回答是“是”时,该病例不能纳入 研究 研究者签名日期□□□□年□□月□□日 一般资料 知情同意书
病例报告表(CRF)记录标准操作规程
病例报告表(CRF)记录标准操作规程 1.目的:为加强对药物研究的监督管理,保证药物临床病历报告表记录真实、规范、完整,提高药物临床试验的质量,根据《中华人民共和国药品管理法》、《国家档案法》以及药物申报和审批中的有关要求,制订本规程。 2.凡在我机构进行的药物临床试验,其病例报告表记录均应遵循本操作规程。 3.药物临床试验病例报告表是指按试验方案所规定设计的一种文件,用以记录每一名受试者在试验过程中的数据。每位受试者在试验中的有关资料均应记录于病例报告表中。 4.病例报告表记录的基本要求:真实、及时、准确、完整、规范,防止漏记和随意涂改。不得伪造、编造数据。为确保达到以上要求,记录时需注意以下事项: 4.1病例报告表中的数据来自原始文件并与原始文件一致,试验中的任何观察、检查结果均应及时、准确、完整、规范、真实地记录于病历和正确地填写至病例报告表中,不得随意更改,确因填写错误,作任何更正时应保持原始记录清晰可辨,由更正者签署姓名和时间; 4.2临床试验中各种实验室数据均应记录或将原始报告复印件粘贴在病例报告表上,在正常范围内的数据也应具体记录。对显著偏离或在临床可接受范围外的数据须加以核实。检测项目必须注明所采用的计量单位; 4.3病例报告表必须使用本研究机构统一专用的带有页码编号的病例报告表。病例报告表的幅面,根据需要设定。 4.4病例报告表中记录的内容要有必要的依据。计算机、自动记录仪器打印的图表和数据资料,临床研究中的检验报告书、体检表、知情同意书、试验图片、照片等应按顺序粘贴在病例报告表的相应位臵上,并在相应处注明试验日期和时间;底片装在统一制作的底片袋内,编号后另行保存。用热敏纸打印的试验记录,须保留其复印件。不宜粘贴的,可另行整理装订成册并加以编号,同时在病例报告表相应处注明,以便查对。 4.5病例报告表应保持完整,不得缺页或挖补;如有缺页、漏页,应详细说明原因。 4.6病例报告表的记录不得使用容易擦改的记录工具如铅笔等,宜用钢笔或圆珠笔写。先用铅笔填写,最后根据需要再擦去后用钢笔填写的做法是不可取的。原始资料记录应用字规范,字迹工整。 4.7常用的外文缩写(包括试验试剂的外文缩写)应符合规范。首次出现时须用中文加以注释。病例报告表中属译文的应注明其外文名称。 4.8病例报告表记录应使用规范的专业术语,计量单位应采用国际标准计量单位,有效数字的取舍应符合试验要求。 4.9临床试验过程中所出现的严重不良事件应详细描述和评价。 4.10入选的未按研究方案完成疗程的病例作为脱落病例处理,需说明脱落原因并记录在案,用于分析研究的质量。脱落病例的数目一般不宜超过10%~15%,比例高时表明随机性很差,意味着试验不够成功。 5.为保护受试者隐私,病例报告表上不应出现受试者姓名。研究者应按受试者的代码确认其身份并记录。 6.监查员可在试验的前、中、后期查访试验点和研究者,确认病例报告表中
临床试验观察表CRF讲解.doc
受试者姓名拼音缩写 封面 □□□□ 阿美宁病例报告表 (C ase Report Form) 受试者姓名: 家庭地址: 联系电话: 试验中心名称: 申办单位:江苏豪森药业股份有限公司 在正式填表前请认真阅读下列填表说明 病例报告表填写说明: 1.筛选合格者填写病例报告表。 2.病例报告表填写务必准确、清晰,不得任意涂改,错误之处纠正时需用横线居中化出,并签署修改者姓名缩写及修改时间。 3.填写记录一律用钢笔或碳素签字笔。 4.患者姓名拼音缩写四个需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每个字的首字母。 5.表中凡有“□”的项,请在符合的条目上划“√”。表格中所有栏目均应填写相应的文字或数字,不得留空。 6.所有检验项目因故未查或漏查,请填写ND;具体合并用药剂量和时间不明,请先写NK 。 7.试验期间应如实填写合并用药记录表、不良事件记录表。记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。如有严重不良事件发生(包括临床验证过程中发生需住院治疗、延长住院时间、伤残、影响工作能力危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究单位伦理委员会及申办单位。 单位联系人联系电话传真 江苏豪森药业股份有限公司
8.临床试验应严格按照临床试验方案要求进行。试验不同时期需完成的检查和需记录的项目,请对照临床流程图执行。 受试者姓名拼音缩写 临床试验流程图 □□□□ 治疗治疗治疗治疗项目治疗前 0 天 1 周 4 周天8 周 基本情况采集 确定入选 /排除病例√√ 签署知情同意书√ 填写一般资料√ 病史与治疗史√ 合并疾病√√√√ 症状与体征√√√√ 合并用药记录√√√√ 安全性观察 不良反应√√√ 疗效性观察 临床症状、体征评分√√√√ 理化指标检查√√ 影像学、心电、 B 超等检查√√ 不良反应评估√ 疗效评定√ 其它工作 随机分组√ 分发研究产品√ 回收研究产品数量√
病例报告表格模板CRF
欢迎共阅 XXXXX)临床试验 病例报告表 (CaseReportForm) (版本号:第二版2010年8月3 日)试验组□对照组口 是否完成研究:□是□否 承担临床试验的医疗机构:1._口 2. 口 受试者拼音缩写:口□□口 试验编号:□□口 研究者姓名:研究开始日期:____ 年 ____ 月日 I 气X. \ X # A 研究结束日期:_________ 年_____ 月 ____ 日 —、、I, 实施者:xxxxxxxxxxxxxXX司 填表说明 1、筛选合格者填写正式病例报告表。 2、病例填写务必准确、清晰,病历及本表作为原始记录,不得随意涂改,错误之处更正时,在错误处划一水平线居中,仍能看到其原始内容,将更正的记录写在旁边,并写上研究者的姓名和更改日期。 举例:原记录为:8.5,修改后式样为8.5 3、填写本表一律使用黑色中性笔。 4、患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字第二字母,四字姓名填写每一个字的首字母。 举例:张悦ZHYU李新华LXHU欧阳冰冰OYBB 5、所有选择项目的□内用“ X”标注。 6、试验期间应如实填写不良事件记录表。记录不良事件的发生时间、严重程度、持续时间、 采取的措施和转归。如有严重不良事件发生,请及时报告本中心临床试验负责人、伦理委员会、实施者、药监局。
(发现严重不良反应时需在小时以内上报有关单位)
患者检查/诊断信息患者主要症状描述:检查/诊断结果: 研究医师签名日期20 年月日
标准
研究医师签名日期20 年月日 义判定:1 =正常;2=异常但无临床意义;3 =异常但有临床意义;4 =未查。 研究医师签名日期20—年月日 术前评分
临床研究病例报告表
临床研究病例报告表 Document number:PBGCG-0857-BTDO-0089-PTT1998
XXXXXXXXXXXXXXX XXXXXXXXXXXXXXXX XXXXXXXXXXXXX 临床研究病例报告表 (X日用药) 受试者姓名缩写□□□□ 药物编号:□□□ 试验中心编号:□ 试验开始日期年月日 填表说明 1.请用签字笔填写,字迹应清晰,易于辨认。 2.受试者姓名按汉语拼音首字母缩写靠左对齐填写。 3.在所有选择项目中,请在相应的方框中划“×”;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。 4.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名修改者及日期。不要用任何方式(橡皮、涂改液等)涂抹原记录。 5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留以上记录副本。 6.知情同意书一般为患者签名。如患者有特殊情况,可由患者法定代理人签名。 试验观察流程图
入组筛选表
1.受试者应为: ?年龄:18 -70岁癌症患者(一般情况尚好,可适当放宽) ?性别不限 ?预计生存期2个月以上的住院患者 ?疼痛强度为中到重度,评分≥4 ?并符合一下条件之一(请在符合的项目上画圈) 1)入选前1周内曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2; 2)入选前1周内曾使用其它镇痛药,其全日剂量相当于40-60mgXX剂量,疼痛强度可缓解到≤2 ?非放疗期或疼痛部位为非照射部位 ?间歇期的化疗者,应由主管医生确认化疗后无止痛作用 ?该患者是否同意参加本试验,并已签署知情同意书 如以上任何一个答案为“否”,此受试者不能参加 2.受试者排除标准: ?本研究开始前4周内曾参加过其他临床试验 ?正在服用或本试验开始前2周内曾服用MAO抑制剂者(如优降宁、苯乙肼等) ?24小时内用过XX类镇痛药,或5日内用过XXX ?癌痛骨转移患者,近4周内接受同位素内放疗或/和双磷酸盐类药物治疗?呼吸抑制、(肺)气道阻塞或组织缺氧 ?胆道疾病 ?心脏疾患(即Ⅱ级和Ⅱ级以上心功能) ?血压高于正常值 ?血液系统疾病 ?肝、肾功能明显异常(即指标高于正常值一倍以上) ?脑部疾病,判定能力异常 ?XX药耐受、过敏,或曾在使用时因不良反应停药 ?药物及∕或酒精滥用 ?孕妇或哺乳期妇女 如以上任何一个答案为“是”,此受试者不能参加 结论:该患者是否符合上述要求,同意入组是 □ □ □ □ □ □ □ □ 是 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 医生签名:______日期____年___月___日 病历简况 检查日期:年月日
CRF表格模板版本
缓衰方对缺血性肾病RAAS阻滞后肾功能进展的影响 病例报告表 患者姓名: 家庭地址: 工作单位: 联系电话: 研究者姓名: 研究单位: 病例观察表填写说明 1.筛选合格者填写正式病例。 2.病例填写务必准确、清晰,不得随意涂改,错误之处纠正时需用横 线居中划出,并签署修改者姓名缩写及修改时间。举例:58.6LGW000212。 3.患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每一个字的首字母。举例:张红ZHHO李淑明LSMI欧阳小惠OYXH。 4.所有选择项目的□内用√标注。如:√。 5.所有检验项目因故未查或漏查,请填写ND;具体用药剂量和时间不明,请填写NK。6.试验期间应如实填写不良反应事件记录表。记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。 临床试验流程图(SOP) 4
缓衰口服液对缺血性肾病RAAS阻滞后肾功能进展的影响 知情同意书 我院肾内科开展“缓衰口服液对缺血性肾病RAAS阻滞后肾功能进展的影响”的研究为国家中医药管理局资助项目,批准文号为。 动脉粥样硬化性肾动脉狭窄是需要临床积极干预的疾病,如治疗不及时,其可能发展至终末期肾衰竭和心力衰竭等。目前,您的临床表现适合药物治疗。因此,建议您参加本临床试验。本研究分为缓衰口服液治疗组与对照组,两组在饮食管理、控制血压(使用RAAS阻滞剂等)、纠正酸中毒和水电解质紊乱方面的基础治疗上进行,如有感染给予及时控制。RAAS阻滞剂是目前首先药物,但可能会出现急性肾功能减退,需要密切监视肾功变化。治疗组将在基础治疗的基础上加服缓衰口服液;对照组采用基础治疗治疗。药物使用方法符合国家法定标准。根据随机的原则,您有可能分配到任何一组,但不论您分为哪个组,都不会影响您的治疗。希望您为了医学研究,给我们配合,在治疗过程中出现任何异常情况,都会得到医生及时处理。 您有权随时退出本研究,不会因为拒绝或退出研究而受到医生的歧视。 患者承诺:我愿加入“缓衰口服液对缺血性肾病RAAS阻滞后肾功能进展的影响”的研究,医生已经将有关事宜告诉我,我将严格遵守试验方案,与医生配合治疗,并按时复查。患者研究者见证人
