强电解质溶液的活度与活度系数

5.3 强电解质溶液的活度和活度系数
5.3.1 电解质溶液的活度和活度系数
对于非理想溶液,其溶质的化学位可表示为:
m a RT ln +=*μμ,m a m γ=
m a — 活度(有效浓度) *
μ
—
标准状态时的化学位,即1a m =时的化学位。
m — 溶质的质量摩尔浓度 γ — 活度系数
对于强电解质溶液,由于电解质在溶剂中解离为离子,故m a m γ=关系不适用于溶质的整体,但对离子本身仍然适用,即:
+++γ=m a ,---γ=m a 设某电解质 -+ννA M 在溶液中电离:
--++ννν+ν→-+z z A M A M
这时:+*
+++=a RT ln μμ, -*
--+=a RT ln μμ 而:
--++*+=+=μνμνμμa RT ln
又: *
--*
++*
μν+μν=μ 故: -+ν
-ν
+?=a a a
因为溶液是电中性的,各种离子的γ、m 无法通过实验测定,而引出“平均离子活度”的概念。
令: -+ν+ν=ν
定义:平均离子活度 (
)νν-
ν+
±-+?=1a a a 平均离子活度系数 (
)
ν
ν-
ν+±-+γ
?γ
=γ1
平均离子浓度 (
)
ν
ν-
ν+
±-
+?=1m
m m
又: m m ++ν=,m m --ν= 得: ① ±±±γ=m a
② (
)ν
ν
-
ν+ν±-
+ν?νγ=m
a
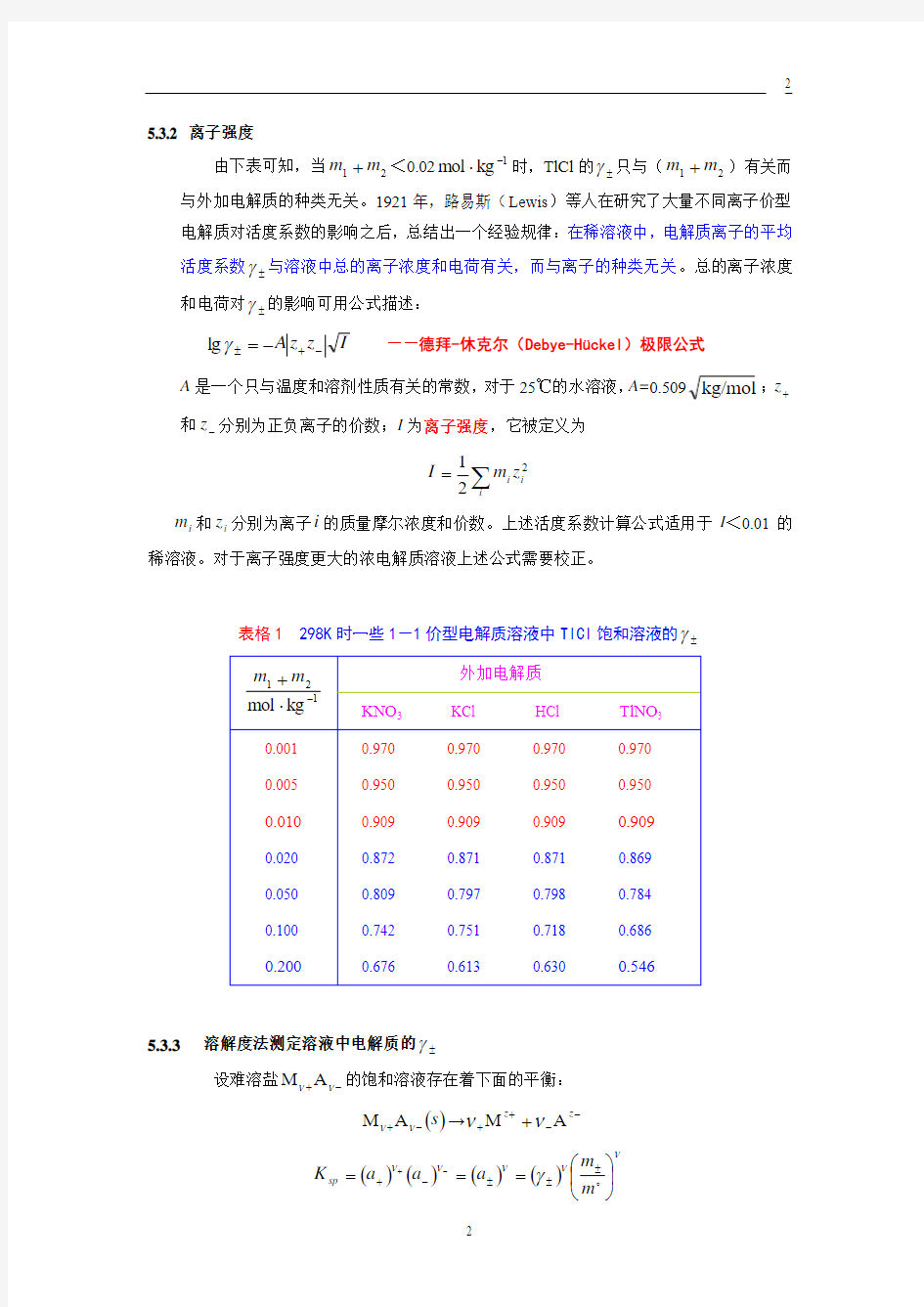
表格1 298K 时一些1-1价型电解质溶液中TlCl 饱和溶液的±γ
5.3.2 离子强度
由下表可知,当21m m +<0.021
kg
mol -?时,TlCl 的±γ只与(21m m +)有关而
与外加电解质的种类无关。1921年,路易斯(Lewis )等人在研究了大量不同离子价型电解质对活度系数的影响之后,总结出一个经验规律:在稀溶液中,电解质离子的平均活度系数±γ与溶液中总的离子浓度和电荷有关,而与离子的种类无关。总的离子浓度和电荷对±γ的影响可用公式描述:
I z z A -+±-=γlg ——德拜-休克尔(Debye-H ückel )极限公式
A 是一个只与温度和溶剂性质有关的常数,对于25℃的水溶液,A=0.509kg/mol ;+z 和-z 分别为正负离子的价数;I 为离子强度,它被定义为
∑=
i
i i z m I 221
i m 和i z 分别为离子i 的质量摩尔浓度和价数。上述活度系数计算公式适用于I <0.01的
稀溶液。对于离子强度更大的浓电解质溶液上述公式需要校正。
5.3.3
溶解度法测定溶液中电解质的±γ
设难溶盐-+ννA M 的饱和溶液存在着下面的平衡:
()s -+ννA M →--+++z z A M νν
()
()
()()
ν
ν
ν
ννγ??
? ??===±±±-+-
+
m m a a a K sp
±
±=m m K sp
νγ (15)
例题: 298K 时,TlCl (s )在水中的溶解度由于外加电解质HCl 的量不同而发生变化,结果如下, 求TlCl 的±γ。
HCl 的浓度(m 2/mol·kg -1): 0.000 0.025 0.050 0.100 0.200 TlCl 的浓度(m 1/mol·kg -1): 0.01607 0.00866 0.00583 0.00383 0.00253 解 由式(10)知
)(211m m m m m m m m +==
=-+-+±-+
ννν 由式(14)知
()
()22112)
( m m m m m m K sp +=??
? ??=±±±γγν
ν
当(21m m +)→0时,±γ→1,sp K →
2211)( m m m m +。因此,以2
211)
( m
m m m +对(21m m +)作图,外推至21m m +=0,所得
2
211)
( m m m m +即为sp K 。用此法求得
sp K =2.02×10-4
。再由式(15)±
±=m m K sp
νγ求各个浓度下的±γ。结果如下:
2
1
2110kg mol --?+m m 1.607 3.366 5.583 10.383 20.253
21
10kg
mol --±
?m 1.606 1.707 1.804 1.994 2.259
±γ
0.885 0.833 0.788 0.713 0.629
电解质溶液知识点总结(教师版)
电解质溶液知识点总结 一、电解质和非电解质 电解质:在水溶液里或熔融状态下能导电的化合物。 非电解质:在水溶液里和熔融状态下都不能导电的化合物。 【注意】 1.电解质和非电解质的范畴都是化合物,所以单质既不是电解质也不是非电解质。 2.化合物为电解质,其本质是自身能电离出离子,有些物质溶于水时所得溶液也能导电,但这些物质自身不电离,而是生成了一些电解质,则这些物质不属于电解质。如:SO2、SO3、CO2、NO2等。 3.常见电解质的范围:酸、碱、盐、金属氧化物、水。 二.强电解质和弱电解质 强电解质:在溶液中能够全部电离的电解质。则强电解质溶液中不存在电离平衡。 弱电解质:在溶液中只是部分电离的电解质。则弱电解质溶液中存在电离平衡。 O _ 1.强、弱电解质的范围: 强电解质:强酸、强碱、绝大多数盐 弱电解质:弱酸、弱碱、水 2.强、弱电解质与溶解性的关系: 电解质的强弱取决于电解质在水溶液中是否完全电离,与溶解度的大小无关。一些难溶的电解质,但溶解的部分能全部电离,则仍属强电解质。如:BaSO4、BaCO3等。 3.强、弱电解质与溶液导电性的关系: 溶液的导电性强弱与溶液中的离子浓度大小有关。强电解质溶液的导电性不一定强,如很稀的强电解质溶液,其离子浓度很小,导电性很弱。而弱电解质溶液的导电性不一定弱,如较浓的弱电解质溶液,其电离出的离子浓度可以较大,导电性可以较强。 4.强、弱电解质与物质结构的关系: 强电解质一般为离子化合物和一些含强极性键的共价化合物,弱电解质一般为含弱极性键的化合物。5.强、弱电解质在熔融态的导电性: 离子型的强电解质由离子构成,在熔融态时产生自由移动的离子,可以导电。而共价型的强电解质以及弱电解质由分子构成,熔融态时仍以分子形式存在,所以不导电。 三、弱电解质的电离平衡: 强电解质在溶液中完全电离,不存在电离平衡。弱电解质在溶液中电离时,不完全电离,存在电离平衡。当弱电解质的离子化速率和分子化速率相等时,则建立了电离平衡。其平衡特点与化学平衡相似。(逆、等、动、定、变) 1.电离方程式: 书写强电解质的电离方程式时常用“==,书写弱电解质的电离方程式时常用“”。 2.电离平衡常数: 在一定条件下达到电离平衡时,弱电解质电离形成的各种离子的浓度的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数,简称电离常数。
第八章 电解质溶液
第八章 电解质溶液 一、基本公式和内容提要 1、Faraday (法拉第)定律 B Q n z F += (8 - 1 - 1) B B Q m M z F += (8 – 1 -2) 2、离子电迁移率和迁移数 E E r u r u l l ++ ==d d ,d d -- (8-2-1) def B B I t I = (8-2-2) I r I r t t I r r I r r +++++= == = ++,-- --- (8-2-3) u u t t u u u u + +++== ++, --- - (8-2-4) B 11t t t t t +++=∑=∑+∑=,-- (8-2-5) m,+ m, m m t t ΛΛΛΛ∞∞+∞∞==, -- (8-2-6) m,++m,u F u F ΛΛ∞∞ ∞∞ ==,-- (8-2-7) 3、电导、电导率、摩尔电导率 1I G R U == - (8-3-1) 1A G l κκ ρ = =, (8-3-2) def m m V c κ Λκ= = (8-3-3) cell 1 l K R R A κρ = == (8-3-4) 4、Kohlrausch(科尔劳奇)经验式 m m 1c ΛΛβ∞ =-() 5、离子独立移动定律 m m ,+m ,-m m ,+v v ΛΛΛΛΛΛ∞∞∞∞∞∞ +-=+=+, (8-5) 6、Ostwald (奥斯特瓦尔德)稀释定律 m m ΛαΛ∞= (8-6-1)
2 m m m m C c c K ΛΛΛΛ∞∞=-() (8-6-2) 7、离子的平均活度、平均活度因子和电解质的平均质量摩尔浓度 111def def def v v v v v v v v v a a a m m m γγγ+-+-+-±+ - ±+ - ±+- ===(), (), () (8-7-1) B v v v m a a a a a m γ+-± ±±+-± ===, (8-7-2) 1、 离子强度 def 2B B B 1 2I m z ∑= (8-8) 9、Debye-Huckel(德拜-休克尔)的极限定律 z A z I γ±+- =-lg (8-9-1) z 1B A z I a I γ+-±= +lg - (8-9-2) 电解质溶液之所以能导电,是由于溶液中含有能导电的正、负离子。若通电于电解质溶 液,正、负离子将朝相反方向移动,电极上就有氧化还原反应发生。电极上起作用的物质的质量与通入的电荷量及该物质的摩尔质量成正比,这可利用faraday 定律进行计算。为了描述电解质溶液的导电行为,引入了离子的迁移速率r +(r -)、离子的电迁移率(也称为离子淌度)u u +-()、离子的迁移数t t +-()、电导G 、电导率κ和摩尔电导率Λm 等概念。由于在电解质溶液中正、负离子总是同时存在,单个离子的性质无法用实验测定,为了描述电解质溶液偏离理想的行为,引入了离子平均活度γ±、离子平均质量摩尔浓度m ±和离子平均活度a ±等概念。引入离子强度I 是为了表示离子浓度和离子价数对平均活度因子的影响。若是强电解质的稀溶液,其离子平均活度因子γ±的理论值可以用Debye-Huckel 极限定律计算,实验值可以用电动势法测定(见第九章)。 迁移数 迁移数的定义是指某种离子产生的电流与溶液中总电流的比值I I +-(),后来还扩展为某种离子迁移的电荷量占通过电池电荷量的分数Q Q +-()、某种离子的迁移速率占所有离子速率加和的分数[]r r r ++-+()、某种离子的电迁移率占所有离子电迁移率加和的分数 []u u u ++-+()、某种离子的摩尔电导率占电解质总摩尔电导率的分数[]++-ΛΛ+Λ()等。迁移 数总是等于后小于1的分数,溶液会走所有离子迁移数的加和等于1。无论是在原电池还是在电解池中,离子在电场的作用下总是做定向移动,阴离子迁向阳极(不一定是正极),阳离子迁向阴极(不一定是负极)。对于只含一种电解质的溶液,若正、负离子的电价相同,则离子迁移的速率也快,迁移的电荷量就越多,迁移数也就越大。但是在混合电解质溶液中,由于离子之间的相互作用,情况就比较复杂。改变外压,可以影响离子的迁移速率,但一般不改变离子的迁移数,因为正、负离子的移动速率成比例地同时改变。 测定迁移数的方法主要有三种: (1) Hittorf (希托夫)法 由于离子在迁移过程中,中部离子的浓度基本不变,只要 分析阴极不(或阳极部)离子浓度的变化,知道离子迁移的方向和电极上发生的反应,就可以计算离子的迁移数。实验比较容易掌握,但计算稍麻烦一点。
电解质溶液活度系数的测定
实验十七 电解质溶液活度系数的测定 一、实验目的 测定不同浓度盐酸溶液中的平均离子活度系数,并计算盐酸溶液中的活度。 二、实验原理 将理想液体混合物中一组分B 的化学势表示式中的摩尔分数 代之以活度,即可表示真实液体混合物中组分B 的化学势。 B B B f a x = B f 为真实液体混合物中组分B 的活度因子。真实溶液中溶质B ,在温度T 、压力P 下, 溶质B 的活度系数为: /(/)B B B a b b θ ?= 其中B ?为活度因子(或称活度系数)。 电池:Ag ,AgC l|HCL |玻璃|试液||KCL (饱和)| 22H g C l Hg ψ 膜 L ψ (液接电势) 玻璃电极 | | 甘汞电极 A /gC l Ag ψψ ψ =+膜 玻璃 22 L H /g C l H g ψψ= 上述电池的电动势: L E ψ ψ ψ =+-玻璃 Hg Cl /Hg 22 (1) 其中:K+0.059lg a ψ =膜 (K 是玻璃膜电极外、内膜表面性质决定的常数) 当实验温度为250 C 时 0.11831l g L E K a ψ ψ ψ =++--AgCl/Ag Hg Cl /Hg 22 0.11831lg K a =- K -0.1183l g m γ=±± (2) 上式可改写为: K -0.1183lg -0.1183lg E m γ =± ± 即 l g (0.1183l g )/ K E m γ =--± ± (1) 根据得拜——休克尔极限公式,对1——1价型电解质的稀溶液来说,活度系数有下述 关系式 0 /(/)B B B a b b γ=l g γ±=- 所以 (0.1183lg )/0.1183K E m --=-±
强电解质和弱电解质 教案
强电解质和弱电解质 一、教学目标 1.结合生活中的实例,理解电解质的概念,感受电解质在生 活、生产中的重要应用。 2.通过方案解读和实验探究,在提升实验技能的同时,认识 到强弱电解质的差异在于他们在水溶液中电离程度的不 同,从而培养严谨的科学态度。 3.掌握电离方程式的书写方法。 二、教学重难点 教学重点:强电解质和弱电解质的概念。 教学难点:强电解质和弱电解质的概念。 三、教学过程 情景导入 师:军训是高中生活难忘的时光,还记得我们军训大汗淋漓之后,教官们建议我们喝什么?是淡盐水?还是糖水? 生:淡盐水 师:为什么是淡盐水更有利于我们的身体健康呢? 生:大量流汗后,汗液中含有的电解质氯化钠随之流失,因此要补充淡盐水,维持人体平衡。 师:糖水中的蔗糖是不是电解质?什么样的物质我们可以称之为电解质? 生:蔗糖不能在水中电离,所以不是电解质。在水溶液中或熔融状态下能导电的化合物称为电解质,而在两种情况下都不能导电 的化合物称为非电解质。 师:来看这样一道习题 下列物质中 ①NaCl溶液② NaOH ③ H2SO4④ Cu ⑤ CH3COOH ⑥ NH3·H2O ⑦ CO2⑧乙醇⑨ H2O 属于电解质的是: 属于非电解质的是: 师:电解质与我们的生活有着密切的关系:
①我们经常看到这样的安全警示标志。不能用潮湿的手触碰 正在工作的电器,否则容易发生触电。 ②在电解水制备H2、O2时,常常向水中加入少量的NaOH溶 液或H2SO4溶液,可以更快的得到氢气和氧气。 师:为什么呢? 生:人体是个大导体,用湿手接触工作的电器,会与大地形成回路,发生触电事件。 生:加入氢氧化钠或者硫酸溶液会增强导电性,而且不会改变电解产物。 师:那为什么不用氨水或者醋酸呢? 生:硫酸和氢氧化钠是强酸强碱,而醋酸和氨水是弱酸弱碱。 实验促学 师:怎么区分酸和碱的强弱呢?以盐酸和醋酸为例来解决这个问题。 生:思考中…… 师:比较同浓度的盐酸和醋酸溶液导电性哪个强可以吗? 教师演示实验1:在两只相同的小烧杯中分别加入100ml物质的量浓度均为0.1mol/L的盐酸和醋酸,连接电路,接通电源,观 察实验现象。 实验现象:连接盐酸的小灯泡亮,连接醋酸的小灯泡暗。 实验结论:同浓度的盐酸导电性比醋酸强。 师:那么我们学过哪些强酸、弱酸、强碱、弱碱呢?将学案中的表格补充完整。 师:刚才连接盐酸的灯泡亮,连接醋酸的灯泡暗。那强酸的导电能力一定强,醋酸的导电能力一定弱吗? 教师演示实验二:在两只相同的小烧杯中分别加入100ml 0.00001mol/L的盐酸和100ml 0.1mol/L的醋酸溶液,连接电 路,接通电源,观察实验现象。 实验现象:连接醋酸的小灯泡暗,而连接盐酸的小灯泡不亮,只是灵敏电流计指针有偏转。 实验结论:100ml 0.1mol/L的醋酸溶液导电性比100ml 0.00001mol/L 的盐酸溶液强。
强电解质溶液的活度与活度系数
5.3 强电解质溶液的活度和活度系数 5.3.1 电解质溶液的活度和活度系数 对于非理想溶液,其溶质的化学位可表示为: m a RT ln +=*μμ,m a m γ= m a — 活度(有效浓度) * μ — 标准状态时的化学位,即1a m =时的化学位。 m — 溶质的质量摩尔浓度 γ — 活度系数 对于强电解质溶液,由于电解质在溶剂中解离为离子,故m a m γ=关系不适用于溶质的整体,但对离子本身仍然适用,即: +++γ=m a ,---γ=m a 设某电解质 -+ννA M 在溶液中电离: --++ννν+ν→-+z z A M A M 这时:+* +++=a RT ln μμ, -* --+=a RT ln μμ 而: --++*+=+=μνμνμμa RT ln 又: * --* ++* μν+μν=μ 故: -+ν -ν +?=a a a 因为溶液是电中性的,各种离子的γ、m 无法通过实验测定,而引出“平均离子活度”的概念。 令: -+ν+ν=ν 定义:平均离子活度 ( )νν- ν+ ±-+?=1a a a 平均离子活度系数 ( ) ν ν- ν+±-+γ ?γ =γ1 平均离子浓度 ( ) ν ν- ν+ ±- +?=1m m m 又: m m ++ν=,m m --ν= 得: ① ±±±γ=m a ② ( )ν ν - ν+ν±- +ν?νγ=m a
表格1 298K 时一些1-1价型电解质溶液中TlCl 饱和溶液的±γ 5.3.2 离子强度 由下表可知,当21m m +<0.021 kg mol -?时,TlCl 的±γ只与(21m m +)有关而 与外加电解质的种类无关。1921年,路易斯(Lewis )等人在研究了大量不同离子价型电解质对活度系数的影响之后,总结出一个经验规律:在稀溶液中,电解质离子的平均活度系数±γ与溶液中总的离子浓度和电荷有关,而与离子的种类无关。总的离子浓度和电荷对±γ的影响可用公式描述: I z z A -+±-=γlg ——德拜-休克尔(Debye-H ückel )极限公式 A 是一个只与温度和溶剂性质有关的常数,对于25℃的水溶液,A=0.509kg/mol ;+z 和-z 分别为正负离子的价数;I 为离子强度,它被定义为 ∑= i i i z m I 221 i m 和i z 分别为离子i 的质量摩尔浓度和价数。上述活度系数计算公式适用于I <0.01的 稀溶液。对于离子强度更大的浓电解质溶液上述公式需要校正。 5.3.3 溶解度法测定溶液中电解质的±γ 设难溶盐-+ννA M 的饱和溶液存在着下面的平衡: ()s -+ννA M →--+++z z A M νν () () ()() ν ν ν ννγ?? ? ??===±±±-+- + m m a a a K sp
NaCl在水中的活度系数 - 研究
NaCl 在O H 2中活度系数的测定 一、目的与要求 (1)了解电导法测定电解质溶液活度系数的原理。 (2)了解电导率仪的基本原理并熟悉使用方法。 二、基本原理 由Debye-H ückel 公式 I a B Z Z A f +??- =- +±1lg (1) 以及Osager-Falkenhangen 公式 I a B I B B ++?=1- 2010)λ(λλ (2) 可以推出公式:)(lg 02 01λλλ-+??= -+±B B Z Z A f (3) 令2 01B B Z Z A a +??= -+λ,则式(3)就变为:)(lg 0λλ-?=±a f (4) 式(4)中,2 36 ) (108246.1T A ε?= ;) 1()(10801.223 61q T q Z Z B +????= -+ε;2 1 2)(25.41)η(εT Z Z B -++= ;ε 为溶剂的介电常数;η为溶剂的黏度;T 为热力学温度;0λ为电解质无限稀释摩尔导电率,单位为1 2 -??mol cm S ;λ为电解质摩尔导电率;I 为溶液的离子强 度;0 000- ++-- +-+- +?+?+?+?=L Z L Z L L Z Z Z Z q ;00-+L L 、是正、负离子的无限稀释摩尔导电率;-+Z Z 、是正、负离子的电荷数。 对于实用的活度系数±γ(电解质正、负离子的平均活度系数)则有: )001.01(vmM f +=±±γ (5) 所以 )001.01lg(lg lg vmM f +-=±± γ (6) 把式(4)代入式(6)得:)001.01lg()(lg 0vmM a +--=± λλγ (7) 式(7)中,M 为溶剂的摩尔质量,单位为1 -?mol g ;v 为单个电解质分子的正、负离子数目的总和(即-++=v v v );m 为电解质溶液的质量摩尔浓度,单位为1 -?kg mol 。稀溶液中:c m ≈。
解读电解质和非电解质 强电解质和弱电解质
解读电解质与非电解质强电解质与弱电解质 河北省宣化县第一中学栾春武 电解质与非电解质、强电解质与弱电解质都就是高中化学中十分重要得概念,正确理解非常重要,因此必须准确把握其内涵与外延,为了让同学们更好地、更准确理解,归纳如下: 电解质:在水溶液里或熔融状态下能够导电得化合物,如酸、碱、盐等、 非电解质:在水溶液里或熔融状态下都不够导电得化合物,如非金属氧化物、酒精、蔗糖等。 从树状分类这个角度上可以把化合物分为电解质与非电解质两类。电解质可分为强电解质与弱电解质两类。 一、电解质与非电解质 (1)金属能导电,但它们不就是化合物,因此金属即不就是电解质,也不就是非电解质。 (2)SO2、NH3溶于水,能导电,导电离子就是H2SO3、NH3·H2O电离出来得,故SO2、NH3不就是电解质。HCl、H2SO4等溶于水,能导电,导电离子就是自身电离出来得,故它们就是电解质、酸、碱、盐就是电解质,非金属氧化物都不就是电解质。 (3)活泼金属氧化物,如Na2O、Al2O3等,在熔融状态下能导电,就是因为它们自身能电离出离子,Al2O3(熔) 2 Al3+ + 3O2-,就是电解质、 (4)难容物(如CaCO3等)得水溶液导电能力很弱,但熔融状态能导电,就是电解质、
(5)酒精、蔗糖等大多数有机物就是非电解质、 (6)电解质不一定导电、强碱与盐等离子化合物在固态时,阴、阳离子不能自由移动,所以不能导电,但熔融状态下或溶于水时能够导电。酸在固态或液态(熔融状态)时只有分子,没有自由移动得离子,因而也不导电,在水溶液里受水分子得作用,电离产生自由移动得离子,而能够导电。 (7)不导电得物质不一定就是非电解质,能导电得物质不一定就是电解质。电解质、非电解质均指化合物、O2不导电,铁、铝能导电,但它们既不就是电解质,也不就是非电解质。 (8)电解质溶液得导电能力与溶液中离子浓度及离子所带电荷多少有关,离子浓度越大,离子所带电荷越多,导电能力越强。 (9)判断电解质就是否导电,关键瞧电解质就是否发生电离,产生了自由移动得离子,还要瞧电离产生得离子浓度得大小、如CaCO3在水中得溶解度很小,溶于水电离产生得离子浓度很小,故认为其水溶液不导电。 二、强电解质与弱电解质
实验四 电解质溶液
实验四电解质溶液 一、实验目的 1.了解强弱电解质电离的差别及同离子效应。 2.学习缓冲溶液的配制方法及其性质。 3.熟悉难溶电解质的沉淀溶解平衡及溶度积原理的应用。 4.学习离心机、酸度计、pH试纸的使用等基本操作。 二、实验原理 1.弱电解质的电离平衡及同离子效应 对于弱酸或弱碱AB,在水溶液中存在下列平衡:AB A++B-,各物质浓度关系满足K? = [A+]·[B-]/[ AB],K?为电离平衡常数。在此平衡体系中,若加入含有相同离子的强电解质,即增加A+或B-离子的浓度,则平衡向生成AB分子的方向移动,使弱电解质的电离度降低,这种效应叫做同离子效应。 2.缓冲溶液 由弱酸及其盐(如HAc-NaAc)或弱碱及其盐(如NH3·H2O-NH4Cl)组成的混合溶液,能在一定程度上对抗外加的少量酸、碱或水的稀释作用,而本身的pH值变化不大,这种溶液叫做缓冲溶液。 3.盐类的水解反应 盐类的水解反应是由组成盐的离子和水电离出来的H+或OH-离子作用,生成弱酸或弱碱的过程。水解反应往往使溶液显酸性或碱性。如:弱酸强碱盐(碱性)、强酸弱碱盐(酸性)、弱酸弱碱盐(由生成弱酸弱碱的相对强弱而定)。通常加热能促进水解,浓度、酸度、稀释等也会影响水解。 4.沉淀平衡 (1)溶度积 在难溶电解质的饱和溶液中,未溶解的固体及溶解的离子间存在着多相平衡,即沉淀平衡。K sp?表示在难溶电解质的饱和溶液中,难溶电解质的离子浓度(以其化学计量数为幂指数)的乘积,叫做溶度积常数,简称溶度积。根据溶度积规则可以判断沉淀的生成和溶解。若以Q表示溶液中难溶电解质的离子浓度(以其系数为指数)的乘积,那么,溶液中Q>K sp?有沉淀析出或溶液过饱和;Q=K sp?溶液恰好饱和或达到沉淀平衡;Q 一、教材分析 教材从“你知道吗”入手,说明强电解质和弱电解质中微粒的不同性,同时,教材中配合图画,进一步说明强、弱电解质在水溶液中的电离情况,使学生更容易理解和接受,同时强弱电解质的判断也是后续学习弱电解质的电离平衡的基础。 二、学情分析 本节课的教学对象是高二理科学生,经过初三和高一的学习,他们已经储备了一定的相关知识,掌握了基本的实验技能;基本上都养成了良好的思考、讨论、探究的习惯。本节内容的教学目标重点不是在知识的深度和广度上,而是让学生通过实验探究和问题解决,体验科学研究的过程,强化科学探究的意识,培养学生的创新能力和实践能力,体会到化学学习的乐趣,并真正做到学以致用。 三、教学目标 1、使学生掌握强弱电解质的概念,电离方程式的书写。 2、通过比较电解质溶液的导电能力,培养学生由表及里的分析问题的能力。 3、通过强弱电解质概念的建立,渗透“透过现象看本质”的辩证唯物主义的思想。 4、通过活动与探究,学习科学探究的一般方法,培养提出问题、探究问题和解决问题的能力。 四、教学重点和难点 教学重点:强弱电解质的概念;弱电解质电离方程式的书写 教学难点: 强弱电解质的概念;弱电解质电离方程式的书写 五、教学过程 [引入] 你能解释下列事实吗? 1.潮湿的手触摸正在工作的电器时,可能会发生触电事故。 2.电解水制H2、O2时,要向水中加入少量的NaOH溶液或H2SO4。 回忆有关电解质的概念及其特点。 概念:电解质——在能够导电的。如等; 非电解质——在都不能导电的。如:等。 电解质特点: 练习:下列物质中,属于电解质的是,属于非电解质的是。 ①铜②氨水③CuSO4·5H2O晶体④盐酸溶液 ⑤石墨⑥酒精⑦碳酸钠⑧蔗糖 为什么我们电解水制H2、O2时向水中加入的是少量的NaOH溶液或H2SO4,而不是氨水或醋酸呢? 分析可能原因,设计实验、讨论方案。 P62[活动与探究] 1.我们将相同浓度的盐酸和醋酸来举例,根据经验,你认为它们的电离程度有无差异?2.若按如下方案进行实验,请仔细观察并记录实验现象 ①测量物质的量浓度均为1mol/L的盐酸和醋酸的pH;②在两支锥形瓶中分别加入等体积、物质的量浓度均为1mol/L的盐酸和醋酸,在两个气球中分别加入经砂纸打磨过的长度相同的镁条,然后将气球套在锥形瓶口,同时将气球中的镁条送入锥形瓶中,观察、比较气球鼓 强电解质和弱电解质 [教学重点]1、掌握强、弱电解质的概念及弱电解质的电离平衡。 2、了解电解质强弱与导电能力的一般关系。 [重点讲解] 一、强电解质和弱电解质 (一)电解质 1、定义:凡是在水溶液里或熔化状态下能导电的化合物 实质:在水溶液或熔化状态下能电离出自由移动的离子的化合物。 注意: (1)电解质和非电解质研究范畴均是化合物。 (2)某些化合物溶于水后其水溶液能导电但不一定是电解质。例:SO3溶于水后可以与水反应生成H2SO4而导电,但SO3为非电解质。 (3)离子化合物呈固态,共价化合物呈液态虽然是电解质但不导电,因为没有自由移动的离子。 (4)电解质和电解质的水溶液不同,前者为纯净物,后者为混合物。 2、中学常见的电解质 酸、碱、大多数盐(中学所学)均是电解质。 3、电解质导电 (1)原因:形成自由移动的离子。 (2)导电能力:相同条件下与溶液中的离子浓度大小有关。 (二)强电解质和弱电解质 1、比较:强电解质弱电解质 电离程度全部部分 电离方程式:H2SO4=2H++SO42- NaHCOO3=Na++HCO3- NaHSO4=Na++H++SO42- 溶质微粒离子分子为主,离子为辅 实例强酸:HCl,HNO3,H2SO4弱酸:HF,HClO,HCOOH,H2CO3 HBr,HI等 CH3COOH,,H2S, H2SO3,H2SiO3,H2O,H3PO4等强碱:KOH,NaOH,Ba(OH)2 弱碱:NH3·H2O,Al(OH)3 Ca(OH)2等不溶性碱 大多数盐:NaCl BaSO4 AgCl等 注意:强弱电解质的判断依据是,该电解质溶解后电离是否完全而不是该溶液中的离子浓度大小。例:BaSO4虽难溶于水,但溶解的部分完全电离,所以是强电解质。 2、弱电解质的电离平衡 (1)概念:在一定条件下弱电解质的电离速率与结合速率相等时,电离过程就达到了平衡状态,叫做电离平衡状态。 (2)特点:等,V电离=V结合; 定,离子浓度和分子浓度不变; 动,动态平衡; 变,条件改变电离平衡发生移动,电离为吸热过程。 (3)影响电离平衡移动的因素:因为电离平衡是动态平衡,其规律仍遵循化学平衡移动原理。 ①浓度:改变浓度电离平衡向削弱该改变的方向移动。加水,弱电解质电离平衡向电离方向移动,但离子浓度均减小。 ②温度:因为电离过程是吸热过程,所以升高温度,弱电解质的电离平衡向电离方向移动。 (4)多元弱酸,分步电离,第一步电离大于第二步电离,第二步电离远大于第三步电离……,例如,0.1mol/L H2S溶液中各步电离[H+]为: [H+]=1×10-4mol/L [H+]=1×10-13mol/L 电离难的原因为:a、一级电离出H+后,剩下的酸根阴离子带负电荷,增加了对H+的吸引力,使第二个H+离子电离困难的多;b、一级电离出的H+抑制了二级的电离。 [例题讲解] 1、把0.05mol NaOH分别加入到下列100mL溶液中,溶液的导电能力变化不大的是() A、自来水 B、0.5mol/L 盐酸 C、0.5mol/L醋酸 D、0.5mol/L氯化铵 分析:电解质溶液导电能力与该溶液中的离子浓度有关,离子浓度越大,导电能力就越强,导电能力变化不大,说明该溶液中在加入NaOH前后离子浓度无显著变化。A选项中自来水中加入NaOH后离子浓度发生显著变化。C选项中醋酸为弱电解质,反应前离子浓度较小,加入NaOH后发生CH3COOH+NaOH=CH3COONa+H2O反应后生成强电解质CH3COONa,离子浓度显著增大。故A、C不 七.电解质溶液 (一)电解质和非电解质、强电解质和弱电解质 1.电解质 凡是水溶液里或熔融状态时能电离进而能导电的化合物叫做电解质。电解质溶于水或熔融时能电离出自由移动的阴、阳离子,在外电场作用下,自由移动的阴、阳离子分别向两极运动,并在两极发生氧化还原反应。所以说,电解质溶液或熔融状态时导电是化学变化。 2.分类 (1)强电解质:是指在水溶液里几乎能完全电离的电解质。 (2)弱电解质:是指在水溶液中只能部分电离的电解质。 用可逆号“” 4.非电解质 凡是在水溶液里或熔融状态都不能电离也不能导电的化合物。 常见的非电解质 非金属氧化物:CO2、SO2、SO3、NO2、P2O5 某些非金属氢化物:CH4、NH3 大多数有机物:苯、甘油、葡萄糖 (二)弱电解质的电离平衡 1.弱电解质的电离特点 (1)微弱:弱电解质在水溶液中的电离是部分电离、电离程度都比较小,分子、离子共同存在。 (2)可逆:弱电解质在水分子作用下电离出离子、离子又可重新结合成分子。因此,弱电解质的电离是可逆的。 (3)能量变化:弱电解质的电离过程是吸热的。 (4)平衡:在一定条件下最终达到电离平衡。 2.电离平衡:当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态。电离平衡是化学平衡的一种,同样具有化学平衡的特征。条件改变时平衡移动的规律符合勒沙特列原理。 (三)水的电离和溶液的pH值 1.水的电离和水的离子积常数 H2O是一种极弱电解质,能够发生微弱电离H2O H+ + OH– 25℃时c(H+)=c(OH–)=10–7mol·L–1 水的离子积K w=c(H+)·c(OH–)=10–14(25℃) ①K w只与温度有关,温度升高,K w增大。如:100℃ K w=10–12 强电解质与弱电解质 【要点精解】 一、强电解质与弱电解质 1.强电解质与弱电解质区别 2.常见的强、弱电解质(1)强电解质: ①强酸:HCl、H 2SO 4 、HNO 3 、HClO 4 、HBr、HI、HMnO 4 … ②强碱:NaOH、Ca(OH) 2、Ba(OH) 2 、KOH、RbOH… ③大部分盐:Na 2CO 3 、BaSO 4 、AgCl、KNO 3 … (2)弱电解质: ①弱酸:如H 2S、H 2 CO 3 、CH 3 COOH、HF、HCN、HClO等。氢氟酸(HF)是具有 强极性共价键的弱电解质;H 3PO 4 、H 2 SO 3 从其酸性强弱看属于中强酸,但仍 属于弱电解质。 ②弱碱:NH 3·H 2 O,多数不溶性的碱[如Fe(OH) 3 、Cu(OH) 2 等]、两性氢氧化物 [如Al(OH) 3、Zn(OH) 2 等]。③少部分盐:如HgCl 2 ,HgBr 2 等。 ④水:是由强极性键构成的极弱的电解质。 二、外界条件对电离平衡的影响 1.影响电离平衡的外界条件 (1)浓度:浓度越大,电离程度越小。在稀释溶液时,电离平衡向右移动,而离子浓度一般会减小。 (2)温度:温度越高,电离程度越大。因电离是吸热反应。 (3)同离子效应:在某电解质溶液中,加入含有某一相同离子的另一电解质,会抑制电解质的电离。如在醋酸溶液中加入醋酸钠或盐酸,均会抑制醋酸的电离。 (4)能反应的离子:加入能与电解质电离出来的离子发生反应的另一物质,会促进电解质的电离。 2.对CH3COOH H++CH3COO-的电离平衡,小结如下: 条件变化平衡移 动 电离 度 K离子数目离子浓度 加热正向移 动 增大增大增多增大 稀释正向移 动 增大不变增多减小 加冰醋酸正向移 动 减小不变增多增大 加盐酸逆向移 动 减小不变H+增多CH 3 COO-减少 加醋酸钠逆向移 动 减小不变H+减少CH 3 COO-增多 说明:电离平衡属于化学平衡,受外界条件如温度和浓度等的影响,其规律遵循勒夏特列原理。 典例精析 【例1】下列物质的水溶液能导电,但属于非电解质的是 高中化学复习考点知识专题训练 27---强电解质与弱电解质 A. 则下列说法正确的是( ) A.气态氢化物的稳定性:M>N B.Z 的最高价氧化物对应的水化物能溶于稀氨水 C.X 和 W 形成的常见化合物阴阳离子个数比为 1:2 D.Z 和 R 组成的化合物是弱电解质 6.下列事实中不能证明 CH3COOH 是弱电解质的是( ) 常见的强电解质: 强酸:HCl、HBr、HI、H2SO4、HNO3、HClO3、HClO4等。 强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等。 多数盐NaCl、(NH4)2SO4、Fe(NO3)3、BaSO4等。 常见的弱电解质: 弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3、CH3COOH 弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2 ?????????等不溶性碱? 少数盐:HgCl2、醋酸铅等(注:CaCO3、BaSO4等是强电解质!!) 注意: ①强电解质、弱电解质与其溶解性无关。 某些难溶或微溶于水的盐,由于其溶解度很小,如果测其溶液的导电能力,往往很弱的,但是其溶于水的部分,却是完全电离的,所以它们仍然属于强电解质,例如:CaCO3、BaSO4等。 注意: 1.电解质和非电解质研究范畴均是化合物。 2.某些化合物溶于水后其水溶液能导电但不一定是电解质。例:SO3溶于水后可以与水反应生成H2SO4而导电,但SO3为非电解质。 3.离子化合物呈固态,共价化合物呈液态虽然是电解质但不导电,因为没有自由移动的离子。 4.电解质和电解质的水溶液不同,前者为纯净物,后者为混合物. 水的电离与溶液的酸碱性 1.影响水的电离的因素 ①温度:水是一种弱电解质,电离过程是吸热的。温度越高,Kw越大(100℃?Kw=?1×10-12),水的电离程度越大。对于中性水,尽管Kw增大,电离程度增大,但仍是中性水,[H+]=[OH-] ②?外加酸碱溶液:加酸或者加碱都会导致电离平衡向逆方向移动,抑制水的电离 2.水的离子积常数注意的几个问题 ??(1)水的离子积常数不仅适用于纯水,也适用于稀的电解质水溶液。一定温度下,稀酸、碱溶液中c(H+)和c(OH-)的乘积总是定值。? ??(2)常温时,向纯水中加入酸或碱,水的电离均受到抑制,但溶液中c(H+)·c(OH-)?仍等于?1×10-14,由水电离产生的c(H+)和c(OH-)仍相等,但小于1×10-7mol/L。? ??(3)在盐酸溶液中Kw=c(H+)·c(OH-)公式中的?c(H+)应该指盐酸电离产生的H+与水电离产生的H+之和,但由于水电离产生的H+远远小于盐酸电离产生的H+,一般把水电离产生的H+忽略掉,实际指盐酸电离产生的H+;c(OH-)指的是由水电离产生的OH-??? (4)在盐酸溶液中下列离子浓度间的关系? ??c(H+)溶液?=?c(H+)酸? c(OH-)溶液=?c(OH-)水? c(H+)水=?c(OH-)水?c(H+)溶液>c(OH-)溶液,??? 例:25℃时,0.1?mol/L盐酸溶液,pH=1,由水电离出的c(H+)?=?c(OH-)=1.0×10-13mol/L???? 第五章 习 题 答 案 5-10 某二组元液体混合物在恒定T 及p 下的焓可用下式表示: )(2121211025450300x x x x x x H +++= 式中H 单位为1mol J -?。试确定在该温度、压力状态下 (1)用1x 表示的1H 和2H ; (2)纯组分焓1H 和2H 的数值; (3)无限稀释下液体的偏摩尔焓∞1H 和∞ 2H 的数值。 解:(1)已知 )1025(450300212121x x x x x x H +++= (A ) 由于 211x x -= 故 )1025(450300212121x x x x x x H +++= )]1(1025)[1()1(450300111111x x x x x x -+-+-+= 31 211155140450x x x -+-= (B ) 根据 P T x H x H H ???-+=))( 1(1 1 P T x H x H H ???-=)( 1 12 其中 211.1 4510140)( x x x H P T -+-=?? 则:)4510140)(1(1551404502 1113 12 111x x x x x x H -+--+-+-= 3 1211305010310x x x +-+= (C ) )4510140(1551404502 111312112x x x x x x H -+---+-= 3 121305450x x +-= (D) (2) 将11=x 及01=x 分别代入式(B ),得纯组元的焓1H 和2H 11m ol J 300-?=H 12m ol J 450-?=H (3)∞1H 和∞2H 是指在01=x 及11=x 时的1H 和2H 的极限值。 电解质溶液知识点总结 一、电解质和非电解质 电解质:在水溶液里或熔融状态下能导电的化合物。 非电解质:在水溶液里和熔融状态下都不能导电的化合物。 【注意】 1.电解质和非电解质的范畴都是化合物,所以单质既不是电解质也不是非电解质。 2.化合物为电解质,其本质是自身能电离出离子,有些物质溶于水时所得溶液也能导电,但这些物质自身不电离,而是生成了一些电解质,则这些物质不属于电解质。如:SO 2、SO 3、CO 2、NO 2等。 3.常见电解质的范围:酸、碱、盐、金属氧化物、水。 二.强电解质和弱电解质 强电解质:在溶液中能够全部电离的电解质。则强电解质溶液中不存在电离平衡。 弱电解质:在溶液中只是部分电离的电解质。则弱电解质溶液中存在电离平衡。 强电解质 弱电解质 定义 溶于水后几乎完全电离的电解质 溶于水后只有部分电离的电解质 化合物类型 离子化合物及具有强极性键的 共价化合物 某些具有弱极性键的共价化合物。 电离程度 几乎100%完全电离 只有部分电离 电离过程 不可逆过程,无电离平衡 可逆过程,存在电离平衡 溶液中存在的微粒(水分子不计) 只有电离出的阴阳离子,不存在 电解质分子 既有电离出的阴阳离子,又有电解质分子 实例 绝大多数的盐(包括难溶性盐) 强酸:H 2SO 4、HCl 、HClO 4等强碱:Ba (OH )2 Ca (OH )2等 弱酸:H 2CO 3 、CH 3COOH 等。 弱碱:NH 3·H 2O 、Cu (OH )2 Fe (OH )3等。 电离方程式 KNO 3→K ++NO 3— H 2SO 4→2 H + +SO 42— NH 3·H 2O NH 4++OH _ H 2S H + +HS _ HS _ H + +S 2- 【注意】 1.强、弱电解质的范围: 强电解质:强酸、强碱、绝大多数盐 弱电解质:弱酸、弱碱、水 2.强、弱电解质与溶解性的关系: 电解质的强弱取决于电解质在水溶液中是否完全电离,与溶解度的大小无关。一些难溶的电解质,但溶解的部分能全部电离,则仍属强电解质。如:BaSO 4、BaCO 3等。 3.强、弱电解质与溶液导电性的关系: 溶液的导电性强弱与溶液中的离子浓度大小有关。强电解质溶液的导电性不一定强,如很稀的强电解质溶液,其离子浓度很小,导电性很弱。而弱电解质溶液的导电性不一定弱,如较浓的弱电解质溶液,其电离出的离子浓度可以较大,导电性可以较强。 强电解质与弱电解质 课型:新课 授课班级:护理班 教学目标: 1.知识和技能: ①认识电解质和非电解质的概念; ②认识强、弱电解质的概念; ③认识弱电解质在溶液中存在电离平衡,掌握弱电解质电离方程式的书写。 2.过程和方法: 通过实验,培养学生观察、分析能力;掌握推理、归纳、演绎和类比等科学方法。 3.情感、态度、价值观: 运用教材对学生适时地进行辩证唯物主义教育,以及普遍性与特殊性的教育。 教学重点、:对强、弱电解质的理解 教学难点:对强、弱电解质概念的理解 教学方法: 采用实验、分析、讨论、演绎和归纳的综合教学方法,引导学生自主学习。 教学过程: A 导入新课 通过实际生活中的漫画图片引出电解质溶液可以导电,通过做习题复习初中学过的有关电解 质的知识,引导学生讨论电解质与非电解质概念。 电解质:在水溶液中或熔融状态下能够导电的化合物。 非电解质: 在水溶液中和熔融状态下都不能导电的化合物。 练一练: 下列物质中 ①NaCl溶液②NaOH ③H2SO4 ④Cu ⑤CH3COOH ⑥NH3·H2O ⑦CO2⑧乙醇⑨H2O 属于电解质的有: ②③⑤⑥⑨ 属于非电解质的有: ⑦⑧ 多媒体展示:电解质图片 问题:电解质的导电能力是否相等呢? 新课教学 演示实验4-1:学生观察实验现象,记录实验结果,小组内进行讨论,归纳总结出实验结论。 在5个烧杯中分别装有等体积的0.5mol/L的盐酸、氢氧化钠、氯化钠、醋酸、氨水溶液进行 导电性实验,观察灯泡发光的明亮程度。 实验结果:灯泡明暗程度不一样。盐酸、氢氧化钠、氯化钠溶液导电时灯泡较为明亮,醋酸、 氨水溶液导电时灯泡较暗。 结论:浓度相同的不同电解质在溶液里电离的程度是不同的。 (一)强电解质 在水溶液里能全部电离成阴、阳离子的电解质称为强电解质。 例如:NaOH = Na+ + OH-或NaOH→Na+ + OH- HCl = H++Cl-或HCl →H++Cl- 常见的强电解质 (1)强酸: 如HCl、H2SO4、HNO3、HClO4、HBr、HI等浙江省衢州市仲尼中学高二化学《强电解质与弱电解质》教案2
高中常见的强电解质和弱电解质
高考电解质溶液知识点总结
最新强电解质与弱电解质
高中化学复习考点知识专题训练27---强电解质与弱电解质(含答案解析0
1.下列属于强电解质的是( )
A.硫酸钡
B.食盐水
C.二氧化硅
D.醋酸
2.水是生命之源,2014 年我国科学家汽次拍摄到水分子团簇的空间取向图像,模型见 图。 下列关于水的说法正确的是( )
A.水是弱电解质
B.可燃冰是可以燃烧的水
C.氢氧两种元素只能组成水
D.0 ℃时冰的密度比液态水的密度大
3.为防止流感病毒的传播,许多公共场所都注意环境消毒,以下消毒药品属于强电解 质的是 ( )
1 / 23
B.
C.
D.
4.下列事实能说明醋酸是弱电解质的是( )
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸稀溶液中存在醋酸分子;
④常温下,0.1mol/L 醋酸的 pH 比 0.1mol/L 盐酸的 pH 大;
⑤醋酸能和碳酸钙反应放出 CO2;
⑥0.1mol/L 醋酸钠溶液 pH=8.9;
⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生 H2 速率慢
⑧pH=a 的溶液的物质的量浓度等于 pH=a+1 的溶液的物质的量浓度的 10 倍
A.③④⑥⑦
B.③④⑤⑥
C.②⑥⑦⑧
D.③④⑦⑧
5.第三周期元素,浓度均为 0.01mol/L 的最高价氧化物对应水化物的 pH 与原子半径的 关系如图所示:
2 / 23
-1
A.0.1mol·L 的 CH3COOH 溶液的 pH=2 B.CH3COOH 溶液中含有 CH3COOH 分子 C.CH3COOH 能与 NaOH 发生中和反应
D.常温下 CH3COONa 溶液的 pH=8
-1
+
-3
-1
7.常温下,0.1mol·L HA 溶液中 c(H )=10 mol·L ,下列说法中正确的是( )
A.HA 是一种强酸
B.相同浓度的 HCl 溶液与 HA 溶液,后者的导电能力更强
3 / 23常见的强电解质
第五章 习题答案
电解质溶液知识点总结(学生版)
《强电解质和弱电解质》电子教案
