氨基酸概述

第三节氨基酸
氨基酸是一类具有特殊重要意义的化合物。因为它们中许多是与生命活动密切相关的蛋白质的基本组成单位,是人体必不可少的物质,有些则直接用作药物。
α-氨基酸是蛋白质的基本组成单位。蛋白质在酸、碱或酶的作用下,能逐步水解成比较简单的分子,最终产物是各种不同的α-氨基酸。水解过程可表示如下:
蛋白质→月示→胨→多肽→二肽→α-氨基酸
由蛋白质水解所得到的α-氨基酸共有20多种,各种蛋白质中所含氨基酸的种类和数量都各不相同。有些氨基酸在人体内不能合成,只能依靠食物供给,这种氨基酸叫做必需氨基酸(见表18-3,*)。
一、氨基酸的构造、构型及分类、命名
(一)氨基酸的构造和构型
分子中含有氨基和羧基的化合物,叫做氨基酸。
由蛋白质水解所得到的α-氨基酸,可用通式表示如下:
除甘氨酸(R=H)外,所有α-氨基酸中的α碳原子均是手性碳,故有D型与L型两种构型。天然氨基酸均为L-氨基酸。
L-氨基酸
(二)α-氨基酸的分类和命名
氨基酸有脂肪族氨基酸、芳香族氨基酸和杂环氨基酸。
在α-氨基酸分子中可以含多个氨基和多个羧基,而且氨基和羧基的数目不一定相等。因此,天然存在的α-氨基酸常根据其分子中所含氨基和羧基的数目分为中性氨基酸、碱性氨基酸和酸性氨基酸。所谓中性氨基酸是指分子中氨基和羧基的数目相等的一类氨基酸。但氨基的碱性和羧基的酸性不是完全相当的,所以它们并不是真正中性的物质,只能说它们近乎中性。分子中氨基的数目多于羧基时呈现碱性,称为碱性氨基酸;反之,氨基的数目少于羧基时呈现酸性,称为酸性氨基酸。
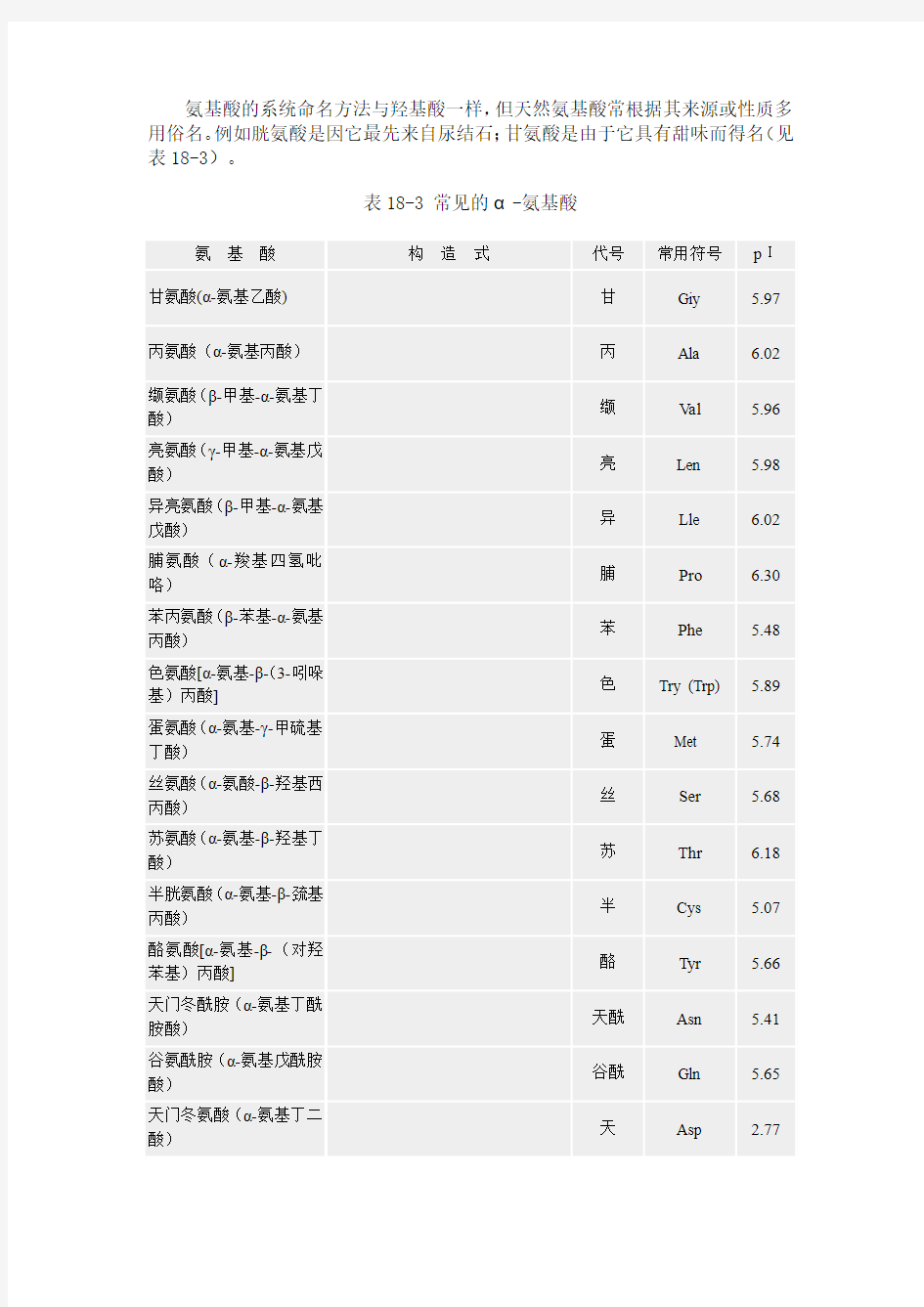
氨基酸的系统命名方法与羟基酸一样,但天然氨基酸常根据其来源或性质多用俗名。例如胱氨酸是因它最先来自尿结石;甘氨酸是由于它具有甜味而得名(见表18-3)。
表18-3 常见的α-氨基酸
二、氨基酸的性质>
α-氨基酸都是无色晶体,熔点一般都较高(常在230-300℃之间),熔融时即分解放出二氧化碳。
α-氨基酸都能溶于酸性或碱性溶液中,但难溶于乙醚等有机溶剂。在纯水中各种氨基酸的溶解度差异较大,加乙醇能使许多氨基酸从水溶液中沉淀析出。
(二)化学性质
氨基酸分子内既含有氨基又含有羧基,因此它们具有氨基和羧基的典型性质。但是,由于两种官能团在分子内的相互影响,又具有一些特殊的性质。
1.两性
氨基酸分子中既有碱性-NH2和酸性-COOH,与强酸或强碱都能作用生成盐,因此氨基酸为两性化合物。
同时,在同一分子内,氨基和羧基也可作用生成盐,这种盐叫内盐。
氨基酸在纯水溶液及固态时都以内盐的形式存在。在一般情况下,氨基酸中羧基的电离程度和氨基的电离程度并不相等。因此纯净氨基酸的水溶液并不一定是中性。在中性氨基酸溶液中,由于羧基的电离程度稍大于氨基的电离度,故它的水溶液的PH值一般略小于7。酸性氨基酸水溶液的PH值小于7;碱性氨基酸水溶液的PH值则大于7。但须注意,无论是何种α-氨基酸,其水溶液中两性离
子都占绝对多数。
2.等电点
若将氨基酸的水溶液酸化,则两性离子与H+结合而成阳离子,若加碱于氨基酸的水溶液中,则两性离子中氮原子上的一个氢离子与OH-结合成水,而两性离子变成阴离子。
若将氨基酸水溶液的酸碱度加以适当调节,可使羧基与氨基的电离程度相等,也就是氨基酸带有正、负电荷数目恰好相同,此时溶液的PH值称为该氨基酸的等电点,以PI表示。由于各种氨基酸分子中所含基团不同,所以每一个氨基酸中氨基和羧基的电离程度各异,因此不同的氨基酸等电点亦不同(表18-3)。中性氨基酸的等电点一般在5.0-6.5之间;酸性氨基酸为2.7-3.2,碱性氨基酸为9.5-10.7。
如果在不同的PH值的氨基酸溶液中通以直流电,当PH>PI(到一定程度)时,由于氨基酸主要以阴离子存在,它们就向阳极移动;若PH<PI(到一定程度)时,因氨基酸主要以阳离子存在,则它们就向阳极移动;如果PH=PI,则不发生电泳,因为这时的氨基酸主要以两性离子存在,其净电荷为零,故在电场中不会向任何一极移动。所以,电泳是可以用来分离子或鉴定氨基酸、蛋白质等的混合物的一种技术,也可作为医学诊断的手段。
3.脱水生成肽
两分子α-氨基酸(相同或不同)可借一个分子中的羧基和另一分子中的氨基脱去一分子水,缩合成为一个简单的肽,即二肽。
二肽分子中含有的酰胺键叫做肽键。二肽分子中的末其端
仍含有自由的氨基和羧基,因此还可以继续与氨基酸缩合成为三肽、四肽以至多肽。
多肽
多肽类物质在天然界中存在很多,它们在生物体中起着各种不同的作用。例如,存在于大部分细胞中的谷胱甘肽(三肽),参与细胞的氧化还原过程。
4.脱羧作用
某些氨基酸在一定条件下,可脱去羧基,生成相应的胺。
脱羧反应是人体内氨基酸代谢的形式之一,例如在肠道细菌作用下,组氨酸
可脱羧生成组胺。
脱羧反应也可在蛋白质腐败时发生。例如在某些细菌作用下,蛋白质中的赖
氨酸可变成毒性很强的尸胺(戊二胺)。
5.与亚硝酸的反应
氨基酸中的氨基具有伯胺的性质,与亚硝酸作用时生成羟基酸,同时定量的放出氮气。
6.与茚三酮的显色反应
α-氨基酸与茚三酮的水合物在水溶液中加热时,生成蓝紫色或紫色化合物,同时产生醛、二氧化碳和氨。这个反应非常灵敏,是鉴定氨基酸最迅速、最简单的方法,常用于α-氨基酸的比色测定或纸层析、薄层层析时的显色。
多肽和蛋白质也有此显色反应。
生物信息学复习题及答案
生物信息学复习题 名词解释 1. Homology (同源):来源于共同祖先的序列相似的序列及同源序列。序列相似序列并不一定是同源序列。 (直系同源):指由于物种形成的特殊事件来自一个共同祖先的不同物种中的同源序列,它们具有相似的功能。 (旁系(并系)同源):指同一个物种中具有共同祖先,通过基因复制产生的一组基因,这些基因在功能上的可能发生了改变。基因复制事件是促进新基因进化的重要推动力。 (异同源):通过横向转移,来源于共生或病毒侵染而产生的相似的序列,为异同源。 Score:The sum of the number of identical matches and conservative (high scoring) substitutions in a sequence alignment divided by the total number of aligned sequence characters. Gap总是不计入总数中。 6.点矩阵(dot matrix):构建一个二维矩阵,其X轴是一条序列,Y轴是另一个序列,然后在2个序列相同碱基的对应位置(x,y)加点,如果两条序列完全相同则会形成一条主对角线,如果两条序列相似则会出现一条或者几条直线;如果完全没有相似性则不能连成直线。 7. E值:得分大于等于某个分值S的不同的比对的数目在随机的数据库搜索中发生的可能性。衡量序列之间相似性是否显著的期望值。E值大小说明了可以找到与查询序列(query)相匹配的随机或无关序列的概率,E值越小意味着序列的相似性偶然发生的机会越小,也即相似性越能反映真实的生物学意义,E值越接近零,越不可能找到其他匹配序列。 值:得分为所要求的分值比对或更好的比对随机发生的概率。它是将观测得到的比对得分S,与同样长度和组成的随机序列作为查询序列进行数据库搜索进行比较得到的HSP(高分片段对)得分的期望分布联系起来计算的。通常使用低于来定义统计的显著性。P=1-e-E 9.打分矩阵(scoring matrix):在相似性检索中对序列两两比对的质量评估方法。包括基于理论(如考虑核酸和氨基酸之间的类似性)和实际进化距离(如PAM)两类方法,是序列相似性分析的基础,其不同的选择将会出现不同的分析结果。 10.空位(gap):在序列比对时,由于序列长度不同,需要插入一个或几个位点以取得最佳比对结果,这样在其中一序列上产生中断现象,这些中断的位点称为空位。 :美国国家生物技术信息学中心,属于美国国立医学图书馆的一部分,具有BLAST, Entrez ,GenBank等工具,还具有PubMed文献数据库。另外还具有Genome, dbEST, dbGSS , dbSTS, MMDB, OMIM, UniGene, Taxonomy, RefSeq, etc. 序列格式:是将DNA或者蛋白质序列表示为一个带有大于号(>)开始的核苷酸或者氨基酸序列的新文件,其中大于号后可以跟上序列的相关信息,其他无特殊要求。 13genbank序列格式:是GenBank 数据库的基本信息单位,是最为广泛的生物信息学序列格式之一。该文件格式按域划分为4个部分:第一部分包含整个记录的信息(描述符);第二部分包含注释,主要包含生物功能或数据库信息;第三部分是feature,对序列的注释;第四部分是序列本身,以“统发生树(Phylogenetic tree )是研究生物进化和系统发育过程中的一种用树状分支图来概括各种生物之间亲缘关系,是一种亲缘分支分类方法。在树中,每个节点代表其各分支的最近共同祖先,而节点间的线段长度对应演化距离(如估计的演化时间)。是用来研究物种进化与多样性的基础,是相近物种相关生物学数据的来源。17.基因树与物种树:物种树反映一组物种进化历程的系统树,其中每一个内部节点就代表一个物种形成的过程,而基因树则是代表来源于不同物种的单个同源基因的差异构建的系统树,而其内部的一个节点则代表一个祖先基因分化为两个新的独特的基因序列的事件。基因
知识点总结:蛋白质及氨基酸生化基础
蛋白质 ▲蛋白质的化学知识 历史 1.1838, Mulder发现了组成生物体的复杂含氮物。 2.1902, Fischer, Hofmeister同时提出肽键理论。(Nobel,1902) 3.1950, Pauling提出蛋白质的二级结构的基本单位:α-螺旋和β-折叠,肽键6个原子在同一平面。(Nobel, 1954) 4.1953, Sanger确定了牛胰岛素一级结构。(Nobel,1958) 5.1961, Anfinsen证明蛋白质的一级结构决定其三级结构, 利用核糖核酸酶的变性和复性 20种氨基酸–一级氨基酸, Primary amino acid ?缩写 丙氨酸(Ala),缬氨酸(Val),亮氨酸(Leu),异亮氨酸(Ile),脯氨酸(Pro),苯丙氨酸(Phe),色氨酸(Trp),蛋氨酸/甲硫氨酸(Met),甘氨酸(Gly),丝氨酸(Ser),苏氨酸(Thr),半胱氨酸(Cys),酪氨酸(Tyr),天冬酰胺(Asn),谷氨酰胺(Gln),赖氨酸(Lys),精氨酸(Arg),组氨酸(His),天冬氨酸(Asp),谷氨酸(Glu) 口诀: ?分类及特性: ?非极性,通过疏水作用稳定蛋白质的结构, Met, Val, Ala, Gly, Ile, Leu ?芳香族氨基酸,相对非极性,都能参与疏水作用。Trp, Try, Phe ?极性不带电:水中溶解度较大或更加亲水,可以与水形成氢键。Ser, Thr, Cry, Asn, Gln, Pro ?植物受到逆境条件的危害,积累Pro。积累一定量的溶质降低水势。Pro主要以游离状态广泛存在于植物中,水溶性最大的氨基酸,具有较强的水和能力。Pro大量积累,含量甚至高达百倍以上。 ?带正电和的三个碱性氨基酸,最为亲水,侧链上有第二个氨基,Arg有带正电的胍基,His有可带电的咪唑基。Lys ?旋光性与手性原子上的构型没有确定的关系。 ?氨基酸的理化性质 ?一般物理性质:无色晶体,熔点较高,溶解度各不同,在紫外有特征吸收的仅三个芳香族的氨基酸Trp、Tyr、Phe。测定280nm处的紫外吸收值。 ?两性电解质:同一氨基酸分子上可以同时解离携带正电荷和负电荷,被称为两性电解质ampholyte。氨基和羧基在不同的PH条件下表现出不同的解离状态。电荷总量为零时(净电荷为零),溶液的PH值为等电点 isoelectric point, pI. ? -氨基参与的反应 ?与亚硝酸反应(Van Slyke 定氮) ?与甲醛发生羟甲基化反应,直接测定氨基酸浓度。 ?烃基化反应(DNFB)法,二硝基氟苯法,桑格反应,Sanger reaction, 鉴定多肽N端氨基酸的重要方法 ?烃基化反应(PITC)法。Edman氨基酸顺序分析法。N端测序,苯异硫氰酸酯。能够不断重复循环,将肽链N端氨基酸逐一进行标记和解离。 ?酰基化反应(丹磺酰氯法),N端测序,丹磺酰-氨基酸有很强的荧光性质,DNS-Cl
氨基酸对农作物的作用
氨基酸对农作物的作用 随科学技术的创新,化学家们让氨基酸登上农业的历史舞台,使它在无污染方面大显身手。氨基酸是蛋白质的基石,它们都含有一定量的氮素,正是农作物生长所必需的。把氨基酸制成的肥料,喷洒在农作物上,农作物像人吃了“补药”一样,茁壮成长,结出丰硕的果实;在蔬菜和瓜果上施用,也会使人得到满意的效果。日本科学家用脯氨酸万分之四的溶液喷洒到玉米上,玉米产量提高20%,只要它喷洒到水稻、黄瓜上,产量均提高15%。日本农业科技人员还将甘氨酸拌人无污染的磷、钾肥中,可增加农作物对磷、钾元素的吸收。甘氨酸本身也起到氮肥的作用美国科学家证明,甘氨酸对甘蔗的生长起特殊作用,如1亩地用85%的甘氨酸溶液0.2公斤洒喷,成熟时甘蔗的糖份可增加13%;此外,还可用谷氨酸钠溶液浸泡大豆种子,大豆生长旺盛,产量大增。氨基酸配成的农药功能十分良好。能起到植物“抗菌素”的作用。实践证明,直接使用各种氨基酸能有效地防、治农作物的各种疾病。如印度科学家辛格用低浓度的蛋氨酸喷在水稻上,防止了水稻腐根菌的侵害。同时蛋氨酸能杀灭黄瓜茎上的许多寄生病菌。日本科学家用万分之五浓度的DI一苏氨酸3O毫升喷于柠檬树上,有效地抵抗黑斑病。近年来许多国家的科学家研究发现把色氨酸、半胱氨酸、丙氨酸等喷洒于农作物上,都有抵抗和消灭农作物病菌的效果。氨基酸农药还有除草作用。根据近年统计,用氨基酸衍生物研究成功的除草剂,形成的专利已有100多个已形成一大类无污染的除草剂。七十年代初德国化学家合成了N—磷酸甲酯甘氨酸,在玉米和大豆田里试用表明,每亩只用1.5公斤就可消灭一切杂草。相继日本化学家合成一种广谱除草剂——硫代氨基酸,它可消灭一切杂草,而且对人畜无害。氨基酸农药可以灭虫或驱虫,例如南瓜子和使君子等药物作驱虫剂,现代化学家研究,其中有效成分就是氨基酸。80年代初美国科学家傲了一个试验,他用10%浓度的半胱氨酸和饱和蔗糖溶液拌合杀黄瓜蝇,20天后黄瓜蝇全部死亡。更有研究人员用4%的月桂酰肌氨酸杀灭体虱,两分钟后体虱全部死亡。氨基酸做成农药和化肥,从理论和实践上已知绝不会蛤环境、空气、水源、土壤造成污染,更不会使农产品(粮食、蔬菜、水果等)带有潜伏性的危害。在这知识创新、科技创新的时代里,农业生产无污染化已提到科技人员的面前,只有更新当前使用的化肥和农药。氨基酸的生理功能氨基酸通过肽键连接起来成为肽与蛋白质。氨基酸、肽与蛋白质均是有机生命体组织细胞的基本组成成分,对生命活动发挥着举足轻重的作用。某些氨基酸除可形成蛋白质外,还参与一些特殊的代谢反应,表现出某些重要特性。(1)赖氨酸赖氨酸为碱性必需氨基酸。由于谷物食品中的赖氨酸含量甚低,且在加工过程中易被破坏而缺乏,故称为第一限制性氨基酸。赖氨酸可以调节人体代谢平衡。赖文档冲亿季,好礼乐相随mini ipad移动硬盘拍立得百度书包氨酸为合成肉碱提供结构组分,而肉碱会促使细胞中脂肪酸的合成。往食物中添加少量的赖氨酸,可以刺激胃蛋白酶与胃酸的分泌,提高胃液分泌功效,起到增进食欲、促进幼儿生长与发育的作用。赖氨酸还能提高钙的吸收及其在体内的积累,加速骨骼生长。如缺乏赖氨酸,会造成胃液分沁不足而出现厌食、营养性贫血,致使中枢神经受阻、发育不良。赖氨酸在医药上还可作为利尿剂的辅助药物,治疗因血中氯化物减少而引起的铅中毒现象,还可与酸性药物(如水杨酸等)生成盐来减轻不良反应,与蛋氨酸合用则可抑制重症高血压病。单纯性疱疹病毒是引起唇疱疹、热病性疱疹与生殖器疱疹的原因,而其近属带状疱疹病毒是水痘、带状疱疹和传染性单核细胞增生症的致病者。印第安波波利斯Lilly研究室在1979年发表的研究表明,补充赖氨酸能加速疱疹感染的康复并抑制其复发。长期服用赖氨酸可拮抗另一个氨基酸――精氨酸,而精氨酸能促进疱疹病毒的生长。(2)蛋氨酸蛋氨酸是含硫必需氨基酸,与生物体内各种含硫化合物的代谢密切相关。当缺乏蛋氨酸时,会引起食欲减退、生长减缓或不增加体重、肾脏肿大和肝脏铁堆积等现象,最后导致肝坏死或纤维化。蛋氨酸还可利用其所带的甲基,对有毒物或药物进行甲基化而起到解毒
蛋白质与氨基酸的关系
一、蛋白质与氨基酸的关系 一般认为,动物蛋白质的营养实质上是氨基酸的营养。只有当组成蛋白质的各种氨基酸同时存在且按需求比例供给时,动物才能有效地合成蛋白质。饲粮中缺乏任何一种氨基酸,即使其他必需氨基酸含量充足, 体蛋白质合成也不能正常进行。同样,体蛋白合成潜力越大的动物(如高瘦肉型猪),对氨基酸的需求量就越高。 畜禽饲粮中必需氨基酸的需要量取决于饲粮中的粗蛋白水平。例如, 仔猪饲粮中蛋白质含量由10%增至22%时, 饲粮赖氨酸的需要量则从0.6 % 增至1.2 % 。另一方面,饲粮粗蛋白质需要量取决于氨基酸的平衡状况。一般而言,依次平衡第一至第四限制性氨基酸后,饲粮的粗蛋白质需要量可降低2-4个百分点。 二、氨基酸间的相互关系 组成蛋白质的各种氨基酸在机体代谢过程中, 亦存在协同、转化、替代和拮抗等关系。 蛋氨酸可转化为胱氨酸,也可能转化为半胱氨酸, 但其逆反应均不能进行。因此, 蛋氨酸能满足总含硫氨基酸的需要, 但是蛋氨酸本身的需要量只能由蛋氨酸满足。半胱氨酸和胱氨酸间则可以互变。苯丙氨酸能满足酪氨酸的需要, 因为它能转化为酪氨酸, 但酪氨酸不能转化为苯丙氨酸。由于上述关系,在考虑必需氨基酸的需要时, 可将蛋氨酸与胱氨酸、苯丙氨酸与酪氨酸合并计算。 氨基酸间的拮抗作用发生在结构相似的氨基酸间, 因为它们在吸收过程中共用同一转移系统, 存在相互竞争。最典型的具有拮抗作用的氨基酸是赖氨酸和精氨酸。饲粮中赖氨酸过量会增加精氨酸的需要量。当雏鸡饲粮中赖氨酸过量时, 添加精氨酸可缓解由于赖氨酸过量所引起的失衡现象。亮氨酸与异亮氨酸因化学结构相似, 也有拮抗作用。亮氨酸过多可降低异亮氨酸的吸收率, 使尿中异亮氨酸排出量增加。此外, 精氨酸和甘氨酸可消除由于其他氨基酸过量所造成的有害作用, 这种作用可能与它们参加尿酸的形成有关。 一、蛋白质与氨基酸的关系 一般认为,动物蛋白质的营养实质上是氨基酸的营养。只有当组成蛋白质的各种氨基酸同时存在且按需求比例供给时,动物才能有效地合成蛋白质。饲粮中缺乏任何一种氨基酸,即使其他必需氨基酸含量充足, 体蛋白质合成也不能正常进行。同样,体蛋白合成潜力越大的动物(如高瘦肉型猪),对氨基酸的需求量就越高。 畜禽饲粮中必需氨基酸的需要量取决于饲粮中的粗蛋白水平。例如, 仔猪饲粮中蛋白质含量由10%增至22%时, 饲粮赖氨酸的需要量则从0.6 % 增至1.2 % 。另一方面,饲粮粗蛋白质需要量取决于氨基酸的平衡状况。一般而言,依次平衡第一至第四限制性氨基酸后,饲粮的粗蛋白质需要量可降低2-4个百分点。 二、氨基酸间的相互关系 组成蛋白质的各种氨基酸在机体代谢过程中, 亦存在协同、转化、替代和拮抗等关系。 蛋氨酸可转化为胱氨酸,也可能转化为半胱氨酸, 但其逆反应均不能进行。因此, 蛋氨酸能满足总含硫氨基酸的需要, 但是蛋氨酸本身的需要量只能由蛋氨酸满足。半胱氨酸和胱氨酸间则可以互变。苯丙氨酸能满足酪氨酸的需要, 因为它能转化为酪氨酸, 但酪氨酸不能转化为苯丙氨酸。由于上述关系,在考虑必需氨基酸的需要时, 可将蛋氨酸与胱氨酸、苯丙氨酸与酪氨酸合并计算。 氨基酸间的拮抗作用发生在结构相似的氨基酸间, 因为它们在吸收过程中共用同一转移系统, 存在相互竞争。最典型的具有拮抗作用的氨基酸是赖氨酸和精氨酸。饲粮中赖氨酸过量会增加精氨酸的需要量。当雏鸡饲粮中赖氨酸过量时, 添加精氨酸可缓解由于赖氨酸过量所引起的失衡现象。亮氨酸与异亮氨酸因化学结构相似, 也有拮抗作用。亮氨酸过多可降
氨基酸用途说明
甘氨酸 产品描述: 分子式C2H5NO2 性状白色斜晶系或六方晶系晶体,或结晶性粉末。无臭,有特殊甜味,味觉阈值0.13%。熔点232-236度。(产生气体并分解)。水溶液呈微酸性(PH值5.5-7.0).易溶于水(25g/100ml,25度).极难溶于乙醇(0.06g/100g无水乙醇).不溶于丙酮、乙醚等有机溶剂。 用途1 调味与丙氨酸合用于含醇饮料,添加量:葡萄酒0.4%,威士忌酒0.2%,香槟酒1.0%。其他如粉末汤料约添加2%;酒糟腌的食品1%。由于其能一定程度呈虾、墨鱼味,可用于调味酱。 2 对枯草杆菌及大肠杆菌的繁殖有一定抑制作用。故可用于鱼糜制品、花生酱等的防腐剂。添加量1%-2%。 3 缓冲作用因甘氨酸为具有氨基和羧基的两性离子,故有很强的缓冲性。对食盐和醋等的味感能起缓冲作用。添加量为盐腌品的0.3%-0.7%,酸渍品0.05%-0.5%。 4 抗氧化作用(利用其金属螯合作用)添加于奶油、干酪、人造奶油、牛乳制品等可延长保存期3-4倍。为使焙烤食品中的猪油稳定,可添加葡萄糖2.5%和甘氨酸0.5%。速煮面用的小麦粉中添加0.1%-0.5%,同时可起调味作用。 医药上用作制酸剂(胃酸过多症)、肌肉营养失调治疗剂、解毒剂等。亦为苏氨酸等氨基酸的合成原料。 5 按我国GB2760-96规定可用作香料。 DL-丙氨酸 产品描述: 分子式C3H7NO2 性状无色至白色无臭针状结晶或结晶性粉末。有甜味。味觉阈值在0.06%.由水-乙醇液重结晶者为斜方晶系,由水重结晶者为针状结晶或结晶性粉末.5%水溶液的PH值5.5-7.0.约为295-300度熔化并分解.化学性质稳定.遇亚硝酸可转化为L-乳酸.易溶于水(16.72g/100ml,25度).微溶于乙醇.无旋光性. 用途营养增补剂。调味料,包括下述若干方面。 1.增强化学调味料的调味效果2.改善人工甜味剂的味感3.改善有机酸的酸味4.提高腌制效果5.提高含醇饮料的质量6.防止油类氧化7.改善浸渍品的风味8.合成清酒的调味料 L-丙氨酸 产品描述: 分子式C3H7NO2 性状白色无臭结晶性粉末。有特殊甜味,甜度约为蔗糖的70%。200度以上开始升华,
氨基酸
氨基酸 氨基酸定义 氨基酸(amino acids):含有氨基和羧基的一类有机化合物的通称。生物功能大分子蛋白质的基本组成单位,是构成动物营养所需蛋白质的基本物质。是含有一个碱性氨基和一个酸性羧基的有机化合物,氨基一般连在α-碳上。 氨基酸的结构通式:构成蛋白质的氨基酸都是一类含有羧基并在与羧基相连的碳原子下连有氨基的有机化合物,目前自然界中尚未发现蛋白质中有氨基和羧基不连在同一个碳原子上的氨基酸。 氨基酸分类 天然的氨基酸现已经发现的有300多种,其中人体所需的氨基酸约有22种,分非必需氨基酸和必需氨基酸(人体无法自身合成)。另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。 1、必需氨基酸(essential amino acid):指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。共有8种其作用分别是: ①赖氨酸(Lysine ):促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化; ②色氨酸(Tryptophane):促进胃液及胰液的产生; ③苯丙氨酸(Phenylalanine):参与消除肾及膀胱功能的损耗; ④蛋氨酸(又叫甲硫氨酸)(Methionine);参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能; ⑤苏氨酸(Threonine):有转变某些氨基酸达到平衡的功能; ⑥异亮氨酸(Isoleucine ):参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺; ⑦亮氨酸(Leucine ):作用平衡异亮氨酸; ⑧缬氨酸(Viline):作用于黄体、乳腺及卵巢。 其理化特性大致有: 1)都是无色结晶。熔点约在230°C以上,大多没有确切的熔点,熔融时分解并放出CO2;都能溶于强酸和强碱溶液中,除胱氨酸、酪氨酸、二碘甲状腺素外,均溶于水;除脯氨酸和羟脯氨酸外,均难溶于乙醇和乙醚。 2)有碱性[二元氨基一元羧酸,例如赖氨酸(lysine)];酸性[一元氨基二元羧酸,例如谷氨酸(Glutamic acid)];中性[一元氨基一元羧酸,例如丙氨酸(Alanine)]
多肽定量构效关系与分子设计
多肽定量构效关系与分子设计 丁俊杰 丁晓琴3 赵立峰 陈冀胜 (北京药物化学研究所 北京102205) 摘 要 综述了多肽定量构效关系和计算机辅助多肽分子设计方法的最新进展,重点介绍了多肽定量 构效关系研究中的化学结构定量描述符和建立数学模型的统计方法,并对模拟肽学和虚拟组合多肽库在多肽分子设计中的应用进行了简要的论述。 关键词 多肽定量构效关系 遗传算法 人工神经网络 模拟肽学 虚拟组合多肽库中图分类号:Q516;O641 文献标识码:A 文章编号:10052281X (2005)0120130207 The Polypeptide Q SAR and Computer 2Aided Molecular Design Ding Junjie Ding Xiaoqin 3 Zhao Lifeng Chen Jisheng (Beijing Institute of Pharmaceutial Chemistry ,Beijing 102205,China ) Abstract The advances in polypeptide QS AR and com puter 2aided m olecular design are reviewed.The chemical structure descriptors and statistical method of mathematical m odeling in the polypeptide QS AR study are introduced in de 2tail.The application of peptidomimetics and virtual combinatorial peptide library in the com puter 2aided polypeptide de 2sign are brielfly described. K ey w ords polypeptide QS AR ;genetic alg orithm ;artificial neural netw orks ;peptidomimetics ;virtual combina 2torial peptide library 收稿:2003年11月,收修改稿:2004年7月 3通讯联系人 e 2mail :dingxq @https://www.360docs.net/doc/1f10092545.html, 多肽是维持生命过程中必不可少的物质,由于它们具有高活性、高选择性以及副作用小等特点,现已逐渐成为药物研究的热点之一。对肽类药物的研究开发及先导化合物的发现,至今仍是一件耗资巨大但效率很低的工作。造成这种状况的一个主要原因就是缺乏深入的理论指导和先进的分子设计方法,因此迫切需要新的理论方法和多肽分子设计技术的出现。近年来,以各种理论计算方法和分子模拟技术为基础的计算机辅助分子设计,在各种肽类化合物的研究开发中得到了广泛的应用。利用计算机分子图形学、分子动力学和量子化学等进行构象分析,寻找多肽及类似物的药效团,进行二维和三维的定量构效关系(QS AR )研究,及应用各种分子设计方法,设计有较高活性的肽类和非肽模拟物,已成为国际上十分活跃的研究领域。 一、多肽的定量构效关系研究 在多肽类似物的研究和开发中,定量构效关系是一个重要的理论计算方法和常用手段。所谓多肽的QS AR ,就是用数学模式来表达多肽类似物的化学结构信息与特定的生物活性强度间的相互关系。多肽的QS AR 研究方法同其它药物的QS AR 研究方 法一样,基本上可分为以下5个步骤[1] :(1)选择和设计一系列多肽类似物;(2)类似物的化学结构的定量描述;(3)合成设计化合物并进行生物活性的测定;(4)建立数学模型,确定化学结构与生物活性之间的函数关系;(5)新类似物的活性预测以及新的高活性类似物的设计。近年来,多肽的QS AR 研究主要集中在如下两个方面:多肽的化学结构定量描述符的研究和建立QS AR 数学模型的统计方法。 第17卷第1期2005年1月 化 学 进 展 PROG RESS I N CHE MISTRY Vol.17No.1 Jan.,2005
最经典总结-组成蛋白质的氨基酸的结构及种类
考点一组成蛋白质的氨基酸及其种类(5年6考) 组成蛋白质的氨基酸的结构及种类 观察下列几种氨基酸的结构 (1)写出图中结构的名称 a.氨基; b.羧基。 (2)通过比较图中三种氨基酸,写出氨基酸的结构通式 (3)氨基酸的不同取决于R基的不同,图中三种氨基酸的R基依次为 (4)氨基酸的种类:约20种 ■助学巧记 巧记“8种必需氨基酸” 甲(甲硫氨酸)来(赖氨酸)写(缬氨酸)一(异亮氨酸)本(苯丙氨酸)亮(亮氨酸)色(色氨酸)书(苏氨酸) 注:评价蛋白质食品营养价值主要依据其必需氨基酸的种类和含量。
组成蛋白质的氨基酸的种类与结构 1.(海南卷)关于生物体内组成蛋白质的氨基酸的叙述,错误的是() A.分子量最大的氨基酸是甘氨酸 B.有些氨基酸不能在人体细胞中合成 C.氨基酸分子之间通过脱水缩合形成肽键 D.不同氨基酸之间的差异是由R基引起的 解析甘氨酸应是分子量最小的氨基酸,它的R基是最简单的氢。 答案 A 2.下图为氨基酸分子的结构通式,下列叙述正确的是() A.结构④在生物体内约有20种 B.氨基酸脱水缩合产生水,水中的氢来自于②和③ C.结构④中含有的氨基或羧基全部都参与脱水缩合 D.生物体内n个氨基酸形成一条多肽链需要n种密码子 解析①为氨基,③为羧基,④为侧链基团(R基)。构成人体氨基酸的种类约有20种,A正确;脱水缩合形成水,水中氢来自①③,B错误;R基中的氨基或羧基不参与脱水缩合,C错误;生物体内n个氨基酸形成一条多肽链需要n个密码子而不是需要n种密码子,D错误。 答案 A 解答本类题目的关键是熟记氨基酸的结构通式,如下图所示
找出氨基酸的共同体,即图中“不变部分”(连接在同一碳原子上的—NH2、—COOH和—H),剩下的部分即为R基。倘若找不到上述“不变部分”,则不属于构成蛋白质的氨基酸。
氨基酸口服液的功效和作用
氨基酸口服液的功效和作用 氨基酸口服液的功效和作用 1、消除疲劳、保持精力旺盛,改善亚健康状态。 现代人常常会为了工作、家庭而压力巨大,或者饮食、休息不科学,或者生活不规律,这些都会直接导致蛋白质消耗过度。氨基酸能从根本上补充人体营养,提高精力;特别是酪氨酸、色氨酸等,能缓解压力,避免沮丧、焦虑等状态,稳定情绪。 2、改善睡眠质量。 色氨酸是人体必需的氨基酸之一,具有神奇的促进睡眠的效果。色氨酸还能够稳定情绪、缓和焦躁及紧张情绪,素有"天然安眠药"的美誉。 3、提高免疫力。 氨基酸是构成人体免疫系统的基本材料。补充全面均衡的氨基酸,是提高人体免疫力的关键。 4、加快手术、创伤愈合。 人体在手术、创伤后,机体的代谢速度加快,支链氨基酸作为维持机体能量的主要来源被大量消耗。如果不及时补充,会严重影响康复速度。 5、补充大脑营养,提高注意力。 大脑处于疲劳状态时,蛋白质的消耗会引起精神不集中、记忆力减退等状况。长期而有规律的补充凯镛复合氨基酸口服液,
可以从根本上避免这种状况的发生,最大限度地提高学习效率。 6、保护肝脏。 精氨酸、天门冬氨酸等多种氨基酸可以起到保肝护肝的作用。 7、养血、生血、补血,治疗缺铁性贫血。 氨基酸对婴幼儿的作用 幼儿由于身体的免疫系统尚未发育完善,人体内抗体的合成能力较低,因此很容易感染各种疾病。而氨基酸口服液能够加快合成人体免疫球蛋白,从根本上提高免疫力,从而预防感冒、发烧、咳嗽等多种疾病。 1、氨基酸营养丰富,全面提供脑营养。 幼儿是生长发育的高峰期,大脑发育也正处于高峰期。此时如果大脑营养不足、不均衡,将会给孩子的成长带来障碍,记忆力低下、弱智、痴呆都有可能。经过科学家研究,发现大脑中的“记忆素”含有7种氨基酸,这7种氨基酸能持续高效补充大脑所需的营养,提供大脑基础的思维和记忆物质。 2、加速骨骼成长。 幼儿身体处于快速生长发育的阶段,对钙的需求量很大。但是,很少人知道,处于发育阶段的孩子补钙离不开氨基酸。氨基酸是人体内各种矿物质和微量元素的“搬运工”。人体在补充了钙、铁、锌、硒等各种矿物质和微量元素后,需要氨基酸和蛋白质将它们搬送到身体各处。如缺少氨基酸,这些微量元素和矿物质就不能被有效的送到人体的各个器官,依然会导致体内缺乏矿物质和微量元素。 3、提高免疫力。
构成蛋白质的氨基酸种类
构成蛋白质的氨基酸种类、分子量、功能和作用(一) 序号分类名称 缩写及 分子量 生理功能 必需氨基酸 1 赖氨酸Lys 146.13 促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化; 2 蛋氨酸 (甲硫氨酸) Met 149.15 参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能; 3 色氨酸 Trp 204.11 促进胃液及胰液的产生; 4 苯丙氨酸 Phe 165.09 参与消除肾及膀胱功能的损耗; 5 苏氨酸 Thr 119.18 有转变某些氨基酸达到平衡的功能; 6 异亮氨酸 Ile 131.11 参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺; 7 亮氨酸Leu 131.11 作用平衡异亮氨酸; 8 缬氨酸 Val 117.09 作用于黄体、乳腺及卵巢; 指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。成人必需氨基酸的需要量约为蛋白质需要量的20%~37%。 条件必需氨基酸 9 精氨酸Arg 174.4 它能促使氨转变成为尿素,从而降低血氨含量。它也是精子蛋白的主要成分,有促进精子生成,提供精子运动 能量的作用。 10 组氨酸 His 155.09 在组氨酸脱羧酶的作用下,组氨酸脱羧形成组胺。组胺具有很强的血管舒张作用,并与多种变态反应及发炎有 关。
人体虽能够合成,但通常不能满足正常的需要,因此,又被称为半必需氨基酸或条件必需氨基酸,在幼儿生长期这两种是必需氨基酸。人体对必需氨基酸的需要量随着年龄的增加而下降,成人比婴儿显著下降。(近年很多资料和教科书将组氨酸划入成人必需氨基酸) 构成蛋白质的氨基酸种类、分子量、功能和作用(二) 序号分类名称 分子量及缩 写 生理功能和作用 非必需氨基酸 11 丙氨酸Ala 89.06 预防肾结石、协助葡萄糖的代谢,有助缓和低血糖,改善身体能量。 12 脯氨酸Pro 115.08 脯氨酸是身体生产胶原蛋白和软骨所需的氨基酸。它保持肌肉和关节灵活,并有减少紫外线暴露和正常老化造 成皮肤下垂和起皱的作用。 13 甘氨酸Gly 75.05 在中枢神经系统,尤其是在脊椎里,甘氨酸是一个抑制性神经递质。 14 丝氨酸Ser 105.06 是脑等组织中的丝氨酸磷脂的组成部分,降低血液中的胆固醇浓度,防治高血压 15 半胱氨酸Cys 121.12 异物侵入时可强化生物体自身的防卫能力、调整生物体的防御机构。 16 酪氨酸 Tyr 181.09 是酪氨酸酶单酚酶功能的催化底物,是最终形成优黑素和褐黑素的主要原料。 17 天冬酰胺Asn 132.6 天冬酰胺有帮助神经系统维持适当情绪的作用,有时还有助于预防对声音和触觉的过度敏感,还有助于抵御疲 劳。 18 谷氨酰胺Gln 146.08 平衡体内氨的含量,谷酰胺的作用还包括建立免疫系统,加强大脑健康和消化功能 19 天冬氨酸Asp 133.6 它可作为K+、Mg+离子的载体向心肌输送电解质,从而改善心肌收缩功能,同时降低氧消耗,在冠状动脉循环 障碍缺氧时,对心肌有保护作用。它参与鸟氨酸循环,促进氧和二氧化碳生成尿素,降低血液中氮和二氧化碳 的量,增强肝脏功能,消除疲劳。 20 谷氨酸 Glu 147.08 参与脑的蛋白和塘代谢,促进氧化,改善中枢神经活动,有维持和促进脑细 胞功能的作用,促进智力的增加 指人(或其它脊椎动物)自己能由简单的前体合成,不需要从食物中获得的氨基酸。 备注:以上简单阐述了各种氨基酸在体内发挥的生理作用,没有阐述其药理和保健作用。以上分类是从营养学角度区分。
氨基酸概述
第三节氨基酸 氨基酸是一类具有特殊重要意义的化合物。因为它们中许多是与生命活动密切相关的蛋白质的基本组成单位,是人体必不可少的物质,有些则直接用作药物。 α-氨基酸是蛋白质的基本组成单位。蛋白质在酸、碱或酶的作用下,能逐步水解成比较简单的分子,最终产物是各种不同的α-氨基酸。水解过程可表示如下: 蛋白质→月示→胨→多肽→二肽→α-氨基酸 由蛋白质水解所得到的α-氨基酸共有20多种,各种蛋白质中所含氨基酸的种类和数量都各不相同。有些氨基酸在人体内不能合成,只能依靠食物供给,这种氨基酸叫做必需氨基酸(见表18-3,*)。 一、氨基酸的构造、构型及分类、命名 (一)氨基酸的构造和构型 分子中含有氨基和羧基的化合物,叫做氨基酸。 由蛋白质水解所得到的α-氨基酸,可用通式表示如下: 除甘氨酸(R=H)外,所有α-氨基酸中的α碳原子均是手性碳,故有D型与L型两种构型。天然氨基酸均为L-氨基酸。 L-氨基酸 (二)α-氨基酸的分类和命名 氨基酸有脂肪族氨基酸、芳香族氨基酸和杂环氨基酸。 在α-氨基酸分子中可以含多个氨基和多个羧基,而且氨基和羧基的数目不一定相等。因此,天然存在的α-氨基酸常根据其分子中所含氨基和羧基的数目分为中性氨基酸、碱性氨基酸和酸性氨基酸。所谓中性氨基酸是指分子中氨基和羧基的数目相等的一类氨基酸。但氨基的碱性和羧基的酸性不是完全相当的,所以它们并不是真正中性的物质,只能说它们近乎中性。分子中氨基的数目多于羧基时呈现碱性,称为碱性氨基酸;反之,氨基的数目少于羧基时呈现酸性,称为酸性氨基酸。
氨基酸的系统命名方法与羟基酸一样,但天然氨基酸常根据其来源或性质多用俗名。例如胱氨酸是因它最先来自尿结石;甘氨酸是由于它具有甜味而得名(见表18-3)。 表18-3 常见的α-氨基酸
CADD药物信息学基本知识
药物信息学初步 1药物信息学: a药物信息学是有关药物研究和开发过程中所涉及的大量小分子、大分子及其相互作用信息的学科。 b药物信息学,简单说来就是化学信息学和生物信息学的加和。 c也包括类药性、药物代谢动力学性质和毒性预测、药靶预测、高内涵筛选及代谢模型等综合信息在新药发现和发展中的整合、分析和应用。 2化学信息学与生物信息学 ?化学信息学(Chemoinformatics,Chemical Informatics),简而言之,一切与小分子化合物有关的计算机操作和运算都属于化学信息学的研究范畴,包括小分子的结构、构象、能量、性质等,也包括小分子与大分子的相互作用,还包括小分子的设计。 ?化学信息学的研究已有较长的历史,比如1960年代出现的QSAR,但作为学科名词1998年才首次出现。 ?与之相对的是生物信息学(Bioinformatics或Biological Informatics)。生物信息学是随着人类基因组计划的实施而出现的,最初仅是指对基因组序列的比较分析。但现在已发展到既对生物大分子的序列、也对生物大分子的结构、构象进行研究。针对生物大分子结构、功能等的计算研究,叫做计算生物学(Computational Biology)。 3 化学信息学在药物设计中的主要应用 ●虚拟组合化学库的设计; ●化合物数据库的相似性分析与多样性分析; ●化合物数据库的类药性分析、ADMET性质预测; ●化合物数据库的虚拟筛选; ●。。。 4 为什么要进行ADMET预测 ●ADMET是候选药物临床研究失败的主要原因(占60%)。 ●ADMET评估已成药物研发的关键,需尽早进行。 ●由于ADMET涉及药物体内过程,因此评估非常困难。 ●实验评价ADMET缺点:代价大、周期长,一般在临床前研究阶段才开始进行,且动物数据与人体数据并 不完全一致。 ●计算机预测ADMET优点:代价低、速度快,可以在化合物合成之前进行,也可以与先导物优化一起进行, 这样可将理论上具有不良ADMET性质的分子尽早排除,从而降低失败率。 5 ADMET预测的基本要求 ●要有大量可靠的实验数据供使用; ●要有合适的方式对分子结构进行表达; ●要有合适的建模方法及评价指标。 6 常规ADMET预测方法 ●分子结构采用分子描述符进行表达;分子描述符与性质之间采用统计回归分析方法建立预测模型。 ●存在的问题:分子描述符是间接描述分子,具有计算繁杂、数据可能不准确,数量众多而难以取舍,模型 可解释性差等问题。 7 基于子结构模式识别的ADMET预测方法 ●新方法:分子结构采用分子指纹进行表达;分子指纹与性质之间采用机器学习方法建立预测模型。 ●优点:跳过分子描述符而直接从分子结构出发来预测分子性质,提高了预测精度;采用信息增益技术识别 关键子结构,建立的模型具有可解释性;等等。 8生物信息学在药物设计中的应用 ●药物作用新靶标的发现与确证: ?人体内靶标 ?病原体内靶标 ●蛋白质序列比较、分析;蛋白质结构相似性比较、同源蛋白的识别。 ●蛋白质二级结构与三维结构的预测。 9 序列比对(sequence alignment) ●序列比对指将两个或多个序列排列在一起,标明其相似之处。序列中可以插入间隔(通常用短横线“-”表示)。
氨基酸滋味概述
氨基酸滋味概述 IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】
氨基酸滋味概述 2012级13班 孙雨辰 “凡是可以食用的东西,都有自己的味道。” ----------------《现代生物化学》 大米的香味与胱氨酸有关,啤酒的苦味与其存在有三个支链的氨基酸有关。 -----------------于自然P8 二十种必须氨基酸是指甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸这二十种组成人体蛋白质的氨基酸。 1.甘氨酸: 甘氨酸有独特的甜味,能缓和酸、碱味,掩盖食品中添加糖精的苦味并增强甜味。人体若摄入甘氨酸的量过多,不仅不能被人体吸收利用,而且会打破人体对氨基酸的吸收平衡而影响其它氨基酸的吸收,导致营养失衡而影响健康。以甘氨酸为主要原料生产的含乳饮料,对青少年及儿童的正常生长发育很容易带来不利影响。 2.丙氨酸: 预防肾结石、协助葡萄糖的代谢,有助缓和低血糖,改善身体能量。 用于合成新型甜味剂及某些手性药物中间体的原料。
3.缬氨酸: 本品为白色结晶或结晶性粉末;无臭,味微甜而后苦。 在水中溶解,在乙醇中几乎不溶。 4.亮氨酸: 亮氨酸一般多用于面包、面类制品。配制氨基酸输液及综合氨基酸制剂,降血糖剂,植物生长促进剂。可用作香料,可改善食品风味。 为白色结晶或结晶性粉末;无臭,味微苦。 5.异亮氨酸: 菱形叶片状或片状晶体,味苦。熔点:284摄氏度。 溶于水,微溶于乙醇。 6.苯丙氨酸: 常温下为白色结晶或结晶性粉末固体,减压升华,溶于水,难溶于甲醇、乙醇、乙醚。苯丙氨酸广泛用于医药和阿斯巴甜的主要原料。 7.脯氨酸: 白色结晶或结晶性粉末或无色针状结晶,含一个结晶水。微臭,味微甜。 8.色氨酸: 为白色或微黄色结晶或结晶性粉末;无臭,味微苦。水中微溶,在乙醇中极微溶解,在氯仿中不溶,在甲酸中易溶,在氢氧化钠试液
生物信息学
第一章 生物信息学:是现代生命科学与信息科学、计算机科学、数学、统计学、物理学和化学等相互渗透而形成的交叉学科。是应用计算机技术和信息论方法采集、储存、传递、检索、分析和解读蛋白质及核酸序列等各种生物信息,以帮助了解生物学和遗传学信息的科学. 基因组信息学是生物信息学的核心。 生物信息学研究的目标: 通过认识生命的起源,进化,遗传,和发育的本质,破译隐藏在DNA序列中的遗传语言,并揭示基因组信息结构的复杂性及遗传语言的根本规律,以及人体生理和病理过程的分子基础,为人类疾病的诊断,预防和治疗提供最合理且有效的方法和途径‘ 生物信息学研究内容: 1 生物信息的收集,储存,管理和提供 2 基因组序列信息的提取和分析 3 生物信息分析技术和方法的研究开发分析工具和实用软件 4 功能基因组相关信息分析 5 生物大分子结构模拟和药物模拟 第二章 表达序列标签(EST):是随机选取的cDNA克隆的部分序列,即一个EST就是对应于某一种mRNA的一个cDNA克隆的一段序列。一般长度为300-500bp,经一定方法定位后转变为STS。EST可用于全长基因的克隆、基因定位、基因表达、基因结构等的分析。 测序标签位点(STS):一段长度约200-300bp的特定的DNA序列,每个STS序列位点对于基因组中一个单独的位置。来源于EST序列和随机序列等。是由PCR方法确定的单拷贝序列。作图时,相当于一个路标。 蛋白质工程(protein engineering):运用蛋白质结构的详细信息、重组DNA技术,对蛋白质分子进行重新设计,从而定向的改造蛋白质的性质,使其具有人们希望的优良性质,甚至创造不存在的蛋白质。主要目的是通过改造编码蛋白质基因中的DNA顺序,或设计合成新的基因,经过宿主细胞的表达获得被改造了的新的蛋白质。 蛋白质组(proteome):对应于基因组的概念,指有一个细胞或一个组织的基因所表达的全部相应的蛋白质。蛋白质组是一个动态的概念:1、和基因不一样,不同组织和不同发育时期都不一样。2、基因在转录后,还有一系列修饰,翻译等过程都可以影响蛋白质的表达。因此通过对蛋白质组的研究,在此基础上更能阐明遗传、发育、进化、功能调控等基本生物学问题与人类健康和疾病相关的生物医学问题。
氨基酸分析
2.2.56氨基酸分析(1)(见注解) 氨基酸分析是指利用方法对蛋白质,多肽和其他药物制剂进行氨基酸组成或含量的分析。蛋白质和多肽一般是氨基酸残基以共价键的形式组成的线性大分子。蛋白质或多肽中氨基酸的序列决定了其分子的性质。蛋白质普遍是由大分子以折叠的方式形成的特定构象,而多肽则比较小,可能只有几个氨基酸组成。氨基酸分析方法可以用于对蛋白质和多肽的量化,基于氨基酸的组成来确定蛋白质或多肽的类型,支撑蛋白质和多肽的结构分析,评估碎片肽段,并检测可能存在于蛋白质或多肽中的不规则氨基酸。并且在氨基酸分析之前必须进行将蛋白质或多肽水解为个别氨基酸。伴随着蛋白质或多肽的水解,氨基酸分析的过程和其他药物制剂中氨基酸的游离是一致的。通常我们采用易于分析的方法来测定样品中的氨基酸成分。 设备 用于氨基酸分析方法通常是基于色谱分离氨基酸的方法设定的。当前的方法是利用自动化色谱仪进行分析。氨基酸分析仪通常是一个能够产生梯度的低压或高压的液相色谱仪,并在色谱柱上分离氨基酸。除非样品在柱前进行了衍生化,否则这些仪器必须具备柱后衍生化的能力。检测器使用的是紫外可见光检测器或荧光检测器。此外,还需具有一个记录仪器(例如,积分仪),用于转化检测到的信号及用于定量测定。而且,这些仪器是专门用于氨基酸分析使用的。 一般预防策施 在氨基酸分析中,分析师关注的一个重点是背景的污染。高纯度的试剂是必要的(例如,低纯度的盐酸的使用在分析中会产生甘氨酸污染)。分析试剂通常是每隔几周更换一次,并且仅使用HPLC级别的溶剂。所用试剂使用之前必须用过滤器将溶剂中可能潜在的微生物和外来材料污染过滤除去,保持溶剂贮存器出于密封状态,并且不可将氨基酸分析仪放置于光照条件下。 实验室的操作规范决定了氨基酸分析的质量。仪器应放置在实验室的空旷区域。保持实验室的卫生干净。根据维修计划,及时清洁和校准移液管,将移液吸头放置在相应的盒子中,分析师不得用手处理移液管。分析师需要穿戴一次性的乳胶手套或同等质量的其他手套。限制测试样品瓶开启和关闭的次数,因为飞灰可以提高甘氨酸,丝氨酸和丙氨酸的浓度。 良好的仪器状态是氨基酸分析结果可接受的一个关键步骤。在日常使
各种氨基酸的作用
天然的氨基酸现已经发现的有300多种,其中人体所需的氨基酸约有22种,分非必需氨基酸和必需氨基酸(人体无法自身合成)。另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。1、必需氨基酸(essential amino acid):指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。共有8种其作用分别是:①赖氨酸(Lysine ):促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化;②色氨酸(Tryptophan):促进胃液及胰液的产生;③苯丙氨酸(Phenylalanine):参与消除肾及膀胱功能的损耗; ④蛋氨酸(又叫甲硫氨酸)(Methionine);参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能;⑤苏氨酸(Threonine):有转变某些氨基酸达到平衡的功能;⑥异亮氨酸(Isoleucine ):参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺;⑦亮氨酸(Leucine ):作用平衡异亮氨酸;⑧缬氨酸(Valine):作用于黄体、乳腺及卵巢。8种人体必需氨基酸的记忆口诀①"借一两本蛋色书来" 谐音: 借(缬氨酸), 一(异亮氨酸),两(亮氨酸),本(苯丙氨酸),蛋(蛋氨酸),色(色氨酸),书(苏氨酸),来(赖氨酸). ②"笨蛋来宿舍,晾一晾鞋" 笨(苯丙氨酸)蛋(蛋氨酸)来(赖氨酸)宿(苏氨酸)舍(色氨酸),晾(亮氨酸)一晾(异亮氨酸)鞋(缬氨酸)③”携带一两本甲硫色书来”携(缬氨酸)带一(异亮氨酸)两(亮氨酸)本(苯丙氨酸)甲硫(甲硫氨酸)色(色氨酸)书(苏氨酸)来(赖氨酸) 其理化特性大致有:1)都是无色结晶。熔点约在230°C 以上,大多没有确切的熔点,熔融时分解并放出CO2;都能溶于强酸和强碱溶液中,除胱氨酸、酪氨酸、二碘甲状腺素外,均溶于水;除脯氨酸和羟脯氨酸外,均难溶于乙醇和乙醚。2)有碱性[二元氨基一元羧酸,例如赖氨酸(lysine)];酸性[一元氨基二元羧酸,例如谷氨酸(Glutamic acid)];中性[一元氨基一元羧酸,例如丙氨酸(Alanine)]三种类型。大多数氨基酸都呈显不同程度的酸性或碱性,呈显中性的较少。所以既能与酸结合成盐,也能与碱结合成盐。3)由于有不对称的碳原子,呈旋光性。同时由于空间的排列位置不同,又有两种构型:D型和L型,组成蛋白质的氨基酸,都属L型。由于以前氨基酸来源于蛋白质水解(现在大多为人工合成),而蛋白质水解所得的氨基酸均为α-氨基酸,所以在生化研究方面氨基酸通常指α-氨基酸。至于β、γ、δ……ω等的氨基酸在生化研究中用途较小,大都用于有机合成、石油化工、医疗等方面。氨基酸及其衍生物品种很多,大多性质稳定,要避光、干燥贮存。2、非必需氨基酸(nonessential amino acid):指人(或其它脊椎动物)自己能由简单的前体合成,不需要从食物中获得的氨基酸。例如甘氨酸、丙氨酸等氨基酸。1,2萘醌、4磺酸钠在碱性溶液深红色(检验α-氨基酸)肽键(peptide bond):一个氨基酸的羧基与另一个氨基酸的氨基缩合,除去一分子水形成的酰胺键。肽(peptide):两个或两个以上氨基通过肽键共价连接形成的聚合物。是氨基酸通过肽键相连的化合物,蛋白质不完全水解的产物也是肽。肽按其组成的氨基酸数目为2个、3个和4个等不同而分别称为二肽、三肽和四肽等,一般含10个以下氨基酸组成的称寡肽(oligopeptide),由10个以上氨基酸组成的称多肽(polypeptide),它们都简称为肽。肽链中的氨基酸已不是游离的氨基酸分子,因为其氨基和羧基在生成肽键中都被结合掉了,因此多肽和蛋白质分子中的氨基酸均称为氨基酸残基(amino acid residue)。多肽有开链肽和环状肽。在人体内主要是开链肽。开链肽具有一个游离的氨基末端和一个游离的羧基末端,分别保留有游离的α-氨基和α-羧基,故又称为多肽链的N端(氨基端)和C端(羧基端),书写时一般将N端写在分子的左边,并用(H)表示,并以此开始对多肽分子中的氨基酸残基依次编号,而将肽链的C端写在分子的右边,并用(OH)来表示。目前已有约20万种多肽和蛋白质分子中的肽段的氨基酸组成和排列顺序被测定了出来,其中不少是与医学关系密切的多肽,分别具有重要的生理功能或药理作用。多肽在体内具有广泛的分布与重要的生理功能。其中谷胱甘肽在红细胞中含量丰富,具有保护细胞膜结构及使细胞内酶蛋白处于还原、活性状态的功
