(完整word版)高中化学必修一知识网络结构图.doc
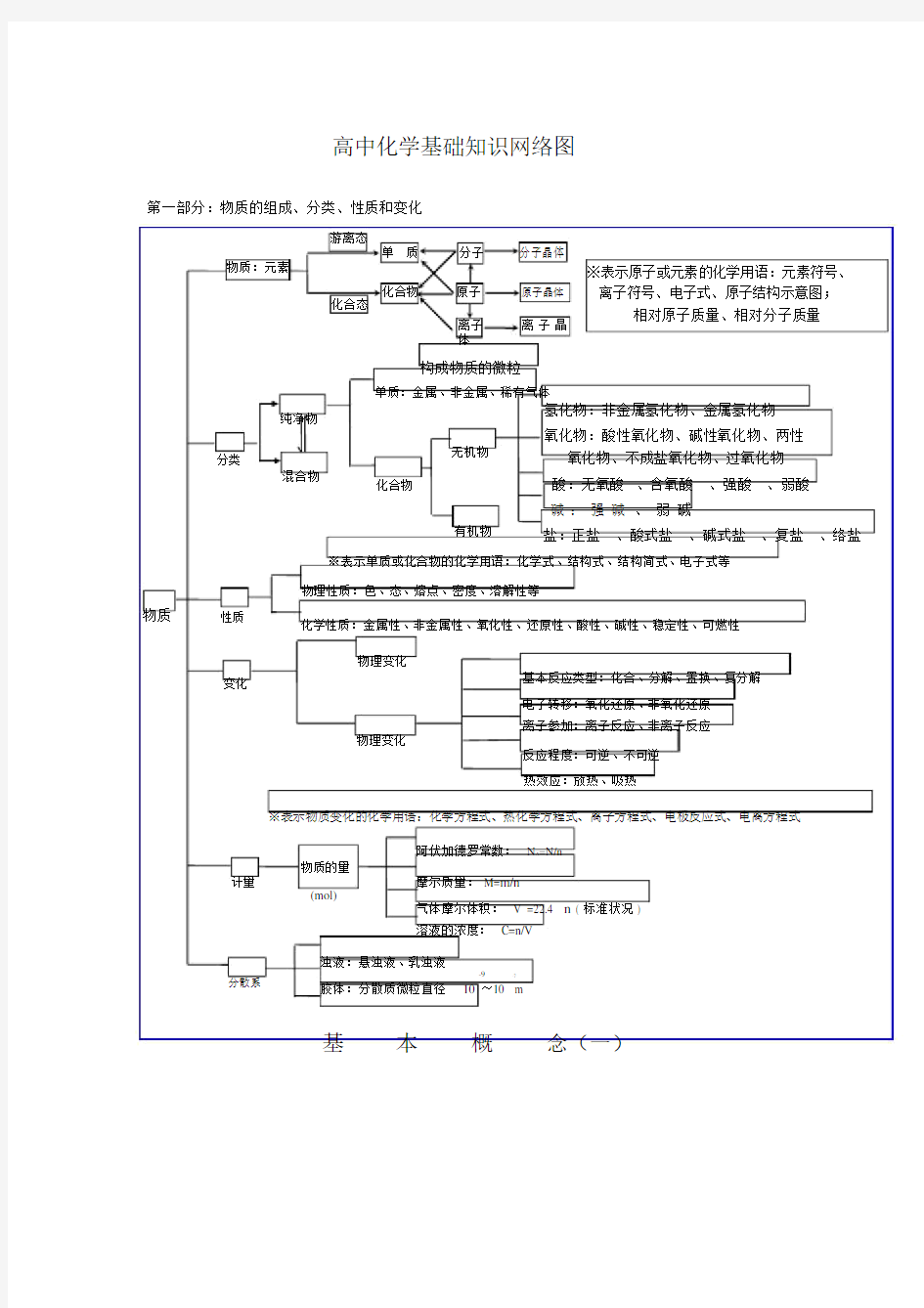

高中化学基础知识网络图
第一部分:物质的组成、分类、性质和变化
游离态
分子分子晶体
单质
物质:元素
化合物原子原子晶体
化合态
离子离子晶
体
构成物质的微粒
单质:金属、非金属、稀有气体※表示原子或元素的化学用语:元素符号、离子符号、电子式、原子结构示意图;
相对原子质量、相对分子质量
纯净物
氢化物:非金属氢化物、金属氢化物
氧化物:酸性氧化物、碱性氧化物、两性分类
无机物氧化物、不成盐氧化物、过氧化物
混合物
化合物酸:无氧酸、含氧酸、强酸、弱酸
碱:强碱、弱碱
有机物盐:正盐、酸式盐、碱式盐、复盐、络盐
※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等
物理性质:色、态、熔点、密度、溶解性等
物质性质
化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性
物理变化
变化基本反应类型:化合、分解、置换、复分解
电子转移:氧化还原、非氧化还原
离子参加:离子反应、非离子反应
物理变化
反应程度:可逆、不可逆
热效应:放热、吸热
※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式
计量分散系
阿伏加德罗常数:N A=N/n
物质的量
摩尔质量: M=m/n
(mol)
气体摩尔体积:V =22.4 n ( 标准状况 )
溶液的浓度: C=n/V
浊液:悬浊液、乳浊液
-9-7
胶体:分散质微粒直径10 ~10 m
基本概念(一)
色、态、味
溶解度、熔点、沸点
密度、硬度、导电性
导热性、塑性
游离态
物理性质
单质宏观
元素
金属性、非金属性
氧化性、还原性
酸性、碱性
稳定性、可燃性金属化学性质单质非金属纯净物稀有气体
化合物
化合态
化合物组大多数有机物
稀有气体分子晶体分
酸子
气态及挥发性物质
原子晶体
原
石墨(混合晶体)
子微观
金属晶体
大多数盐
强碱离子晶体
离
碱性氧化物
子
部分过氧化物性质
分类
无机物
物质
氢化物
氧化物
变化
酸
碱
盐
有机物
金属氢化物酸性
非金属氢化物碱性
成盐氧化物
两性
特殊
不成盐氧化物含
氧酸、无氧酸强
酸、弱酸
强碱、弱碱
可溶碱、难容碱
正盐
酸式盐
碱式盐
复盐;络盐
潮解、分馏混合物
升华、萃取
有机、无机
物理变化化学变化
化合、分解、置换、复分解风化、干馏
氧化还原;非氧化还原
溶解、盐析
裂化、裂解
分子、离子基本概念(二)吸热、放热
可逆、不可逆第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)
物质结构分子
化分分分子子子
学的的间
运键形极作
成性用动
力状
共离金(态
范
价子属极非
德特键键键
性极华殊
分性共离金力性
子分)
价子属子
电化化单
影子合合质
物物及响云
合物
金理
性
晶
质
体结构简图
类
型
电子式
金分原离
属子子子
晶晶晶晶横:周期体体体体
原子
核外电子原子核
(
分
排
层
布
)
规
律
最次各能
外外层量
层层最最
不不多低
超超容原
过过纳理
8 18 2n
个个 2
个
表
示
方
法表
的
结
构
元素种类起止序号
中子质量数同位素
核电荷数元素
质子性规
质
原子序数变律
化
元
素
周
期
律
表现形式
元
素
实周
质期
律
元
编
元元核
素素归素决外
周制周
纳
性定电
期期质子
表律的排
周布
期周
性期
性
n=1 n=2 n=3 n=4 n=5 n=6 n=7 纵:族
2
短周期
1~ 2
8 3~10
周
元素性质
8 11~ 18 原18
长周期
19~36 期子18 37~54 表结
位
32 55~86 构
置
21 不完全周期87~111
主族:
ⅠA ~Ⅶ A
副族:ⅢB ~Ⅶ B 、Ⅰ B Ⅱ B
Ⅷ族
0族
比较类型离子晶体原子晶体分子晶体构成晶体微粒阴、阳离子原子分子形成晶体作用力离子键共价键范德华力
熔沸点较高很高低硬度硬而脆大小
物
导电性不良熔融
.导电绝缘体 ( 半导体 ) 不良
理水溶液
性
传热性不良不良不良质
延展性不良不良不良
溶解性易溶于极性溶剂不溶于任何溶剂相似相溶
典型实例NaCl ,KBr 单质:金刚石、 SiC 、单质:H2、O2 Si 、SiO2 化合物:冰、干冰
化表示方法学
反
特点
速
率
算:v A =△c A /△t 位: mol/L ·s(min 或 h )
是平均速率,均取正
同一反用不同的物表示速率,数可能不同各物表示的速率比等于反方程式的系数比
化
和化学化反学
学
反
平衡速
率
影响因素
用
条合
件成
的氨
化适
于
学
平
衡
内因 (主 )
外因()
可逆反
化学平衡建立的条
件: v 正=v 逆≠ 0
化学平衡的特征
(平衡志的判断)
反物的构、性
度
温度
催化
其他条件光、超声波、
激光、放射?
定各成分百分含量保持不
等v 正 =v 逆≠ 0
平衡
条件改,平衡状改
化学平衡、化学
反应速率度
影响化学平衡因素
平衡移原理
(勒沙特列原理 )
温度
强电解质(完全电离 ) AB A -+B -
已电离的弱电解质分子数
(
电离度的定义 (电离度α = ×100%)
电离平衡 AB A -+B - 弱电解质的分子总数
电 弱 部
解 电 分
电离度平衡的移动
化 质
解 电
质 离
水的离子积 K W =1× 10
-14
(25℃ )
合
物
) 水的电离平衡 H 2O
H ++OH
-
溶液的酸碱性: PH=-log[H + ]
实质
装置
发生条件
表示方式-离子方程式
离子反应
非氧化还原
常见类型
氧化还原
类型
盐类的水解
规律(酸碱性性判断)
影响因素
复分解反应
水解反应
络合反应
置换反应
溶液中氧化还原反应
原理
蓄电池
化 能
应用
电源
干电池
高能电池
学 的 原电池
能 转
化学能
电解池
电能
与 换
原理
氯碱工业(电解饱和食盐水)
电 :
电镀
应用
非
电解精练(精练铜)
电
解 电冶炼金属(冶炼铝)
质
电
解 质 溶 液
比较
装置
能量转换 (实质) 装置特点
电极名称
电子流向
电极反应
原电池 电解池
化学能→电能
电能→化学能
(两极分别发生氧化还原反应产生电流) (在电流作用下两极分别发生氧化还原反应)
外电路无电源;两极为活泼性不同 外电路必须有直流电源;两极材料均
(或其中之一为能导电的非金属)的金属 能导电即可
负极(-)——较活泼 阴极——连接电源负极
正极(+)较不活泼 阳极——连接电源正极
e e
e
负极(-)→正极(+)
电源负极→阴极
电源正极→阳极
氧化n+
活泼金属失去电子
+还原
n+
还原
负极: M -ne → M 阴极: 2H +2e →H 2 ↑或 M + ne → M
被氧化、被溶解、被腐蚀。
惰性电极(石墨或铂)
氧化
R n--ne → R
还原
(例 2Cl - —2e Cl2
↑)
正极: 2H ++2e →H 2 ↑ ( 酸性电解质溶液 )
或 M n+
还原
-
H 2 O +O 2↑ + ne →M (不活泼金属的盐溶液)
或 4OH — 4e
-
金属电极做阳极,电极本身被氧化
H 2 O + O 2+ 4e → 4OH (
中性、弱酸性
条件下的吸氧腐蚀 )
氧化
n+
M - ne →M
第三部分:元素化合物转化关系
Mg 3N 2 N 2
煅烧
Na 2S
Na 2O
NaOH
NaCl
CO 2
O 2 H 2O H 2O
MgO
Mg
MgO
△ Mg(OH) 2
MgCO 3
Na
Na 2O 2
Na 2CO 3
H 2O
HCl
NaOH H 2O △
Cl 2
HCl 或
Mg(OH) 2
HCl C 2H 5ONa
NaCl
CH 3 COONa
NaHCO 3
HCl
CO 2 OH -
X 2
电解
MgX 2
MgCl 2 Mg(HCO 3)2
CaCl 2 Na 2CO 3
CO 2+ H 2O
HCl CaCO 3
△ CaHCO 3
AlCl 3(Al 3+
)
HCl
NaOH
HCl HCl
CO 2
Cl 2 或
HCl
HCl
HCl
O 2 H 3PO 4 HCl
2
电解
Al H 2O(沸腾 )
NaOH
CaHPO 4
Al 2O 3
Ca CaO H O
Ca(OH) 2
O 2
Al(OH) 3
CO 2
NaOH 或 HCl
C(电炉 )
H 2 O
NaOH
CO 2 NaOH
H 2O
NaAl O 2
CaC 2
Ca(ClO) 2
Na 2S
HCl
FeS
S
Fe
HCl FeCl 2
H 2SO 4
CO
O 2
Cl 2 Fe
CO
浓 2
H 2 SO 4
O 2
稀 Na S
等
Cl 2 、HNO 3
H 2SO 4
O 2
HCl
KSCN
2
FeCl3
Fe(SCN)3
FeO
Fe O
KSCN
NaOH H 2 SO 4
Fe O
NaOH
HCl
4
Fe(SCN)3
3
Fe(OH) 2
Fe(OH) 3
O 2 和 H 2O
Cu O
2
S
O 2
NH 3H 2O
[Cu(NH 3 4 2+
Cu 2S
Cu
CO 、Al 、H 2
CuO
Cu(OH) 2
) ]
HNO3 或 H 2SO 4(浓)
H +
△
H +
NaOH
CuS Na 2S
Cu 2+(NO 3 -、 SO42-)
金属部分:
按照单质 氧化物 氢氧化物 盐为线索进行搜罗寻找关系
AgBr
H2SO4
KClO 3 HgO CH3Cl
Zn
HBr NaBr
CH4 Na2O2 Cl
NH 4Cl KMnO 4
FeCl2
FeCl3 Br
2 2
CuCl2 CO l CH3CH 2OH H2 H2O O2 CH3COOH PCl3、 PCl5 Cl2 HCl NaCll
NaClO I
2
CuCl2
H2
O2 HClO
Ca(ClO)2
HI NaI CH 2=CHCl
NH 3 Cu Ca(OH) 2 Fe3O4 SO2 CO2+H2 O
CH 2ClCH 2Cl
AgI
FeS
PbS
FeS2 S H2S Na2S Mg 3N2 N2 NO NO2 N2 O4
CuS
Na2 SO3
BaSO3
PCl 3
P PCl 5
Na3PO4
CaHPO4
NH 4Cl NH 3NaNO 3HNO 3Cu(NO3 )2 SO2SO3Na2SO4
NO2
3 2
]
+
NH
3·H 2 6 7 2
[Ag (NH ) O NO2或(C H O ) NO2 H2SO3 H2SO4 BaSO4 NO2 n
P2O5
HPO 3
CaSiO3 SiH 4 SiF4 CO H2CO3 Ca(HCO3 ) 2
Ca3(PO4 )2H3PO4
H2SiO 3SiO 2Si C CO2CaCO3
Ca (H 2PO4)2
H4SiO 4Na 2SiO3SiCl 4CaC2Ca(OH) 2CaO
非金属:按照化合价寻找各类物质,主要有
氢化物、单质、氧化物、含氧酸、及其盐
第四部分:有机化学
烃
有
机
化烃的衍生物合
物
糖
链烃饱和链烃烷烃: C n H2n+2 (n≥1)R—CH 3
官有(脂肪烃)烯烃: C n H2n (n≥2) R—CH=CH 2
能机
不饱和链烃
二烯烃: C n H2n-2(n ≥4)R—CH=CH — CH=CH2
团抓
环烷烃 C n H2n (n≥ 3)
炔烃: C n H2n-2 (n≥2) R— C≡CH
的住环烃性芳香烃(苯和苯的同系物) C n H 2n-6(n≥ 6) R 质
卤代烃(官能团:— X):饱和一卤代烃 C n H2n+1 X(n ≥1)R—X
醇(官能团:— OH):饱和一元醇 C n H2n+1OH(n ≥1)R —OH
醚C n H2n+2O (n ≥2)R —O—R
酚(苯酚)(官能团:— OH)C H O (n ≥2)
OH
n 2n-6
醛(官能团:— CHO)C n H2n O (n≥1)R —CHO
酮(官能团:— CO—) C n H2n O (n≥3)R— CO—R’
羧酸(官能团:— COOH):饱和一元羧酸C n H2n+1O2 (n≥1)R— COOH
酯(官能团:— COO—R):饱和一元羧酸和饱和一元醇形成的酯C n H2n O2 (n≥2)R—COOR’
硝基化合物(官能团—NO2)R—NO 2
胺(官能团— NH 2)R—NH 2
单糖:葡萄糖、果糖C6 H12 O6(互为同分异构 )
二糖:蔗糖、麦芽糖C12 H22O11(互为同分异构 )
多糖:淀粉、纤维素(C6 H12 O6)n (n 值不同 )
蛋白质:多肽、氨基酸(官能团:—NH 2和— COOH )
天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质高分子化合物合成塑料
合成高分子
合成橡胶
合成纤维
高中化学知识结构图汇总
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化 大纲要求(1)了解分子、原子、离子等概念的含义。了解原子团的定义。 (2)理解物理变化与化学变化的区别与联系。 (3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。 (4)理解酸、碱、盐、氧化物的概念及其相互联系。
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)大纲要求 物质结构和元素周期律 (1)了解元素、核素和同位素的含义。 (2)了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。 (3)了解原子核外电子排布。 (4)掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。 (5)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。 (6)以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。 (7)了解金属、非金属在元素周期表中的位置及其性质递变的规律。 (8)了解化学键的定义。了解离子键、共价键的形成。 化学反应与能量 (1)了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。掌握常见氧化还原反应的配平和相关计算。 (2)了解化学反应中能量转化的原因,能说出常见的能量转化形式。 (3)了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。 (4)了解热化学方程式的含义。 (5)了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。 (6)了解焓变与反应热的含义。了解△H=H(反应产物)—H(反应物)表达式的含义。 (7)理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。 (8)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。了解常见化学电源的种类及其工作原理。 (9)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。 化学反应速率和化学平衡 (1)了解化学反应速率的概念、反应速率的定量表示方法。 (2)了解催化剂在生产、生活和科学研究领域中的重大作用。 (3)了解化学反应的可逆性。 (4)了解化学平衡建立的过程。了解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。 (5)理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。 (6)了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。 电解质溶液 (1)了解电解质的概念。了解强电解质和弱电解质的概念。 (2)了解电解质在水溶液中的电离,以及电解质溶液的导电性。
化学必修一知识网络图
混合物的分离与提纯 必修一 第一章《从实验学化学》知识网络归纳 一、混合物的分离与提纯 ①依据:状态不同 过滤 ②从液体中分离出不溶的固体物质 ③举例:出去食盐中的泥沙 ①依据:挥发性不同 蒸发 ②从溶液中分离出溶质 ③举例:从NaCl 溶液中分离出NaCl ①依据:溶解度随温度变化 结晶 ②把两种可溶性固体从溶液中分开 ③举例:NaCl 和KNO 3的分离 物理方法 ①依据:沸点不同 蒸馏 ②把两种互溶的液体分开 ③举例:石油分离为汽油、煤油、柴油等。 ①依据:二者互补相容 分液 ②把两种互不相容的液体分开 ③举例:分离四氯化碳和水 ①依据:溶质在不同溶剂中溶解度的不同 萃取 ②把溶质从溶剂中提取到另一种另一种溶剂中 ③举例:用四氯化碳提取碘水中的碘 原则:不增、不减、易分、复原 化学方法 沉淀法:如除去:SO 42-、Ca 2+、Mg 2+、等 方法 气化法:如除去CO 32+等 一、高考中常考的离子检验 ① 从外观观察其颜色、状态 步骤 ②配成溶液,观察溶液颜色、有无沉淀或气体生成 ③用化学试剂检验 ①稀盐酸、BaCl 2溶液 SO 42- ②生成白色沉淀 化学 ③BaCl 2+Na 2SO 4=BaSO 4↓+2NaCl 方法 ①稀HNO 3、AgNO 3溶液 Cl - ②生成不溶于稀HNO 3的白色沉淀 ③ AgNO 3+ NaCl=AgCl↓+NaNO 3
二、物质的量及物质的量浓度 × M × 1000ρ × 溶质摩尔质量
第二章《化学物质及其分类》知识网络归纳 一、物质的分类。金属:Na、Mg、Al 单质 非金属:S、O、N 酸性氧化物:SO3、SO2、P2O5等 氧化物碱性氧化物:Na2O、CaO、Fe2O3 氧化物:Al2O3等 纯盐氧化物:CO、NO等 净含氧酸:HNO3、H2SO4等 物按酸根分 无氧酸:HCl 强酸:HNO3、H2SO4、HCl 酸按强弱分 弱酸:H2CO3、HClO、CH3COOH 化一元酸:HCl、HNO3 合按电离出的H+数分二元酸:H2SO4、H2SO3 物多元酸:H3PO4 强碱:NaOH、Ba(OH)2 物按强弱分 质弱碱:NH3·H2O、Fe(OH)3 碱 一元碱:NaOH、 按电离出的HO-数分二元碱:Ba(OH)2 多元碱:Fe(OH)3 正盐:Na2CO3 盐酸式盐:NaHCO3 碱式盐:Cu2(OH)2CO3 溶液:NaCl溶液、稀H2SO4等 混悬浊液:泥水混合物等 合乳浊液:油水混合物 物胶体:Fe(OH)3胶体、淀粉溶液、烟、雾、有色玻璃等
人民版高中历史必修一知识点总结
必修一知识点 古代中国的政治制度 1.世袭制:夏朝王位世袭制确立,家天下形成,宗族关系从此成为基本的政治关系; 2宗法制:宗法制的特点和作用 目的:确定和巩固父系家长在本族的地位。 (1)特点 ①以嫡长子继承制为核心,大宗和小宗有相对性。 ②血缘纽带与政治关系相结合,“国”与“家”结合。 ③大宗与小宗既是家族关系,又是政治隶属关系。 ④形成森严的社会等级。 (2)作用 ①对西周:保证了贵族在政治上的垄断和特权地位,有利于统治集团内部的稳定和团结。是西周政治的建制原则和指导思想。 ②对后世:影响了中国传统社会结构、日常生活观念。如修族谱、认祖归宗、重视家庭建设、提倡尊老爱幼,甚至过分强调家庭本位和重视人情关系等。 商朝时期实行宗法制。 3、分封制 目的:巩固周王朝统治 基本内容:①分封对象和主要国家:A、王族(姬姓贵族);B、功臣;C、先代贵族等;齐、鲁、燕、卫、宋、晋 权利和义务:受封者获得世袭的统治权,但承担一定的义务:服从周王的命令,镇守疆土,随从作战,交纳贡赋,朝觐述职。 特点:层层分封,等级森严,政治与血缘关系紧密结合。 影响:A、积极作用:有利于稳定当时的政治秩序,扩大疆域。B 弊端:后来诸侯国之间出现了强国兼并弱国的形势,使周天子的权威逐渐削弱,形成割据混战局面。 4、分封制与宗法制的关系: A、互为表里,相辅相成; B、“分”是“宗”在政治上的表现(分封制是按照宗法制的等级秩序严格进行的) C、“宗”是“分”的主要依据和血缘纽带 走向大一统的秦汉政治 1、六王毕 公元前230年到公元前221年秦灭六国(韩赵魏楚燕齐),建立中国历史上第一个统一的专制主义中央集权的王朝---秦王朝。 2、四海一 北击匈奴 蒙恬收回河套地区,修筑长城和“直道”,加强北部边防,设九原郡 统一岭南地区 修灵渠(最初服务于军事)沟通湘水和漓水,岭南设郡(南海郡),归入中央王朝管理的开始 “西南夷” 开辟“五尺道”,部分地区任命官吏,该地区进入中原统一政权版图开始 秦朝统一的历史意义: 它结束了中国长期分裂割据的局面。它奠定了中国辽阔的版图,加强了中原和边疆以及汉族和少数民族之间的联系,对后世产生了巨大的影响。它促进了中国社会的飞速发展。秦统一后,中国社会进入快速发展一途。
人教版高中历史高考必修一知识结构图
讲学稿()世界史知识结构与框架(必修一部分) 年级:高三学科: 历史主备人:杨臣时间: 2016年10月23日 课程标准: 学习目标: 导课: 一、古代希腊、罗马的政治制度 ①地理:希腊地理环境的特点及对雅典民主政治形成产生重大影响; (1)形成的历史条件③经济:商品经济发达,有利于平等互助、自由、民主观念形成 ②政治前提:城邦政体孕育古代希腊民主的摇篮; 城邦的特点:小国寡民、独立自主 背景:贵族与平民矛盾尖锐,工商业奴隶主崛起。 颁布“解负令”,债务奴隶重获自由 鼓励发展农工商业 措施颁布财产等级制度,将公民分为四个等级 古①梭伦改革恢复公民大会 希 (公元前六世纪初) 改革国家权力机构新设“四百人会议” 腊设立陪审法庭 的评价:雅典民主政治的奠基 民(2)雅典民主政治演变过程 主②克里斯提尼改革(公元前六世纪末)——雅典民主的确立 制 A除十将军外,以抽签方式产生各级官职 度③伯里克利时代民主政治 B民主政治的主要机构:公民大会、五
(“黄金时代”)百人会议、陪审法庭。 C公职津贴。 意义:为近现代西方政治制度奠定了最初的基础(3)雅典民主政治的基本特点:主权在民、轮番而治、公民平等、法律至上 早期习惯法:贵族担当法官,随心所欲解释法律, 平民利益受损 ①习惯法到成文法标志:《十二铜表法》公元前五世纪中期 成文法诞生特点:内容广泛,条文清晰 评价:贵族对法律随意解释受到限制, 平民利益得到保护 古 代时间:罗马共和国时期 罗马(1)罗马法的发展演变公民法使用范围:罗马公民 的缺陷:有明显的狭隘性 法②公民法到万民法形成时间:由共和国到帝国过程中(三世纪)律适用范围:罗马帝国统治范围内一切自由民 万民法作用:使法律有了更大的适用范围 成为巩固罗马统治的重要工具 ③民法大全时间:六世纪;意义:罗马法律体系最终完成 ①地位:欧洲历史上第一部叫系统的法律体系 ②积极意义:a对罗马:稳定社会秩序,保护统治阶级利益 (2)罗马法的评价 b调节社会矛盾,稳固帝国统治 ③影响后世:a对近代欧美国家文法和同法制度产生影响 b成为资产阶级反对封建制度,推进资本主义发展的思想武器 ④局限:a维护奴隶主阶级的利益,并非法律面前人人平等
高中化学选修3 物质结构与性质 全册知识点总结
高中化学选修3知识点总结 主要知识要点: 1、原子结构 2、元素周期表和元素周期律 3、共价键 4、分子的空间构型 5、分子的性质 6、晶体的结构和性质 (一)原子结构 1、能层和能级 (1)能层和能级的划分 ①在同一个原子中,离核越近能层能量越低。 ②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。 ③任一能层,能级数等于能层序数。 ④s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍。 ⑤能层不同能级相同,所容纳的最多电子数相同。 (2)能层、能级、原子轨道之间的关系 每能层所容纳的最多电子数是:2n2(n:能层的序数)。
2、构造原理 (1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。 (2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。 (3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E (5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。原子轨道的能量关系是:ns<(n-2)f <(n-1)d <np (4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目。 根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8个电子;次外层不超过18个电子;倒数第三层不超过32个电子。 (5)基态和激发态 ①基态:最低能量状态。处于最低能量状态的原子称为基态原子。 ②激发态:较高能量状态(相对基态而言)。基态原子的电子吸收能量后,电子跃迁至较高能级时的状态。处于激发态的原子称为激发态原子。 ③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和放出(激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或利用特征谱线鉴定元素。 3、电子云与原子轨道 (1)电子云:电子在核外空间做高速运动,没有确定的轨道。因此,人们用“电子云”模型来描述核外电子的运动。“电子云”描述了电子在原子核外出现的概率密度分布,是核外电子运动状态的形象化描述。
高中化学必修一 重要知识点网络化总结【精品】
第一章从实验学化学 一、化学计量 ①物质的量 定义:表示一定数目微粒的集合体符号n 单位摩尔符号 mol 阿伏加德罗常数:0.012kgC-12中所含有的碳原子数。用NA表示。约为6.02x1023 微粒与物质的量 N 公式:n= NA ②摩尔质量:单位物质的量的物质所具有的质量用M表示单位:g/mol 数值上等于该物质的分子量 质量与物质的量 m 公式:n= M ③物质的体积决定:①微粒的数目②微粒的大小③微粒间的距离 微粒的数目一定固体液体主要决定②微粒的大小 气体主要决定③微粒间的距离 体积与物质的量 V 公式:n= Vm 标准状况下,1mol任何气体的体积都约为22.4L ④阿伏加德罗定律:同温同压下,相同体积的任何气体都含有相同的分子数 ⑤物质的量浓度:单位体积溶液中所含溶质B的物质的量。符号CB 单位:mol/l 公式:C B=n B/V n B=C B×V V=n B/C B 溶液稀释规律 C(浓)×V(浓)=C(稀)×V(稀) ⑥溶液的配置 (l)配制溶质质量分数一定的溶液 计算:算出所需溶质和水的质量。把水的质量换算成体积。如溶质是液体时,要算出液体的体积。 称量:用天平称取固体溶质的质量;用量简量取所需液体、水的体积。 溶解:将固体或液体溶质倒入烧杯里,加入所需的水,用玻璃棒搅拌使溶质完全溶解. (2)配制一定物质的量浓度的溶液(配制前要检查容量瓶是否漏水) 计算:算出固体溶质的质量或液体溶质的体积。 称量:用托盘天平称取固体溶质质量,用量简量取所需液体溶质的体积。 溶解:将固体或液体溶质倒入烧杯中,加入适量的蒸馏水(约为所配溶液体积的1/6),用玻璃棒搅拌使之溶解,冷却到室温后,将溶液引流注入容量瓶里。 洗涤(转移):用适量蒸馏水将烧杯及玻璃棒洗涤2-3次,将洗涤液注入容量瓶。振荡,使溶液混合均匀。 定容:继续往容量瓶中小心地加水,直到液面接近刻度2-3mm处,改用胶头滴管加水,使溶液凹面恰好与刻度相切。把容量瓶盖紧,再振荡摇匀。 5、过滤过滤是除去溶液里混有不溶于溶剂的杂质的方法。 过滤时应注意:①一贴:将滤纸折叠好放入漏斗,加少量蒸馏水润湿,使滤纸紧贴漏斗内壁。
历史必修一第一单元知识框架
第一单元古代中国政治制度知识结构 1、分封制与宗法制的关系是什么? 分封制和宗法制互为表里;宗法制是分封制的内核和纽带,分封制是宗法制在政治制度
上的体现。 2、早期政治制度特点: ①以宗法制为核心,带有浓厚的部族(血缘)色彩(主要);②有很强的专制性;③具备继承性和发展性;④神权与王权相结合;⑤最高执政集团尚未实现权力的高度集中。
背景:明清时,中国封建制度走向衰落,地主阶级更加腐朽,社会矛盾更加尖锐
目的:稳定和巩固封建统治,加强皇权 原因:地方废除行中书省,设三司(布政司、都指挥司、按察使司)分管地方行政、军政、 监察,隶属中央部门,地方权集中央, 废宰相制宰相职权扩大,妨碍皇权高度集中。明丞相胡惟庸骄横跋扈,擅权专恣。 同时也鉴于元宰相权力太大,导致社会动荡 时间:1380年明太祖废中书省、丞相制,权分六部 评价:君主专制加强,防止了宰相专权,但更易导致决策失误和暴政, 当君主无能或不理朝政时,更易导致权臣或太监乱政 原因:宰相制度废除,皇帝政务繁多,无力应付 太祖:设殿阁大学士,作为侍从顾问 创内阁:过程成祖:阁臣获得参决机务的权力,内阁制度正式确立 宣宗:阁臣又获得票拟权 后来:内阁地位日益提高。首辅权压众臣 性质:为皇帝提供顾问的内侍机构 评价:内阁不是法定的中央一级的行政机构或决策机构,而是为皇帝 提供顾问的内侍机构。阁臣的升降和职权的大小,完全取决于皇 帝的旨意。因此,内阁是君主专制强化的产物。阁权不同于相权, 不可能对皇权起到制约作用 原因:皇权受到议政王大臣会议很大的限制 康熙帝:设南书房影响:与内阁、议政王大臣会议并立,最终集权于皇帝 特点:简(机构人员)、速(办事效率)、密 职责:商议军国大事,跪受笔录,上传下达 雍正帝:设军机处:人员组成:皇帝亲信的满汉官员 性质:由最初的暂设的军事机构,逐步发展辅助皇帝处理 政务的中枢机构 影响:提高了行政效率,君主专制制度发展到顶峰,也加 强了中央集权 利:有利于多民族国家的巩固统一和社会安定,封建经济发展,民族融合政治上:专制独裁易导致决策失误和暴政,权臣乱政;助长因循守旧之风,官僚主义盛 行,人浮于事,腐败成风;地方没有一定的自主权,不能有效的治 理;人民受到沉重的政治压迫 影响:弊:经济上:使之发展缓慢,妨碍了资本主义萌芽的成长 思想文化上:钳制了思想,摧残了文化,不利于民主科学思想的产生与发展总之,极大地妨碍着社会的进步和资本主义萌芽的成长,从此开始大大落后于西方,从而埋下日后被动挨打的祸根 1、中国古代政治制度有何主要特点? ①专制中央集权制历经数千年的发展过程,从未中断,源流分明,沿革清晰;②以君权为中心,权力高度集中;③人治高于法治;④统治机构设置完备,统治网络严密周全;⑤宗法关系的残余影响深远;⑥儒家思想是君主专制的理论基础
人教版高一化学必修一知识点总结
一、重点聚焦 1.混合物的分离原理和分离方法。 2.混合物分离方法的操作。 3.离子的检验及检验试剂的选择。 4.物质分离与提纯过程的简单设计。 5.物质的量及其单位——摩尔。 6.阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量浓度等概念。 7.有关物质的量、微观粒子数、质量、体积、物质的量浓度等之间转化的计算。 8.一定物质的量浓度溶液的配制 二、知识网络 本章包括化学实验基本方法、化学计量在实验中的应用两节内容,其知识框架可整理如下: 1.实验安全 严格按照实验操作规程进行操作,是避免或减少实验事故的前提,然后在实验中要注意五防,即防止火灾、防止爆炸、防止倒吸引起爆裂、防止有害气体污染空气、防止暴沸。 2.实验中意外事故的处理方法 (1)创伤急救 用药棉或纱布把伤口清理干净,若有碎玻璃片要小心除去,用双氧水擦洗或涂红汞水,也可涂碘酒(红汞与碘酒不可同时使用),再用创可贴外敷。 (2)烫伤和烧伤的急救 可用药棉浸75%—95%的酒精轻涂伤处,也可用3%—5%的KMnO4溶液轻擦伤处到皮肤变棕色,再涂烫伤药膏。 (3)眼睛的化学灼伤 应立即用大量流水冲洗,边洗边眨眼睛。如为碱灼伤,再用20%的硼酸溶液淋洗;若为酸灼伤,则用3%的NaHCO3溶液淋洗。 (4)浓酸和浓碱等强腐蚀性药品
使用时应特别小心,防止皮肤或衣物被腐蚀。如果酸(或碱)流在实验桌上,立即用NaHCO3溶液(或稀醋酸)中和,然后用水冲洗,再用抹布擦干。如果只有少量酸或碱滴到实验桌上,立即用湿抹布擦净,再用水冲洗抹布。 如果不慎将酸沾到皮肤或衣物上,立即用较多的水冲洗,再用3%—5%的NaHCO3溶液冲洗。如果碱性溶液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。 (5)扑灭化学火灾注意事项 ①与水发生剧烈反应的化学药品不能用水扑救。如钾、钠、钙粉、镁粉、铝粉、电石、PCl3、PCl5、过氧化钠、过氧化钡等着火。 ②比水密度小的有机溶剂,如苯、石油等烃类、醇、醚、酮、酯类等着火,不能用水扑灭,否则会扩大燃烧面积;比水密度大且不溶于水的有机溶剂,如CS2着火,可用水扑灭,也可用泡沫灭火器、二氧化碳灭火器扑灭。 ③反应器内的燃烧,如是敞口器皿可用石棉布盖灭。蒸馏加热时,如因冷凝效果不好,易燃蒸气在冷凝器顶端燃着,绝对不可用塞子或其他物件堵塞冷凝管口,应先停止加热,再行扑救,以防爆炸。 3.混合物的分离和提纯 (1)混合物分离和提纯方法的选择 ①固体与固体混合物:若杂质或主要物质易分解、易升华时用加热法;若一种易溶,另一种难溶,可用溶解过滤法;若二者均易溶,但溶解度受温度的影响差别较大,可用重结晶法;还可加入某种试剂使杂质除去,然后再结晶得到主要物质。 ②固体与液体混合物:若固体不溶于液体,可用过滤法;若固体溶于液体,可用结晶或蒸馏方法。 ③液体与液体混合物:若互不相溶,可用分液法,若互溶在一边且沸点差别较大,可用蒸馏法;若互溶在一起且沸点差别不大,可选加某种化学试剂萃取后再蒸馏。 ④气体与气体混合物:一般用洗气法,可选用液体或固体除杂试剂。 (2)几种常见的混合物的分离和提纯方法 分离和提纯方法分离的物质主要仪器应用举例 倾析从液体中分离密度较大且不溶的固体烧杯、玻璃棒分离沙和水
高中历史必修一知识结构图75586
精品文档考试教学资料施工组织设计方案 第一单元古代中国的政治制度 夏朝:“家天下”制度的形成 商朝:实行宗法制、神权与王权的密切结合 诸侯的权利:1、在封疆内可对卿大夫再分封 2、职位世袭 3、设置官员 4、建立武装 (1)分封制 5、正派赋役 早期政治制度诸侯的义务:1、必须服从周天子的命令 2、镇守疆土 3、随从作战 4、缴纳贡赋 5、召见述职 (夏商周时期) (宗法制和分封制关系:互为表里) 西周政治制度 ①含义:是用父系血缘关系的亲疏来维系政治等级、巩固国家统治的制度 (2)宗法制②特点:a用父系血缘关系的亲疏来维持政治等级 b最大的特点:嫡长子继承 制 c大宗和小宗是相对的,且有双重关系 (嫡长子与其他之后再血缘上是兄弟关系,在政治上是君臣关系) ③影响:保证了各级贵族在政治上的垄断和特权地位,有利于统治集团内部的 稳定和团结。 御史大夫 建立:秦朝:皇帝制→中央官制丞相→郡(守)→县(令)→乡(里) 太尉 古郡国、郡县并存(封国是朝廷的依靠力量,但有时与朝廷对抗)代①汉朝 推恩令(是中央集权得到加强) 中②唐朝:节度使制和藩镇(削弱中央集权) 国(1)中央集权军事:兵权收归中央;各地调派精兵,充当中央禁军 ③宋朝行政:派文官担任地方长官,同时设置通判负责监督 财政:地方赋税一小部分作为地方开支,其余全部由中央管理 ④元朝:行省制度(加强了中央集权) 的 政①汉朝:内外朝制度(加强军权) 治②唐朝:三省六部制中书(拟)门下(审)尚书(执) 制演进与强化(2)君主专制③宋朝:分割相权:军事、行政、财政→(加强军权) 度中央集权制度(汉至清)④元朝:中书省(削弱军权) (秦朝至清朝) 汉:察举制
高中化学选修4知识网络架构
化学选修化学反应原理 第一章 一、焓变反应热 1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量 2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应(1).符号:△H(2).单位:kJ/mol 3.产生原因:化学键断裂——吸热化学键形成——放热 放出热量的化学反应。(放热>吸热) △H 为“-”或△H <0 吸收热量的化学反应。(吸热>放热)△H 为“+”或△H >0☆常见的放热反应:①所有的燃烧反应②酸碱中和反应 ③大多数的化合反应④金属与酸的反应 ⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等 ☆常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl ②大
多数的分解反应 ③以H2、CO、C为还原剂的氧化还原反应 ④铵盐溶解等 二、热化学方程式 书写化学方程式注意要点: ①热化学方程式必须标出能量变化。 ②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示) ③热化学反应方程式要指明反应时的温度和压强。 ④热化学方程式中的化学计量数可以是整数,也可以是分数 ⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变 三、燃烧热 1.概念:25 ℃,101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量。燃烧热的单位用kJ/mol表示。 ※注意以下几点: ①研究条件:101 kPa
②反应程度:完全燃烧,产物是稳定的氧化物。 ③燃烧物的物质的量:1 mol ④研究内容:放出的热量。(ΔH<0,单位kJ/mol) 四、中和热 1.概念:在稀溶液中,酸跟碱发生中和反应而生成1mol H2O,这时的反应热叫中和热。 2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为: H+(aq) +OH-(aq) =H2O(l) ΔH=-mol 3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于mol。 4.中和热的测定实验 五、盖斯定律 1.内容:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成的反应热是相同的。
最新高一历史必修一(人教版)知识点归纳
一.1、夏是我国历史上第一个王朝,我国的早期国家政治制度始于夏; 2、王位世袭制的确立,是我国原始社会过渡到奴隶社会的重要标志 3、分封制。特点:周天子是诸侯的共同主子,诸侯是周王的臣属。 意义:加强统治,巩固王权 4、西周宗法制最大特点是:嫡长子继承制; 影响:保证贵族的垄断地位,有利于统治集团内部的稳定与团结。 5、西周的宗法制是与分封制互为表里的具有政治性质的制度。 6、王位世袭制、宗法制和分封制一起构成了夏商周时期的政治制度的主体,对中国社会产生了深远的影响。 二.1、秦朝是中国历史上第一个统一的、中央集权的封建国家。 2、中央集权制度的形成(1)皇帝制度:①“皇帝”称号的由来②皇帝制度:皇帝独尊、皇权至上、皇位世袭③皇帝制度的核心内容:皇权至上、皇帝独裁(2)中央政府的三公九卿制和地方推行郡县制 ①秦朝中央官僚机构的特点:第一、它是以皇权为中心的中央行政体制。第二、充分体现出“家天下”的特点。(封建时代的
统治特点——国与家同治)②废除分封制,实行郡县制,是建立中央集权制度的根本性变革。郡是秦朝中央政府辖下的地方最高一级行政单位。 3、巩固统一的措施:①颁布秦律②统一度量衡、货币和车轨 ③统一文字 4、秦朝中央集权制度的影响: (1)对秦朝的影响:①有利于封建经济文化的发展;②初步奠定祖国疆域,巩固统一③形成以华夏族为主体的中华民族。 ④建立了地主阶级对广大人民的专制统治,秦朝的暴政造成人民处境的恶化。 (2)对后世的影响:秦朝建立的中央集权专制统治的政治制度具有很大的开创性,奠定了中国两千多年封建政治制度的基本格局,为历代封建王朝所沿用,且不断加强与完善。 三.1、两汉时期中央政治制度的特点:汉承秦制“中朝”和“外朝” 2、魏晋南北朝时期中央政治制度的特点:逐步形成三省六部制 3、我国古代三省六部制的完善是在隋唐时期 4、宋朝的政治制度特点:不断削弱和分割宰相的职权,进一步加强皇权。 5、宋朝的“二府”:中书门下是最高行政机构;枢密院是最高军政机构。
高中历史必修一知识结构
高中历史必修一知识结构 专题一古代中国的政治制度 【知识结构】 本专题主要讲述我国古代政治制度的演变,可分为两大阶段:夏商周时期的早期政治制度(课本第1课);秦朝以来的中央集权制度的确立、演进和强化(课本第2、3、4课)。 中央集权制度构成有三个部分:皇帝制度、中央行政制度、地方行政制度,该制度下包含二大基本矛盾:皇权与相权的矛盾;中央与地方的矛盾。概括掌握中央集权制度发展的历程。在掌握上述史实的基础上概括和理解中央集权制度发展的两大趋势(特点):相权日益分散削弱,君权日益加强;地方权力日益分散削弱,中央权力日益加强。 夏朝:“家天下”制度的形成 商朝:实行宗法制、神权与王权的密切结合 ①背景: 早期政治制度②内容: (夏商周时期) (1)分封制③主要封国 ④诸侯的权利和义务概括早期政治制度特点 西周政治制度⑤影响: ①含义: (2)宗法制②特点: ③影响: (1)前提:秦的统一。(要求:掌握秦统一的过程和意义) ①皇帝制:特点、地位 确立 (2)确立②三公九卿制和“朝议”制度:三公名称及职权、评价 (秦) ③郡县制:由来、内容、意义。 (3)比较西周分封制和秦朝郡县制 古 代①汉朝:频繁换相、中外朝制度 中②唐朝:三省六部制、政事堂设立; 国(1)中央行政③宋朝:中书门下、枢密院、三司 的制度变化④元朝:中书省、宣政院 政⑤明朝:废丞相、设内阁。 治⑥清朝:设置军机处 制演进与强化①秦朝:郡县制 度中央集权制度(汉至清)②汉朝:汉初,郡国并行,东汉末,州郡县 (秦朝至清朝) (2)地方行政③唐朝:道、州、县 制度变化④宋朝:路、州、县 ⑤元朝:行省(行省制度)、路、府、州、县 ⑥明清:沿用行省设置。 (3)古代中央政治制度和地方行政制度演变的特点(发展趋势) ①秦:中央:御史大夫;地方:监御史; ②两汉:中央:御史大夫;地方:设刺史 (1)监察体制完善③唐:御史台 ④宋:提点刑狱司 制度保障⑤元明:元朝设有御史台,明朝改都察院 ①世官制:含义 (2)选官制度变化②察举制:含义、发展、特征 ③科举制:含义、创立、评价。 专制主义中央集权制度强化对中国社会发展的影响:
(完整word版)高中化学必修一知识网络结构图.doc
高中化学基础知识网络图 第一部分:物质的组成、分类、性质和变化 游离态 分子分子晶体 单质 物质:元素 化合物原子原子晶体 化合态 离子离子晶 体 构成物质的微粒 单质:金属、非金属、稀有气体※表示原子或元素的化学用语:元素符号、离子符号、电子式、原子结构示意图; 相对原子质量、相对分子质量 纯净物 氢化物:非金属氢化物、金属氢化物 氧化物:酸性氧化物、碱性氧化物、两性分类 无机物氧化物、不成盐氧化物、过氧化物 混合物 化合物酸:无氧酸、含氧酸、强酸、弱酸 碱:强碱、弱碱 有机物盐:正盐、酸式盐、碱式盐、复盐、络盐 ※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等 物理性质:色、态、熔点、密度、溶解性等 物质性质 化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性 物理变化 变化基本反应类型:化合、分解、置换、复分解 电子转移:氧化还原、非氧化还原 离子参加:离子反应、非离子反应 物理变化 反应程度:可逆、不可逆 热效应:放热、吸热 ※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式 计量分散系 阿伏加德罗常数:N A=N/n 物质的量 摩尔质量: M=m/n (mol) 气体摩尔体积:V =22.4 n ( 标准状况 ) 溶液的浓度: C=n/V 浊液:悬浊液、乳浊液 -9-7 胶体:分散质微粒直径10 ~10 m 基本概念(一)
色、态、味 溶解度、熔点、沸点 密度、硬度、导电性 导热性、塑性 游离态 物理性质 单质宏观 元素 金属性、非金属性 氧化性、还原性 酸性、碱性 稳定性、可燃性金属化学性质单质非金属纯净物稀有气体 化合物 化合态 化合物组大多数有机物 稀有气体分子晶体分 酸子 气态及挥发性物质 原子晶体 原 石墨(混合晶体) 子微观 金属晶体 大多数盐 强碱离子晶体 离 碱性氧化物 子 部分过氧化物性质 分类 无机物 物质 氢化物 氧化物 变化 酸 碱 盐 有机物 金属氢化物酸性 非金属氢化物碱性 成盐氧化物 两性 特殊 不成盐氧化物含 氧酸、无氧酸强 酸、弱酸 强碱、弱碱 可溶碱、难容碱 正盐 酸式盐 碱式盐 复盐;络盐 潮解、分馏混合物 升华、萃取 有机、无机 物理变化化学变化 化合、分解、置换、复分解风化、干馏 氧化还原;非氧化还原 溶解、盐析 裂化、裂解 分子、离子基本概念(二)吸热、放热 可逆、不可逆第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)
高中历史必修一知识框架
高中历史必修一知识框架 专题一古代中国的政治制度 【知识结构】 本专题主要讲述我国古代政治制度的演变,可分为两大阶段:夏商周时期的早期政治制度(课本第1课);秦朝以来的中央集权制度的确立、演进和强化(课本第2、3、4课)。 中央集权制度构成有三个部分:皇帝制度、中央行政制度、地方行政制度,该制度下包含二大基本矛盾:皇权与相权的矛盾;中央与地方的矛盾。概括掌握中央集权制度发展的历程。在掌握上述史实的基础上概括和理解中央集权制度发展的两大趋势(特点):相权日益分散削弱,君权日益加强;地方权力日益分散削弱,中央权力日益加强。 夏朝:“家天下”制度的形成 商朝:实行宗法制、神权与王权的密切结合 ①背景: 早期政治制度②内容: (夏商周时期) (1)分封制③主要封国 ④诸侯的权利和义务概括早期政治制度的特点 西周政治制度⑤影响: ①含义: (2)宗法制②特点: ③影响: (1)前提:秦的统一。(要求:掌握秦统一的过程和意义) ①皇帝制:特点、地位 确立 (2)确立②三公九卿制和“朝议”制度:三公名称及职权、评价 (秦) ③郡县制:由来、内容、意义。 (3)比较西周分封制和秦朝郡县制 古 代①汉朝:频繁换相、中外朝制度 中②唐朝:三省六部制、政事堂设立; 国(1)中央行政③宋朝:中书门下、枢密院、三司 的制度变化④元朝:中书省、宣政院 政⑤明朝:废丞相、设内阁。 治⑥清朝:设置军机处 制演进与强化①秦朝:郡县制 度中央集权制度(汉至清)②汉朝:汉初,郡国并行,东汉末,州、郡、县 (秦朝至清朝) (2)地方行政③唐朝:道、州、县 制度变化④宋朝:路、州、县 ⑤元朝:行省(行省制度)、路、府、州、县 ⑥明清:沿用行省设置。 (3)古代中央政治制度和地方行政制度演变的特点(发展趋势) ①秦:中央:御史大夫;地方:监御史; ②两汉:中央:御史大夫;地方:设刺史 (1)监察体制完善③唐:御史台 ④宋:提点刑狱司 制度保障⑤元明:元朝设有御史台,明朝改为都察院 ①世官制:含义 (2)选官制度变化②察举制:含义、发展、特征
高中化学知识的结构体系
高中化学知识的结构体系 ★在高考考试大纲中,对高考化学科考试范围分为“必考内容”与“选考内容”两部分。 总计51个知识点,167个考点。 1、必考内容:涵盖必修模块“化学1”、“化学2”与选修模块“化学反应原理”的内容。 2、选考内容:涵盖选修模块“化学与生活”、“化学与技术”、“物质结构与性质”、“有机化学基础”的内容,在高考中考生从 中任选一个模块考试。 必考内容,必修一:19个知识点,56个考点。 必考内容,必修二:10个知识点,32个考点。 必考内容,选修四:5个知识点,21个考点。 选考内容,选修一二三:10个知识点,33个考点。
选考内容,选修五六:7个知识点,25个考点。 (必考)必修1——人教版高一上学期 第一章从实验学化学 ?本章特点内容比较简单,但就是从第二节物质的量开始很多学生学不明白。 ?本章就是高一学生开始化学退步的开始,甚至就是高三理科生的死结。 ?应对办法:真正的理解知识,配合少量的习题。 ?高考命题:计算题或者阿伏伽德罗常数的选择题,属于高考热点。 第二章化学物质及其变化 ?本章内容主要就是氧化还原与离子反应。 ?本章很多同学存在的困难就是氧化还原配平。 ?应对办法:学习配平技巧。 ?高考命题:离子共存、离子方程正误的选择题,属于高考热点、常考点。氧化还原易出计算类选择或者计算题,也可能出判断类选择。 第三章金属及其化合物 ?本章重点内容就是金属钠、过氧化钠、金属铁的两种变价、铝的两性。就是会考重点。 ?本章方程式增多,学生困惑在方程式的记忆。但本章学生自己感觉难度不大。 ?应对办法:学习归纳法的技巧,系统学习。 ?高考命题:推断题,实验题,选择题。 第四章非金属及其化合物 ?本章重点内容就是氨气、氯气、碳与硅。就是会考重点。尤其就是氯气与氨气的制取就是会考必考点。 ?本章方程式增多,学生困惑在方程式的记忆。但本章学生自己感觉难度不大。 ?应对办法:学些归纳法之类的技巧,系统学习。 ?高考命题:推断题。 (必考)必修2——人教版高一下学期
化学必修一知识网络图
混合 物 的分 离 与提 纯 必修一 第一章《从实验学化学》知识网络归纳 一、混合物的分离与提纯 ①依据: 过滤 ②从液体中分离出 ③举例: ①依据: 蒸发 ②从溶液中分离出 ③举例:从NaCl 溶液中分离出 ①依据: 结晶 ②把两种可溶性固体从溶液中分开 ③举例:NaCl 和KNO 3的分离 物理方法 ①依据: 蒸馏 ②把两种 分 开 ③举例:石油分离为汽油、煤油、柴油等。 ①依据: 分液 ②把两种 的液体分开 ③举例:分离四氯化碳和水 ①依据: 萃取 ②把溶质从溶剂中提取到另一种另一种溶剂中 ③举例:用 提取碘水中的碘 原则: 化学方法 沉淀法:如除去:SO 42-、Ca 2+、Mg 2+、等 方法 气化法:如除去CO 32+等 一、高考中常考的离子检验 ① 从外观观察其 步骤 ②配成溶液,观察 ③用化学试剂检验 ①试剂: SO 42- ②现象: 化学 ③方程式: 方法 ①试剂: Cl - ②现象: ③方程式:
第二章《化学物质及其分类》知识网络归纳 一、物质的分类。金属: 单质 非金属: 酸性氧化物:等 氧化物碱性氧化物: 两性氧化物:等 纯 净含氧酸:等 物按酸根分 无氧酸: 强酸: 酸按强弱分 弱酸: 化一元酸: 合按电离出的H+数分二元酸: 物多元酸: 强碱: 物按强弱分 质弱碱: 碱 一元碱: 按电离出的HO-数分二元碱: 多元碱: 正盐: 盐酸式盐: 碱式盐:Cu2(OH)2CO3 溶液:NaCl溶液、稀H2SO4等 混悬浊液:泥水混合物等 合乳浊液:油水混合物 物胶体:Fe(OH)3胶体、淀粉溶液、烟、雾、有色玻璃等
最新高中化学物质结构知识点总结
分子结构与性质 共价键:原子间通过共用电子对形成的化学键。 极性键:正电中心和负电中心不重合; 非极性键:正电中心和负电中心重合; 分子极性与非极性判别: 极性:中心原子最外层电子未全部成键; 非极性:中心原子最外层电子全部成键; 氢键:氢键是由已经与电负性很强的原子(如N、F、O)形成共价键的氢原子与另一个分子中或同一分子中电负性很强的原子之间的作用力。 氢键对物质性质的影响 (1)当形成氢键时,物质的熔、沸点将升高。 (2)氢键不属于化学键; σ键、π键判别规律: 1.共价单键全部都是σ键; 2.共价双键中一个是σ键,一个是π键; 3.共价三键中一个是σ键,两个是π键; 价层电子对互斥理论: 价层电子对数目=(中心原子的价电子数+配位原子提供的电子数)/2 a、如果是离子团,离子的价电子对数应考虑离子所带的电荷: (1)负离子的价电子数=中心原子的价电子数+所带的负电子数; (2)正离子的价电子数=中心原子的价电子数-所带的正电荷数; b、如果成键原子是配位原子,与中心原子之间的化学键是单键时,配位原子提供的价电子数是1,如H、卤素原子;双键时,配位原子提供的价电子数为0,如氧原子,三键时,配位原子提供的原子为-1,如乙炔。双键、三键都当做一个配位原子。 c、σ键电子对数:由分子式确定。如H2O、NH3、CH4分子中的中心原子O、N、C分别含有 2、3、4对σ键电子对。 d、中心原子上的孤对电子数:为,式中a为中心原子的价电子数(主族元素的价电子数就是最外层电子数);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数(氢为1,其他原子等于“8-该原子的价电子数”)
高中历史必修一知识结构图总结
第一单元古代中国的政治制度 夏朝:“家天下”制度的形成 商朝:实行宗法制、神权与王权的密切结合 诸侯的权利:1、在封疆内可对卿大夫再分封 2、职位世袭 3、设置官员 4、建立武装 (1)分封制 5、正派赋役 早期政治制度诸侯的义务:1、必须服从周天子的命令 2、镇守疆土 3、随从作战 4、缴纳贡赋 5、召见述职 (夏商周时期) (宗法制和分封制关系:互为表里) 西周政治制度 ①含义:是用父系血缘关系的亲疏来维系政治等级、巩固国家统治的制度 (2)宗法制②特点:a用父系血缘关系的亲疏来维持政治等级 b最大的特点:嫡长子继承 制 c大宗和小宗是相对的,且有双重关系 (嫡长子与其他之后再血缘上是兄弟关系,在政治上是君臣关系) ③影响:保证了各级贵族在政治上的垄断和特权地位,有利于统治集团内部的 稳定和团结。 御史大夫 建立:秦朝:皇帝制→中央官制丞相→郡(守)→县(令)→乡(里) 太尉 古郡国、郡县并存(封国是朝廷的依靠力量,但有时与朝廷对抗)代①汉朝 推恩令(是中央集权得到加强) 中②唐朝:节度使制和藩镇(削弱中央集权) 国(1)中央集权军事:兵权收归中央;各地调派精兵,充当中央禁军 ③宋朝行政:派文官担任地方长官,同时设置通判负责监督 财政:地方赋税一小部分作为地方开支,其余全部由中央管理 ④元朝:行省制度(加强了中央集权) 的 政①汉朝:内外朝制度(加强军权) 治②唐朝:三省六部制中书(拟)门下(审)尚书(执) 制演进与强化(2)君主专制③宋朝:分割相权:军事、行政、财政→(加强军权) 度中央集权制度(汉至清)④元朝:中书省(削弱军权) (秦朝至清朝) 汉:察举制 (3)选官用官制度魏晋:九品中正制 隋—清:科举制 明:废丞相,权分六部→设内阁 顶峰:明清:君主专制清:议政大臣会议→南书房→军机处
化学必修一知识网络图
混合物的分离与提纯 必修一 第一章《从实验学化学》知识网络归纳 一、混合物的分离与提纯 ①依据:状态不同 过滤 ②从液体中分离出不溶的固体物质 ③举例:出去食盐中的泥沙 ①依据:挥发性不同 蒸发 ②从溶液中分离出溶质 ③举例:从NaCl 溶液中分离出NaCl ①依据:溶解度随温度变化 结晶 ②把两种可溶性固体从溶液中分开 ③举例:NaCl 和KNO 3的分离 物理方法 ①依据:沸点不同 蒸馏 ②把两种互溶的液体分开 ③举例:石油分离为汽油、煤油、柴油等。 ①依据:二者互补相容 分液 ②把两种互不相容的液体分开 ③举例:分离四氯化碳和水
①依据:溶质在不同溶剂中溶解度的不同 萃取②把溶质从溶剂中提取到另一种另一种溶剂中 ③举例:用四氯化碳提取碘水中的碘 原则:不增、不减、易分、复原 化学方法 沉淀法:如除去:SO42-、Ca2+、Mg2+、等 方法 气化法:如除去CO32+等 一、高考中常考的离子检验 ①从外观观察其颜色、状态 步骤②配成溶液,观察溶液颜色、有无沉淀或气体生成 ③用化学试剂检验 ①稀盐酸、BaCl2溶液 SO42-②生成白色沉淀 化学③BaCl2+Na2SO4=BaSO4↓+2NaCl 方法 ①稀HNO3、AgNO3溶液 Cl-②生成不溶于稀HNO3的白色沉淀 ③ AgNO3+ NaCl=AgCl↓+NaNO3
二、物质的量及物质的量浓度 × M 物质的量 ÷×N A n (mol ) ÷M ×溶质的摩尔质量× N A m 溶质的物质的量 ÷溶质的摩尔质量 ÷N A 、、 ÷
物质的量浓度 C B(mol/L) ×溶质摩尔1000ρ1000ρ×溶质摩尔质量 溶质质量分数
历史必修一知识点总结(人教版)
高一年级历史必修一模块终结考试复习提纲 第一单元古代中国的政治制度 一、分封制 目的:巩固国家政权 内容:①分封对象——王族、功臣、先代的贵族,②受封者义务——服从周王的命令、镇守疆土、随从作战、交纳贡赋、朝觐述职。③受封者权利——职位世袭、设置官员、建立武装、征派赋役。 作用:①加强了周天子对地方的管辖。②扩大了统治区域,开发了边远地区;③形成对周王室众星捧月一般的政治格局; ④周成为一个延续数百年的强国。但诸侯国有相当大的独立性,埋下分裂割据的隐患。 二、宗法制 定义:宗法制是依据父系血缘关系的亲疏来维系政治等级、巩固统治的一种社会制度。 特点:血缘纽带和政治关系结合起来、 宗法制与分封制的关系:分封制和宗法制是西周政治制度的两大支柱,互为表里。 中国早期政治制度特点:以宗法制为核心,带有浓厚的部族色彩。 目的——巩固统治秩序,解决权力、财产和土地继承矛盾 核心——嫡长子继承制体系——大宗、小宗相对 影响——A不仅是家庭等级关系,也是政治隶属关系 B确立分配继承制度,保障世卿世禄特权 C利于凝聚宗族力量,“国”“家”结合起来 三、礼乐制:政治生活准则,实质是宗法分封的工具 四、秦的统一: 公元前221年,秦灭六国,秦王嬴政建立了中国历史上第一个统一的、封建专制主义中央集权的国家——秦朝。 秦朝专制主义中央集权政治制度的形成 特征:权力高度集中 内容:①建立“皇帝”称号,确立皇帝制度。全国的政治、经济、军事大权由皇帝总揽,从中央到地方的主要官吏由皇帝任免。表现:A皇权至上 B皇位世袭 ②设置三公九卿中央官制:丞相——帮助皇帝处理全国政事;御史大夫——监察百官;太尉——负责全国军务。 ③在地方推行郡县制:郡的长官是郡守,县的长官称县令或县长,均由皇帝直接任免。 影响:形成中央集权政治体制,彻底打破传统的贵族分封制,奠定大一统王朝的基础,巩固了国家的统一,促进了社会的安定和经济文化的发展,奠定了中国两千多年政治制度的基本格局,对中华民族的形成起了重要的作用。 消极作用:加强对人民的压榨,容易导致暴政,造成阶级矛盾的激化。 秦朝巩固统一的措施: ①颁布秦律、统一法令;②统一货币、度量衡;③统一文字;④修建驰道、灵渠;⑤修筑万里长城;组织移民。 秦朝灭亡的原因是秦的暴政 五、汉武帝加强中央集权 背景:汉初郡国并行,出现王国问题 措施:汉景帝平定“七国之乱”;汉武帝实行推恩令 作用:解决了王国问题,加强中央集权,巩固和发展了大一统局面。 唐末至五代出现了藩镇割据局面 六、宋初中央集权的强化 措施:宋太祖采纳宰相赵普的建议,从“权、钱、兵”入手加强中央集权 A收精兵:禁军由殿前司、侍卫马军司,侍卫步军司三衙统领,发兵权归枢密院。 B削实权:削弱宰相、节度使、州郡和官,下设通判向朝廷直接奏报。 C制钱谷:州郡财赋,除自留小部分,其余由中央掌握,消除了地方割据势力的物质基础影响:①加强了中央对地方的控制,消除了藩镇割据现象。②造成冗官、冗兵、冗费,埋下了“积贫积弱”的祸根。八、唐实行三省六部制 唐朝中央设中书省、门下省和尚书省,分别负责决策、审议和执行。三省的长官都是宰相,分散了相权。尚书省下设吏、户、礼、兵、刑、工六部,确立并完善了三省六部的管理体制。运行机制:中书省—门下省—尚书省—六部
