小容量注射剂生产工艺规程通则
目 录
1. 小容量注射剂生产工艺流程图、小容量注射剂车间概况(附图) 2. 需要验证的关键工序及工艺验证(列表) 3. 操作过程及工艺条件
4. 技术安全、工艺卫生及劳动保护 5. 物料平衡及技经指标 6. 设备一览表 7. 岗位定员
8. 附件目录(岗位操作、清洁规程) ?
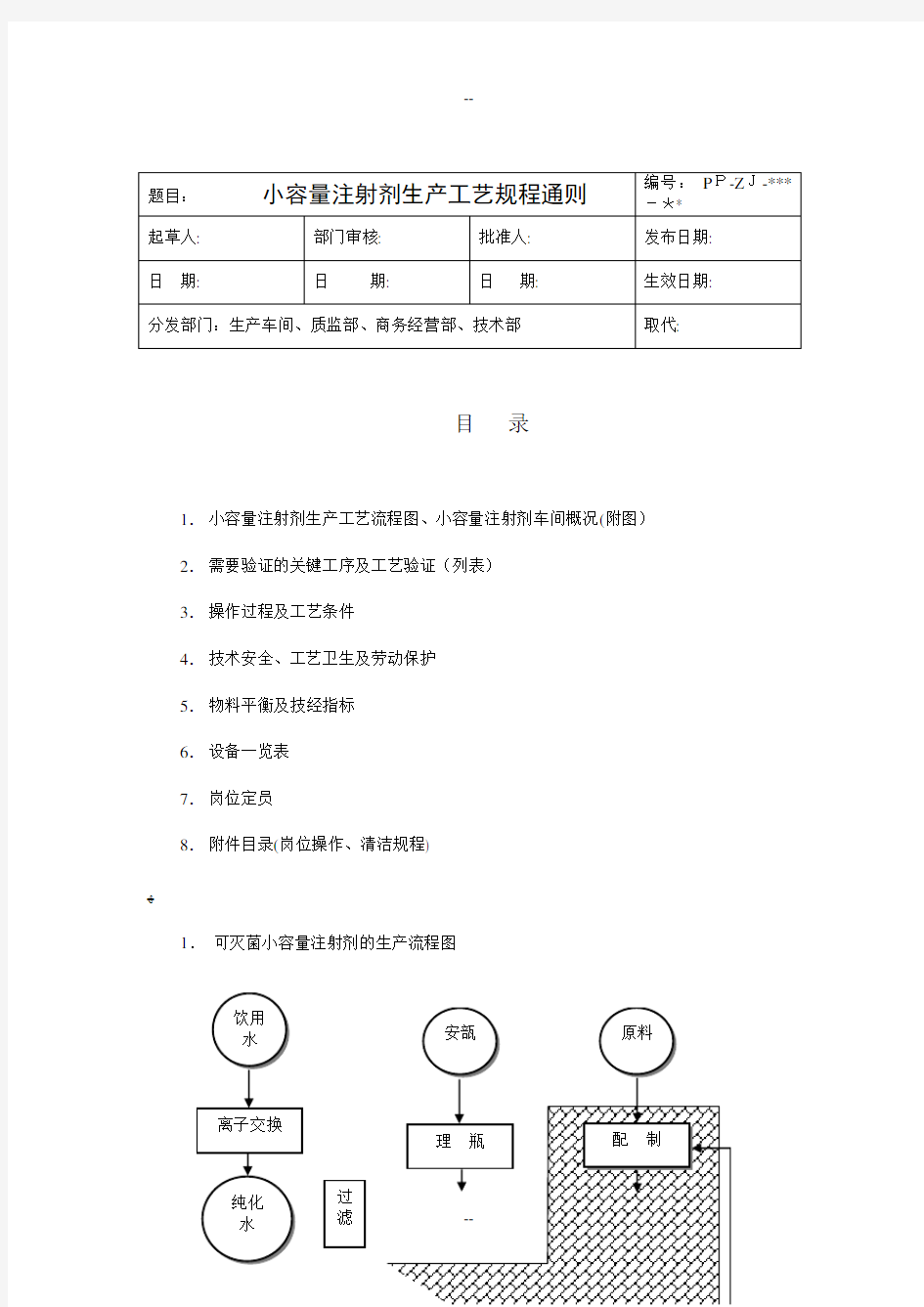
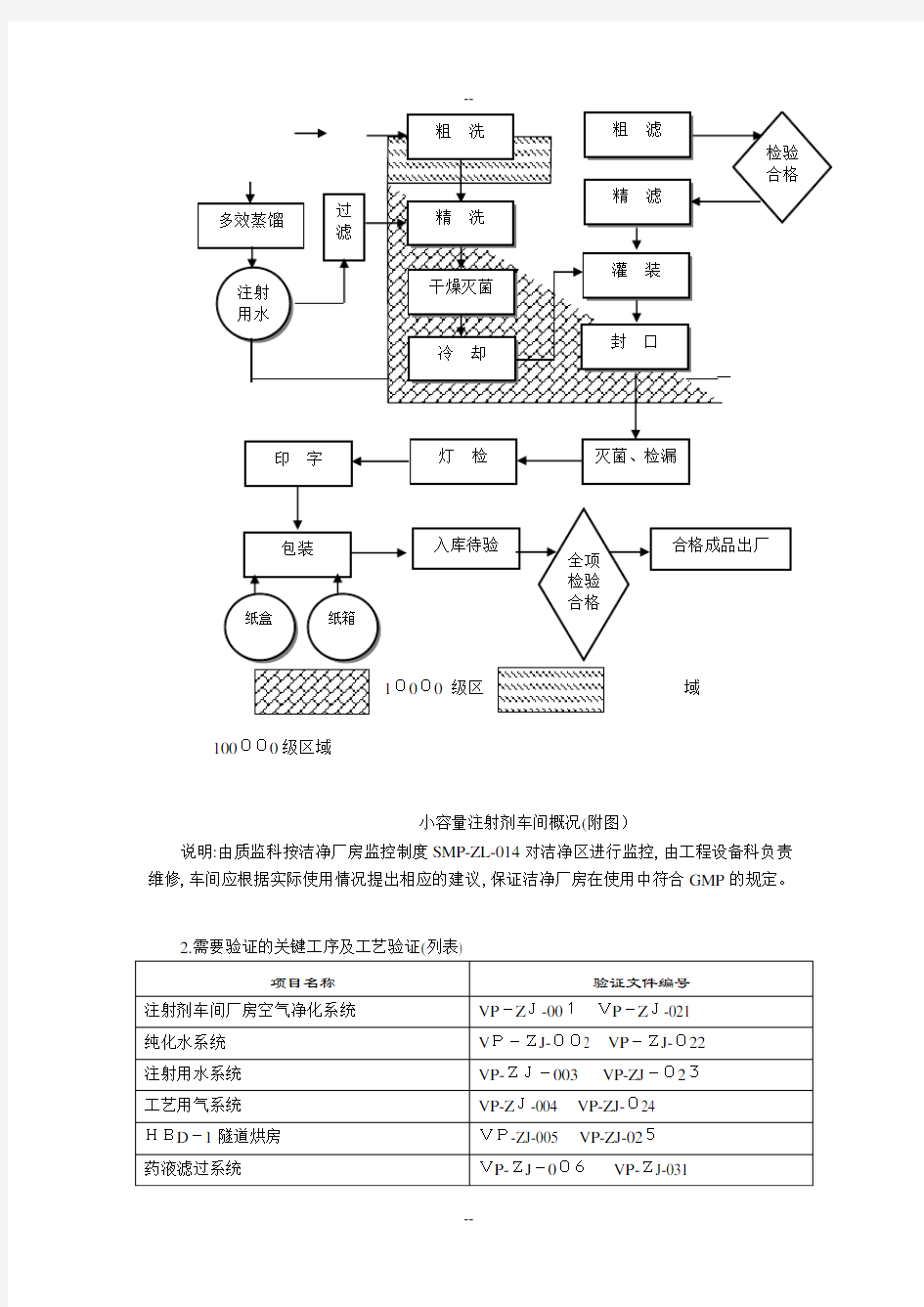
1. 可灭菌小容量注射剂的生产流程图
100000级区域
小容量注射剂车间概况(附图)
说明:由质监科按洁净厂房监控制度SMP-ZL-014对洁净区进行监控,由工程设备科负责维修,车间应根据实际使用情况提出相应的建议,保证洁净厂房在使用中符合GMP的规定。
说明:每年需按验证管理制度SMP-ZL-012对上述关键工序及工艺进行验证(再验证或回顾性验证)。若系统、设备设施发生变更则必须进行相应的验证。
验证由厂验证小组负责。车间应根据情况及时提出相应的申请。
3.操作过程及工艺条件
3.1工艺用水:
3.1.1操作过程:
3.1.1.1原水为符合国家饮用水的标准自来水。
3.1.1.2 纯化水由原水经石英砂过滤→精滤(PE棒)→阴床→阳床→混床→紫外灯灭菌→进入贮罐。
3.1.1.3 注射用水由纯化水经多效蒸馏水机经过蒸馏而得。
3.1.2工艺条件:
3.1.2.1 原水应符合国家饮用水标准。
3.1.2.2 原水的预处理的进水流量应≤3m3/h。
3.1.2.3 温床的流量为3m3/h。
3.1.2.4 多放蒸馏水机蒸气压力应在0.30~0.4Mpa之间,压缩空气压力应在0.3~0.4MPa之间。
3.1.2.5纯化水的电导率应≤2us/cm,离子检查符合?中国药典?2005版二部“纯化水”的标准。
注射用水的电导率≤2us/cm,离子检查符合?中国药典?2005版二部“注射用水”的标准。
3.2 理瓶工序
3.2.1 本公司可灭菌小容量注射剂所选用直接接触药品的容器为低硼硅玻璃安瓿,执行国家药品监督管理局国家药用包装容器(材料)标准(试行)YBB00332002,以下均可简称安瓿。
3.2.2 操作过程:
按批生产指令领取安瓿并除去外包装,烧字安瓿要核对批号、品名、规格、数量。
在理瓶间逐盘理好后送入联动机清洗或送入粗洗间用纯化水粗洗后送入精洗间超声,注射用水甩干并检查清洁符合规定后送隧道烘房。
3.2.3工艺条件:
3.2.3.1 纯化水应符合?中国药典?2005年版二部标准
注射用水应符合?中国药典?2005年版二部标准
3.2.3.2洗瓶用注射用水水温应为50℃±5℃,冲瓶水压应在0.15-0.2MPa之间。
3.3 配制工序:
3.3.1 操作过程
3.3.1.1按批生产指令,领取原辅料。
3.3.1.2特别注意:注射剂用原料药,非水溶媒,部分辅料经本公司检验核发的检验报告
单加注了“供注射用”字样,请仔细核对!!
3.3.1.3 根据原辅料检验报告书,对原辅料的品名、批号、生产厂家规程及数量核对,并分别标(量)取原辅料,各不同品种的具体操作按“工艺规程各论”执行。
3.3.1.4原辅料的计算、称量、投料必须进行复核,操作人、复核人均应在原始记录
上签名。
3.3.1.5过滤前后,过滤器均需要做起泡点试验,应合格。
3.3.1.6配料过程中,凡接触药液的配制容器、管道、用具、胶管等均需做特别处理。
3.3.1.7 称量时使用经计量检定合格,标有在有效期内的合格证的衡器,每次使用前应校正。
3.3.2 工艺条件:
3.3.2.1配制用注射用水应符合?中国药典?2005年版二部“注射用水标准”,每次配料前必须确认所用注射用水已按规定检验;并取得符合规定的结果及报告。
3.3.2.2 将处方量药用炭放入3000ml注射用水中煮沸,自然放冷。
3.3.2.3 其余工艺条件按“工艺规程各论”执行。
3.3.2.4 药液从配制到灭菌的时间不超过12小时。
3.4灌封:
3.4.1操作过程:
3.4.1.1将已处理的灌装机、活塞、针头、液球、胶管等安装好,用0.5μm及0.22μ
m滤芯过滤的新鲜注射用水洗涤,调试灌封机,并校正装量,并抽干注射用水。同时根据
需要调整管道煤气和氧气压力。
3.4.1.2接通药液管道,将开始打出的适量药液回入配制,重新过滤,并检查可见异物情况,合格后,开始灌封,灌封时每一小时抽检装量一次并每小时检查药液澄明情况一次,装量差异应符合产品“工艺规程各论”的规定,并填写在原始记录上。
3.4.1.3充氮要求应符合产品“工艺规程各论”的规定。
3.4.2 工艺条件:
3.4.2.1 检测装量注射器,准确度1ml注射器应至0.02ml、2ml注射器至0.1ml、5ml注射器至0.2ml、20ml注射器至1.0ml。已灌装的半成品,必须在4小时内灭菌。
3.5灭菌及检漏
3.5.1操作过程:
3.5.1.1按批生产指令,设定好温度、时间、真空度等数据。
3.5.1.2将封口后的安瓿产品根据产品流转卡,核对品名、规格、批号、数量正确后,送入安瓿检漏灭菌柜中,关闭柜门,按下启动键。灭菌检漏结束后(过程由电脑控制)打开柜门,取出产品,再用纯化水进一步冲洗,逐盘将进色水产品检出后,送去湿房(1)去湿。
3.5.2 工艺条件:
3.5.2.1 按产品“工艺规程各论”执行。
3.5.2.2 去湿房(1)温度55℃±5℃,时间三小时。特殊情况见“工艺规程各论”。3.6灯检:
3.6.1操作过程
产品去湿后进入灯检室,核对品名、规格、批号、数量正确后,按《中国药典2005版二部附录》进行可见异物检查,剔除外观不良品、内在质量不合格品和有装量差异的,灯检后产品送入去湿房(2)。
3.6.2 工艺条件
3.6.2.1 去湿房(2)温度55℃±5℃,时间二小时。特殊情况见“工艺规程各论”。
3.7 印包:
3.7.1操作过程:
3.7.1.1 根据批包装指令,按100%领取一切包装材料。
3.7.1.2按产品流转卡核对品名、规格、批号、数量等,并根据产品名称、规格、批号,安装印字铜板(品名、批号、规格由工序负责人和工序质监员核对)。
3.7.1.3 核对无误后开印包机,同时检查印字字迹是否清晰并将印字后产品逐一装入纸盒内,每10小盒为一扎,同时检查有无漏装。
3.7.1.5 需手工包装的产品,每1小盒为一组,每5小盒或10小盒为1中盒,每10中盒或20中盒为一箱,最后装入大箱中,由工序质监员核对装箱单和拼箱单内容,放入装箱单和拼箱单,核对品名、规格、数量等无误后封箱。
3.7.2工艺条件:
3.7.2.1按产品“工艺规程各论”执行
4.技术安全,工艺卫生及劳动保护
4.1技术安全:
4.1.1洗瓶工序操作人员操作时应按规定穿戴好劳保用品,并严格按设备操作规程进行
操作,做到人离、关机、关水、关电。
4.1.2药液过滤器起泡点值为0.34Mpa(0.22μm滤芯),完整性测试见SOP-ZJ-50。4.1.3 灌封应严格控制管道煤气,氧气的压力,封口完及时关闭管道煤气和氧气开关及一切电源开关。
4.1.4包装材料严格防火措施。
4.1.5 经常检查管道煤气、氧气有无泄漏。
4.1.6相关岗位应防酸、碱等化学试剂损伤。
4.2 工艺卫生:
精洗、配料、灌封区域的风速、换气次数、尘埃粒子、菌落数、温湿度按“洁净环境监控制度”执行。
执行厂房、设备的清洁规程和清场管理制度。
4.3 劳动保护:
4.3.1产生粉尘的房间(如称料间)在操作过程中,应开启除尘罩。
4.3.2 操作人员按规定穿戴好工作衣、帽,一万级区域需戴好口罩。
4.3.3 使用注射用水、烘箱时要注意安全,以防烫伤。
4.3.4除国家有关劳保规定外,本生产线无特殊劳保要求。
注:1.取前三年的平均值作为平衡计算的指标±5 %,制定为平衡在允许范围内为合格,上限≤100% 。
2.新产品为上一年度全年同容量规格产品的平均值。
6.设备一览表
8.附件目录:(岗位操作、清洁规程)
口服液工艺规程10ml
1. 主题内容 ........................................... 错误!未定义书签。 2. 适用范围 ........................................... 错误!未定义书签。 3. 责任 (3) 4. 产品名称及剂型 ..................................... 错误!未定义书签。 5. 产品概述 ........................................... 错误!未定义书签。 .产品特点......................................... 错误!未定义书签。 6. 工艺流程图 (2) 7. 操作过程及工艺条件 (3) .处方............................................. 错误!未定义书签。 .称量 (3) .配液............................................. 错误!未定义书签。 .理瓶............................................. 错误!未定义书签。 .洗瓶 (4) .灌装加塞轧盖..................................... 错误!未定义书签。 .操作过程 (4) .灭菌 (4) .灯检 ............................................. 错误!未定义书签。 .包装............................................. 错误!未定义书签。 8. 生产过程中重点工艺控制检查(包括中间体检查) ...... 错误!未定义书签。 9. 技术安全与劳动保护 ................................ 错误!未定义书签。 .工作场所......................................... 错误!未定义书签。 .机器设备 (6) 防火.............................................. 错误!未定义书签。 .工艺卫生......................................... 错误!未定义书签。 10.操作工时与生产周期 (7) 11.原辅料质量标准..................................... 错误!未定义书签。 12.包装材料质量标准................................... 错误!未定义书签。 13.成品、半成品、中间体质量标准 (8)
小容量注射剂生产工艺
小容量注射剂生产工艺规程通则 目录 1.小容量注射剂生产工艺流程图、小容量注射剂车间概况(附图)2.需要验证的关键工序及工艺验证(列表) 3.操作过程及工艺条件 4.技术安全、工艺卫生及劳动保护 5.物料平衡及技经指标 6.设备一览表 7.岗位定员 8.附件目录(岗位操作、清洁规程)
1.可灭菌小容量注射剂的生产流程图 100000级区域 小容量注射剂车间概况(附图) 说明:由质监科按洁净厂房监控制度SMP-ZL-014对洁净区进行监控,由工
程设备科负责维修,车间应根据实际使用情况提出相应的建议,保证洁净厂房在 使用中符合GMP的规定。 2.需要验证的关键工序及工艺验证(列表) 说明:每年需按验证管理制度SMP-ZL-012对上述关键工序及工艺进行验证(再验证或回顾性验证)。若系统、设备设施发生变更则必须进行相应的验证。 验证由厂验证小组负责。车间应根据情况及时提出相应的申请。 3.操作过程及工艺条件 3.1 工艺用水: 3.1.1 操作过程: 3.1.1.1 原水为符合国家饮用水的标准自来水。 3.1.1.2 纯化水由原水经石英砂过滤→精滤(PE棒)→阴床→阳床→混床→ 紫外灯灭菌→进入贮罐。 3.1.1.3 注射用水由纯化水经多效蒸馏水机经过蒸馏而得。 3.1.2 工艺条件: 3.1.2.1 原水应符合国家饮用水标准。
3.1.2.2 原水的预处理的进水流量应≤3m3/h。 3.1.2.3 温床的流量为3m3/h。 3.1.2.4 多放蒸馏水机蒸气压力应在0.30~0.4Mpa之间,压缩空气压力应在 0.3~0.4MPa之间。 3.1.2.5 纯化水的电导率应≤2us/cm,离子检查符合?中国药典?2005版二 部“纯化水”的标准。 注射用水的电导率≤2us/cm,离子检查符合?中国药典?2005版二部“注射用水”的标准。 3.2 理瓶工序 3.2.1 本公司可灭菌小容量注射剂所选用直接接触药品的容器为低硼硅玻璃 安瓿,执行国家药品监督管理局国家药用包装容器(材料)标准(试行)YBB00332002,以下均可简称安瓿。 3.2.2 操作过程: 按批生产指令领取安瓿并除去外包装,烧字安瓿要核对批号、品名、规格、数量。在理瓶间逐盘理好后送入联动机清洗或送入粗洗间用纯化水粗洗后送入精洗间超声,注射用水甩干并检查清洁符合规定后送隧道烘房。 3.2.3 工艺条件: 3.2.3.1 纯化水应符合?中国药典?2005年版二部标准 注射用水应符合?中国药典?2005年版二部标准 3.2.3.2 洗瓶用注射用水水温应为50℃±5℃,冲瓶水压应在0.15-0.2MPa 之间。 3.3 配制工序: 3.3.1 操作过程 3.3.1.1 按批生产指令,领取原辅料。 3.3.1.2 特别注意:注射剂用原料药,非水溶媒,部分辅料经本公司检验 核发的检验报告单加注了“供注射用”字样,请仔细核对!! 3.3.1.3 根据原辅料检验报告书,对原辅料的品名、批号、生产厂家规程 及数量核对,并分别标(量)取原辅料,各不同品种的具体操作按“工艺规程各论”执行。 3.3.1.4 原辅料的计算、称量、投料必须进行复核,操作人、复核人均应 在原始记录上签名。 3.3.1.5 过滤前后,过滤器均需要做起泡点试验,应合格。
氧氟沙星注射液生产工艺规程
制药有限公司 氧氟沙星注射液生产工艺规程 颁发单位:GMP办公室
工艺规程批准程
目录 1. 剂型、规格 (3) 2. 生产工艺流程 (3) 3. 操作过程及工艺条件 (4) 4.质量控制要点 (7) 5.设备一览表、主要设备生产能力 (7) 6.工艺过程中的SOP (8) 7.中间产品的控制 (9) 8.验证工作要点 (9) 9.工艺验证的具体要求 (10) 10.工艺卫生和环境卫生 (10) 11.劳动组织及岗位定员 (10)
一、制剂类型:最终灭菌小容量注射液,10ml规格,安瓿瓶包装。10ml:0.2g 二、流程图:氧氟沙星注射液生产工艺流程图
三、操作过程及工艺条件 1 生产前的检查与确认 1.1 是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格 证”。 1.2 检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上 “合格”标示。 1.3 所使用原辅料是否准备齐全。是否有质量检验报告单,合格品才能 使用。 1.4 检查工艺用水是否新鲜制备,贮存不得超过24小时。 1.5 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是 否已准备齐全。 1.6 检查确认生产场所的温度是否在规定范围内(18-26℃,相对湿度在 30%-65%)。 2 洗瓶、干燥灭菌 2.1理瓶:根据“批生产指令”准备所需的清洁盘、领取必须的安瓶。在 理瓶室将安瓶的合格品摆满瓶盘。 2.2粗洗:把安瓿瓶盘放在不锈钢传送链条上,开动洗瓶机用高压循环纯 化水洗安瓿瓶内外壁。将安瓿瓶盘对称放置,固定在甩水机上,启动 甩水机,甩水处理8分钟,至安瓶甩干。重复上述操作。 2.3 精洗:用水温50--60℃,经孔径0.45um滤膜滤过的澄明度合格的 注射用水清洗安瓿瓶内外壁,重复粗洗步骤。定时检查安瓿的清洁度: 目检1000ml注射用水无可见异物,抽50支,毛、块≤2%。 2.4 干燥与灭菌:安瓿盘均匀放入烘干箱内,150℃烘干1小时,消除热 原。 2.5 灭菌后的安瓿立即使用或清洁存放,贮存不得超过48小时。洗瓶岗 位按清场SOP进行清场,并填写生产记录。 3 称量、配料 原辅料除去外包装、经净化处理后,经缓冲区进入称量室。对称量室 内的案称、天平、量筒等计量器具进行校零。称量人核对原辅料、中
恩诺沙星溶液生产工艺规程
制药有限公司 恩诺沙星溶液生产工艺规程 颁发单位:GMP办公室
工艺规程批准程序
目录 1、产品概述 (3) 2、生产的工艺流程图 (4) 3、操作过程及工艺条件 (4) 4、生产质量控制要点 (6) 5、设备一览表及主要设备生产能力 (6) 6、工艺验证及具体要求 (7) 7、中间品的控制 (7) 8、验证工作要点 (7) 9、工艺卫生和环境卫生 (7) 10、技术经济指标计算 (8) 11、技术安全及劳动保护 (9) 12、劳动组织与岗位定员 (9)
一、产品概述 (1)产品名称 商品名: 通用名:恩诺沙星溶液 (2)剂型:溶液 (3)规格:500ml:25g;包装规格:500ml/瓶(4)处方:300L水+7.5kg恩诺沙星 (5)依据:二OO五版《中国兽药典》一部(6)有效期:二年 (7)成品贮存方法及注意事项: 成品贮存方法:遮光、密闭保存。 注意事项:按用法用量使用。 (8)原辅材料、半成品和成品质量标准:参见:塑料瓶质量内控标准 标签、说明书内控质量标准 纯水内控质量标准 恩诺沙星内控质量标准 恩诺沙星溶液半成品内控质量标准 恩诺沙星溶液成品内控质量标准 (9)原辅材料贮存注意事项: 贮藏:遮光、密封,在阴凉处保存(10)半成品检查方法及生产质量控制 恩诺沙星口服液半成品检验标准操作规程(11)包装要求:20瓶/件 (12)标签、说明书(附样本):
二、流程图: 注:加粗部分为主要控制点 三、操作过程及工艺条件 1 生产前的检查与确认 1.1是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格证”。 1.2检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上“合格”标示。 1.3所使用原辅料是否准备齐全。是否有质量检验报告单,合格品才能使用。 1.4 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是否已准备齐全。 2 称量、配料 2.1原辅料或中间产品,除去外包装、经净化处理后,经缓冲区进入称量室。对称量室 内的案称、天平、量筒等计量器具进行校零。称量人核对原辅料、中间产品的品名、
口服液工艺设计规程10ml
专业文档 1. 主题内容 (1) 2. 适用范围 (1) 3. 责任 (3) 4. 产品名称及剂型 (1) 5. 产品概述 (2) 5.1.产品特点 (2) 6. 工艺流程图 (2) 7. 操作过程及工艺条件 (3) 7.1.处方 (2) 7.2.称量 (3) 7.3.配液 (3) 7.4.理瓶 (3) 7.5.洗瓶 (4) 7.6.灌装加塞轧盖 (3) 7.7.操作过程 (4) 7.8.灭菌 (4) 7.9.灯检 (4) 7.10.包装 (4) 8. 生产过程中重点工艺控制检查(包括中间体检查) (5) 9. 技术安全与劳动保护 (6) 9.1.工作场所 (6) 9.2.机器设备 (6) 9.3防火 (6) 9.4.工艺卫生 (6) 10.操作工时与生产周期 (7) 11.原辅料质量标准 (7) 12.包装材料质量标准 (7) 13.成品、半成品、中间体质量标准 (8) 14.劳动组织与岗位定员 (7) 15.主要设备一览表 (8) 16.原材料消耗定额 (8) 17.物料平衡、收率 (8) 1主题内容本文件规定了口服液的生产工艺过程、人员配备、原辅材料、包装材料的技术要求、安全生产要求、三废处理、物料平衡等内容。 2适用范围本文件是生产口服液的基础技术文件,用于指导生产操作。 3责任本文件由生产技术部负责起草,质量管理部经理审核,总经理批准。 4产品名称及剂型 产品名称:单糖浆口服液 汉语拼音名: dan tang jiang kou fu ye
5产品概述 5.1产品特点 5.1.1性状:本品为淡棕色的液体,无味5.1.2规格:10ml/瓶 5.1.3类别:口服溶液剂 5.1.4用法与用量:-- 5.1.5贮藏:遮光,密封保存 5.1.6有效期:二年 6工艺流程图 7操作过程及工艺条件 7.1处方
小容量注射液生产工艺规程
制药有限公司 小容量注射液生产工艺规程 文件编号:1 颁发单位:GMP办公室
工艺规程批准程序 1. 剂型、规格 (2) 2. 生产工艺流程 (2) 3. 操作过程及工艺条件 (3) 4.质量控制要点 (6) 5.设备一览表、主要设备生产能力 (6) 6.工艺过程中的SOP (7) 7.中间产品的控制 (8) 8.验证工作要点 (8) 9.工艺验证的具体要求 (9) 10.工艺卫生和环境卫生 (9) 11.劳动组织及岗位定员 (9)
一、制剂类型:最终灭菌小容量注射液,10ml规格,安瓿瓶包装。 二、流程图:小容量注射液生产工艺流程图
三、操作过程及工艺条件 1 生产前的检查与确认 1.1 是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格 证”。 1.2 检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上 “合格”标示。 1.3 所使用原辅料是否准备齐全。是否有质量检验报告单,合格品才能 使用。 1.4 检查工艺用水是否新鲜制备,贮存不得超过24小时。 1.5 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是 否已准备齐全。 1.6 检查确认生产场所的温度是否在规定范围内(18-26℃,相对湿度在 30%-65%)。 2 洗瓶、干燥灭菌 2.1理瓶:根据“批生产指令”准备所需的清洁盘、领取必须的安瓶。在 理瓶室将安瓶的合格品摆满瓶盘。 2.2粗洗:把安瓿瓶盘放在不锈钢传送链条上,开动洗瓶机用高压循环纯 化水洗安瓿瓶内外壁。将安瓿瓶盘对称放置,固定在甩水机上,启动 甩水机,甩水处理8分钟,至安瓶甩干。重复上述操作。 2.3 精洗:用水温50--60℃,经孔径0.45um滤膜滤过的澄明度合格的 注射用水清洗安瓿瓶内外壁,重复粗洗步骤。定时检查安瓿的清洁 度:目检1000ml注射用水无可见异物,抽50支,毛、块≤2%。 2.4 干燥与灭菌:安瓿盘均匀放入烘干箱内,150℃烘干1小时,或350℃ 烘干5分钟,消除热原。 2.5 灭菌后的安瓿立即使用或清洁存放,贮存不得超过48小时。洗瓶岗 位按清场SOP进行清场,并填写生产记录。 3 称量、配料 原辅料除去外包装、经净化处理后,经缓冲区进入称量室。对称量室内的
双黄连口服液生产工艺规程
制药有限公司 双黄连口服液生产工艺规程 颁发单位:GMP办公室
工艺规程批准程序
目录 1、剂型及规格 (3) 2、处方和依据 (3) 3、生产过程质控要点 (3) 4、生产的工艺流程图 (4) 5、操作过程及工艺条件 (4) 6、工艺过程中所需SOP名称及要求 (8) 7、工艺卫生及环境卫生 (8) 8、工艺验证及具体要求 (9) 9、设备一览表及主要设备生产能力 (9) 10、物料平衡及经济技术指标计算 (9) 11、技术安全及劳动保护 (10) 12、劳动组织与岗位定员 (10)
1.剂型及规格 剂型:合剂。 2.处方和依据 2005版《中华人民共和国兽药典》第二部。3.生产过程质控要点:
4.生产的工艺流程图 5.操作过程及工艺条件 5.1 生产前准备: 5.1.1上一批次是否进行清场。清场者、检查者是否签字,将“清场合格证” 副件归入本批生产记录。未取得清场合格证不得进行下一批次的生产。 5.1.2检查生产场所的环境、设施卫生是否符合该区域清洁卫生要求。不得 有上批生产遗留物。 5.1.3检查设备有“已清洁”标牌,并进行试运转,检查合格后,挂上“运 行中”标牌后才能使用。所有工具、容器、设备是否已按清洗规程完
成并符合标准。 5.1.4对计量容器、衡器要进行检查、校正以后才能使用。 5.1.5检查与生产相适应的相关文件,记录等是否齐全。 5.1.6对所用物料、半成品核对品名、规格、批号、数量,准确无误后方可 使用。 5.2 指令的下达: 由生产部提前一天下达批生产指令单与批包装指令单,质管部审核后工艺员将批生产指令一份送中药原辅料仓库管理员,另一份送生产部口服液车间班长,准备生产。 5.3 备料 仓库管理员根据批生产指令,按《原辅料备料、称量岗位操作规程》准备所需原料、辅料,按包装指令和《标签、包装、使用说明书管理制度》准备规定数量的包装材料。并由质量监督员复核品名、数量、规格、编号、检验报告单,复核无误后,通知生产部领料。 5.4 领料 5.4.1由领料员接收物料,领料时严格按《领料岗位操作规程》操作,并由 质量监督员进行监督复核,复核物料的品名、规格、编号、数量、供 货单位及检验合格证明,核对无误后由领料员在领料单及批生产指令 单上签字。领料员将物料送到车间,在提取车间将包装袋外灰尘用抹 布擦试干净。 5.4.2不合格的物料拒绝接收。 5.5 称量 5.5.1进行生产前检查,检查合格后按《提取车间称量配料岗位操作规程》进行 操作。 5.5.2原料、辅料按生产指令单下达的要求的重量及原料水分、含量进行计算称 量,填写岗位记录和盛装单并悬挂于周转桶上,标明品名、批号、编号、数量、使用日期、使用者。剩余的原料退回原料库。 5.5.3称量后的净药材,从提取罐的投料口放入提取罐中,打开自来水阀门加入 自来水3000kg,封闭投料口。
小容量注射剂生产工艺
小容量注射剂生产工艺 ***制药有限公司工艺规程文件编号:PP-ZJ-***-** 小容量注射剂生产工艺规程通则 目录 1.小容量注射剂生产工艺流程图、小容量注射剂车间概况(附图) 2.需要验证的关键工序及工艺验证(列表) 3.操作过程及工艺条件 4.技术安全、工艺卫生及劳动保护
5.物料平衡及技经指标 6.设备一览表 7.岗位定员 8.附件目录(岗位操作、清洁规程) 2/ 10 小容量注射剂生产工艺规程通则. ***制药有限公司工艺规程文件编号:PP-ZJ-***-** 1.可灭菌小容量注射剂的生产流程图
小容量注射剂车间概况(附图) 3/ 10 小容量注射剂生产工艺规程通则. ***制药有限公司工艺规程文件编号:PP-ZJ-***-** 说明:由质监科按洁净厂房监控制度SMP-ZL-014对洁净区进行监控,由工程设备科负责维修,车间应根据实际使用情况提出相应的建议,保证洁净厂房在使用中符合GMP的规定。
说明:每年需按验证管理制度SMP-ZL-012对上述关键工序及工艺进行验证(再验证或回顾性验证)。若系统、设备设施发生变更则必须进行相应的验证。 验证由厂验证小组负责。车间应根据情况及时提出相应的申请。 3.操作过程及工艺条件 3.1 工艺用水: 3.1.1 操作过程: 3.1.1.1 原水为符合国家饮用水的标准自来水。 3.1.1.2 纯化水由原水经石英砂过滤→精滤(PE棒)→阴床→阳床→混床→紫外灯灭菌→进入贮罐。 3.1.1.3 注射用水由纯化水经多效蒸馏水机经过蒸馏而得。 4/ 10 小容量注射剂生产工艺规程通则. ***制药有限公司工艺规程文件编号:PP-ZJ-***-** 3.1.2 工艺条件: 3.1.2.1 原水应符合国家饮用水标准。 3/h。3.1.2.2 原水的预处理的进水流量应≤3m 3/h。温床的流量为3m 3.1.2.3 3.1.2.4 多放蒸馏水机蒸气压力应在0.30~0.4Mpa之间,压缩空气压力应在0.3~0.4MPa之间。 3.1.2.5 纯化水的电导率应≤2us/cm,离子检查符合?中国药典?2005版二部“纯化水”的标准。 注射用水的电导率≤2us/cm,离子检查符合?中国药典?2005版二部“注射用水”的标准。 3.2 理瓶工序 3.2.1 本公司可灭菌小容量注射剂所选用直接接触药品的容器为低硼硅玻璃安
冻干粉针生产工艺规程通则
1.目的:建立冻干粉针生产工艺规程,确保冻干粉针的生产过程按规定程序进行。 2.范围:适用于冻干粉针生产的全过程。 3.责任者:生产管理部技术员、质量管理部QA 监督员、车间工艺员、各工段长、操作工。 题 目 冻干粉针工艺规程通则 编 码 STP-TF (Z ) -1001-02 制 定 人 制定日期 审 核 人 审核日期 批 准 人 批准日期 颁发部门 生产管理部 颁发数量 3份 执行日期 替 代 STP-TF (Z ) -1001-01 分发部门 质量管理部、生产车间、生产管理部 变更原因 更换版本 共 11 页 第 1 页 黑龙江澳利达奈德制药有限公司 HEILONGJIANG AOLIDANED PHARMACEUTICAL CO.,LTD . 标 准 技 术 规 程
4.正文 冻干粉针工艺流程及环境区域划分示意图。 操作过程及工艺条件 4.2.1洗瓶 4.2.1.1瓶子需经纯化水或注射用水冲洗,最终淋洗用μm滤膜滤过的注射用水至少冲洗一次。 4.2.1.2洗净的瓶子应在4小时内灭菌,灭菌温度设为350℃,时间在5分钟以上。 4.2.1.3隧道式干热灭菌器已灭菌/去热原瓶子的出口应在单向流保护罩内存放。 4.2.2胶塞清洗:丁基胶塞需用注射用水清洗,至最终淋洗水符合质量要求。 4.2.3胶塞的灭菌:经125℃灭菌150分钟。 4.2.4称量 冻干粉针工艺流程及环境区域划分示意图。
图例 D 级区 C 级区 B 级区 ﹡ A 级区 非最终灭菌无菌冻干粉注射剂工艺流程及环境区域划分示意 图
4.2.4.1按处方及SOP要求配料,记录原辅料代号、品名、批号并做好称量记录。 4.2.4.2称量及计算必须复核,操作人、复核人应在记录上签名。 4.2.4.3剩余的原辅料应封口贮存。 4.2.4.4天平及其他称重设备每次使用前应校正,并定期由计量部门专人校验,校验结果应予记录。 4.2.5配液 4.2. 5.1配制药液用的注射用水必须符合要求。 4.2. 5.2按品种进行在线控制。如测定PH值等。 4.2. 5.3凡接触药液的设备、管道和容器具,应根据SOP进行清洁,必要时进行灭菌处理。 4.2. 5.4在线控制用计量器具应按SOP要求校验后方可使用。 4.2. 5.5按批生产记录及SOP的要求做好各种记录。 4.2.6过滤
口服液生产流程
口服液生产流程 Company number:【0089WT-8898YT-W8CCB-BUUT-202108】
现有业务流程调研报告 生产计划与控制模块 流程编号:AI-PP-010 流程名称:口服液生产流程 流程描述 本流程描述口服液制剂(太太、美容、静心)的生产工艺过程,包括提取、配液、灌装、包装等工序,并记录相关物流、单据的传递过程。 储运部:备料负责人 质保部:生产线检验人员 生产部:各车间主管,工艺负责人 1.生产计划部门根据《周生产计划》将《批生产记录》、《批包装记录》下达到储运部,储运部提前组织备料,将备好的原料和该批料的《批生产记录》存放于备料赞存室,待投料时领用; 2.提取车间按照《周生产计划》的要求领料,在接收批生产纪录、物料时,工序负责人应核对产品名称、批号,物料名称及数量、重量,确认无误后方可接收,接收物料后,工序负责人应确认该批料在那条提取线生产,无误后方可投料生产。生产中按照《批生产记录》及工艺规程的要求,进行浸泡、煎
煮、一次离心、浓缩、二次离心等工艺操作,及时监控并调整生产设备的各项技术指标,同时详细记录各生产工艺过程中的浓度、密度、PH值、温度等各项指标,生产出合格的口服液浓缩原液,暂存在储液罐中; 3.配液车间通过炼蜜工艺生产配液用辅料,生产完成后将生产信息如批号、日期等在《生产控制台帐》登记; 4.在配液车间按照《批生产记录》的工艺要求,经过配液、第三次离心、精滤、定容等四步工艺,并将生产的各项参数指标记录在《批生产记录》;5.在口服液车间的注塑工序,按计划生产10毫升、15毫升两种规格的PP瓶身、瓶底;其生产是根据库存量及月度口服液生产计划安排生产,货物存放由注塑工序自行管理; 6.灌装工序按照《批生产记录》及工艺规程的要求,经灌装、理瓶、打压、灭菌等四道工序,完成中间产品的生产; 7.灭菌完成后,质保部门对每批产品抽检,该检测时间为72小时(成品检测); 8.清洗中间产品,存放24小时待包装; 9.储运部按照《周生产计划》提前备料,将包装材料提前配货到包装车间,并由提料工将包装材料提前存放在包材周转区,等待领用; 10.包装车间,按照生产计划部门下达的《周生产计划》包装要求,到储运部包材周转区领取包材及《批包装记录》,同时复核包材编码、名称、数量等,无误后则上线首检生产包装入库。
口服液生产工艺规程参考
(前面目录包括1-3项参照片剂) 4 产品概述 4.1 产品名称及剂型 产品名称:鹿茸口服液 剂型:液体口服液剂 4.2产品特点 4.2.1规格:每支装10ml。 4.2.2性状:本品为橙黄色的澄清液体;气芳香,味甜。 4.2.3功能与主治:温肾壮阳,生精养血,补髓健骨。用于阳萎滑精,胃寒无力,血虚眩晕,腰膝痿软,虚寒血崩。 4.2.4用法与用量:口服,一次10ml,一日2次。 4.2.5贮藏:密封,置阴凉处。 4.3 处方来源 本处方出自。。。。。。。。。。。。(此处写自己处方来源,和标准号)
5.处方与依据 5.1处方 物料名称处方量批量 鹿茸(去毛) 10g 7.2kg 蜂蜜 700g 504kg 枸橼酸钠 10g 7.2kg 香精(乙醇溶解)适量适量 制成 1000ml 7.2万支 5. 2依据:部颁标准十一册九六版第176页 批准文号:国药准字Z22022653 6.生产工艺流程 见附录中附图:鹿茸口服液生产工艺流程图 7.原药材的整理炮制 《中国药典》2010年版一部 7.2 整理炮制依据:《中华人民国药典》2010年版(一部)(附录 D药材炮制通则)的方法和操作。 8 操作过程及工艺条件(按100付处方量) 8.2 提取 8.2.1 物料恒算 8.2.2提取当归、川芎 8.2.3操作人员将领取的当归、川芎,投入多功能提取罐中,加入药材重量的6倍量的饮用水,浸泡1小时后,将汽阀打开,同时打开冷却循环水,开始蒸馏。用洁净的容器收集芳香液(芳香液为白色浑浊液体),每隔2小时记录一次,直至芳香液无白色为止。在蒸馏过程中温度控制在95~100℃,夹层压力不得超过0.1MPa。芳香液放入洁净桶中,入冷库。 8.2.4设备操作执行型多功能提取罐标准操作规程。 8.2.5提取鹿茸口服液提取液
最终灭菌小容量注射剂通常工艺处理制度
最终灭菌小容量注射剂通用 工 艺 规 程
###动物药业有限公司GMP管理文件 一、目的:建立最终灭菌小容量注射剂通用工艺规程,保证产品生产工艺符合《兽药生产质量管理规范》的要求,产品质量符合产品法定质量标准的规定。 二、适用范围:适用于最终灭菌小容量注射剂通用生产工艺管理。 三、责任者:技术部负责人、生产部负责人、质管部负责人、车间主任、QC检验员、QA检查员。 四、内容目录: 一、产品简介 (3) 二、工艺流程及环境区域划分 (3) 三、处方和依据 (4) 四、操作过程及工艺条件 (5) 五、设备一览表及主要设备生产能力 (11) 六、技术安全、劳动保护及卫生要求 (14) 七、包装要求、标签说明书管理与产品贮存方法 (16) 八、劳动组织与定岗定员 (18) 九、产品质量标准 (19) 十、各工序质量控制要点和检查方法 (19)
十一、消耗定额、技术经济指标、物料平衡以及各项指标的计算方法 (24) 十二、产品相关验证的具体要求 (25) 十三、主要标准操作规程(SOP)名称及要求 (28) 十四、附录(常见理化常数、曲线、图表、计算公式及换算表等) (36) 十五、附页(变更记录) (38)
一、产品简介 包括产品名称(通用名、商品名)、批准文号、剂型、规格和包装等,这些都必须以国家法定质量标准或国家兽药行政管理部门所批准的为准。 二、工艺流程及环境区域划分
100000级区10000级区 三、处方和依据 1 处方:根据具体产品处方而定,详见产品工艺规程。 2 依据:根据具体产品执行标准而定,详见产品工艺规程。
注射剂生产工艺流程与厂方设计布局
2.2注射剂生产工艺流程简介 图1:注射剂生产流程图 由图1,注射剂生产流程图可以看出: 注射剂生产流程[4]主要包含以下工序:原料领料工序,要求领料人员进行原料品种、批号的复核。原料经过拆外包工序,由一般区经传递窗消毒和灭菌后,传递至十万级暂存称量间存放。称量工序,要求操作人员准确对衡器进行校验,进行称量时要求双人二次复核品种、批号和质量并做好标识。配液工序要求操作人员应完全遵守并按照生产指令和生产工艺卡片执行配液的各项操作,依此保证生产出合格的中间品(半成品)。半成品经取样交质保部检测,检测标准依据《兽药典》[5]半成品检验检测合格后,药液被送入灌装工序。 内包材领料工序,要求领料人员复核瓶子外观和规格。经过拆外包后,由一般区经传递窗传至十万级洗瓶间,由洗瓶机进行洗瓶。西林瓶经超声清洗后进行烘干灭菌工序,按照生产工艺要求和实际生产需要进行洗瓶,根据生产要求,合理控制洗瓶数量,待灭菌冷凉瓶后,由十万级经传递窗转移至万级灌装间进入灌封工序。灌封工序为灌装和加塞操作,其主要要求是最大限度保证装量均匀度。灌装加塞后由传送带送至十万级扎盖间,进行扎盖工序后,进行最终灭菌工序,按照每种产品的灭菌工艺要求灭菌。灯检工序要求按生产操作规程进行灯检,应明确标识待灯检品的品种、批号,灯检后的合格与不合格品,杜绝混批事故出现。灯检合格后,进行贴签。 外包装材料领料工序,其主要要求准确复核标签规格和批准文号。依据生产 贴 签 湿热灭菌 灯 检 包 装 装 箱 入 库 拆外包 原 料 配 液 称 量 灌 封药液 西林瓶 拆外包 洗 瓶 烘干灭菌 扎 盖 库房领料 批 生 产 指 令
指令进行打印标签和合格证,经复核无误后进行贴签。贴签工序要求按统一整齐美观标准进行贴签。包装后进行装箱,装箱要求产品按顺序摆放并放置合格证。包装完毕后进行入库。 3.生产车间介绍 3.1车间平面布局 图2:注射剂车间平面布局图 由图2,注射剂车间平面布局图可以看出: 注射剂车间包含非洁净区的普通区和洁净区的十万级区和万级区[6]。非洁净区(普通区)与洁净区的十万级区间人流通道设有缓冲间,物流通道设有传递窗,洁净区内不同洁净级别间,十万级区与万级区间同样设有缓冲间和传递窗。 非洁净区和洁净区分别配有各自级别内且独立的其他房间有洁具洗、洁具存和器具洗、器具存,以及洗衣间和整衣间。其中洁净区的洗衣间设在十万级区,万级服在洗衣间(十万级)洗衣后,经低温烘干臭氧灭菌柜(双扉互锁)灭菌后,由后门整衣间(万级)取出并整衣备用。 此外,普通区的地面为灰色环氧树脂涂层,十万级区为绿色环氧树脂自流平,万级区为黄绿色环氧自流平。
口服液工艺规程10ml
1. 主题内容 (2) 2. 适用范围 (2) 3. 责任 (3) 4. 产品名称及剂型 (2) 5. 产品概述 (2) 5.1.产品特点 (2) 6. 工艺流程图 (2) 7. 操作过程及工艺条件 (3) 7.1.处方 (3) 7.2.称量 (3) 7.3.配液 (3) 7.4.理瓶 (3) 7.5.洗瓶 (4) 7.6.灌装加塞轧盖 (4) 7.7.操作过程 (4) 7.8.灭菌 (4) 7.9.灯检 (4) 7.10.包装 (5) 8. 生产过程中重点工艺控制检查(包括中间体检查) (5) 9. 技术安全与劳动保护 (7) 9.1.工作场所 (7) 9.2.机器设备 (6) 9.3防火 (7) 9.4.工艺卫生 (7) 10.操作工时与生产周期 (7) 11.原辅料质量标准 (8) 12.包装材料质量标准 (8) 13.成品、半成品、中间体质量标准 (8) 14.劳动组织与岗位定员 (8) 15.主要设备一览表 (9) 16.原材料消耗定额 (9) 17.物料平衡、收率 (10)
1主题内容本文件规定了口服液的生产工艺过程、人员配备、原辅材料、包装材料的技术要求、安全生产要求、三废处理、物料平衡等内容。 2适用范围本文件是生产口服液的基础技术文件,用于指导生产操作。 3责任本文件由生产技术部负责起草,质量管理部经理审核,总经理批准。 4产品名称及剂型 产品名称:单糖浆口服液 汉语拼音名: dan tang jiang kou fu ye 5产品概述 5.1产品特点 5.1.1性状:本品为淡棕色的液体,无味 5.1.2规格:10ml/瓶 5.1.3类别:口服溶液剂 5.1.4用法与用量:-- 5.1.5贮藏:遮光,密封保存 5.1.6有效期:二年 6工艺流程图
小容量注射剂生产工艺规程通则
目 录 1. 小容量注射剂生产工艺流程图、小容量注射剂车间概况(附图) 2. 需要验证的关键工序及工艺验证(列表) 3. 操作过程及工艺条件 4. 技术安全、工艺卫生及劳动保护 5. 物料平衡及技经指标 6. 设备一览表 7. 岗位定员 8. 附件目录(岗位操作、清洁规程) ? 1. 可灭菌小容量注射剂的生产流程图
100000级区域 小容量注射剂车间概况(附图) 说明:由质监科按洁净厂房监控制度SMP-ZL-014对洁净区进行监控,由工程设备科负责维修,车间应根据实际使用情况提出相应的建议,保证洁净厂房在使用中符合GMP的规定。
说明:每年需按验证管理制度SMP-ZL-012对上述关键工序及工艺进行验证(再验证或回顾性验证)。若系统、设备设施发生变更则必须进行相应的验证。 验证由厂验证小组负责。车间应根据情况及时提出相应的申请。 3.操作过程及工艺条件 3.1工艺用水: 3.1.1操作过程: 3.1.1.1原水为符合国家饮用水的标准自来水。 3.1.1.2 纯化水由原水经石英砂过滤→精滤(PE棒)→阴床→阳床→混床→紫外灯灭菌→进入贮罐。 3.1.1.3 注射用水由纯化水经多效蒸馏水机经过蒸馏而得。 3.1.2工艺条件: 3.1.2.1 原水应符合国家饮用水标准。 3.1.2.2 原水的预处理的进水流量应≤3m3/h。 3.1.2.3 温床的流量为3m3/h。 3.1.2.4 多放蒸馏水机蒸气压力应在0.30~0.4Mpa之间,压缩空气压力应在0.3~0.4MPa之间。 3.1.2.5纯化水的电导率应≤2us/cm,离子检查符合?中国药典?2005版二部“纯化水”的标准。 注射用水的电导率≤2us/cm,离子检查符合?中国药典?2005版二部“注射用水”的标准。 3.2 理瓶工序
鱼腥草注射液生产工艺规程资料
鱼腥草注射液 工 艺 规 程 ***********有限公司
鱼腥草注射液工艺规程 (一)产品概述 产品名称:鱼腥草注射液 剂型:最终灭菌小容量注射剂 规格:10ml/支,每1ml相当与原药材2g.。 性状:本品为无色或微黄色的澄明液体,有鱼腥味。 包装规格:10ml/支×5支/盒×120盒/箱 批量:60L 批准文号:待批 (二)处方和依据 1. 处方: 原辅料处方量规格每100支量鱼腥草 2.0kg 提取液 聚山梨酯80 3g 分析纯 氯化钠9g 分析纯 用注射用水稀释至1000ml 每千支量 鱼腥草20kg 提取液 聚山梨酯80 30g 分析纯 氯化钠90g 分析纯 注射用水适量稀释至10000ml
每批量 鱼腥草120kg 提取液 聚山梨酯80 180g 分析纯 氯化钠540g 分析纯 注射用水适量稀释至60000ml 2. 依据标准:《中华人民共和国兽药典》2005年版二部
(四)生产工艺操作过程及条件 4.1原辅料的领取 根据本工艺处方及生产指令,车间领料员填写领料单,经车间主任签字后,按“原辅料领用发放规程”到原辅料仓库领取辅料。领料前,认真核对所领辅料的品名、规格、批号、生产厂家用及检验合格报告单和辅料放行单,核对无误后,称取规定量的辅料,需拆零称量的辅料,可以整件领取到车间称量室称量,剩余辅料包装密闭,挂上物料标签,并填上品名、批号、当次称量日期、剩余量,称量人签名。仓库保管员及车间领料员分别称量及复核,并在领料单上签字,运至中药提取车间,同步填写生产记录,与下工序进行交接。 4.2提取冷凝 取药材饮片,置提取罐中,以水浸没药材为度,冷浸1小时,加温至100℃,提取2小时,收集冷凝液,用整洁密闭的容器在洁净取样车内进行提取冷凝液的采集(洁净级别不低于10万级)。转入小容量注射剂车间,进行注射剂的配制。 4.3 配制 4.3.1 配制的洁净级别为10万级洁净区。配制应检查生产指令内容与生产所用的原辅料进行核对。取检验合格的鱼腥草蒸馏和辅料聚山梨酯80、氯化钠,清洁后脱去外包,消毒后经传递窗传至配制室,核对生产指令及处方,然后进行称量。 4.3.2 先向浓配罐内加入1/3量的合格的注射用水。 4.3.3 按照原辅料顺序进行投料,搅拌至全溶。 4.3.4用钛棒过滤器过滤至稀配罐。加注射用水至规定体积。 4.3.5 测试半成品,检验合格后再用钛棒过滤器过滤,进行灌装。 4.3.6 称量前应该对原辅料品名、批号、生产厂家、规格等,应与检验报告单相符。调 换原辅料供应商时应有小样试验合格单或已经经过验证的报告。 4.3.7称重前应先对称量器(定期由计量部门校验)校零,确认无误后再进行称量,称量 时必须有复核人,操作人和复核人均应在称量原始记录上签名。处方必须复核按处方量的100%投料。 4.3.8配料前应对配料罐的容量进行验证。每一个配制罐必须标明配制液的品名、规格批号和配制量。 4.3.9配制时,每一种原辅料的加入和调制,必须由核对人确认并做好记录。配制过程中
口服液生产工艺规程
制药有限公司 口服液生产工艺规程颁发单位:GMP办公室
工艺规程批准程序
目录 1. 剂型、规格 (3) 2. 生产工艺流程 (3) 3. 操作过程及工艺条件 (4) 4.质量控制要点 (6) 5.设备一览表、主要设备生产能力 (6) 6.工艺过程中的SOP (7) 7.中间产品的控制 (7) 8.验证工作要点 (7) 9.工艺卫生和环境卫生 (8) 10.劳动组织及岗位定员 (8)
一、制剂类型:非最终灭菌口服液生产,500ml 规格,洁净塑料瓶包装。 二、流程图: 口服液生产工艺流程图 注:加粗部分为主要控制点 三、操作过程及工艺条件
1 生产前的检查与确认 1.1是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格证”。 1.2检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上“合格” 标示。 1.3所使用原辅料是否准备齐全。是否有质量检验报告单,合格品才能使用。 1.4 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是否已准备齐全。 2 称量、配料 2.1原辅料或中间产品,除去外包装、经净化处理后,经缓冲区进入称量室。 对称量室内的案称、天平、量筒等计量器具进行校零。称量人核对原辅料、中间产品的品名、规格、批号、合格证等确认无误后记录、签名。 称量必须复核,复核人对品名、数量确认无误后记录、签名。配好的批量辅料、中间产品装入洁净密闭容器中,附上标志,注明品名、规格、批号、数量称量人、日期。 3 配制、过滤 3.1口服液的质量,采用纯水配制。称量好的原辅料、中间产品加入到500L 配液罐中,注根据不同产品的工艺要求进行配制,配制好的药液应作性状、PH、相对密度、定性、定量等质量检验。配制中添加的防腐剂、抑菌剂的品种和用量应当无害、不影响疗效,对质量标准规定的检验方法无干扰。 3.2要求选用适宜的滤材及过滤方法(经验证确认的方法),过滤后药液先经 含量、澄清度检查合格后打入灌装室。 4 灌装、旋盖、封口 4.1瓶子必须是不低于10万级净化环境生产,并经微生物检验合格的产品。 灌装前检查所用瓶子是否有检验合格证,包装是否完好、洁净。开机灌装初期应检查装量,调整至装量符合要求后,正式操作。配制好的药液应在当天灌装完毕。 4.2旋盖、封口时检查瓶盖的紧密度,质量符合要求后正式操作。操作过程 中随时检查装量和旋盖、封口质量,剔除不合格品。
11恩诺沙星注射液生产工艺规程
目录1产品概述 2处方依据 3生产工艺流程及环境区域划分示意图4操作过程及工艺条件 5工艺卫生和环境卫生 6质量控制要点 7原辅材料、中间产品和成品的质量标准8技术安全及劳动保护 9原辅材料的消耗定额、技术经济指标10主要设备及生产能力 11劳动组织及岗位定员 12物料平衡以及各项指标的计算方法 13常用理化常数及换算表 14、附页
目的:建立恩诺沙星注射液生产工艺流程,使其生产能按规定的工艺程序进行。范围:适用于恩诺沙星注射液的生产。 职责:生产管理部、小容量注射剂生产车间及质量管理部对本规程的实施负责。规程: 1 产品概述 1.1品名及规格 通用化学名称:恩诺沙星注射液 规格:100ml:2.5g 包装规格:5 ml×5支×60盒 1.2剂型 小容量注射剂(安瓿瓶拉丝灌封) 2 处方与依据 2.1处方 2.2 依据: 1、《中华人民共和国兽药典》2000年版一部 2、批准文号:粤兽药字
3 生产工艺流程示意图 一般生产区为100000级区为10000级区
4 操作过程及工艺条件 4.1 安瓿的处理 4.1.1拆外包与理瓶: 按领料单领来安瓿,先在拆外包间做好安瓿箱的外清洁,除去外包装箱后由物料传递口传入理瓶间,将安瓿整理并清出破损安瓿后,装盘,送入粗洗瓶间,进行清洗。 4.1.2安瓿的清洗及干燥灭菌: 4.1.2.1首先按超声波洗瓶机操作要求调试机器,检查使用纯化水是否合格,合格方可 使用,检查超生波洗瓶机各运转部位的润滑情况,接通电源,开动超生波洗瓶机试运行。一切正常后,将安瓿托盘置于安瓿洗瓶机清洗槽内,开始进行粗洗。粗洗使用水源为纯化水。将用纯化水进行粗洗后的安瓿瓶,经传递窗传至精洗 间,精洗瓶条件为100000级区,精洗使用水源为经孔径为0.45μm滤膜滤过的澄明度合格的注射用水。 4.1.2.2清洗干净后安瓿应进行清洁度检查。 4.1.2.3清洗干净后安瓿必须在4小时内灭菌处理。 4.1.2.4将安瓿置于托盘上烘箱内进行灭菌,灭菌条件为167O C、120分钟; 4.1.2.5安瓿干燥后,由灌装岗位操作人员出瓶,并将安瓿凉瓶间自然冷却降温待用, 贮存至使用时间不得超过24小时。 4.2原辅料称量备料 4.2.1称量备料 4.2.1.1从质量管理部批准的供货单位进购原辅材料。原辅料须验合格由质量管理部门放 行后,方可使用。原辅料生产商的变更应通过小样试验,必要时须通过验证。 4.2.1.2物料应经脱外包间及传递窗进入暂存室,原辅料配料室的环境和空气洁净度与生 产一致,并有捕尘和防止交叉污染措施。 4.2.1.3称量时应一人称量一人复核,并填写相应称量记录,称量好后的物料应做好明显 的状态标志。 4.3配液 4.3.1检查配好料的物料标签,物料标签应标有品名、规格、批号、数量、日期和操作者
