麦克斯韦—玻尔兹曼分布(M—B分布)

麦克斯韦—玻尔兹曼分布(M—B分布)
麦克斯韦速率分布律的推导和验证
完美WORD 格式 编辑 麦克斯韦速度分布律的推导与实验验证 摘要:本文对麦克斯韦速度分布律的内容及其历史来历做了简略概述,重点是用初等方法 推导了麦克斯韦速度分布律,同时简单地描述了一下它的实验验证。 关键词:速度分布函数,实验验证。 一. 内容 1、麦克斯韦速度分布律的内容 当气体处于平衡态时,气体分子的速度在v ~v dv +间隔内,及分子速度分量在 x x x v ~v dv +,y y y v ~v dv +,z z z v ~v dv +间隔内的分子数dN(v)占总分子数N 的比率为: 2223 ()/22x y z d v m ()v v v N 2kT x y z m v v v kT N e d d d π-++=(), 其中m 为分子的质量,T 为气体温度,k 为波尔兹曼常数,22 22 11()v 22 x y z m v v v m ++=为气体分子平动能。d v N N () 表示速度矢量的端点在速度体元d τ内的分子数占总 分子数的比率,换言之,一个分子取得v ~v dv +间隔内速度的几率。 2、分子速度分布函数 2223()/22m f ()2kT x y z m v v v kT e π-++=x y z dN(v)(v )=Ndv dv dv f (v )的物理意义是:分子速度在v 附近,单位时间间隔内的分子数占总分子数的比率。 3、速度分量分布函数 2221 /221/221 /22m f ()2kT m f ()2kT m f ()2kT x y z mv kT mv kT mv kT e e e πππ---===x x x y y y z z z dN(v )(v )=Ndv dN(v )(v )=Ndv dN(v )(v )=Ndv 3、麦克斯韦速率分布律
麦克斯韦速率分布律与平动动能分布律关系
麦克斯韦速率分布律与平动动能分布律关系 卜子明(1号) 摘要:麦克斯韦首先把统计学的方法引入分子动理论,首先从理论上导出了气体分子的速率分布率,现根据麦克斯韦速率分布函数,求出相应的气体分子平动动能分布律,并导出与麦克斯韦分布函数类似的一些性质,求出平动动能的最概然值及平均值。并比较相似点和不同点。 引言:麦克斯韦把统计方法引入了分子动理论,首先从理论上导出了气体分子的速分分布律。这是对于大量气体分子才有的统计规律。现做进一步研究,根据其成果麦克斯韦速率分布函数,导出相应的平动动能分布律,并导出与麦克斯韦分布函数类似的一些性质并求出平动动能的最概然值及平均值,并且由此验证其正确性。 方法:采用类比的方法,用同样的思维,在麦克斯韦速率分布函数的基础上,作进一步研究,导出能反映平均动能在ε附近的单位动能区间内的分子数与总分子数的比的函数 )(εf 的表达式。并由此进一步推出与麦克斯韦分布函 数相对应的一些性质,并比较分析一些不同点。 麦克斯韦速率分布律Ndv dN v f = )(这个函数称为气体分子的速率分布函 数麦克斯韦进一步指出,在平衡态下,分子速率分布函数可以具体地写为 2 223 2 24)(v e kT m Ndv dN v f kT mv πππ-?? ? ??==式中T 是气体系统的热力学温度, k 是玻耳兹曼常量,m 是单个分子的质量。式(8-30)称为麦克斯韦速率分布律。式子 dv v f v v ?=?2 1 )(N N 表示在平衡态下,理想气体分子速率在v 1到v 2 区间的分子数 占总分子数的比率。 而应用麦克斯韦速率分布函数可以求出气体分子三个重要的速率: (1)最概然速率p v ,f(v)的极大值所对应的速率 M RT M RT m kT v p 41 .1220 ≈= = 其物理意义为:在平衡态的条件下,理
麦克斯韦速率分布律、三种统计速率习题11
麦克斯韦速率分布律、三种统计速率 1、选择题 题号:21111001 分值:3分 难度系数等级:1 麦克斯韦速率分布曲线如图所示,图中A ,B 两部分面积相等,则该图表示 (A )0v 为最概然速率 (B )0v 为平均速率 (C )0v 为方均根速率 (D )速率大于和小于0v 的分子数各占一半 [ ] 答案:( D ) 题号:21111002 分值:3分 难度系数等级:1 麦克斯韦速率分布函数)(v f 的物理意义是,它是气体分子 (A ) 处于v 附近单位速率区间的概率 (B ) 处于v 附近的频率 (C ) 处于dv v v +~速率区间内的概率 (D ) 处于dv v v +~速率区间内的相对 分子数 [ ] 答案:( A ) 题号:21111003 分值:3分 难度系数等级:1 气体的三种统计速率:最概然速率p v 、平均速率v 、方均根速率2 v ,它们之间的大小关系为 (A )2..v v v p > > (B )2v v v p ==
(C )2v v v p < < (D )无法确定 [ ] 答案:( C ) 题号:21111004 分值:3分 难度系数等级:1 设在平衡状态下,一定量气体的分子总数为N ,其中速率在dv v v +~区间内的分子数为dN ,则该气体分子的速率分布函数的定义式可表示为 (A )N dN v f = )( (B )dv dN N v f 1)(= (C )vdv dN N v f 1)(= (D )dv v dN N v f 21)(= [ ] 答案:( B ) 题号:21112005 分值:3分 难度系数等级:2 空气中含有氮分子和氧分子,它们两者的平均速率关系为 (A )22O N v v > (B )22O N v v = (C )22O N v v < (D )无法确定 [ ] 答案:( A ) 题号:21112006 分值:3分 难度系数等级:2 已知n 为单位体积分子数,)(x v f 为麦克斯韦速度分量的分布函数,则x x dv v nf )(表 示为 (A )单位时间内碰到单位面积器壁上的速度分量x v 处于x x x dv v v +~区间的分子数 (B )单位体积内速度分量x v 处于x x x dv v v +~区间的分子数 (C )速度分量在x v 附近,x dv 区间内的分子数占总分子数的比率 (D )速度分量在x v 附近,x dv 区间内的分子数 [ ] 答案:( B )
麦克斯韦速率分律与平动动能分布律关系
麦克斯韦速率分律与平动动能分布律关系
————————————————————————————————作者:————————————————————————————————日期:
麦克斯韦速率分布律与平动动能分布律关系 卜子明(1号) 摘要:麦克斯韦首先把统计学的方法引入分子动理论,首先从理论上导出了气体分子的速率分布率,现根据麦克斯韦速率分布函数,求出相应的气体分子平动动能分布律,并导出与麦克斯韦分布函数类似的一些性质,求出平动动能的最概然值及平均值。并比较相似点和不同点。 引言:麦克斯韦把统计方法引入了分子动理论,首先从理论上导出了气体分子的速分分布律。这是对于大量气体分子才有的统计规律。现做进一步研究,根据其成果麦克斯韦速率分布函数,导出相应的平动动能分布律,并导出与麦克斯韦分布函数类似的一些性质并求出平动动能的最概然值及平均值,并且由此验证其正确性。 方法:采用类比的方法,用同样的思维,在麦克斯韦速率分布函数的基础上,作进一步研究,导出能反映平均动能在ε附近的单位动能区间内的分子数 与总分子数的比的函数 )(εf 的表达式。并由此进一步推出与麦克斯韦分布函 数相对应的一些性质,并比较分析一些不同点。 麦克斯韦速率分布律 Ndv dN v f = )(这个函数称为气体分子的速率分布函 数麦克斯韦进一步指出,在平衡态下,分子速率分布函数可以具体地写为 222 32 24)(v e kT m Ndv dN v f kT mv πππ-?? ? ??==式中T 是气体系统的热力学温度,k 是玻耳兹曼常量,m 是单个分子的质量。式(8-30)称为麦克斯韦速率分布律。式子 dv v f v v ?=?2 1 )(N N 表示在平衡态下,理想气体分子速率在v 1到v 2 区间的分子数 占总分子数的比率。 而应用麦克斯韦速率分布函数可以求出气体分子三个重要的速率: (1)最概然速率 p v ,f(v)的极大值所对应的速率 M RT M RT m kT v p 41 .1220≈==其物理意义为:在平衡态的条件下,理
麦克斯韦速率分布律的推导与验证.
麦克斯韦速度分布律的推导与实验验证 摘要:本文对麦克斯韦速度分布律的内容及其历史来历做了简略概述,重点是用初等方法 推导了麦克斯韦速度分布律,同时简单地描述了一下它的实验验证。 关键词:速度分布函数,实验验证。 一. 内容 1、麦克斯韦速度分布律的内容 当气体处于平衡态时,气体分子的速度在v ~v dv +间隔内,及分子速度分量在 x x x v ~v dv +,y y y v ~v dv +,z z z v ~v dv +间隔内的分子数dN(v)占总分子数N 的比率为: 2223 ()/22x y z d v m ()v v v N 2kT x y z m v v v kT N e d d d π-++=(), 其中m 为分子的质量,T 为气体温度,k 为波尔兹曼常数,22 2211()v 22 x y z m v v v m ++=为气体分子平动能。d v N N () 表示速度矢量的端点在速度体元d τ内的分子数占总 分子数的比率,换言之,一个分子取得v ~v dv +间隔内速度的几率。 2、分子速度分布函数 2223()/22m f ()2kT x y z m v v v kT e π-++=x y z dN(v)(v )=Ndv dv dv f (v )的物理意义是:分子速度在v 附近,单位时间间隔内的分子数占总分 子数的比率。 3、速度分量分布函数 2221 /221 /221 /22m f ()2kT m f ()2kT m f ()2kT x y z mv kT mv kT mv kT e e e πππ---===x x x y y y z z z dN(v )(v )=Ndv dN(v )(v )=Ndv dN(v )(v )=Ndv 3、麦克斯韦速率分布律
麦克斯韦速率分布函数的物理意义
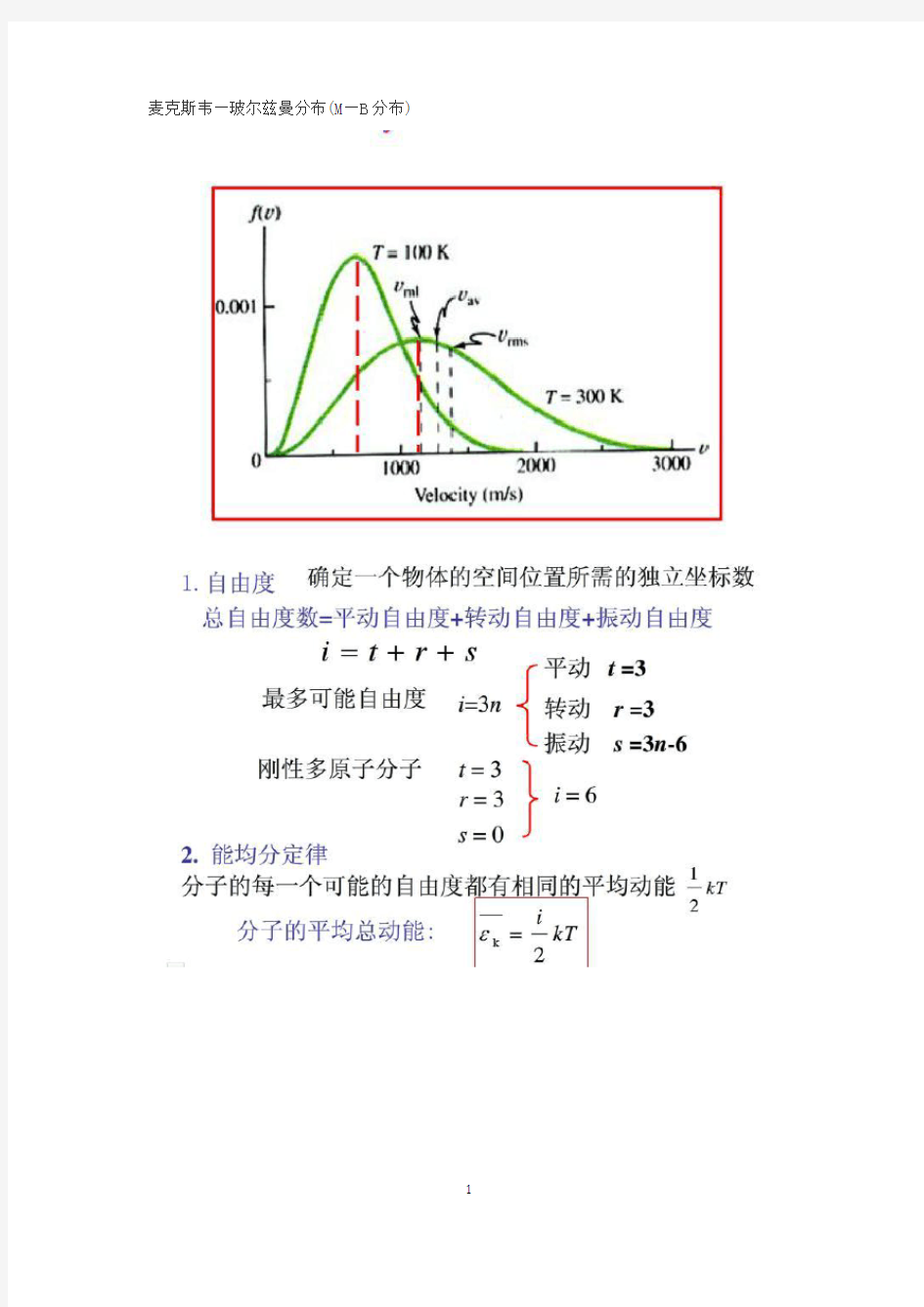
速率分布函数[1]是一个描述分子运动速率分布状态的函数。一个符合玻尔兹曼分布的粒子体系,如理想气体,其体系中粒子运动速率的分布可以用如下的速率分布函数来描述:通常速率分布函数也采用依动量和依动能分布的形式,虽然形式上有所不同但因为动量动能和速率的相关关系,这些表达方式本质上和依速率表示的速率分布函数还是一样的在处理某些特殊体系的情况下可能会用到二维和一维的速率分布函数,如固体表面吸附的理想气体就可以看做是在二维平面上运动的一个二维独立粒子体系,当处理这个体系有关分子运动速率的问题的时候就要用到二维速率分布函数 在平衡状态下,当分子的相互作用可以忽略时,分布在任一速率区间v~v+△v间的分子数dN占总分子数N的比率(或百分比)为dN / N . dN / N是v 的函数,在不同速率附近取相等的区间,此比率一般不相等.当速率区间足够小时(宏观小,微观大),dN / N 还应与区间大小成正比: 其中f(v)是气体分子的速率分布函数.分布函数f(v)的物理意义是:速率在v 附近,单位速率区间的分子数占总分子数的比率. 分布函数f(v)满足归一化条件: 大量分子的系统处于平衡态时,可以得到速率分布函数的具体形式:式中T是热力学温度,m为分子质量,k为玻尔兹曼常数.上式就是麦克斯韦速率分布律. 麦克斯韦速率分布是大量分子处于平衡态时的统计分布,也是它的最
概然分布.大量分子的集合从任意非平衡态趋于平衡态,其分子速率分布则趋于麦克斯韦速率分布,其根源在于分子间的频繁碰撞. 上图是麦克斯韦速率分布函数f(v)示意图,曲线下面宽度为dv 的小窄条面积等于分布在此速率区间内的分子数占总分子数的比率dN/N . 我们可以看到:同一种理想气体在平衡状态下,温度升高时速率分布曲线变宽、变平坦,但曲线下的总面积不变.随着温度的升高,速率较大的分子在分子总数中的比率增大.同一温度下,分子质量m越小,曲线越宽越平坦,在分子总数中速率较大的分子所占比率越高.
麦克斯韦气体速率分布函数
设总粒子数为N,粒子速度在x,y,z三个方向的分量分别为v(x),v(y),v(z)。(1)以dNv(x)表示速度分量v(x)在v(x)到v(x)+dv(x)之间的粒子数,则一个粒子在此dv(x)区间出现的概率为dNv(x)/N。粒子在不同的v(x)附近区间dv(x)内出现的概率不同,用分布函数g(v(x))表示在单位v(x)区间粒子出现的概率,则应有dNv(x)/N=g(v(x))dv(x) 系统处于平衡态时,容器内各处粒子数密度n相同,粒子朝任何方向运动的概率相等。因此相应于速度分量v(y),v(z),也应有相同形式的分布函数g(v(y)), g(v(z)),使得相应的概率可表示为 dNv(y)/N=g(v(y))dv(y) dNv(z)/N=g(v(z))dv(z) (2)假设上述三个概率是彼此独立的,又根据独立概率相乘的概率原理,得到粒子出现在v(x)到v(x)+dv(x),v(y)到v(y)+dv(y),v(z)到v(z)+dv(z)间的概率为dNv/N=g(v(x))g(v(y))g(v(z))dv(x)dv(y)dv(z)=Fdv(x)dv(y)dv(z) 式中F=g(v(x))g(v(y))g(v(z)),即为速度分布函数。 (3)由于粒子向任何方向运动的概率相等,所以速度分布应与粒子的速度方向无关。因而速度分布函数应只是速度大小v=√(v(x)2+v(y)2+v(z)2)的函数。这样,速度分布函数就可以写成下面的形式: g(v(x))g(v(y))g(v(z))=F(v(x)2+v(y)2+v(z)2) 要满足这一关系,函数g(v(x))应具有C*exp(A*v(x)^2)的形式。因此可得 F=C*exp(A*v(x)2)*C*exp(A*v(y)2)*C*exp(A*v(z)2)=C3exp(Av2) 下面来定常数C及A。考虑到具有无限大速率的粒子出现的概率极小,故A应为负值。令A=-1/α2,则 dNv/N=C3exp(-v2/α2)dv(x)dv(y)dv(z)=C3exp[-(v(x)2+v(y)2+v(z)2)/α2]dv(x)dv(y)dv (z) 由于粒子的速率在从-∞到+∞的全部速率区间内出现的概率应等于1,即分布函数应满足归一化条件,所以 ∫dNv/N=C3∫exp(-v(x)2/α2)dv(x)∫exp(-v(y)2/α2)dv(y)∫exp(-v(z)2/α2)dv(z)=C3√(πα2)3=1, 可得C=1/(α√π),从而得到麦克斯韦速度分布律: dNv/N=(α√π) ̄3exp(-v2/α2)dv(x)dv(y)dv(z)=(α√π) ̄3exp[-(v(x)2+v(y)2+v(z)2)/α2]dv( x)dv(y)dv(z) (4)由上式还可导出速率分布律。可以设想一个用三个相互垂直的轴分别表示 v(x),v(y),v(z)的“速度空间”。在这一空间内从原点到任一点(v(x),v(y),v(z))的连线都代表一个粒子可能具有的速度。由于速率分布与速度的方向无关,所以粒子的速率出现在同一速率v处的速率区间dv内的概率相同。这一速率区间是半径为v,厚度为dv的球壳,其总体积为4πv2dv,从而可得粒子的速率在v到v+dv 区间出现的概率为 dNv/N=4π(α ̄3/√π)exp(-v2/α2)v2dv (5)确定常数α。由上式可求出粒子速率平方的平均值为
