高三一轮复习资料金属及其化合物学习知识重点情况总结
高三化学总复习――金属及其化合物知识点总结 5.18一.金属的通性
1.位置:金属元素位于周期表的左下角,最外层电子数大部分少于4个。
2.物理通性:大部分有延展性、金属光泽,都有导热导电性等。
3.化学性质:易失电子,被氧化,金属表现还原性。
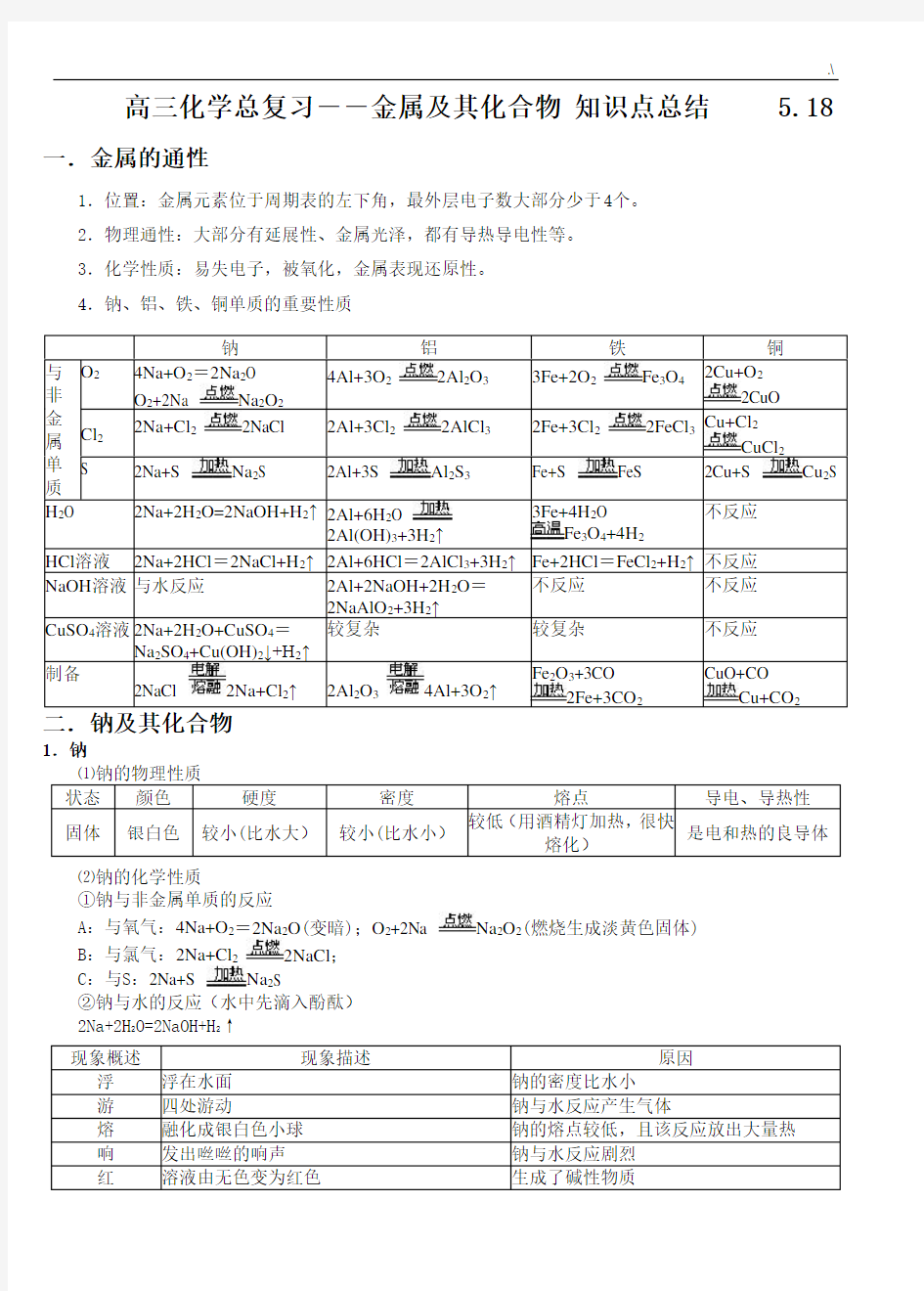
4.钠、铝、铁、铜单质的重要性质
钠铝铁铜
与非金属单质O24Na+O2=2Na2O
O2+2Na Na2O2
4Al+3O22Al2O33Fe+2O2Fe3O42Cu+O2
2CuO
Cl22Na+Cl22NaCl 2Al+3Cl22AlCl32Fe+3Cl22FeCl3
Cu+Cl2
CuCl2
S 2Na+S Na
2
S 2Al+3S Al2S3Fe+S FeS 2Cu+S Cu2S
H2O 2Na+2H2O=2NaOH+H2↑2Al+6H
2
O
2Al(OH)3+3H2↑3Fe+4H2O
Fe3O4+4H2
不反应
HCl溶液2Na+2HCl=2NaCl+H2↑2Al+6HCl=2AlCl3+3H2↑Fe+2HCl=FeCl2+H2↑不反应NaOH溶液与水反应2Al+2NaOH+2H2O=
2NaAlO2+3H2↑
不反应不反应
CuSO4溶液2Na+2H2O+CuSO4=
Na2SO4+Cu(OH)2↓+H2↑
较复杂较复杂不反应
制备
2NaCl 2Na+Cl2↑2Al2O34Al+3O2↑Fe2O3+3CO
2Fe+3CO2
CuO+CO
Cu+CO2
二.钠及其化合物
1.钠
⑴钠的物理性质
状态颜色硬度密度熔点导电、导热性
固体银白色较小(比水大)较小(比水小)较低(用酒精灯加热,很快
熔化)
是电和热的良导体
⑵钠的化学性质
①钠与非金属单质的反应
A:与氧气:4Na+O2=2Na2O(变暗);O2+2Na Na2O2(燃烧生成淡黄色固体)
B:与氯气:2Na+Cl22NaCl;
C:与S:2Na+S Na2S
②钠与水的反应(水中先滴入酚酞)
2Na+2H2O=2NaOH+H2↑
现象概述现象描述原因浮浮在水面钠的密度比水小
游四处游动钠与水反应产生气体
熔融化成银白色小球钠的熔点较低,且该反应放出大量热响发出咝咝的响声钠与水反应剧烈
红溶液由无色变为红色生成了碱性物质
③钠与酸的反应:2Na+2H+=2Na++H2↑
④钠与盐溶液的反应:
2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑;6Na+6H2O+2FeCl3=6NaCl+2Fe(OH)3↓+3H2↑
⑤Na可与某些有机物反应:
2CH3COOH+2Na→2CH3COONa+H2↑;2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
2C6H5OH+2Na→2C6H5ONa+H2↑;
⑶钠的保存
通常钠保存在煤油中,原因是①钠极易与空气中的O2、水蒸气反应;
②钠不与煤油反应;
③钠的密度比煤油大,沉于底部。
注意:钠保存在煤油中,而不能保存在汽油、CCl4中,因汽油易挥发,CCl4的密度比钠的密度大,起不到隔离O2和H2O的作用。
⑷钠的用途:①冶炼金属:TiCl4+4Na Ti+4NaCl;
②钠钾合金,作原子反应堆的导热剂;
③在电光源上,用钠制高压钠灯。
2.钠的重要化合物
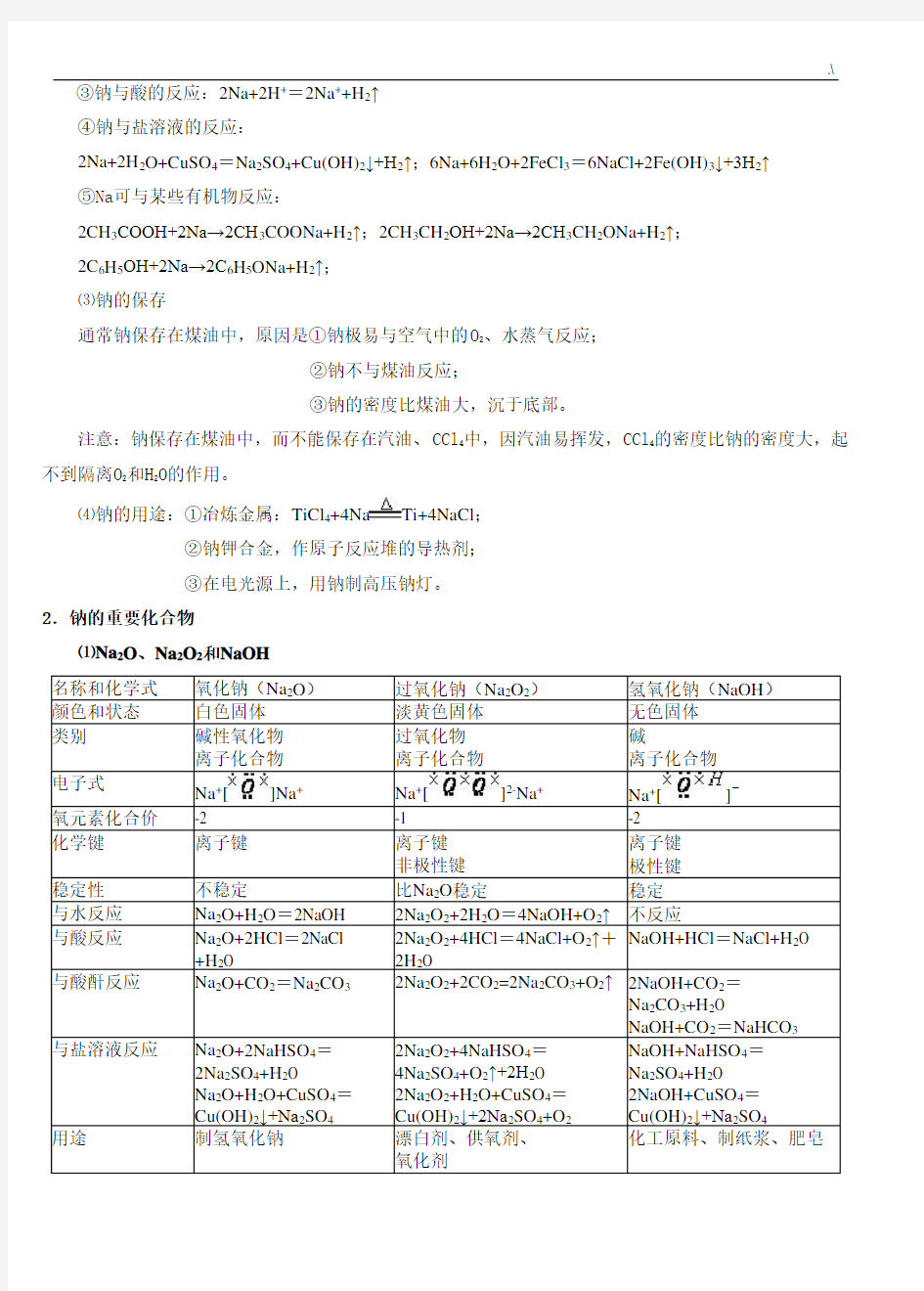
⑴Na2O、Na2O2和NaOH
名称和化学式氧化钠(Na2O)过氧化钠(Na2O2)氢氧化钠(NaOH)
颜色和状态白色固体淡黄色固体无色固体
类别碱性氧化物
离子化合物过氧化物
离子化合物
碱
离子化合物
电子式
Na+[]Na+Na+[]2-Na+Na+[]-氧元素化合价-2 -1 -2
化学键离子键离子键
非极性键离子键极性键
稳定性不稳定比Na2O稳定稳定与水反应Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑不反应
与酸反应Na2O+2HCl=2NaCl
+H2O 2Na2O2+4HCl=4NaCl+O2↑+
2H2O
NaOH+HCl=NaCl+H2O
与酸酐反应Na2O+CO2=Na2CO32Na2O2+2CO2=2Na2CO3+O2↑2NaOH+CO2=
Na2CO3+H2O
NaOH+CO2=NaHCO3
与盐溶液反应Na2O+2NaHSO4=
2Na2SO4+H2O
Na2O+H2O+CuSO4=
Cu(OH)2↓+Na2SO42Na2O2+4NaHSO4=
4Na2SO4+O2↑+2H2O
2Na2O2+H2O+CuSO4=
Cu(OH)2↓+2Na2SO4+O2
NaOH+NaHSO4=
Na2SO4+H2O
2NaOH+CuSO4=
Cu(OH)2↓+Na2SO4
用途制氢氧化钠漂白剂、供氧剂、
氧化剂
化工原料、制纸浆、肥皂
知识拓展:Na
2O
2
的强氧化性:能氧化SO
2
、FeCl
2
、H
2
S、Na
2
SO
3
、等,因强氧化性而使品红
溶液褪色。
⑵Na2CO3和NaHCO3
名称和化学式碳酸钠(Na2CO3)碳酸氢钠(NaHCO3)
俗名纯碱、苏打小苏打
颜色和状态白色晶体白色粉末
水中溶解性易溶易溶(比Na2CO3溶解度小)
热稳定性稳定不稳定:2NaHCO
3
Na2CO3+CO2↑+H2O 与酸反应CO32-+H+=HCO3-
HCO3-+H+=H2O+CO2↑
HCO3-+H+=CO2↑+H2O
与某些碱反应Ba(OH)2+Na2CO3=BaCO3↓+2NaOH NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O 与某些盐反应BaCl2+Na2CO3=BaCO3↓+2NaCl NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑
与CO2反应Na2CO3+CO2+H2O=2NaHCO3不反应
相互转化
Na2CO3 NaHCO3
制法NaOH+CO2=NaHCO3
2NaHCO32Na2CO3+H2O+CO2↑
NaOH+CO2=NaHCO3
鉴别加酸产生CO2
加热难分解加酸产生CO2较Na2CO3快加热分解出CO2
用途制玻璃、肥皂、造纸、纺织发酵粉、治胃酸过多知识拓展:
①钠在露置于空气中的变化过程:
Na→Na2O→NaOH→NaOH(aq) →Na2CO3·10H2O→Na2CO3
银白色→变暗→白色固体→溶液→白色块状→白色粉末
②碳酸钠与盐酸的反应:
若将盐酸逐滴缓慢滴加到碳酸钠溶液中:H++CO32-=HCO3-;HCO3-+H+=H2O+CO2↑。
现象:开始无气体生成,滴加到一定量后出现气体。
若将碳酸钠逐滴缓慢滴加到盐酸中:2H++CO32-=H2O+CO2↑。
现象:立即出现气泡。(常用来相互鉴别)
⑶钠及其化合物间的相互转化
3.碱金属元素的原子结构和性质及其递变规律
名称和符号锂(Li)钠(Na)钾(K)铷(Rb)铯(Cs)原子序数 3 11 19 37 55
结构原子结构结构简
图
电子式Li·Na·K·Rb·Cs·主要化合价+1 +1 +1 +1 +1 相同点最外层电子数相同,都是1个电子
不同点原子核外电子层数不同,依次增多
原子半径依次递增
离子半径依次递增
金属活动性依次递增
质还原性依次递增
阳离子氧化性依次递减
物理性质颜色和状态银白色固体
密度0.534g/cm30.97g/cm30.86g/cm3 1.523g/cm3 1.879g/cm3熔点依次递减
沸点依次递减
化学性质跟氧气反应4Li+O2=2Li2O
4Na+O2=2Na2O
2Na+O2Na2O2
2K+O2=K2O2
K+O2KO2
Rb+O2
RbO2
Cs+O2CsO2跟卤素反应2M+X2=2MX(M、X2分别表示碱金属、卤素)
跟硫反应2M+S=M2S
与水反应2M+2H2O=2MOH+H2↑反应剧烈程度:Li<Na<K<Rb<Cs
与酸反应2M+2H+=2M++H2↑
与盐溶液反应
(CuSO4)
制法2MCl2M+Cl
2
↑(K:Na+KCl K+NaCl)
知识拓展:碱金属的特殊性:
①Na、K需保存于煤油中,但Li的密度比煤油小,所以Li必须保存在密度更小的石蜡中或密封于石蜡
中。
②碱金属中,从Li→Cs,密度呈增大的趋势,但ρ(K) <ρ(Na)
③试剂瓶中的药品取出后,一般不能放回原瓶,但金属Na、K等除外。
三.镁、铝及其化合物
1.镁与铝
⑴原子结构及物理性质
镁铝在周期表中位置第3周期第ⅡA族第3周期第ⅢA族
原子结构示意图
色态较低较低但大于镁
熔点较小较小但大于镁
密度较小较小但大于镁
硬度较小较小但大于镁⑵镁铝的化学性质
项目Mg Al
与非金属反应O2
方程式2Mg+O22MgO 4Al+3O22Al2O3现象剧烈反应、耀眼白光、放出大量热S Mg+S MgS 2Al+3S Al2S3
N23Mg+N2Mg3N2
与H2O 方程式Mg+2H2O Mg(OH)2+H2↑2Al+6H2O=2Al(OH)3↓+3H2↑
现象冷水慢,沸水快一般不反应,只有氧化膜被破坏后反应
与酸反应Mg+2H+=Mg2++H2↑2Al+6H+=2Al3++3H2↑(常温下,在浓H2SO4、浓HNO3中钝化)
与NaOH溶液2Al+2NaOH+2H2O=2NaAlO2+3H2↑与某些氧化物2Mg+CO22MgO+C 2Al+Fe2O32Fe+Al2O3
主要用途镁合金汽车、飞机制造、照明弹等铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等
工业制备MgCl
2
Mg+Cl2↑2Al2O34Al+3O2↑2.镁和铝氧化物的对比
氧化物MgO Al2O3
属类碱性氧化物两性氧化物
色态白色粉末、熔点高白色粉末、熔点高
化学性质H2O MgO+H2O=Mg(OH)2↓(反应缓慢进行) 不溶解也不反应
酸液MgO+2H+=Mg2++H2O Al2O3+6H+=2Al3++3H2O NaOH溶液不溶解也不反应Al2O3+2NaOH=2NaAlO2+H2O
重要用途制造耐火、耐高温材料制造耐火、耐高温器材,冶炼铝3.镁和铝的氢氧化物
氢氧化物Mg(OH)2Al(OH)3
属类碱两性氢氧化物
色态白色固体白色固体
溶解性难溶难溶
电离方程式Mg(OH)2Mg2++2OH-H2O+AlO2-+H+Al(OH)3Al3++3OH-
与HCl等酸溶液Mg(OH)2+2HCl=MgCl2+2H2O
(可溶于NH4Cl等强酸弱碱盐)
Al(OH)3+3HCl=AlCl3+3H2O
与NaOH溶液不反应Al(OH)3+NaOH=NaAlO2+2H2O 热不稳定性Mg(OH)2 MgO+H2O 2Al(OH)3Al2O3+3H2O
实验室制法可溶性镁盐加NaOH溶液
Mg2++2OH- =Mg(OH)2↓
可溶性铝盐加氨水
Al3++3NH3·H2O=Al(OH)3↓+3NH+4
4.铝及其化合物间相互转化、铝三角及相关图象
实验操作实验现象图象离子方程式
①向可溶性铝盐溶液中滴加NaOH溶液至过量先生成沉淀又溶解Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-
=AlO2-+2H2O
②向可溶性铝盐溶液
中滴加稀氨水至过量
出现白色沉淀Al3++3NH3·H2O=Al(OH)3↓+3N H4+
③向NaOH溶液中滴加可溶性铝盐溶液至过量开始无明显变化,
一段时间后出现沉
淀
Al3++4OH-=AlO2-+2H2O;
3AlO2-+Al3++6H2O=4Al(OH)3↓
④向可溶性偏铝酸盐溶液中滴加盐酸至过量先沉淀又溶解H++AlO2-+H2O = Al(OH)3↓;
Al(OH)3 +3H+=Al3++3H2O
⑤向可溶性偏铝酸盐溶液中逐渐通入CO2气体至过量先无明显变化,后
出现沉淀
AlO-2+2H2O+CO2(过量)
=Al(OH)3↓+HCO-3
2AlO2-+3H2O+CO2(少量)
=Al(OH)3↓+CO2-3
⑥向盐酸中滴加可溶性偏铝酸盐溶液至过量出现白色沉淀 4 H++AlO2-=Al3++2H2O;
3AlO2-+Al3++6H2O=4Al(OH)3↓
知识拓展:
⑴Al(OH3)的两性:H2O+AlO2-+H+Al(OH)3Al3++3OH-
酸式电离碱式电离
当向Al(OH)3中加入酸溶液,平衡向碱式电离方向移动,使Al(OH)3溶解。当向Al(OH)3中加入强碱溶液时,平衡向酸式电离方向移动,使Al(OH)3溶解。
⑵铝热反应及应用:2Al + Fe2O32Fe + Al2O3;4Al + 3MnO23Mn + 2Al2O3
铝热剂――铝粉和金属氧化物;助燃剂――KClO3;引燃剂――镁条。
铝热反应应用:焊接钢轨,冶炼熔点较高的金属如:钒、铬、锰等。
⑶既能与强酸又能与强碱反应的物质:
①金属单质:Al;②两性氧化物:Al2O3;③两性氢氧化物Al(OH)3;④弱酸的酸式盐:NaHCO3、
NH4HCO3等;⑤弱酸铵盐:(NH4)2CO3、(NH4)2S等。
四.铁及其化合物
1.铁
⑴铁的原子结构:位于第4周期Ⅷ族,是过渡元素。
原子结构示意图:;常见价态+2,+3价。
⑵物理性质:纯铁为银白色有金属光泽,有延展性和导热性,能导电,能被磁铁吸引,密度7.86g/cm3,熔点1535℃,沸点2750℃。
⑶化学性质:
铁能与Cl2、Br2、O2、I2、S等非金属单质反应;与稀硫酸、浓硫酸、硝酸、盐酸等酸反应;与H2O、Fe3+、Cu2+等反应。
①与铁生成+3价的有:Cl2、Br2、浓硫酸、硝酸等。
②与铁生成+2价的有:I2、S、稀硫酸、盐酸、Fe3+、Cu2+等。
③与铁生成Fe3O4的有:O2、H2O等。
2.铁的氧化物
3.铁的氢氧化物
4.亚铁和铁盐的鉴别
5.铁三角
知识拓展:
●Fe3+的性质规律:
⑴水解性:
①Fe3+半径小,所带电荷高,水解能力强。
常温下,Fe3++3H2O Fe(OH)3+3H+
沸水中,Fe3++3H2O(沸水)Fe(OH)3(胶体)+3H+
②遇HCO3-、CO32-、AlO2-、ClO-等离子时,水解完全。
如Fe3++3HCO3-=Fe(OH)3↓+3CO2↑。
③将FeCl3溶液蒸干并灼烧,得Fe2O3。
④在pH≥4时,它就形成Fe(OH)3而沉淀完全。
⑵较强的氧化性:
①Fe3+的氧化性在金属阳离子中是比较强的,其氧化性:
H+ ②Fe3+表现氧化性的反应有: ⑶特征络合反应:Fe3++3SCN-=Fe(SCN)3显红色。 Fe3++6C6H5OH=[Fe(C6H5O)6]3-+6H+,显紫色。 ●制Fe(OH)2白色沉淀: Fe(OH)2极易被氧化,溶解在水中少量的O2都能将它氧化成Fe(OH)3,所以按一般强碱与弱酸盐反应制弱碱的操作很难得到Fe(OH)2白色沉淀。要制得Fe(OH)2白色沉淀必须用加热煮沸过的蒸馏水(以减少溶解在水中的O2)临时配制的FeSO4溶液,最好在溶液中再滴几滴植物油以避免FeSO4溶液与空气接触,准备加入的NaOH溶液也要先加热煮沸,加入NaOH溶液时应将滴管尖嘴伸人FeSO4溶液的试管底部再挤出NaOH溶液。 五.铜及其化合物 1.铜 ⑴原子结构:铜元素位于元素周期表第4周期ⅠB族,过渡元素。 原子结构示意图:;常见价态+1和+2价。 ⑵物理性质:紫红色光泽,熔点1083.4℃,沸点为2567℃,有良好延展性,是电和热的良导体。 ⑶化学性质: ①与非金属单质2Cu+O22CuO(黑色);2Cu+S Cu2S;Cu+Cl2CuCl2 ②与酸反应:与非氧化性酸反应(稀盐酸、稀硫酸)不反应。 Cu+2H2SO4(稀)CuSO4+SO2↑+2H2O;Cu+4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O; 3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O; ③盐溶液:Cu+2AgNO3=2Ag+Cu(NO3)2;Cu+2FeCl3=CuCl2+2FeCl2 ④在潮湿空气中生成铜绿:2Cu+O2+H2O+CO2=Cu2(OH)2CO3 2.铜的化合物 ⑴铜的氧化物[CuO] CuO+2HCl=CuCl2+H2O;H2+CuO Cu+H2O;C+2CuO2Cu+CO2↑ ⑵铜的氢氧化物[Cu(OH)2]:蓝色难溶于水。 Cu(OH)2+2HCl=CuCl2+2H2O;Cu(OH)2CuO+H2O; CH3CHO+2Cu(OH)2Cu2O↓+CH3COOH+2H2O ⑶硫酸铜[CuSO4] CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;CuSO4+Fe=Cu+FeSO4; CuSO4·5H2O CuSO4+5H2O(蓝色粉末变为白色粉末);CuSO4+5H2O =CuSO4·5H2O(白色粉末变成蓝色,常用来检验水的存在)。 3.铜及其化合物间的相互转化 2016年高考历史知识点汇总 1、中国古代史中国古代史的历史沿革: 一、原始社会(二三百万年前——公元前21世纪) 过渡时期(皇帝尧舜禹时期大约4000——5000年前) 二、奴隶社会(公元前21世纪——春秋时期公元前476年) 三、封建社会(战国时期公元前475年——鸦片战争1840年 四、半殖民地半封建社会(1840年——1949年) 五、过渡时期(新民主主义社会)(1949——1956年) 六、社会主义社会(1956年——今天) 一、奴隶社会的发展史: 1、夏(统一的奴隶制国家建立)(前21世纪——前16世纪) 2、商(奴隶制社会的发展时期)(前16世纪——前11世纪) 3、西周(奴隶制社会的鼎盛时期)(前11世纪——前8世纪即公元前771年) 4、东周(奴隶制社会的衰落时期) (春秋时期(奴隶制社会的瓦解时期)(前770年——前476年) (战国时期(封建社会的形成时期)(前475年——前221年 二、封建社会的历史沿革: 1、秦汉时期(统一的多民族的封建社会形成时期) (前221年——公元220年魏取代东汉) 2、三国两晋南北朝时期(大分裂时期也是民族大融合时期)(公元220年魏国建立——589年隋朝建立) 3、隋唐时期(封建社会的鼎盛时期)(589年——907年) 4、五代十国时期(大分裂时期)(907年唐灭——960年北宋建立) 5、辽宋夏金元时期(少数民族政权并立时期也是民族大融合时期)(960年北宋建立——1368年明朝建立) 6、明清时期(封建社会的衰落时期)(1368年——1912年清帝退位) 如何巧记方法:以奴隶社会为例: 夏(前21世纪)减去5个世纪——就是商(前16世纪) 再减去5个世纪——就是西周(前11世纪)——减去3个世纪(就是东周即春秋时期开始(前8世纪前771年)——再减去3个世纪(就是战国时期开始(前5世纪前475年,进入封建社会) 理解记忆:半殖民地——政治上主权部分沦丧,区别于印度、埃及等殖民地 半封建——经济上资本主义开始兴起,但是封建的自给自足的自然经济仍占主导地位。 如何运用政治学原理分析历史问题: 如“生产力与生产关系;经济基础决定上层建筑原理”—— 化学:人教版必修一《非金属知识点总结》教案 一、氯及其化合物的转化关系 1、液氯、新制的氯水和久置的氯水比较 液氯新制氯水久置氯水分类纯净物混合物混合物[ 颜色黄绿色黄绿色无色 成分Cl2 Cl2、H2O、HClO、H+、Cl―、 ClO―、极少量的为OH― H+、Cl―、H2O、极少量的OH― 稀盐酸 性质氧化性氧化性、酸性、漂白性酸性2、氯气的性质 与金属钠反应方程式2Na+Cl 2点燃 2NaCl 与金属铁反应方程式2Fe+3Cl 2点燃 2FeCl3 与金属铜反应方程式Cu+Cl 2点燃 CuCl2 与氢气反应方程式H 2+Cl22HCl;H2+Cl22HCl 与水反应方程式H2O +Cl2 ==HCl+HClO 制漂白液反应方程式Cl2+2NaOH==NaCl+NaClO+H2O 制漂白粉反应方程式2Cl2 +2C a(O H)2==CaCl2 +C a(C l O)2 +2H2O 实验室制法MnO 2+4HCl(浓)△ MnCl2 +Cl2↑+2H2O 氯离子的检验试剂以及反应方程式AgNO3溶液:g++Cl―==AgCl 二、硅及其化合物的转化关系 ①Si 的还原性大于C ,但C 却能在高温下还原出Si 。2C +SiO2=====高温 Si +2CO↑; ②Si 能与NaOH 溶液反应放出H2,而其他非金属单质无此性质; ③非金属单质一般为非导体,但Si 为半导体,石墨为良导体; ④非金属氧化物一般为分子晶体,但SiO2晶体为原子晶体。 1、二氧化硅和二氧化碳比较 二氧化硅 二氧化碳 类别 酸性氧化物 _酸性氧化物 晶体结构 原子晶体 分子晶体 熔沸点 高 低 与水反应方程式 不反应 CO 2+H 2O H 2CO 3 与酸反应方程式 SiO 2 + 4HF==SiF 4↑+2H 2O 不反应 与烧碱反应方程式 SiO 2+2NaOH == Na 2SiO 3+H 2O 少:2NaOH+CO 2==Na 2CO 3+H 2O 过:NaOH+CO 2==Na HCO 3 与CaO 反应方程式[来 SiO 2+CaO 高温 CaSiO 3 CaO+CO 2==CaCO 3 存在状态 水晶、玛瑙、石英、硅石、沙子 人和动物排放 2、硅以及硅的化合物的用途 物质 用途 硅单质 半导体材料、光电池(计算器、人造卫星、登月车、探测器) SiO 2 饰物、仪器、光导纤维、玻璃 硅酸钠 矿物胶 SiC 砂纸、砂轮的磨料 金属氧化物是指氧元素与另外一种金属化学元素组成的二元化合物,如氧化铁(Fe2O3)、氧化钠(Na2O)等。以下是金属氧化物知识点。 1、低价态的还原性 6feo+o2===2fe3o4 feo+4hno3===fe(no3)3+no2+2h2o 2、氧化性 na2o2+2na===2na2o (此反应用于制备na2o) mgo,al2o3几乎没有氧化性,很难被还原为mg,al.一般通过电解制mg和al. fe2o3+3h2===2fe+3h2o (制还原铁粉) fe3o4+4h2===3fe+4h2o 3、与水的作用 na2o+h2o===2naoh 2na2o2+2h2o===4naoh+o2 (此反应分两步:na2o2+2h2o===2naoh+h2o2 ; 2h2o2===2h2o+o2. h2o2的制备可利用类似的反应: bao2+h2so4(稀)===baso4+h2o2) mgo+h2o===mg(oh)2 (缓慢反应) 4、与酸性物质的作用 na2o+so3===na2so4 na2o+co2===na2co3 na2o+2hcl===2nacl+h2o 2na2o2+2co2===2na2co3+o2 na2o2+h2so4(冷,稀)===na2so4+h2o2 mgo+so3===mgso4 mgo+h2so4===mgso4+h2o al2o3+3h2so4===al2(so4)3+3h2o (al2o3是两性氧化物 al2o3+2naoh===2naalo2+h2o) feo+2hcl===fecl2+3h2o fe2o3+6hcl===2fecl3+3h2o fe2o3+3h2s(g)===fe2s3+3h2o fe3o4+8hcl===fecl2+2fecl3+4h2o 人教版高中历史选修一《历史上重大改革回眸》 第一单元梭伦改革 课标内容要求: (1)了解梭伦改革前雅典的社会状况,认识梭伦改革的必要性。 (2)简述梭伦改革的主要措施,指出改革的基本特点。 (3)分析梭伦改革对雅典民主政治建设的影响。 知识要点: 一、梭伦改革的背景: 1、政治: 雅典城邦国家产生(公元前9~前8世纪)——设立中央议事会和行政机构贵族制国家确立(公元前8~前6世纪)——贵族专权而平民无权 2、经济发展 农工商业以及贸易得到发展 3、阶级变化: 工商业奴隶主形成,公民内部斗争激烈:“山地派”、“平原派”、“海岸派” 4、梭伦当选为首席执政官:雅典贵族与平民长期斗争的结果 二、梭伦改革: 1、内容:“颁布解负令” 确立财产等级制度、恢复公民大会权力、建立“四百人会议” 设立公民陪审法庭、鼓励发展农工商业 2、特点:奠定民主政治基础、促进工商业发展 三、梭伦改革的评价 1、历史意义:改革为雅典的民主政治奠定基础 克里斯梯尼改革促进雅典民主政治的形成 伯利克里改革使雅典民主政治得以最终确立 2、历史局限:贵族在国家政权中占据绝对优势,下层平民未享有充分的权利氏族制度残余及贵族拥有世袭占有土地的特权 贵族和平民的矛盾未得以从根本上解决,社会政局动荡不安 第二单元商鞅变法 课标内容要求: (1)知道春秋战国时期各国改革的基本史实,认识春秋战国时期的时代特征。 (2)了解商鞅变法的具体措施和内容,认识其特点。 (3)探讨商鞅变法的历史作用。 知识要点: 一、背景:春秋战国时期的社会大变革 1、根本原因:社会生产力的发展——铁器、牛耕的使用 2、经济基础:生产关系的变化——私田增多出现新的封建剥削方式井田制瓦解封建土地私有制确立 3、阶级基础:阶级关系的变化——新的阶级形成新兴地主阶级要求变革 4、社会条件:春秋战国时期的战争频繁、思想繁荣、各国竞相改革变法 齐国管仲改革、鲁国“初税亩”、魏国李悝变法、楚国吴起变法 二、商鞅变法内容: 1、以农求富的经济改革:废井田、开阡陌;重农抑商、奖励耕织;统一度量衡 人教版化学九年级第九单元金属和金属材料知识点归纳总结 课题1:金属材料 一、金属材料的发展与利用 1、从化学成分上划分,材料可以分为金属材料、非金属材料、有机材料及复合材料等四大类。 2、金属材料包括纯金属和合金。 (1)金属材料的发展 石器时代→青铜器时代→铁器时代→铝的应用→高分子时代 (2)金属材料的应用 ①最早应用的金属是铜,应用最广泛的金属是铁,公元一世纪最主要的金属是铁 ②现在世界上产量最大的金属依次为铁、铝和铜 ③钛被称为21世纪重要的金属 二、金属的物理性质 1、金属共同的物理性质:常温下金属都是固体(汞除外),有金属光泽,大多数金属是电和热的良导体,有延展性,密度较大,熔沸点较高等。 2、金属的特性: ①纯铁、铝等大多数金属都呈银白色,而铜呈紫红色,金呈黄色; ②常温下,大多数金属都是固体,汞却是液体; ③各种金属的导电性、导热性、密度、熔点、硬度等差异较大。 3、金属之最 地壳中含量最多的金属元素—铝(Al) 人体中含量最多的金属元素—钙(Ca) 导电、导热性最好的金属——银(Ag) 目前世界年产量最高的金属—铁(Fe) 延展性最好的金属———金(Au) 熔点最高的金属————钨(W) 熔点最低的金属————汞(Hg) 硬度最大的金属————铬(Cr) 密度最小的金属————锂(Li) 密度最大的金属————锇(Os) 最贵的金属————锎kāi(Cf) 4、金属的用途:金属在生活、生产中有着非常广泛的应用,不同的用途需要选择不同的金属。【练习】 (1)为什么菜刀、镰刀、锤子等用铁制而不用铅制?答:因为铁的硬度比铅大,且铅有毒。 (2)银的导电性比铜好,为什么电线一般用铜制而不用银制?答:银和铜的导电性相近,但银比铜贵得多,且电线用量大,经济上不划算。 (3)为什么灯泡里的灯丝用钨制而不用锡制?如果用锡制的话,可能会出现什么情况?答:因为钨的熔点(3410℃)高,而锡的熔点(232℃)太低。如果用锡制的话,通电时锡易熔断,减少灯泡的使用寿命,还会造成极大浪费。 高一化学金属及其化合物知识点总结 文档编制序号:[KKIDT-LLE0828-LLETD298-POI08] 高一化学金属及其化合物知识点总结 1.元素的存在形式有两种:游离态和化合态。 (1)钠镁铝只以化合态形式存在:钠元素的主要存在形式是氯化钠,镁元素的存在形式有菱镁矿,铝元素的存在形式有铝土矿。 (2)铁元素有两种存在形式:游离态的陨铁和化合态的铁矿石。 2.金属单质的用途: (1)利用钠元素的特征焰色(黄色)制高压钠灯,高压钠灯的透雾力强,可以做航标灯;利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反应堆的导热剂;利用钠单质制备过氧化钠,利用钠单质还原熔融态的四氯化钛制备金属钛。 (2)镁条燃烧发出耀眼的白光,用来做照明弹。 (3)利用铝的良好导电性,做导线。利用铝块和铝粉的颜色都是银白色,铝粉制成银粉(白色涂料)。 3.金属化合物的用途: (1)过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;氯化钠做为制备单质钠和氯气的原料,氯化钠做为制备氢氧化钠、氢气、氯气的原料。 (2)氧化镁的熔点高,做耐高温的材料:耐火管、耐火坩埚、耐高温的实验仪器。 (3)明矾做净水剂。 4.金属的分类: (1)根据冶金工业标准分类:铁(铬、锰)为黑色金属,其余金属(钠镁铝等)为有色金属。(2)根据密度分类:密度大于cm3的金属是重金属:如铁、铜、铅、钡,密度小于cm3的金属是轻金属:如钠、镁、铝。 5.氧化物的分类:二元化合物,其中一种元素是氧元素,并且氧元素呈负二价的化合物是氧化物。(1)氧化物(根据氧化物中非氧元素的种类)分为金属氧化物和非金属氧化物。 (2)金属氧化物分为酸性氧化物、碱性氧化物、两性氧化物。 (3)非金属氧化物分为酸性氧化物、不成盐氧化物。 (4)氧化物(根据氧化物是否与碱或酸反应生成盐)分为成盐氧化物和不成盐氧化物(CO 、NO)。 (5)成盐氧化物分为酸性氧化物、碱性氧化物、两性氧化物。 (6)酸性氧化物分为高价态的金属氧化物(Mn2O7)和非金属氧化物(CO2)。 1.公元前2070年,禹建立我国历史上第一个王朝是夏;我国的早期国家政治制度起源于夏朝。 2.原始社会后期禅让制被王位世袭制所取代。 3.为了进行有效的统治,周朝在政治上实行分封制。西周宗法制的最大特点是嫡长子继承制。 分封制与宗法制的关系是互为表里,相辅相成。 4.柳宗元的《封建论》说“夏、商、周、汉封建而延,秦郡邑而促”。文中的“封建”的含义是分封制。 5.保证了贵族在政治上的垄断和特权地位,也有利统治集团内部的稳定和团结的是宗法制。 6.秦朝是中国历史上第一个统一的封建王朝。秦始皇首创的皇帝制度,是中国封建专制制度的重特征。在中央设置丞相、御史大夫和太尉三个最高官职。 7.唐朝时,掌握草拟、审议和行政的职能分别是中书省、门下省和尚书省。 8.宋朝和元朝最高行政机构分别是中书门下省和中书省。9.元朝时,统领宗教事务和管辖西藏地区的机构是宣政院。为管理边远地区设置宣慰司。 10.明太祖(皇帝)时,中国的宰相制度从此被废除。 11.雍正帝时设置军机处,标志着君主专制制度发展到了顶峰。12.古代中国农业生产的主要组织方式是以家庭为单位从事生产劳动。古代中国农业生产的主要特点是形成精耕细作的农业生产体系。 13.牛耕是我国农业技术史上耕作方式的一次革命。 14.春秋战国和秦汉时期,使用了当时世界上最先进的耕作方式是垄作法。 15.古代中国手工业的三种主要经营形态分别是官营手工业、民营手工业、家庭营手工业。 16.明清时期,苏州和杭州是最著名的丝织业中心。 17.“商人”最早出自于商朝。 18.我国最早的银行雏形是柜坊。世界上最早的纸币是北宋发行的“交子”。 19.元代时,泉州被外国旅行家誉为世界第一大港。清代时实行闭关锁国的政策,只广州一处对外通商。 20.唐朝时,专管对外贸易的机构称为市舶使。宋代时,在边境设置与少数民族贸易场所称为榷场。中国最早的商标是宋代山东济南刘家功夫针。 21.“百家争鸣”是中国历史上第一次思想解放运动。 22.孔子整理的“六经”是《诗》《书》《礼》《易》《乐》《春秋》。四书是指《论语》《孟子》《大学》《中庸》。 23.提出“性善论”是孟子;提出“性恶论”是荀子。提出“三纲五常”的思想是董仲舒。提出“心性论”是朱熹。最早提出“天下兴亡,匹夫有责”的思想是顾炎武。 24.后人称孔子为“至圣”、称孟子为“亚圣”。朱熹宋朝理学集大成者。黄宗羲、顾炎武和王夫之是明未清初著名思想家。25. ①提出“爱人者,人恒爱之” “民为贵,社稷次之,君为轻”是孟子。 ②提出“节用而爱人”“为政以德”“已所不欲,勿施于人” 是孔子 ③提出“与人为善,暖于布帛”“以德服人”“君舟民水”是荀子。 ④提出“君权神授”“天人合一”“天人感应”是董仲舒。 ⑤提出“万物皆只是一个天理”“父子君臣,天下之定理”是二程(程颢、程颐)。 ⑥提出“心外无物”“致良知”“宇宙便吾心”是王阳明。 ⑦提出“咸以孔子之是非为是非,故未尝是非”是李贽。 ⑧提出“人民为主”“天下为主,君为客”“工商皆民生之本”是黄宗羲 ⑨提出“经世致用”的有顾炎武和王夫之 26.世界上最早用赤道坐标表示恒星位置的,是中国战国时期的天文学石申,他著有《天文》; 27.《石氏星表》是世界上现存最古老的星表。 28.在望远镜发明以前,浑仪是世界上最先进的天文观测工具。29.混合选择法最早见于西汉农书《汜胜之书》;《齐民要术》是中国现存最早最完整的一部农书。 30.素有“天下第一行书”美誉,是指王羲之创作的《兰亭序》;知识点整理(二) 1.罗马法从形式上可分成文法和习惯法。从按结构上分为公民法、万民法和自然法。 2.公元前5世纪中期,《十二铜表法》标志着罗马成文法的诞生;《民法大会》标志着罗马法体系的最终完成; 3.公民法适用范围仅限于罗马公民,用来调整罗马公民之间的 属 工 -艺 学 第 五 版 上 强度:金属材料在里的作用下,抵抗塑性变形和断裂的能力。指标:屈服点(b s)、抗拉强度(b b)塑性:金属材料在力的作用下产生不可逆永久变形的能力。指标:伸长率(S)、断面收缩率( 3 硬度:金属材料表面抵抗局部变形,特别是塑性变形压痕、划痕的能力。 1布氏硬度:HBS (淬火钢球)。HBW (硬质合金球) 指标:-2洛氏硬度:HR (金刚石圆锥体、淬火钢球或硬质和金球) 3韦氏硬度 习题: 1什么是应力,什么是应变? 答:试样单位面积上的拉称为应力,试样单位长度上的伸长量称为应变。 5、下列符号所表示的力学性能指标名称和含义是什么? 答:b b:抗拉强度,材料抵抗断裂的最大应力。 (7 S :屈服强度,塑性材料抵抗塑性变形的最大应力。 6:条件屈服强度,脆性材料抵抗塑性变形的最大应力 7 -1 :疲劳强度,材料抵抗疲劳断裂的最大应力。 S:延伸率,衡量材料的塑性指标。 a k :冲击韧性,材料单位面积上吸收的冲击功。 HRC洛氏硬度,HBS压头为淬火钢球的布氏硬度。HBW压头为硬质合金球的布氏硬度。 过冷度:理论结晶温度与实际结晶温度之差。冷却速度越快,实际结晶温度越低,过冷度越大。纯金属的结晶包括晶核的形成和晶核的长大。 同一成分的金属,晶粒越细气强度、硬度越高,而且塑性和韧性也越好。 原因:晶粒越细,晶界越多,而晶界是一种原子排列向另一种原子排列的过度,晶界上的排列是犬牙交错的,变形是靠位错的变移或位移来实现的,晶界越多,要跃过的障碍越多。 M提高冷却速度,以增加晶核的数目。 J 2在金属浇注之前,向金属液中加入变质剂进行变质处理,以增加外来晶核,还可以采用热处理或塑性加工方法,使固态金属晶粒细化。 3采用机械、超声波振动,电磁搅拌等 合金:两种或两种以上的金属元素,或金属与非金属元素溶合在一起,构成具有金属特性的新物质。组成元素成为组员。 U、固溶体:溶质原子溶入溶剂晶格而保持溶剂晶格类型的金属晶体。 铁碳合金组织可分为:2、金属化合物:各组员按一定整数比结合而成、并具有金属性质的均匀物质 (渗 < 碳体) 3、机械混合物:结晶过程所形成的两相混合组织。 高中化学复习——非金属及其化合物知识点总结 一、卤族元素 1、包括:元素名称: 元素符号: 卤族元素最外层有个电子,位于元素周期表第族,气态氢化物的通式为;除氟元素外,其它元素的最高价氧化物的通式为,最高价氧化物对应的水化物的通式为。 2、卤族元素随着原子序数的递增,电子层数逐渐,原子半径,得电子的能力逐渐,非金属性,最高价氧化物对应的水化物酸性,气态氢化物的稳定性。气态氢化物的水溶液酸性。 3、 4、F2有性,它与H2相遇即爆炸,写出该反应的化学方程式,它与水反应的方程式为。 5、氯气的性质 ①Cl2密度空气,有气味,毒。氯气的电子式为,是一种常见的剂。 ②Cl2与H2在或条件下都可发生反应,写出其反应的化学方程式; ③Cl2能在条件下,与钠、镁、铝、铁、铜等金属发生反应,写出铁在氯气中反应的化学方程式,该反应的实验现象为,把得到的色固体溶于水中,可配制成色的溶液;写出铜在氯气中反应的化学方程式,该反应的实验现象为,把得到的色固体溶于水中,可配制成色的溶液。 ④氯气溶于水,且能和水反应生成两种酸:和,其中有漂白性,一旦漂白有色织物,颜色不能复现。写出氯气与水反应的离子方程式 ,在该反应中,氯气起到了剂的作用。若有1mol氯气参与反应,有 mol电子发生转移。 ⑤氯气的水溶液叫做,包括的微粒有。其中使氯水有酸性,使氯水有强氧化性。 ⑥氯气与强碱溶液可发生反应,类似于氯气与水的反应,在反应中能生成两种盐。写出氯气与NaOH溶液反应的离子方程式,该反应的产物中,是家庭常用的“84”消毒液的主要成分。氯气与熟石灰反应可以用来制漂白粉,写出该反应的化学方程式,在产物中起到漂白作用的有效成分是。 ⑦当把氯气通入FeCl2溶液中一段时间后,溶液颜色变化为,写出该反应的离子方程式;把氯气通入FeBr2溶液中,写出该反应的离子方程式。在以上的两个反应中,氯气都作剂。 ⑧工业上可以通过电解饱和食盐水的方法来制取氯气,该生产过程又叫做,写出该反应的化学方程式。 ⑨若要得到干燥的氯气,常用作为干燥剂。可用试纸来检验氯气 第三章金属及其化合物知识点总结及方程式一、钠、镁、铝单质 (一)、物理性质: 1、钠:银白色固体,它的密度比水要小,比煤油大,质软,熔沸点低,保存在煤油或石蜡油中。 2、铝:银白色固体,有金属光泽,导电、导热性良好、密度较小,地壳中含量最多的金属元素。 3、铁:银白色固体,导电、导热性良好,地壳中含量居第四位。 (二)、化学性质: Na Mg Al Fe 与O2常温: 4Na + O2 = 2Na2O 点燃: 2Na+O2 Na2O2 现象:熔化燃烧,火焰 呈黄色,生成淡 黄色的固体 常温下生成氧化膜,点 燃燃烧: 2Mg + O2 2MgO 常温下氧化生成致密氧化 膜: 4Al + 3O2 = 2Al2O3 纯氧中点燃生成Fe3O4 3Fe + 2O2 Fe3O4 与H2O 2Na+2H2O=2NaOH+ H2↑ 现象:浮熔游响红 与冷水缓慢的反应,与热 水较快的反应: Mg+2H2O=Mg(OH)2+ H2↑ 受氧化膜阻碍与冷水不反应 加热时与水蒸气反应 与酸Mg +2H+=== Mg2+ + H2↑ 与盐2Na+2H2O+CuSO4= Cu(OH)2↓+Na2SO4+ H2↑ 现象:浮熔游响 蓝色沉淀 置换出较不活泼金属: Mg+Cu2+=Mg2++Cu 置换出较不活泼金属 置换出较不活泼金属 Fe+Cu2+=Cu+Fe2+ Fe+2Fe3+= 3Fe2+ 现象:溶液黄色变为浅绿色 与碱与水反应不反应2Al+2NaOH+2H2O=2NaAl O2 +3H2↑ 2mol铝做还原剂6mol水 做氧化剂 不反应 二、钠的重要化合物 (一)、氧化钠与过氧化钠 Na2O Na2O2 (过氧根O22-)化合价 (O) -2-1 颜色状态白色粉末淡黄色粉末 类别碱性氧化物过氧化物,非碱性氧化物 高考历史复习要点 (必修1) 一、古代中国的政治制度: 分封制:把土地和人民分封给王族、功臣和先代贵族,建立诸侯国,拱卫王室,加强了周天子对地方的统治,但同时存在分裂的隐患。 古代中央集权制度的形成: ①秦代中央设置三个最高官职:丞相,帮助皇帝处理全国的政事;御史大夫,执掌奏章,下达诏令,兼理国家监察事务;太尉,负责全国军事。 ②郡县制建立:秦始皇在全国范围废除分封制,实行郡县制。 中央集权制度的影响:有利于封建经济文化的发展,对祖国疆域的初步奠定、巩固国家统一,以及形成以华夏族为主体的中华民族,都起了重要作用。 唐朝三省六部制:中书省掌决策,负责草拟和颁发皇帝诏令;门下省掌审议,负责审核政令;尚书省负责执行政令,并下设吏、户、礼、兵、刑、工六部。 汉初,在地方上,郡国二制并行。 元朝:中央以中书省为最高行政机构,在地方采用行省(行中书省)制度,是地方行政制度的重大变革,是中国省制的开端。 汉的州和唐的道,起先都是监察机构,后都演变成地方行政实体。 明朝:通过废除丞相制度和创设内阁,君主专制达到了新的高度。 清朝:雍正帝时,军机处的创设,使君主专制制度发展到了顶峰。 君主专制制度的影响:极大地妨碍了社会的进步,自此,中国社会的发展开始大大落后于西方。 二、列强武装侵略与中国人民的反抗 从鸦片战争到八国联军侵华 鸦片战争(1840~1842):战争中,广州北郊三元里人民自发起来反抗英国侵略者。1842年8月,中英《南京条约》签订,内容规定:①割香港岛给英国;②赔款2100万银元;③开放广州、厦门、福州、宁波、上海五口通商; ④协定关税。影响:是中国半殖民地半封建社会的开端,中国进入了旧民主主义革命时期。 第二次鸦片战争(1856~1860):英法联军侵入北京,洗劫焚烧了圆明园。1860年清政府被迫签订《北京条约》。俄国在此期间趁机先后共侵占了中国150多万平方千米的领土。 甲午中日战争(1894):黄海海战中致远舰管带邓世昌英勇作战,壮烈殉国。1895年,清政府被迫与日本签订中日《马关条约》,内容规定:①割辽东半岛、台湾(台湾人民反割台斗争)、澎湖列岛给日本;②赔款白银2亿两; ③开放沙市、重庆、苏州、杭州为商埠;④允许日本在通商口岸开设工厂。影响:中国半殖民地化程度大大加深了。 八国联军侵华:1900年6月,八国联军借口镇压义和团运动,发动侵华战争。1901年9月,清政府与侵略者签订了丧权辱国的《辛丑条约》,内容规定:①赔款白银4.5亿两;②划定北京东交民巷为使馆界,允许各国派兵保护; ③拆除北京至大沽的炮台,允许各国派兵驻守北京到山海关铁路沿线;④严禁中国人民参加反帝斗争。影响:标志着中国完全沦为半殖民地半封建社会。 抗日战争开始标志:1937年的“卢沟桥事变”。 侵华日军罪行:1937年12月,日本攻陷南京后,屠杀南京平民和放下武器的军人30万人。日军还在中国成立了从事细菌战的“七三一部队”。 抗日战争:面对日军侵华,国共两党停止内战,组成抗日民族统一战线,奋起抗战。淞沪会战粉碎了日军三个月灭亡中国的企图。抗战前期,中国军队取得了平型关战役(太原会战)、台儿庄战役(徐州会战)的胜利。1940年,彭德怀指挥八路军发动百团大战,这是中国军队主动出击日军的一次大规模战役。 抗战胜利的历史地位:①是中国人民一百多年来第一次取得反帝斗争的完全胜利;②大大增强了全国人民的民族自尊心和自信心;③对世界反法西斯战争的胜利作出了重大贡献;④中国的国际地位得到提高。 常見金属的化学性质 一.钠及其化合物钠⑴钠的化学性质 ○1与氧气反应在常溫时4Na+O2=2Na2O (白色)在点燃时2Na+O2=Na2O2(淡黃色) ○2.钠能跟卤素.硫磷氢等非金属直接发生反应生成相应化合物,如2Na+Cl2=2NaCl 2Na+S=Na2S(硫化钠)(跟硫化合时甚至发生爆炸。)2Na+Br2=2NaBr(溴化钠)(溴化钠可以做鎮定剂) ○3钠跟水的反应2Na+2H2O=2NaOH+H2↑ 钠由于此反应剧烈,能引起氢气燃烧,所以钠失火不能用水扑救,必须用干燥沙土来灭火。钠具有很强的还原性,可以从一些熔融的金属卤化物中把金属置换出来。由于钠极易与水反应,所以不能用钠把居于金属活动性顺序钠之后的金属从其盐溶液中置换出来。 ○4钠与酸溶液反应钠与酸溶液的反应涉及到钠的量,如果钠少量,只能与酸反应,如钠与盐酸的反应:2Na+2HCl=2NaCl+H2↑ 如果钠过量,则优先与酸反应,然后再与酸溶液中的水反应 ○5钠与盐反应a将钠投入盐溶液中,钠先会和溶液中的水反应,生成的氢氧化钠如果能与盐反应则继续反应。 如将钠投入硫酸铜溶液中:2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ b与熔融盐反应这类反应多数为置换反应,常见于金属冶炼工业中,如4Na+TiCl4(熔融) =4NaCl+Ti(条件为高温) Na+KCl=K+NaCl(条件为高温)★钠与熔融盐反应不能证明金属活动性的强弱 ○6钠与有机物反应钠还能与某些有机物反应,如钠与乙醇反应: 2Na+2C2H5OH→2CH3CH2ONa+H2↑(生成物为氢气和乙醇钠) ⑵钠化学方程式 ⑴与非金属单质: 2Na+H2=高温=2NaH 4Na+O2=2Na2O (白色固体)2Na+O2=点燃 =Na2O2 (淡黄色粉末) ⑵与金属单质; 不反应⑶与水: 2Na+2H2O=2NaOH+H2↑ ⑷与酸: 2Na+2HCl=2NaCl+H2↑ ⑸与碱; 不反应(与碱溶液反应) ⑹与盐; ①4Na+TiCl4=高温=4NaCl+Ti 6Na+2NaNo2=高温 =N2↑+4Na2O Na+KCl=高温=K↑+NaCl ②2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ 或2Na+2H2O=2NaOH+H2↑ NH4Cl+NaOH=NaCl+NH3↑+H2O ⑺与氧化物: 4Na+CO2=点燃=2Na2O+C↓ ⒉氧化钠⑴化学性质①与水的反应Na2O+H2O—→2NaOH②与二氧化碳反应 Na2O+CO2--->Na2CO3 ③与酸反应Na2O+HCl=NaCl+H2O ⑵合成方法Na2CO3(碳酸钠)—△→ Na2O+CO2 ⒊过氧化钠 ①与最高价气态非金属氧化物能发生氧化还原反应,生成盐,放出氧气,例: 2Na?O?+2CO?══ 2Na?CO?+O?↑ 2Na?O?+2SO?══ 2Na?SO?+ O?↑ ②与次高价气态非金属氧化物能发生氧化还原反应,生成盐,但不放出氧气,如: Na?O?+CO ══ Na?CO? Na?O?+SO?══ Na?SO? ③与水反应,生成氧气:2Na?O?+2H?O ══ 4NaOH + O?↑,反应放热 制作Na2O+O2=Na2O2 ⒋碳酸钠①其水溶液呈碱性,能与酸产生一定反应。 Na2CO3+ 2HCl ==== 2NaCl + H2O + CO2↑(酸过量)Na2CO3+ HCl ==== NaCl + NaHCO3(碳酸钠过 ②Na2CO3与碱反应。Na2CO3+ Ca(OH)2==== CaCO3↓+ 2NaOH Na2CO3与NaOH不反应。 ③Na2CO3与盐反应。Na2CO3+ BaCl2==== 2NaCl + BaCO3↓ 3Na2CO3+ Al2(SO4)3+ 3H2O==== 2Al(OH)3↓+ 3Na2SO4+ 3CO2↑ 考点一 把握分类标准,理清物质类别 1.物质常见的分类情况 2.氧化物的常见分类方法 氧化物?????? ? 按组成元素????? 金属氧化物:如K 2O 、CaO 、Fe 2O 3非金属氧化物:如SO 2、CO 2、SO 3、P 2O 5按性质????? 成盐氧化物????? 酸性氧化物:如CO 2、SO 3碱性氧化物:如Na 2O 、CuO 两性氧化物:如Al 2O 3 不成盐氧化物:如CO 、NO 特殊氧化物:如Fe 3O 4、Na 2O 2、H 2O 2 3.正误判断,辨析“一定”与“不一定” (1)同种元素组成的物质一定是纯净物(×) (2)强碱一定是离子化合物,盐也一定是离子化合物(×) (3)碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物(√) (4)酸性氧化物不一定是非金属氧化物,非金属氧化物也不一定是酸性氧化物(√) (5)能电离出H + 的一定是酸,溶液呈碱性的一定是碱(×) (6)在酸中有几个H 原子就一定是几元酸(×) (7)含有离子键的化合物一定是离子化合物,共价化合物一定不含离子键(√) (8)盐中一定含金属元素(×) (9)能导电的一定是电解质,不导电的一定是非电解质(×) (10)强电解质的导电性一定大于弱电解质的导电性(×) 4.识记常见混合物的成分与俗名 (1)水煤气:CO、H2 (2)天然气(沼气):主要成分是CH4 (3)液化石油气:以C3H8、C4H10为主 (4)裂解气:以C2H4为主 (5)水玻璃:Na2SiO3的水溶液 (6)王水:浓盐酸与浓硝酸的混合物(体积比3∶1) (7)波尔多液:主要成分是CuSO4和Ca(OH)2 (8)肥皂:主要成分是C17H35COONa (9)碱石灰:NaOH、CaO (10)铝热剂:铝粉和金属氧化物的混合物 (11)漂白粉:Ca(ClO)2和CaCl2的混合物 考点一洞悉陷阱设置,突破阿伏加德罗常数应用 一、抓“两看”,突破“状态、状况”陷阱 一看“气体”是否处于“标准状况”。 二看“标准状况”下,物质是否为“气体”(如CCl4、H2O、Br2、SO3、HF、己烷、苯等在标准状况下不为气体)。 题组一气体摩尔体积的适用条件及物质的聚集状态 1.正误判断,正确的划“√”,错误的划“×”。 (1)2.24 L CO2中含有的原子数为0.3N A(×) (2)常温下,11.2 L甲烷气体含有的甲烷分子数为0.5N A(×) (3)标准状况下,22.4 L己烷中含共价键数目为19N A(×) (4)常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2N A(×) (2012·新课标全国卷,9D) (5)标准状况下,2.24 L HF含有的HF分子数为0.1N A(×) 二、排“干扰”,突破“质量、状况”陷阱 题组二物质的量或质量与状况 2.正误判断,正确的划“√”,错误的划“×”。 (1)常温常压下,3.2 g O2所含的原子数为0.2N A(√) (2)标准标况下,18 g H2O所含的氧原子数目为N A(√) (3)常温常压下,92 g NO2和N2O4的混合气体中含有的原子数为6N A(√) 三、记“组成”,突破“物质组成”陷阱 第一篇金属材料材料导论 第一章金属材料的主要性能 第一节金属材料的力学性能 力学性能的定义:材料在外力作用下,表现出的性能。 一、强度与塑性 概念:应力;应变 拉伸实验 F( k· F ?L(mm) ?L e 1.强度: 定义:塑性变形、断裂的能力。 衡量指标:屈服强度、抗拉强度。 (1)屈服点: 定义:发生屈服现象时的应力。 公式:σs=F s/A o(MPa) (2)抗拉强度: 定义:最大应力值。 公式:σb=F b/A o 2.塑性: 定义:发生塑性变形,不破坏的能力。 衡量指标:伸长率、断面收缩率。 (1)伸长率: 定义: 公式:δ=(L1-L0)/L0×100% (2)断面收缩率: 定义: 公式:Ψ=(A0-A1)/A0×100% 总结:δ、Ψ越大,塑性越好,越易变形但不会断裂。 二、硬度 硬度: 定义:抵抗更硬物体压入的能力。 衡量:布氏硬度、洛氏硬度等。 1.布氏硬度:HB (1)应用范围:铸铁、有色金属、非金属材料。 (2)优缺点:精确、方便、材料限制、非成品检验和薄片。 2.洛氏硬度:HRC用的最多 一定锥形的金刚石(淬火钢球),在规定载荷和时间后,测出的压痕深度差即硬度的大小(表盘表示)。 (1)应用范围:钢及合金钢。 (2)优缺点:测成品、薄的工件,无材料限制,但不精确。 总结:数值越大,硬度越高。 第二章铁碳合金 第一节纯铁的晶体结构及其同素异晶转变 一、金属的结晶 结晶:液态金属凝结成固态金属的现象。 实际结晶温度-金属以实际冷却速度冷却结晶得到的结晶温度Tn。一、金属结晶的过冷现象: 金属的实际结晶温度总是低于理论结晶温度,Tn 高一化学金属及其化合物知识点总结 1.元素的存在形式有两种:游离态和化合态。 (1)钠镁铝只以化合态形式存在:钠元素的主要存在形式是氯化钠,镁元素的存在形式有菱镁矿,铝元素的存在形式有铝土矿。 (2)铁元素有两种存在形式:游离态的陨铁和化合态的铁矿石。 2.金属单质的用途: (1)利用钠元素的特征焰色(黄色)制高压钠灯,高压钠灯的透雾力强,可以做航标灯;利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反应堆的导热剂;利用钠单质制备过氧化钠,利用钠单质还原熔融态的四氯化钛制备金属钛。 (2)镁条燃烧发出耀眼的白光,用来做照明弹。 (3)利用铝的良好导电性,做导线。利用铝块和铝粉的颜色都是银白色,铝粉制成银粉(白色涂料)。 3.金属化合物的用途: (1)过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;氯化钠做为制备单质钠和氯气的原料,氯化钠做为制备氢氧化钠、氢气、氯气的原料。 (2)氧化镁的熔点高,做耐高温的材料:耐火管、耐火坩埚、耐高温的实验仪器。 (3)明矾做净水剂。 4.金属的分类: (1)根据冶金工业标准分类:铁(铬、锰)为黑色金属,其余金属(钠镁铝等)为有色金属。 (2)根据密度分类:密度大于4.5g/cm3的金属是重金属:如铁、铜、铅、钡,密度小于4.5g/cm3的金属是轻金属:如钠、镁、铝。 5.氧化物的分类:二元化合物,其中一种元素是氧元素,并且氧元素呈负二价的化合物是氧化物。 (1)氧化物(根据氧化物中非氧元素的种类)分为金属氧化物和非金属氧化物。 (2)金属氧化物分为酸性氧化物、碱性氧化物、两性氧化物。 (3)非金属氧化物分为酸性氧化物、不成盐氧化物。 高考历史知识点总结 1.公元前2070年,禹建立我国历史上第一个王朝是夏;我国的早期国家政治制度起源于夏朝。 2.原始社会后期禅让制被王位世袭制所取代。 3.为了进行有效的统治,周朝在政治上实行分封制。西周宗法制的最大特点是嫡长子继承制。 分封制与宗法制的关系是互为表里,相辅相成。 4.柳宗元的《封建论》说“夏、商、周、汉封建而延,秦郡邑而促”。文中的“封建”的含义是分封制。 5.保证了贵族在政治上的垄断和特权地位,也有利统治集团内部的稳定和团结的是宗法制。 6.秦朝是中国历史上第一个统一的封建王朝。秦始皇首创的皇帝制度,是中国封建专制制度的重特征。在中央设置丞相、御史大夫和太尉三个最高官职。 7.唐朝时,掌握草拟、审议和行政的职能分别是中书省、门下省和尚书省。 8.宋朝和元朝最高行政机构分别是中书门下省和中书省。 9.元朝时,统领宗教事务和管辖西藏地区的机构是宣政院。为管理边远地区设置宣慰司。 10.明太祖(皇帝)时,中国的宰相制度从此被废除。 11.雍正帝时设置军机处,标志着君主专制制度发展到了顶峰。12.古代中国农业生产的主要组织方式是以家庭为单位从事生产劳 动。古代中国农业生产的主要特点是形成精耕细作的农业生产体系。13.牛耕是我国农业技术史上耕作方式的一次革命。 14.春秋战国和秦汉时期,使用了当时世界上最先进的耕作方式是垄作法。 15.古代中国手工业的三种主要经营形态分别是官营手工业、民营手工业、家庭营手工业。 16.明清时期,苏州和杭州是最著名的丝织业中心。 17.“商人”最早出自于商朝。 18.我国最早的银行雏形是柜坊。世界上最早的纸币是北宋发行的“交子”。 19.元代时,泉州被外国旅行家誉为世界第一大港。清代时实行闭关锁国的政策,只广州一处对外通商。 20.唐朝时,专管对外贸易的机构称为市舶使。宋代时,在边境设置与少数民族贸易场所称为榷场。中国最早的商标是宋代山东济南刘家功夫针。 21.“百家争鸣”是中国历史上第一次思想解放运动。 22.孔子整理的“六经”是《诗》《书》《礼》《易》《乐》《春秋》。四书是指《论语》《孟子》《大学》《中庸》。 23.提出“性善论”是孟子;提出“性恶论”是荀子。提出“三纲五常”的思想是董仲舒。提出“心性论”是朱熹。最早提出“天下兴亡,匹夫有责”的思想是顾炎武。 24.后人称孔子为“至圣”、称孟子为“亚圣”。朱熹宋朝理学集大成者。 铸造将液态金属浇注到具有与零件形状、尺寸相适应的铸型型腔中,待其冷却凝固,以获得毛坯或零件的生产方法 液态合金的充型能力液态合金充满铸型型腔,获得形状完整、轮廓清晰铸件的能力 缩孔它是集中在铸件上部或最后凝固部位容积较大的孔洞。缩孔多呈倒圆锥形,内表面粗糙,通常隐藏在铸件的内层,但在某些情况下,可暴露在铸件的上表面,呈明显的凹坑。 缩松分散在铸件某区域内的细小缩孔,称为缩松。当缩松与缩孔的容积相同时,缩松的分布面积要比缩孔大得多。缩松的形成原因也是由于铸件最后凝固区域的收缩未能得到补足,或者,因合金呈糊状凝固,被树枝状晶体分隔开的小液体区难以得到补缩所致。 热应力它是由于铸件的壁厚不均匀、各部分的冷却速度不同,以致在同一时期内铸件各部分收缩不一致而引起的。 机械应力它是合金的固态收缩受到铸型或型芯的机械阻碍而形成的内应力 热裂热裂是在高温下形成的裂纹。其形状特征是:缝隙宽、形状曲折、缝内呈氧化色 结晶:金属的结晶就是金属液体转变为晶体的过程,亦即金属原子由无序到有序的排列过程。 热处理:就是将钢在固态下,通过加热、保温和冷却,以改变钢的组织,从而获得所需性能的工艺方法。 冷裂冷裂是在低温下形成的裂纹。其形状特征是:裂纹细小、呈连续直线状,有时缝内呈轻微的氧化色 可锻铸铁可锻铸铁又称为玛铁。它是将白口铸铁经石墨化退火而形 成的一种铸铁。 球墨铸铁球墨铸铁是上世纪40年代末发展起来的一种铸造合金, 它是向出炉的铁水中加入球化剂和孕育剂而得到的球状石墨铸铁。 起模斜度为了使模样(或型芯)便于从砂型(或芯盒)中取出,凡 垂直于分型面的立壁在制造模样时,必须留出一定的倾斜度(图2-36), 此倾斜度称为起模斜度。 熔模铸造用易熔材料制成模样,然后在模样上涂挂耐火材料,经硬 化之后,再将模样熔化以排出型外,从而获得无分型面的铸型。由于 模样广泛采用蜡质材料来制造,故又常将熔模铸造称为“失蜡铸造”。 金属型铸造将液态合金浇人金属铸型、以获得铸件的一种铸造方法。由于金属铸型可反复使用多次(几百次到几千次),故有永久型铸造之称 压力铸造简称压铸。它是在高压下(比压约为5~150MPa)将液态或半液态合金快速地压人金属铸型中,并在压力下凝固,以获得铸件的方法 离心铸造将液态合金浇人高速旋转(250~1500 r/min)的铸型,使金属液在离心力作用下充填铸型并结晶 利用金属在外力作用下所产生的塑性变形,来获得具有一定形状、尺寸和力学性能的原材料、毛坯或零件的生产方法,称为金属压力加工,又称金属塑性加工。轧制金属坯料在两个回转轧辊的孔隙中受压变形,以获得各种产品的加工方法。拉拔金属坯料被拉过拉拔模的模孔而变形的加工方法。 挤压金属坯料在挤压模内被挤出模孔而变形的加工方法。 锻造金属坯料在抵铁或锻模模膛内变形而获得产品的方法。 高一化学知识点金属氧化物公式精品学习为各位同学整理了高一化学知识点:金属氧化物公式,供大家参考学习。更多各科知识点请关注新查字典化学网。 1、低价态的还原性: 6feo+o2===2fe3o4 feo+4hno3===fe(no3)3+no2+2h2o 2、氧化性: na2o2+2na===2na2o (此反应用于制备na2o) mgo,al2o3几乎没有氧化性,很难被还原为mg,al.一般通过电解制mg和al. fe2o3+3h2===2fe+3h2o (制还原铁粉) fe3o4+4h2===3fe+4h2o 3、与水的作用: na2o+h2o===2naoh 2na2o2+2h2o===4naoh+o2 (此反应分两步:na2o2+2h2o===2naoh+h2o2 ; 2h2o2===2h2o+o2. h2o2的制备可利用类似的反应: bao2+h2so4(稀)===baso4+h2o2) mgo+h2o===mg(oh)2 (缓慢反应) 4、与酸性物质的作用: na2o+so3===na2so4 na2o+co2===na2co3 na2o+2hcl===2nacl+h2o 2na2o2+2co2===2na2co3+o2 na2o2+h2so4(冷,稀)===na2so4+h2o2 mgo+so3===mgso4 mgo+h2so4===mgso4+h2o al2o3+3h2so4===al2(so4)3+3h2o (al2o3是两性氧化物: al2o3+2naoh===2naalo2+h2o) feo+2hcl===fecl2+3h2o fe2o3+6hcl===2fecl3+3h2o fe2o3+3h2s(g)===fe2s3+3h2o fe3o4+8hcl===fecl2+2fecl3+4h2o高考历史知识点汇总
高中化学《非金属知识点总结》(精选.)
高考化学复习金属氧化物知识点
人教版高中历史选修一知识点归纳
人教版化学金属和金属材料知识点总结
高一化学金属及其化合物知识点总结
高三历史知识点总结
金属工艺学重点知识点
高考复习--非金属及其化合物知识点总结
金属和化合物知识点总结与方程式
高考历史知识点精简版总结
金属非金属知识点总结
【记忆】高考化学知识点总结
金属工艺学复习要点
高一化学金属及其化合物知识点总结
高考历史知识点总结
金属工艺学(邓文英)经典知识点总结
高一化学知识点金属氧化物公式
