洁净室检测报告
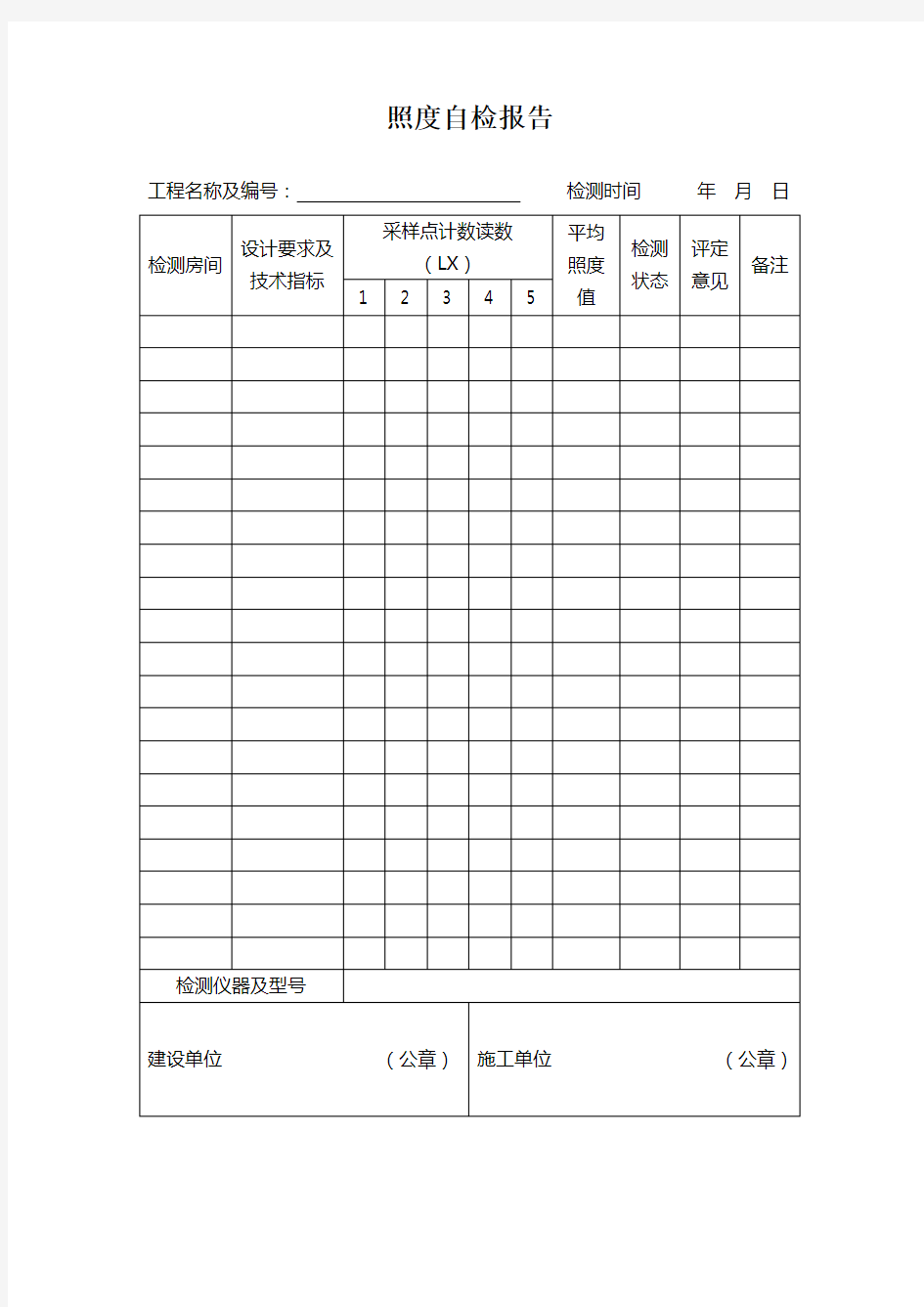

照度自检报告
室内外压差检测报告
噪声检测报告
送风风速检测报告
洁净区环境监控管理规程
1目的 规范洁净区环境监控管理,确保洁净区的环境符合GMP要求。 2范围 适用于各生产车间的洁净区的监控。 3职责 QA负责各车间洁净区的环境监控。 4内容 4.1定义 4.1.1静态 4.1.1.1静态a:洁净室(区)在净化空气调节系统已安装完毕且功能完备的情况下,生产工艺设备已安装,洁净室(区)内没有生产人员的状态。 4.1.1.2静态b:洁净室(区)在生产操作全部结束,生产操作人员撤离现场并经过20min自净后。 4.1.2动态:洁净室(区)已处于正常生产状态,设备在指定的方式下进行,并且有指定的人员按照规范操作。 4.2测试项目、标准及频次 4.2.1风速、风量及换气次数 4.2.1.1风速测试:A级区进行风速测试,检测频次:每个月一次。 4.2.1.2风量及换气次数测试:A级区外的其它区域测量风量及换气次数。检测频次:至少每年一次。 4.2.1.3标准 a.A级区风速:层流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s。 b.换气次数:B级洁净室换气次数n≥50次/h,C级洁净室换气次数n≥25次/h,D级洁净室换气次数n≥15次/h。 4.2.2流型 4.2.2.1检测区域:A级区,检测频次:至少每年一次。 4.2.2.2标准:应为层流 4.2.3压差 4.2.3.1检测频次:正常投产时每天一次。 4.2.3.2标准
a.洁净区与非洁净区之间、不同等级洁净区之间的压差应不低于10帕斯卡。 b.相同洁净度等级不同功能的操作间之间应保持适当的压差梯度,以防止污染和交叉污染。 4.2.4温度、相对湿度 4.2.4.1检测频次:正常投产时每天一次。 4.2.4.2标准:温度18-26℃,相对湿度45-65%。 4.2.5高效过滤器检漏 4.2. 5.1检测频次:A级区每半年用尘埃粒子计数扫描巡检法进行一次过滤器完整性测试,每年用气溶胶法进行一次过滤器完整性测试;B级、C级区每年用气溶胶法进行一次过滤器完整性测试,D级区每年用尘埃粒子计数扫描巡检法进行一次过滤器完整性测试。新更换高效过滤器要进行完整性测试。悬浮粒子检测结果异常,调查怀疑高效泄漏的可进行完整性测试。 4.2. 5.2标准:气溶胶法泄漏率应≤0.03%。(气溶胶法需外协检测) 4.2.6空气悬浮粒子 4.2.6.1灌装间A级区每批一次在线监测;B级区每个月进行一次动态监测,所有房间每3个月进行一次静态监测;C级区每2个月进行一次监测,动、静态不限;D级区每3个月进行一次静态监测,特殊情况下可进行动态监测。 4.2.6.2标准 各级别空气悬浮粒子标准规定
手术室检测
洁净室洁净度的检测项目主要有如下 : 1.臭氧二氧化碳 2.悬浮微生物 3.洁净度 4.温度, 湿度 5.噪声 6.静压差 7.浮游菌 8.沉降菌 9.单向流洁净室截面风速不均匀度 10.照度 11.风量,风速 12.甲醛 13.氨 四、洁净手术部的检测、维护和监测 洁净手术部的施工、检测、维护和定期监测是洁净手术部正常运行的保证。施工必须是具 有资质的单位承担。检测验收是非常重要一环。因要求指标多,规范强调必须由具有省以 上检测资质权的单位承担。 维护:一方面要求施工单位给予保修维护,另一方面要进行本单位专门人员培训。 工程验收检测:测试项目:空气细菌浓度、洁净度级别、截面风速、换气次数、新风量、静 压差、噪声、照度、温、相对温度等10 项指标进行综合性能的检测。 1、空气细菌浓度的测定 在空态和静态情况下用直径为9cm的普通营养琼脂平皿,放在室内离地面或0.8m 高度的各采样点处(送风口集中布置时,手术区和周边区分别检测,测点数为:100级测13点,1000级 9 点, 10000 级 7 点; 100000 级或送风口分散布置的洁净室,全室统一检测,10000 级至少测试 4 个点, 100000 级至少 2 个点),暴露30min 采样,置37℃温箱中培养24h,分别计数手术区周边区的平均细菌菌落数。监测:按要求每月进行一次生物学监测,采用空气沉降法。 沉降菌浓度检测方法(医院) (1)设备材料:编号ф 90mm培养皿若干,普通培养基, 37℃温箱。 (2)条件:净化空调系统在开启状态,房间清洁并擦试消毒后,进行测试。 (3)时间:培养皿沉降 30 分钟后,用 37℃温箱培养 24 小时。 (4)人员要求:测试人员穿着洁净服,戴口罩,手消毒或戴手套。动作要轻,避免产生污 染干扰。 (5)放置方法、次序:放置培养皿从总平面中最靠里的房间开始布置,依次向外布,最后 人员撤出。每间房间也是从房间最靠里的房间开始布置,最后布置门附近的点,然后人员撤出。收取培养皿时顺序相反,从最外边的房间开始收,每间房间从最靠门的培养皿开始收, 最先布置的皿最后收,沉降时间略有差别。用ф 90mm培养皿,在洁净房间内均匀点测试, 另外再布置 1 点作为对照皿。培养皿放置地面后拿开皿盖,搭放在皿边上,沉降30分钟后,盖上皿盖收起,用37℃温箱培养24 小时后,数出菌落数,将检测结果签字盖章后,交给我 方。 (6)对照皿:对照皿放置方法为将皿盖拿开后,马上重新盖上,同样放置30 分钟,收起,
洁净室的测试及验收标准
洁净室的测试及验收标准 控制洁净室空气参数的目的—检查洁净室是否符合给定的洁净度级别。无论是在投产调试工作完成后的洁净室检测阶段,还是洁净室使用阶段都要完成空气参数的控制工作。在各种标准和建议(16)中都详细地制订了和提出了洁净室空气参数的测试和控制方法。至今这些方法已成为广大科技界的共同财富。 在洁净室内,按其用途的不同应控制下列参数: 1、测试状态的确定 2、空气中粒子的浓度 3、气流的风速和单向性(对单向气流而言) 4、风量和换气次数 5、最终过滤器的整体性 6、空气温度和湿度 7、洁净室的密闭性 8、洁净室表面的洁净度 测试状态的确定:根据设计要求,一般洁净室都是对洁净室内的空气进行静态检测,一般不做动态检测,如需动态检测,需要制定或参照其他标准。 空气粒子浓度的检测 洁净度级别 洁净室和洁净区均按一项指标划分级别—一定粒径粒子的最大允许浓度(每1m3空气中的粒子数)。 空气洁净度级别和空气洁净度的测定方法均按下表中的规定确定,根据该标准的规定,洁净室的洁净级别是由粒径≥给定阀值D的粒子的最大允许浓度确定的。 在确定实际洁净室的洁净度级别时,应对粒径≥阀值的粒子进行统计,下面的粒子给定粒径都是指阀值粒径。
所列为整数级别序数N和最常见值D的粒子最大允许浓度 洁净度级别表示实例 ISO 4级;静态;给定粒径微米(352粒子/m3)。 ISO 5级;静态;给定粒径微米(3520粒子/m3);微米(29粒子/m3)。 因此,在测试具体的洁净室的相应洁净度级别时,不需要检测如上表所示的该级别的所有粒子粒径。而只要检测为该种洁净室给定的粒子粒径。
测定洁净度级别的方法 在检测洁净室的洁净度级别时,应测定洁净室内1点或数点的悬浮粒子浓度(即取样点的粒子浓度)。 因此必须满足下列要求 1)确认洁净室的状态与给定的相符; 2)确定给定粒径,洁净室取样点的数量和位置; 3)确定每一取样点的取样数量; 4)确定对每一种给定粒径在每1取样点上,每1次取样的取样量和取样时间; 5)取样之后应对每一种给定粒径的粒子进行相应统计; 6)将取样数据填入按各种给定粒径统计的粒子统计记录表内(适于采用无计算机软件的粒子计数器的场合下); 7)整理取得的数据; 8)对结果进行分析; 9)整理方案确定级别应符合上表要求。 气流的检测 在洁净室中的气流: 气流风速(通常是控制单向气流的风速) 气流均匀性(单向气流风速稳定性)并目视检查气流。 空气(单向气流)的风速和风量 空气单向气流的风速是在垂直于气流方向的平面上并距离风源150-500mm处测得的。 测试点的数量应大于被测表面面积的平方根,但不得小于3,应在每一个设定的网格中进行测量,测量点应均匀地分布在平面上。 应在距离过滤器表面150mm处测试过滤器出口处的风速。在评价气流的均匀性时,应在距离过滤器表面300mm以上处测试风速。 每1点的测量时间不得少于10秒。并且要确定平均值,最大和最小值。
实验室报告模板
实验室报告模板 《2014年实验室年度报告》至少包括以下内容: 一是基本情况。主要包括:本机构及主要负责人对报告内容真实性的承诺;实验室的人员、设备、场所、资产概况及与上年度同比情况,实验室的最高管理者、技术管理者、授权签字人、工作场所以及资质认定的项目、参数、标准(规范、规程、方法)变化情况。 二是业务工作情况。主要包括:实验室的出具检测报告数量及与上年度同比情况,检验检测工作营业收入及占全部业务收入的百分比和与上年度营业收入同比情况,承担行政主管部门下达的指令性或法定检验任务的情况,科研、技术咨询等其他业务工作开展情况及与上年度同比情况。 三是接受的外部评审检查情况。主要包括:实验室接受各级质监部门的资质认定评审和证后监督检查,实验室认可评审和监督,行业主管部门的资质评审和监督等外部评审检查情况。 四是质量控制活动开展情况。主要包括:实验室参加能力验证和内外部比对试验的工作情况,其他质量控制活动开展情况。 五是内部质量管理情况。主要包括:内审、管理评审、质量监督和日常监督工作开展情况,人员培训开展情况,顾客满意度调查和处理申诉、投诉及客户反馈情况,纠正措施和预防措施实施情况。 六是工作建议和2015年度工作计划。主要包括:对质
监部门各项工作的建议和本单位在2015年度的工作计划或工作思路。 七是其他需向质监部门报告的事项(如有相关事项)。 《2014年实验室年度报告》应言简意赅,相关情况和数据应当真实、有效,可图文并茂。 《2014年实验室社会责任报告》至少包括以下内容:一是前言。主要包括:本机构及主要负责人对报告内容真实性的承诺;报告的时间和范围界定;报告编制的依据;本机构的社会责任战略、方针、目标和/或价值理念等。 二是检测机构基本情况。主要包括:本机构的基本信息;开展的各项业务及发检测报告数量等;人力资源情况;财务状况及财务审计情况等。 三是社会责任管理体系和制度的建立情况。主要包括:本机构建立的履行社会责任的措施及制度规定,相关体系运行和自我改进情况,利益相关方的识别和参与等。 四是履行社会责任情况及绩效评价。参照上述第三部分内容的提示,并结合本机构的实践和理解,真实反映本机构的情况。 五是结语。主要包括:本机构对未来履行社会责任的发展计划,报告反馈联系方式等。 《2014年实验室社会责任报告》应言简意赅,相关情况和数据应当真实、有效,可图文并茂。 注:实验室社会责任内容主要包括:遵守法律、规范运作、诚实守信、提升服务水平、创新发展、环保节能减排、
洁净区环境监测管理规程
1.目的:规定了公司洁净区洁净度的测试规则和控制标准。目的是规范洁净区的洁净度的监测,确保洁净区符合生产及质量检测要求。 2.范围:适用于我公司所有洁净区的洁净度测试和管理。 3.职责: 3.1.生产管理部:负责洁净区高效过滤器的检漏和补漏的监督管理工作; 3.2.生产管理部:负责空调净化系统的调试和使用,确保空调净化系统的正常运行; 3.3.质量管理部QA:负责悬浮粒子、浮游菌、沉降菌测试; 3.4.质量管理部QC:配合负责浮游菌、沉降菌的测试。 4.内容: 4.1.1.洁净区:对尘粒及微生物污染规定需进行环境控制的功能间或区域。其建筑结构、装备及其使用均具有减少对该区域污染源的介入、产生和滞留的功能。 4.1.2.洁净工作台:一种工作台或者与之类似的一个封闭围挡工作区。其特点是自身能够供给经过过滤的空气或气体,如垂直层流罩、水平层流罩、垂直层流洁净工作台、水平层流洁净工作台、自净器等。 4.1.3.局部空气净化:仅使室内工作区域特定的局部空间的空气含悬浮粒子浓度达到规定的空气洁净度级别,这种方式称局部空气净化。 4.1.4.洁净度:洁净环境内单位体积空气中含大于或等于某一粒径悬浮粒子的允许统计数。 4.1. 5.菌落:细菌培养后,由一个或几个细菌繁殖而形成的细菌集落,简称CFU。通常用个数表示。 4.1.6.单向流:沿着平行流线,以一定流速、单一通路、单一方向流动的气流。 4.1.7.垂直单向流:与水平面垂直的单向流。 4.1.8.水平单向流:与水平面平行的单向流。 4.1.9.非单向流(曾称为乱流):具有多个通路循环特性或气流方向不平行的,不满足单向流定义的气流。 4.1.10.静态测试:功能间净化空气调节系统已处于正常运行状态,工艺设备已安装,功能间内没有生产人员的情况下进行的测试。 4.1.11.动态测试:功能间已处于正常生产状态下进行的测试。 4.1.12.置信上限(UCL)
洁净手术室的维护与管理制度
第一部分:层流净化手术室基本知识及日常管理 一、层流净化的概念与作用 层流净化,是指气流以匀速向一定方向输送,通过高效过滤器净化,呈流线状进入手术室内,再以等速通过手术空间后流出。手术室内的尘粒和病原微生物随气流方向被排出,不会在室内扩散,层流手术室即以此设计而得名。 层流系统是达到空气净化、创造洁净手术空间的一种先进设备,是目前一种安全有效、经济方便的空气除菌手段。 二、层流净化技术在手术室的重要性 手术室是医院对病人进行手术治疗的重要场所,手术质量的高低往往反映了一家医院的治疗水平。 对手术成功的重要保障,就是要树立严格的无菌观念,重视手术中的无菌技术操作,防止手术感染。手术后一旦发生感染,将会造成的后果,很多医院为了避免类似情况的发生,不得不加强对病人抗生素的用量,这种方法对病人的伤害很大,目前国家也在立法通过行政手段来控制抗生素的用量。所以对手术中各个环节的无菌控制越来越受到各家医院的重视。 三、手术室的污染源和污染途径 手术室的污染源主要有来自外部和来自手术室内部的两部分: 1、来自外部的污染源主要是送到手术室的新风。具统计室外空气中的细菌和微生物的数量大约为1-1000个/英尺3,而且这些细菌和微生物大多都附着在灰尘粒子上,不同地区的污染程度也不相同。 2、来自洁净手术室内部的污染源,主要是手术的医生和护士、手术的患者以及手术过程的产菌产尘。 最大的内部污染源是手术医生、麻醉医生和护士等人,他们的衣服、皮肤和呼吸都会产生大量的尘埃和细菌,产生灰尘和细菌的数量与他们的着装、动作的强度和频度、医生的技能、消毒的程度以及全面管理的水平有关。因此,进入手术室的医护人
实验室洁净度自检验检测报告模板格式
精心整理 检验检测报告 INSPECTION TEST REPORT 安装工程有限公司 检验检测报告 产品名 称/检测名称实验室检测 样品数量2间 洁净度等 级 一间整体万级(7级)局部百 级(5级)、 一间十万级(8级) 施工单 位 ------ 检测类别委托检测 受检单 位 地址 委托人委托日期2017-06-03 检测地 点 实验室检测状态静态 检测日 期 2017-06-10 报告日期2017-06-18 检测依据GB50591-2010《洁净室施工及验收规范》、GB/T16292-2010《医药工业洁净室(区)悬浮粒子的测试方法》 判定依据GB50073-2013《洁净厂房设计规范》、GB50346-2011《生物安全实验室建筑技术规范》、受检方使用要求。
检测项 目 悬浮粒子计数、温度、相对湿度、静压差、噪音、照度所用仪 器仪器制造单位型号证书编号 设备检定单 位 激光尘埃粒 子计数器 Y09-301 温湿度计DT-321S 数字微压计DP1000-ⅢB 数字式照度计AR813A 声级计AWA5636 检测结论 依据GB/T16292-2010《医药工业洁净室(区)悬浮粒子的测试方法》对受检单位实验室悬浮粒子计数进行检测,其检测结果为局部百级实验室整体符合万级标准,局部符合百级标准,P2实验室符合十万级标准; 依据GB50591-2010《洁净室施工及验收规范》对受检单位实验室温度、相对湿度、静压差、噪音、照度进行检测,其检测结果符合相应标准。 检测数据详见后续页。 签发日期:2017年6月18日 备注 编制:审核:批准:检验项 目名称标准要求检验结果 单项结 论 悬浮粒 子数,pc/m3 局部百级实验室 (整体万级) 粒径≥0.5μm 7级(万级) <352000 A1=13192 A2=11896 合格 粒径≥5μm A1=942
实验室设备管理系统测试报告
案卷号 日期 <实验室设备管理系统> 测试用例报告 作者: 完成日期: 签收人: 签收日期: 修改情况记录: 版本号修改批准人修改人安装日期签收人 目录
1........................................................................... (1) 引言 1编写目的...................................................................................................................................... 1.1 1背景.............................................................................................................................................. 1.2 1........................................................................... ................................................................... 2 测试设计 5........................................................................... ................................................................... 3 测试用例 5 ............................................................................................................... 用例1:用户登录页面3.1 6 ............................................................................................................... 用例2:用户注册页面3.2 8 ....................................................................................................... 用例3:用户找回密码页面3.3 014:用户退出..................................................................................................................... 3.4用例..................................................................................................... 11:一般用户操作界面用例53.5 21...................................................................................... 3.6用例6:一般用户修改个人信息界面41...................................................................................... 用例7:一般用户书写个人日志界面3.7 6..................................................................................... 18:一般用户查询个人信息界面.3.8用例 7 ................................................................................................. 13.9用例9:管理员浏览信息界面9..................................................................................... 1:管理员管理教师操作界面.3.10用例10 12 ...................................................................................... 用例3.1111:管理员修改个人资料界面 32 .......................................................................... 3.12用例12:管理员浏览实验室人员信息界面52.......................................................................... 3.14用例14:管理员管理实验室设备操作界面7..................................................................................... 215:管理员仪器设备报损界面.3.15用例 92 :管理员贵重仪器购置操作界面.............................................................................. 3.16用例16 13:系统帮助界面......................................................................................................... 用例3.1717 3 ................................................................................................................. 3用例3.1818:系统备分 43 ......................................................................... ................................................................... 4 测试评估4 ............................................................................................................................ 34.1测试任务评估 43 ............................................................................................................................ 测试对象评估4.2 1 引言 1.1 编写目的 该文档的目的是描述实验室设备管理系统的测试设计,其主要内容包括:
手术室检测
洁净室洁净度的检测项目主要有如下: 1.臭氧二氧化碳 2.悬浮微生物 3.洁净度 4.温度,湿度 5.噪声 6.静压差 7.浮游菌 8.沉降菌 9.单向流洁净室截面风速不均匀度 10.照度 11.风量,风速 12.甲醛 13.氨 四、洁净手术部的检测、维护和监测 洁净手术部的施工、检测、维护和定期监测是洁净手术部正常运行的保证。施工必须是具有资质的单位承担。检测验收是非常重要一环。因要求指标多,规范强调必须由具有省以上检测资质权的单位承担。 维护:一方面要求施工单位给予保修维护,另一方面要进行本单位专门人员培训。 工程验收检测:测试项目:空气细菌浓度、洁净度级别、截面风速、换气次数、新风量、静压差、噪声、照度、温、相对温度等10项指标进行综合性能的检测。 1、空气细菌浓度的测定
在空态和静态情况下用直径为9cm的普通营养琼脂平皿,放在室内离地面或0.8m高度的各采样点处(送风口集中布置时,手术区和周边区分别检测,测点数为:100级测13点,1000级9点,10000级7点;100000级或送风口分散布置的洁净室,全室统一检测,10000级至少测试4个点,100000级至少2个点),暴露30min采样,置37℃温箱中培养24h,分别计数手术区周边区的平均细菌菌落数。监测:按要求每月进行一次生物学监测,采用空气沉降法。 沉降菌浓度检测方法(医院) (1)设备材料:编号ф90mm培养皿若干,普通培养基,37℃温箱。 (2)条件:净化空调系统在开启状态,房间清洁并擦试消毒后,进行测试。 (3)时间:培养皿沉降30分钟后,用37℃温箱培养24小时。 (4)人员要求:测试人员穿着洁净服,戴口罩,手消毒或戴手套。动作要轻,避免产生污染干扰。 (5)放置方法、次序:放置培养皿从总平面中最靠里的房间开始布置,依次向外布,最后人员撤出。每间房间也是从房间最靠里的房间开始布置,最后布置门附近的点,然后人员撤出。收取培养皿时顺序相反,从最外边的房间开始收,每间房间从最靠门的培养皿开始收,最先布置的皿最后收,沉降时间略有差别。用ф90mm培养皿,在洁净房间内均匀点测试,另外再布置1点作为对照皿。培养皿放置地面后拿开皿盖,搭放在皿边上,沉降30分钟后,盖上皿盖收起,用37℃温箱培养24小时后,数出菌落数,将检测结果签字盖章后,交给我方。 (6)对照皿:对照皿放置方法为将皿盖拿开后,马上重新盖上,同样放置30分钟,收起,
医院洁净手术室的管理与监测
医院洁净手术室的管理与监测 医院手术室是医院感染控制的重点部门之一,其对建筑卫生学的要求最高,也最复杂(硬件)。90年代以来,随着现代化医院的建设与发展,洁净手术室的建设已逐步普及,同时也给医院感染管理工作带来新的更高的要求。 一、空调净化技术 起源于20世纪60年代,首先用于工业制药,电子等技术方面。80年代逐步用于生物医学领域。 空调净化技术是利用空调系统中装置多级空气过滤设备,使进入房间的空气在热、湿调节的同时除去空气中的细菌。洁净手术部正是建立在空气净化技术和手术全过程的感染控制,切断所有污染途径(人流、物流、气流、水流)的理念之上的。其要求不仅手术室是洁净的,并且在手术整个过程、环节及必要的配套辅助性用房区域也必须是洁净的。其不仅有阻止外部细菌的进入,也是阻止室内由于长期消毒破坏菌种平衡后使特定细菌大量繁殖的有效手段。 二、我国洁净手术室的分级 根据手术室无菌程度将手术室分为5类:(1)一类手术室相当I级洁净手术室(手术区100级,周边区1000级),也称无菌净化手术室。多用于神经外科、心脏、脏器移植、全关节置换、眼科、大面积烧伤植皮等深部重大手术。这类手术不得有产生感染的因素。(2)二类手术室相当于II级洁净手术室(手术区1000级,周边区10000级),即一般无菌手术室。多用于脾、肾、肺等脏器切除、闭合性骨折切开复位等。这类手术,外部条件属无菌,但在手术过程中,因内部因素可能发生感染。(3)三类手术室相当于III级洁净手术室,多用于本身已感染的有菌手术,如胃、胆囊、阑尾手术等,但手术过程是在无菌条件下进行的。(4)IV类手术室也是用于有菌手术,如创口已严重化脓和感染。(5)五类手术室为负压手术室,应用于有传染性的手术,如全同绿假单胞菌、气性坏疽、破伤风、MRSA等细菌的感染伤口的手术。病人自身有菌,感染力强,散发大量传染病菌,对环境严重污染、危害大,故应隔离,空调系统也应分开设置。 手术室的数量、等级依医院性质、规模、级别和财力而定。我国规定,100张床位,需4-5间手术室,有菌无菌手术室分开。综合性医院I级手术室间数不应超过洁净手术室总间数的15%,专科医院视需要而定。三、洁净手术室的布局与流程 1、洁净手术部的组成 手术部是由若干手术室及为手术室服务的辅助用房(辅助区)组成。辅助区又分直接和间接为手术室服务用房。直接为手术室服务的功能房间有:无菌敷料存放室、药品存放室、一次性无菌用品室、无菌器械贮存室、麻醉室(包括麻醉复苏室)、刷手室、护士站、准备室、洁净走廊、清洁走廊等。间接为手术服务的房间如:办公室、会议室、示教室、值班室等,其外延又涉及有家属等候室、ICU、输血科、病理科等。是以手术室为核心,组合成相对独立的医疗功能单元。 2、洁净手术部的布局流程 (1)洁净手术部在医院建筑中的位置有以下几种类型 ①设在病房最顶层;②设在病房中间一层;③设在病房底层;④设在工字组合体的连接体中; ⑤设在工字体分岔组合体的分岔中;⑥设在门诊与病房其他部位。 (2)洁净手术室分区
洁净度测试
洁净度测试SOP 1.范围 制剂车间、提取车间内的洁净区、QC卫检室、采样车、洁净工作台、压缩空气、洁净区自主采风设备进风的洁净度测试。 2.职责 检验员:负责本厂洁净区尘埃粒子数、沉降菌、照度的测试 QC、QA主管:监督检查执行情况 3.要求 3.1.我厂洁净区洁净度是按10万级和30万级设计、施工,所以也应按10万级和30万级的洁净 级别进行监测。 3.2.洁净厂房洁净度测试标准按《洁净室(区)环境评定标准》执行。 4.尘埃粒子 4.1.仪器和设备:激光尘埃粒子计数器。 4.2.采样方法 将已稳定激光粒子计数器采样口打开,启动泵进气即可。 4.3.注意事项 4.3.1.检查测定仪器是否正常,并作外表洁净后方可进入测试环境,采样管必须清洁并无渗漏, 仪器按规定预热至稳定。 4.3.2.测试点及采样次数均应在测试开始前确定,防止在测试过程中随意改变测试点及改变采样 次数。 4.3.3.计数器采样口和仪器工作位置应在同一气压和温度下,以免产生测量误差。 4.3.4.在确认洁净室(区)送风量和压差达到要求后,方可进行采样。布置采样点时,应避开回 风口。 4.3. 5.更换测试点时,应待仪器读数下降至稳定后,方可开始新测试点的读数。 4.3.6.测试过程中测试人员应位于采样口的下风侧。 4.3.7.采样管的长度为仪器使用所允许的长度。无规定时,不宜超过1.5米。 4.3.8.测试结果不符合洁净级别要求时,应按原方法重复一次,并且每个测试点的采样次数增加 2次;重复测试结果符合规定时,即可判定为符合该洁净级别的要求。 4.4.测试规则 4.4.1.测试条件
4.4.1.1.温度湿度 要求与生产及工艺相适应(温度18~26℃,相对湿度45~65%为宜) 4.4.1.2.压差 洁净度级别不同的洁净室(区)之间压差>5P a,洁净区与非洁净区之间压差>10P a。4.4.2.测试状态:静态测试和动态测试 4.4.2.1.静态测试:系指洁净厂房的空气净化调节系统已处于正常运行状态,生产设备已安装,室 内没有生产人员的测试。 4.4.2.2.动态测试:系指洁净厂房的空气净化调节系统已处于正常运行状态,生产设备及生产人员 等已处于正常生产状态下的测试。 4.4.2.3.静态测试时,室内人员应不超过2人。测试记录和报告中应标明所测试的状态。 4.4.3.测试时间 4.4.3.1.对单向流,空气净化调节系统正常运行时间不少于10min后开始测试。 4.4.3.2.对非单向流,空气净化调节系统正常运行时间不少于30min后开始测试 4.4.4.采样点数目
第三方实验室检测报告
第三方实验室调研 一、分类及数量 据中国能效标识网站新闻公告,截至目前,共28类(实际上类别数量并不明确,如此处说是28类,但网站上备案实验室分类列表中有34类,已备案表格中有36类),产品1000多家实验室申请能效标识检测实验室备案,通过现场核验和数据一致性核验,备案实验室共870家,其中第一方实验室占比约65%,第三方实验室占比约35%。(各类别实验室、企业备案数详见附件1) 二、能效检测业务概况 经查询多种类别、二十余家备案实验室,发现多为大型实验室(检测研究院),业务广泛,能效检测均非主要业务,且各类别能效检测差异很大,因此未取得能效检测业务的收费方式、标准(如确定具体类别,可进行针对性调研)。 具备设计生产能力的企业,一般具有能效检测能力,且产品能效检测为自我申报、备案,监测方式为抽查、并不严格,故单纯第三方能效检测业务面较小。 三、设备场所要求 因已备案实验室多为大型实验室(检测研究院),且业务不专注于能效检测,其设备、场所参考性不大。目前,《能效检测实验室能力要求(2009)》中有11篇具体类别的设备标准(因是2009年版,部分或已过期,已咨询标准化研究院人员,也无新版文件),联系标准化研究院仅取得通风机、电力变压器两篇设备标准(各类别产品检测、实验室备案有专人负责,确定具体类别后可进一步咨询)。(详见附件2) 四、备案流程 1、网上注册企业信息,填写注册表单(附件3) https://www.360docs.net/doc/3310610890.html,:8000/lab/reg/register.jsp 2、通过网上审核后,邮寄文本资料(详见附件4) a)实验室概况 b)能源效率检测产品目录
空气洁净度检测
空气洁净度是指洁净环境中空气含尘(微粒) 量多少的程度。含尘浓度高则洁净度低,含尘浓度低则洁净度高。空气洁净度本身是无量纲的。但是,空气洁净度的高低可用空气洁净度级别来区分。空气洁净度级别则以每立方米空气中的最大允许微粒数来确定。 一般在洁净室内有登记的,采用多种工序操作时,应根据各工序不同的要求,采用不同的空气洁净度等级,依据工序要求确定等级。医药工业药生产工序的洁净级别和洁净区的划分,照中制剂和原料药工艺内容及环境区域划分而定。药品生产洁净室的空气洁净度划分为四个等级。 在满足生产工艺要求的前提下,首先应采用低洁净等级的洁净湿或局部空气净化;其次可采用局部工作区域空气净化和第等级全市空气净化相结合或采用全面空气净化。 也有的地方按空气过滤的等级 一、洁净室的空气洁净度,应进行下列测试: (一)空态、静态测试 空态测试:洁净室已竣工,净化空气调节系统已处于正常运行状态,室内没
有工艺设备和生产人员的情况下边行测试。静态测试:洁净室净化空气调节系统已处于正常运行状态,工艺设备已安装,室内没有生产人员的情况下进行测试。 (二)动态测试洁净室已处于正常生产状态下进行测试。 洁净室的风量、风速、正压、温度、湿度、噪声的检测,可按一般通用、空气调节的有关规定执行。 二、空态、静态测试 (一)测试前的准备 1、应对洁净室及其净化空气调节系统进行彻底清洁。 2、采用光散射粒子计数器对高效空气过滤器进行检漏测试。首先测定高效空气过滤器的上风侧静压箱内(或风管内)粒径大于或等于0.5微米的尘粒数应为大于或等于30,000粒/升。 (二)测试内容 1、总送风量、总回风量、新鲜空气量、排风量等; 2、洁净室压力值; 3、层流洁净室断面风速和气流流向; 4、洁净工作区的洁净度; 杭州克林埃尔检测技术有限公司是一家行业独立商检机构,具有独立法人地位和第三方实验室地位。为国内净化厂房和设备提供第三方检测、调试和咨询服务。公司目前是一家净化检测项目齐全的检测机构。公司拥有先进的检测设备、配备资深技术团队及丰富经验的质量管理专家,力求为产品的安全符合性提供量身定制的解决方案。
物理实验室安全隐患检查报告
物理实验室安全隐患检查报告 实验室的安全非常重要,有时可能会发生爆炸、灼伤、触电等事故,为了避免事故的发生,保障在校师生的安全,为此,对我校物理实验室进行全方位多层次的安全隐患排查。 首先介绍一下我校物理实验室的基本情况。物理实验室位于我校教学楼C区二楼,分为三个实验室,每个实验室有三间,包括实验室、准备间和仪器室,仪器室中分别摆放光学、热学、声学以及力学和电磁学方面的仪器。 以下是物理实验室安全隐患检查中存在的问题: 一、物理基础实验中安全隐患最多的是用电问题。我校物理实验室三间的结构都相同,学生实验用的电源固定在桌面上,电源线用PVC管包裹,装修时将线埋于地下,无法看出是否老化需要更换等问题,还有待专业电工进行进一步检测。至于实验室中的其他配备,比如配电箱、插座、开关、灯、风扇及输电线路,从2010年使用至今,可能也存在不同程度的老化,有待检测。因此,在实验中我们应该着重学生的安全用电问题,正确进行实验操作,例如;不用潮湿的手触摸电线开关,实验时先连接电路再接通电源,结束时要先断开电源再拆开电路,其他的电学实验也应按照教师讲解的正确步骤操作,尽可能的避免用电安全问题。至于辐射、射线等安全隐患问题,由于高中物理实验做的是基础实验,基本不存在这类伤害。 二、防火方面存在的的问题。灭火器设在楼道中,实验室中没有 配备,由于在实验中可能存在操作错误,线路短接或是线路老化导致触电着火等突发状况,应立即切断电源,情况危急时要及时求救或先用灭火器灭火,尽可能的减少伤害。 三、用水方面的问题。物理实验室只在准备间装了一个水槽,物理实验中也基本不需要用水,因此,在打扫时注意保持地面干燥,以避免学生做实验时滑倒摔伤。
洁净厂房环境监测风险评估报告
报告编号:QRM2012-007 洁净厂房环境监测风险评估报告 报告起草签名日期 质量管理部年月日 报告审核签名日期 QC主管年月日 设备动力部部长年月日 质量管理部部长年月日 报告批准签名日期 质量受权人/负责人年月日 第页共6页
目录 1.概述 2.风险评估的目的和适用范围 3.风险评估小组成员及职责 4.风险评估 4.1风险分析识别 4.2风险判断标准 4.3风险识别结果 4.4风险评价结果 第页共6页
1.概述: 我公司根据检测需要,严格按照GMP要求和产品要求,质量管理部和设备动力部负责对洁净区环境进行监测。环境监控有悬浮粒子计数器、浮游菌采样器、照度仪、风速计、噪声仪、臭氧浓度检测仪、气体检测报警仪等检测检验设备,能够完成满足生产过程控制的要求。同时根据区域或房间不同的设置和功能,具体分析每个区域或房间的风险来源,并制定相对应的监测措施,为在这些洁净区内进行的所有生产活动提供符合GMP的洁净级别要求。 2.风险评估的目的和适用范围: 评估的目的:对影响生产过程控制的因素进行评价,对可能的危害进行判定,对于每种危害可能产生损害的严重程度、危害的发生概率和可检测性进行估计,在某一风险水平不可接受时,建议采取了降低风险的措施,在日常管理中进行控制。 适用范围:各车间洁净区的环境监控。 3. 风险评估小组成员及职责: 姓名部门职务职责 **** 质量总监组长组织成立风险评估小组,提供风险管理所需的资源,批准风险管理计划,批准风险管理报告。 **** 质量管理部组员参与风险的识别、分析、制定控制措施及确认执行,负责风险评估报告的汇总、起草。 第页共6页
洁净手术室沉降法测定沉降菌浓采样布点法.doc
洁净手术室沉降法测定沉降菌浓度采样布点法 手术室的级别分为:Ⅰ级手术室,Ⅱ级手术室,Ⅲ级手术室,Ⅳ级手术室。Ⅰ-Ⅲ级手术室有手术区和周边区之分,手术区为需要特别保护的手术台及其周围区域,余下区域均为周边区。Ⅳ级手术室不分手术区和周边区。各级手术室不同区域的空气洁净度级别不同,有5级、6级、7级、8万级及8.5级之分。 GB50333-2013中(13.3.18.4)要求采用沉降法测定沉降菌浓度时,细菌浓度测点数要和被测区域含尘浓度测点数(13.3.11-2)相同,同时应满足表13.3.18-2 规定的最少培养皿(不含对照皿)数的要求。也就是说按这两种方法中布点数多的布点。 表13.3.18-2 沉降菌最小培养皿数 表13.3.11-2 测点位置表 上表明确指出5级洁净度区域最少培养皿是13个;而含尘浓度的检测布点方法是
(13.3.11.2)Ⅰ级手术室手术区5个,所以在测沉降菌的时候,Ⅰ级手术室手术区布点数应为13个。沉降菌最少培养皿数明确指出6级洁净度区域最少培养皿是4个;而含尘浓度的检测布点方法是Ⅰ级手术室周边区8个,所以Ⅰ级手术室周边区布点数应为8个,即Ⅰ级手术室沉降菌采样共需布21个点(不包括对照)。 沉降菌最少培养皿数指出6级洁净度区域最少培养皿是4个;而含尘浓度的检测布点方法是Ⅱ级手术室手术区3个,所以Ⅱ级手术室手术区布点数应为4个。沉降菌最少培养皿数指出7级洁净度区域最少培养皿是3个;而含尘浓度的检测布点方法是Ⅱ级手术室周边区6个,所以Ⅱ级手术室周边区布点数应为6个。即Ⅱ级手术室沉降菌采样共需布10个点(不包括对照)。 沉降菌最少培养皿数指出7级洁净度区域最少培养皿是3个;而含尘浓度的检测布点方法是Ⅲ级手术室手术区3个,所以Ⅲ级手术室手术区布点数为3个。沉降菌最少培养皿数指出8级洁净度区域最少培养皿是2个;而含尘浓度的检测布点方法是Ⅲ级手术室周边区6个,所以Ⅲ级手术室周边区布点数应为6个。即Ⅲ级手术室沉降菌采样共需布9个点(不包括对照)。 洁净手术室的等级标准(空态或静态)及沉降法测定细菌浓度布点 ) 2、检测细菌浓度,必须有2次空白对照。第1次对用于检测的培养皿做对比试验,即每次采样时留一个培养皿直接送培养并采取单盲法(即送检的人知道是对照而微生物实验室的人不知道)。第2次是在检测时,每室或每区1个对照皿,对操作过程做对照试验:模拟操作过程,但培养皿打开后即立即封盖。两次对照结果都必须为阴性。整个操作应符合无菌操作的要求。 3、采样后的培养皿,应尽快置于37℃条件下培养24h,然后计数生长的菌落数。菌落数的平均值均四舍五入进位到小数点后1位。 4、当某个皿菌落数太大受到质疑时,应重测,如结果仍很大以两次均值为准;如果结果很小可再重测或分析判定。布皿和收皿的检测人员必须遵守无菌操作的要求。 13个点 布点示意: 2014-6-13
英国实验室管检测报告
CERTIFICATE OF ANALYSIS Page 1 of 6 Certificate Number: IWTN/COA/W663/001 (14 May 2014) Test Facility Details: Customer Details: Name: NPT Address: NPT ASIA Intertek Wilton The Wilton Centre Wilton Redcar TS10 4RF UK Tel:+44 (0)1642435773 Fax:+44 (0)1642435777 Material: TUBALL SINGLE WALL CARBON NANOTUBES Customer reference N o: Lot 4 – 18032014 (Homogenised) Date of Sample Receipt: 26 March 2014 Intertek Wilton Sample Ref. N o : IWTN/W000000663 General Comments The analyses carried out show that this sample contains a high concentration of single wall carbon nanotubes. All measurements were made on the dry powder as supplied; the sample was not dispersed or purified in any way prior to analysis. Results of Analysis Specification Value Method Total carbon ~85 % w/w Oxidative Combustion1,TGA2 Nanotube purity (T1%) ~74% +/- 1.5% TGA3 Primary oxidation peak (T ox) Mean = 615°C, σ = 1.73°C TGA Main non-carbon species detected4 Fe, O, Ni, Si, Cr, Na, S EDX, XRF,CHNO Raman G/D ratio 30.5 +/- 2.3 86.5 +/- 7.1 (non - homogenised) Raman, 633nm5 Main tube diameters - metallic 1.25, 1.30, 1.47, 1.58 nm Raman 633nm and 785nm6 Main tube diameters - semiconducting 1.43, 1.63, 1.66, 1.78, 2.01nm Raman 633nm and 785nm6 Approximate average tube diameter ~1.5nm TEM7 ITS Testing Services (UK) Ltd Registered in England No. 1408264 Registered Office: Academy Place, 1-9 Brook Street, Brentwood, Essex, CM14 5NQ
